Накопленные данные позволяют трактовать эти два заболевания как двуединое системное поражение «печень — кишечник». Медицинское сообщество все больше склоняется к мысли, что ПСХ и ВЗК — «двуликий Янус», два плеча одного коромысла, как аллегорически изображено на рисунке 1.
Рис. 1. Взаимосвязь между воспалительными заболеваниями кишечника (ВЗК) и поражением печени.
Примечание: ЛИПП — лекарственно индуцируемые поражения печени, НАЖБП — неалкогольная жировая болезнь печени, НЯК — неспецифический язвенный колит, ПСХ — первичный склерозирующий холангит. Рисунок А. Р. Рейзис (2017)

Коварство данного своеобразного тандема заключается в том, что выраженные клинические проявления ПСХ на фоне ВЗК или, наоборот, ВЗК на фоне ПСХ одновременно встречаются не чаще чем у 10–20% больных. У подавляющего большинства пациентов сочетанное поражение протекает подспудно, ВЗК и ПСХ начинаются и проявляются в разное время, будучи разделенными годами и десятилетиями, когда диагностируют одно из этих заболеваний, а второе существует «за кадром», латентно.
Механизмы связи ВЗК и ПСХ до сих пор не раскрыты, но факт ее существования очевиден и настолько закономерен, что служит даже диагностическим признаком (табл. 1) разграничения первичного и вторичного холангита (ассоциированные заболевания).
Таблица 1
Кардинальные различия первичного и вторичного склерозирующего холангита
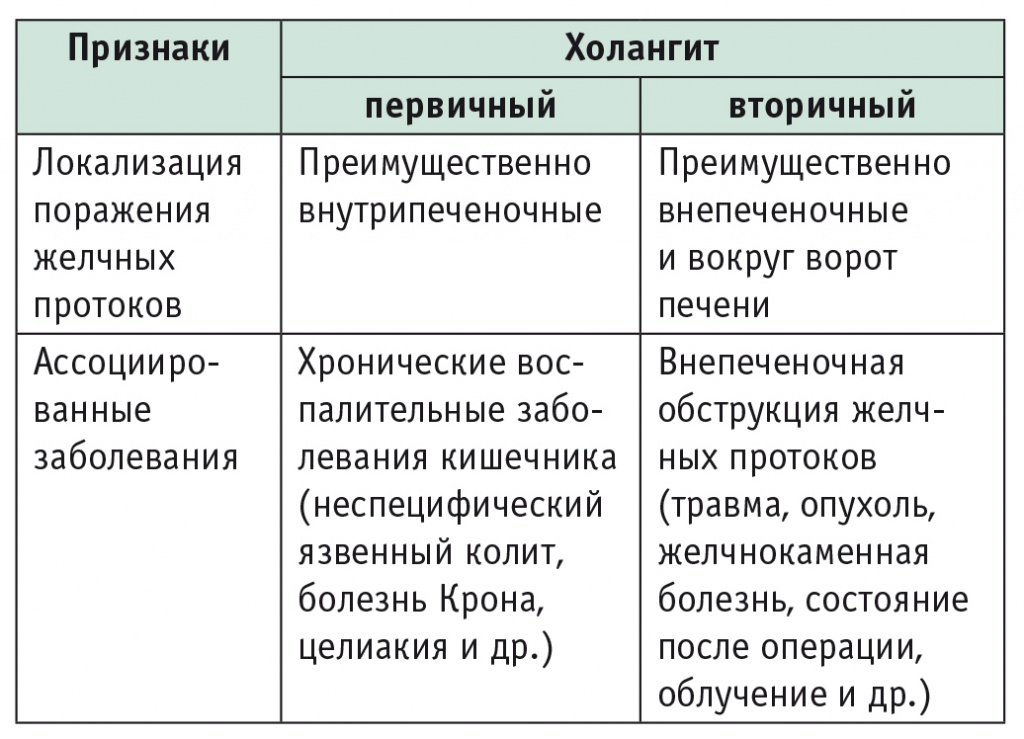
Предпринимают все новые попытки выяснить патогенез таинственной сопряженности ВЗК и ПСХ. Исследования самых последних лет трактуют их связь с точки зрения современного учения о микробиоме [6] и с позиций иммуногенетики [7]. Так, проведя иммуногенетические исследования и обнаружив 23 локуса восприимчивости к комбинации ВЗК и ПСХ в лейкоцитарном комплексе антигенов человека, B. K. Сhung и G. M. Hirschfield сделали вывод о соотношении этих двух заболеваний как объекта и его зеркального отражения [7]. J. M. Ridlon и J. S. Bajaj представляют новый взгляд на энтерогепатическую циркуляцию как на совокупность «микробиом — желчные кислоты» [6]. Авторы рассматривают ее как единый «эндокринный орган», названный ими «стеролбиом», контролирующий в равной степени как состав микробиоты, так и синтез и циркуляцию желчных кислот.
Кроме того, сегодня предложена теория восходящей патофизиологии холестатических заболеваний печени, к которым относится ПСХ [8]. Первые ранние поражения нижних отделов желчных путей ведут к застойным явлениям и повышению давления в вышестоящих желчных канальцах и капиллярах, где создается высокая концентрация токсичных желчных кислот, вызывая патологические изменения органа.
По мнению авторов, продолжительное субклиническое течение ПСХ обусловлено огромным потенциалом адаптации печени к холестазу. Как правило, отсутствие или бедность клинических проявлений приводит к его позднему распознаванию. Не случайно в клинической практике привлекает внимание различная частота выявления ВЗК на фоне уже диагностированного ПСХ и ПСХ у пациентов с уже установленным диагнозом ВЗК (рис. 2).
Рис. 2. Соотношение диагнозов первичного склерозирующего холангита и воспалительных заболеваний кишечника. Рисунок А. Р. Рейзис (2017)
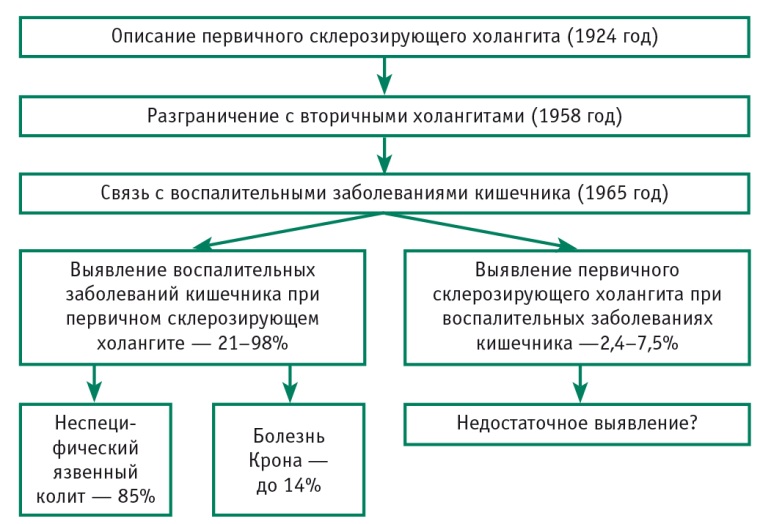
Так, ВЗК обнаруживают у 21–98% больных ПСХ (преимущественно в виде неспецифического язвенного колита, реже — болезни Крона), а ПСХ у больных с диагнозом ВЗК регистрируют существенно реже — в 2,4–7,5% случаев [2]. Такое различие отражает не столько истинное положение вещей, сколько отсутствие нацеленности на диагностику ПСХ. Эту мысль подтверждают данные последних 10 лет, демонстрирующие, что пристальное внимание к данному вопросу повышает вероятность выявления ПСХ у пациентов с ВЗК до 50% [5] (рис. 3).
Рис. 3. Динамика частоты выявления первичного склерозирующего холангита у пациентов с воспалительными заболеваниями кишечника за 10 лет в США. Рисунок А. Р. Рейзис (2017), составлен по данным [5]
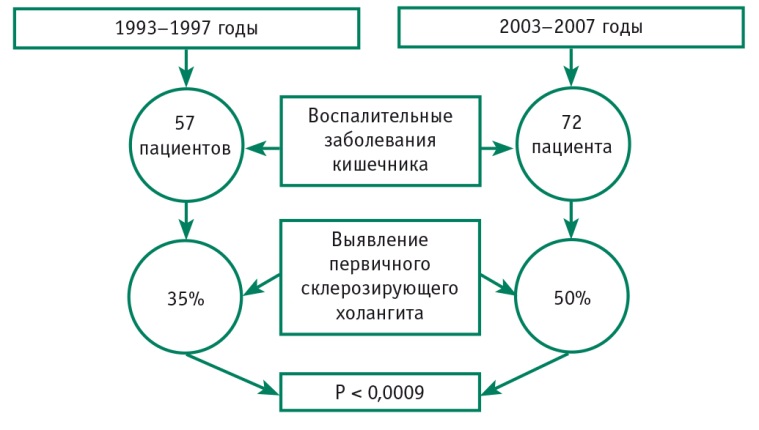
В последние годы увеличивается частота обнаружения ПСХ на фоне ВЗК и у детей (до 10,5%) [4].
Этиология ПСХ, как и ВЗК, до сих пор не разгадана. Наиболее вероятно их аутоиммунное происхождение. Воздействие триггера на фоне генетической предрасположенности ведет к повреждению тканей (желчных протоков, эпителия кишечника и др.), извращению иммунных процессов и каскаду аутоиммунных реакций.
Диагностические критерии в настоящее время также недостаточно изучены и не абсолютны, в связи с чем при диагностике необходимо специальное целенаправленное обследование.
Диагностические критерии ПСХ [9, 10]:
- повышение активности щелочной фосфатазы (ЩФ) более 1,5 нормы и/или γглутамилтрансферазы (ГГТ) более 3 норм в течение 6 мес, реже — повышение активности АЛТ и/или АСТ;
- выявление антинейтрофильных цитоплазматических атипичных аутоантител (pANCA);
- четкообразные изменения внутрипеченочных желчных протоков при холангиографии (или магнитнорезонансной холангиографии);
- склерозирование и облитерация внутрипеченочных желчных протоков по типу «луковой шелухи» по результатам пункционной биопсии печени;
- исключение вторичного склерозирующего холангита.
У детей особенно трудно распознать ПСХ на фоне ВЗК. Для них характерен еще менее выраженный рост активности ЩФ, которая в 50% случаев соответствует норме даже при холестазе и в периоды роста. Кроме того, особенностью детей является повышение титров таких аутоантител, как антинуклеарный фактор и антигладкомышечные антитела, более типичных для аутоиммунного гепатита или перекрестного (overlap) синдрома.
Трудности диагностики не отменяют непреложного факта, что своевременное распознавание сопутствующего патологического процесса в печени имеет огромное значение для судьбы пациента с ВЗК. Показано, что ассоциация ВЗК и ПСХ существенно изменяет течение и проявления обоих сопряженных заболеваний. Так, неспецифический язвенный колит, ассоциированный с ПСХ, имеет другое клиническое «лицо» и другие исходы, чем то же заболевание, протекающее изолированно (табл. 2).
Таблица 2
Особенности течения неспецифического язвенного колита, ассоциированного с первичным склерозирующим холангитом
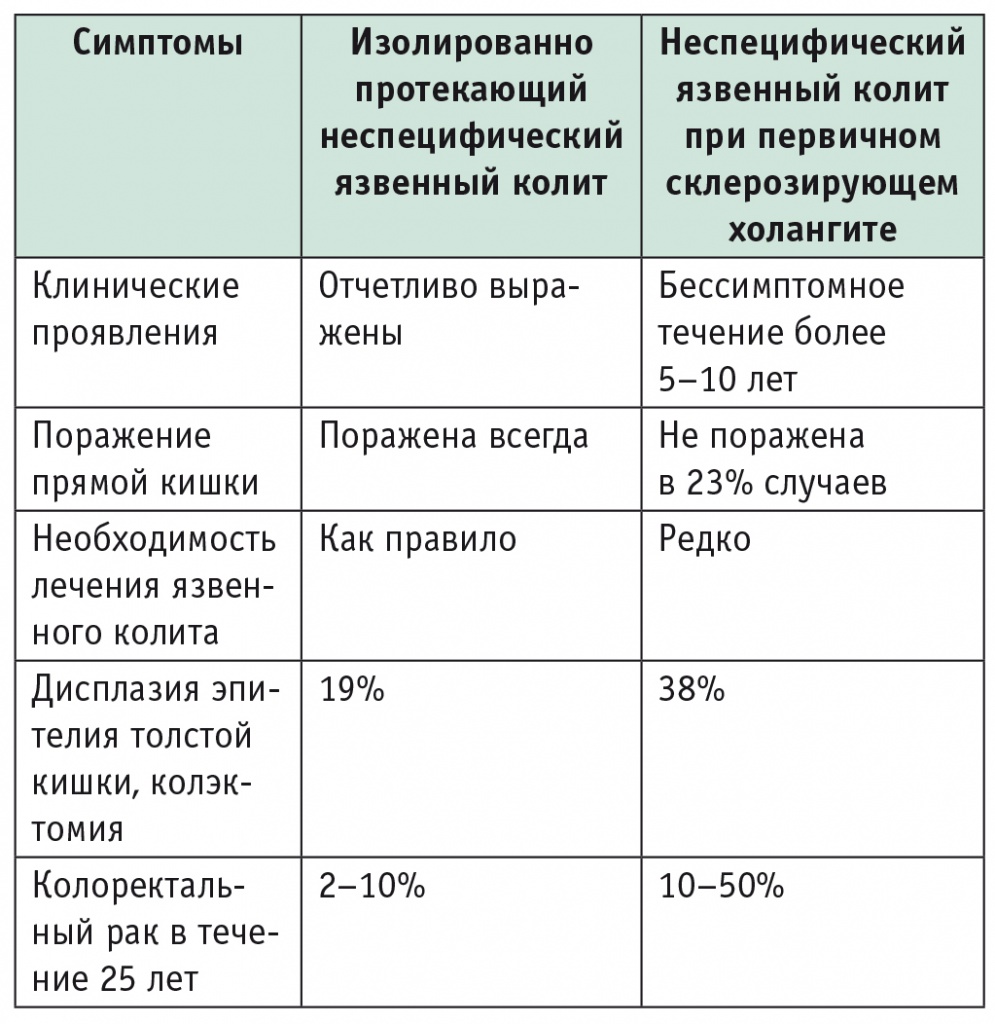
Особенно угрожающе выглядит многократное увеличение частоты кишечных дисплазий (38% против 19%) и колоректального рака (10–50% против 2–10%) при сочетанном течении неспецифического язвенного колита и ПСХ [2, 11–13]. Следовательно, несмотря на существенные трудности, задача раннего выявления «второго плеча коромысла» у пациента с ВЗК и/или ПСХ актуальна и нередко судьбоносна для больного.
Одной из возможных причин малигнизации может быть нарушение кинетики желчных кислот в каловых массах при ПСХ [14]. Как показали T. Tadano и соавт. в 2007 г., у пациентов с колоректальным раком (n = 89) статистически значимо (p < 0,001) повышено содержание в каловых массах деоксихолевой и литохолевой кислот, служащих агрессивными факторами онкогенеза, и наоборот, значимо снижена концентрация гидрофильной урсодеоксихолевой кислоты (УДХК). Сегодня УДХК признана не только важным фактором супрессии онкогенеза и защиты от него [15–19], но и препаратом, который «существенно улучшает биохимические показатели при холестазе независимо от его причины и может приостановить или замедлить прогрессирование болезней печени» [20].
При сочетанном течении ПСХ и ВЗК это благоприятное действие УДХК дополнительно обусловлено важнейшей ролью желчных кислот в работе ЖКТ, в частности регулирующим действием желчных кислот на секрецию кишечника [21] и процессы апоптоза в толстой кишке [15]. Нарушение обмена желчных кислот при ПСХ в сторону преобладания агрессивных желчных кислот и дефицита УДХК, выполняющей защитные функции, дополнительно предрасполагает к поражению кишечника, возникновению ВЗК и его неблагоприятному течению вплоть до малигнизации.
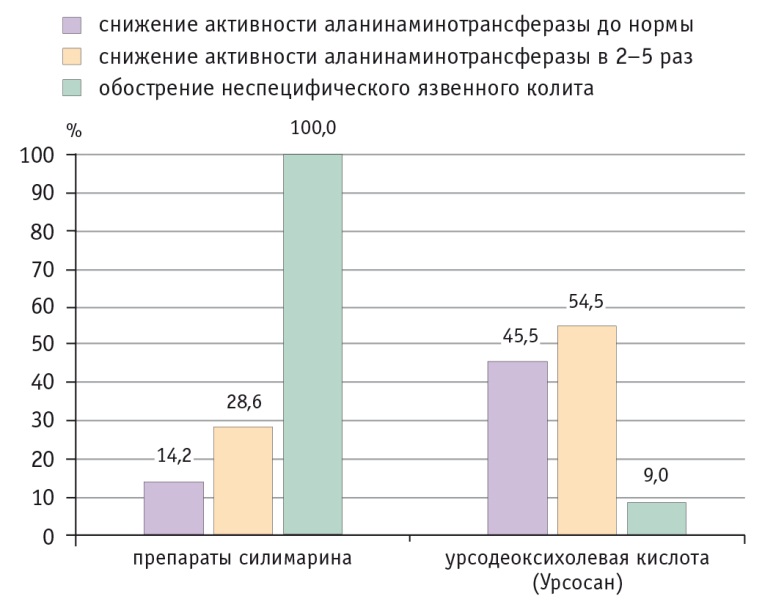
Нами уже 10 лет назад [3] показано, что УДХК (Урсосан) — единственный препарат патогенетического действия, применение которого на фоне ВЗК у 45,5% больных нормализует активность трансаминаз, а в остальных случаях в 2–5 раз снижает ее, лишь у 9% пациентов вызывая обострение колитического процесса. В противоположность этому препараты силимарина обостряли ВЗК у всех больных, а улучшение показателей функций печени достигалось существенно реже (рис. 4).
Рис. 4. Действие урсодеоксихолевой кислоты при неспецифическом язвенном колите у детей [3]
В масштабном (1285 пациентов) двойном слепом рандомизированном клиническом исследовании [22] удалось продемонстрировать превентивную роль УДХК для колоректальной аденомы (КРА). В течение 3 лет наблюдения КРА зарегистрирована у 39% получавших плацебо и лишь у 12% участников эксперимента, принимавших УДХК (p = 0,03).
Столь же выраженный эффект предотвращения малигнизации показан и для второго (печеночного) «плеча» заболевания. Так, в специальном проспективном исследовании 1990–2001 гг. у 52 из 225 пациентов с ПСХ развилась холангиокарцинома [23], причем доказанными предикторами ее возникновения были позднее установление диагноза ПСХ и отсутствие лечения препаратами УДХК. Имела значение и длительность приема УДХК: холангиокарцинома не выявлена ни у одного из пациентов, получавших препараты УДХК в течение 8 лет и более.
В 2013 г. опубликованы результаты систематического обзора и метаанализа превентивной роли УДХК в развитии КРА у пациентов с ПСХ, сопряженным с ВЗК [24]. Анализ включил 763 человека, из которых КРА обнаружена у 177: у 35% больных, получавших плацебо, и лишь у 19% принимавших УДХК в дозе 8–10 мг/кг/сут (p < 0,005).
Естественно, столь благоприятное действие отражается на общей продолжительности жизни пациентов. Так, по данным J. M. Wolf и соавт. [19], летальность среди больных с документированным сочетанным течением ПСХ и ВЗК (n = 120, средний возраст — 43 года, средний срок наблюдения — 3,5 года), получавших УДХК, в 4 раза ниже (0,22), чем в группе получавших плацебо (0,9; p = 0,02).
Новую главу в изучении сочетанного течения ПСХ и ВЗК открывают современные хирургические методы лечения этих заболеваний. Однако трансплантация печени у пациентов с ПСХ и колэктомия у больных ВЗК нередко не решают проблему, напротив, становятся триггером, вызывающим к жизни «второе плечо» обсуждаемой связки, дополнительно выявляющим тайное сродство, подспудную сопряженность данных заболеваний [25].
Выяснилось, что трансплантация печени при ее циррозе в исходе ПСХ не только не облегчает течение существующего ВЗК, но может способствовать возникновению ВЗК de novo. И наоборот, колэктомия по поводу КРА в исходе ВЗК не улучшает течение ПСХ и не предотвращает его появление у пациента.
Так, авторы приводят данные о трансплантации печени у больных с известным двойным диагнозом (ПСХ + ВЗК) и с диагнозом независимо протекающего ПСХ. В первой группе у трети пациентов наблюдали улучшение течения сопутствующего ВЗК, однако еще у трети больных зафиксировано его ухудшение. Более того, у 14–30% пациентов с диагнозом ПСХ отмечено развитие (или первое проявление) ранее не диагностированного, но вероятно предсуществовавшего ВЗК [25]. Ни причины этого явления, ни предрасполагающие факторы, ни его прогностические признаки сегодня еще не известны и подлежат глубокому и всестороннему изучению.
В настоящее время единственным доступным выходом из этой ситуации служит своевременное выявление ПСХ при диагнозе ВЗК или ВЗК при диагностированном ПСХ и превентивное длительное лечение препаратами УДХК в дозе 10–15 мг/кг массы тела в сутки. Ранняя диагностика сопряженного заболевания и длительная терапия препаратами УДХК благоприятно влияет на течение обоих процессов, улучшает качество и продолжительность жизни пациентов.
КЛИНИЧЕСКИЕ ПРИМЕРЫ
Мальчик Марин Э-ов, 2000 г. р., наблюдался с диагнозом: «Язвенный колит, тотальный, тяжелое, непрерывно рецидивирующее течение. ПСХ с исходом в цирроз печени, активный; портальная гипертензия, варикозное расширение вен пищевода 1–2й степени; гиперспленизм, класс В по Чайлд — Пью». Из анамнеза известно, что ребенок рос в многодетной семье, его считали здоровым. Условия жизни не позволяли следить за частотой и характером стула.
В 7 лет мальчик пошел в школу. Тогда впервые обнаружили учащенный разжиженный стул с примесью крови. К врачам не обращались. В 2014 г. появилась нарастающая слабость. Лечился у «целителя» в течение 1 года.
В январе 2015 г. в тяжелом состоянии поступил в республиканскую детскую больницу (г. Симферополь) с выраженной желтухой и диагнозом вирусного гепатита.
Результаты обследования
УЗИ органов брюшной полости: гепатоспленомегалия, диаметр vena рortae — 12 мм.
Фиброгастродуоденоскопия: варикозное расширение вен нижней трети пищевода I–II степени.
Колоноскопия: язвенный проктосигмоидит, тотальное поражение толстой кишки.
Общий анализ крови: концентрация гемоглобина — 70 г/л, число эритроцитов — 2,8 млн, цветовой показатель — 0,9, количество лейкоцитов — 7,6 тыс., нейтрофилов — 79%, тромбоцитов — 59 тыс.
Биохимический анализ крови: концентрация общего билирубина — 78,5 мкмоль/л (прямого — 38 мкмоль/л), активность АЛТ — 2,5–3 нормы, АСТ — 1,5 нормы, ГГТ — 360 (15 норм!), ЩФ — в норме, содержание общего белка — 57 г/л, альбумина — 35,0 г/л, γглобулинов — 28,0 г/л, αфетопротеина — в норме; антинуклеарные, антимитохондриальные антитела и антитела к микросомальному антигену печени и почек не определяются, антитела против цитоплазматических антигенов нейтрофилов — 1 : 640.
Данных за вирусные гепатиты, α1трипсиновую недостаточность, гемохроматоз, болезнь Вильсона — Коновалова не получено.
Как только на фоне начатого лечения мальчику стало лучше, родители забрали его домой.
История болезни демонстрирует фатальное течение обоих сопряженных заболеваний: ПСХ и язвенного колита, ни одно из которых не было своевременно диагностировано и пролечено.
Сергей Р-ов, 17 лет, наблюдался с диагнозом «Язвенный колит, ассоциированный с ПСХ (overlapсиндром?)». Из анамнеза известно, что в раннем возрасте практически не болел. С 7 лет выявлен семейный контакт с больным туберкулезом. Проводили превентивную терапию изониазадом и пиразинамидом.
В 14 лет температура тела повысилась до субфебрильной, появился учащенный стул с примесью слизи, иногда крови, похудел на 10 кг в течение 1 года. При обследовании диагностирован язвенный колит, назначен месалазин. По результатам биохимического анализа крови впервые выявлены изменения: концентрация общего билирубина — 20,0 мкмоль/л, активность АЛТ — 43,0–66,0 Ед/л, АСТ — 65,0–69,0 Ед/л, ГГТ и ЩФ — в норме. На фоне терапии месалазином в течение года отмечена положительная динамика: температура тела и характер стула нормализовались, по данным колоноскопии, язвенный колит в стадии ремиссии; содержание общего билирубина — 20,0 мкмоль/л, активность АЛТ — 40,0 Ед/л, АСТ — 32,0 Ед/л, ГГТ, ЩФ — в норме. В 16 лет (2014 г.) на фоне продолжающейся ремиссии язвенного колита отмечены изменения результатов биохимических анализов крови: явления холестаза и цитолиза (табл. 3).
Таблица 3
Динамика биохимических показателей больного Р-ва
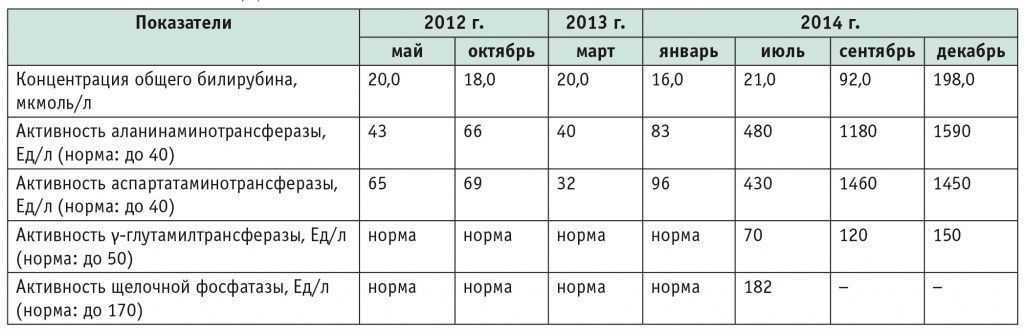
В августе 2014 г. появилась желтуха. УЗИ обнаружило незначительное расширение внутрипеченочных желчных протоков; магнитнорезонансная холангиопанкреатография — расширение внутри и внепеченочных протоков. Проведена эластометрия печени, диагностирован цирроз (F4). Назначена терапия: препарат УДХК (Урсосан) из расчета 10–15 мг/кг/сут; в/в ГКС в дозе 0,75 мг/кг/сут; антибактериальное лечение (ванкомицин и др.) На фоне терапии явления желтухи купированы.
В настоящее время продолжает принимать УДХК в дозе 15 мг/кг массы тела в сутки, на фоне чего у мальчика достигнута стойкая ремиссия по обоим заболеваниям.
ЗАКЛЮЧЕНИЕ
Поражение печени при воспалительных заболеваниях кишечника (ВЗК) — не случайность, а закономерно ассоциированное заболевание, наиболее часто представленное первичным склерозирующим холангитом (ПСХ). Время возникновения и выраженность клиниколабораторных проявлений ПСХ не совпадают с таковыми ассоциированных с ним ВЗК, поэтому необходимо взаимное целенаправленное выявление этих заболеваний.
Раннее распознавание сопутствующего, часто и длительно субклинически протекающего ПСХ судьбоносно для больных ВЗК.
Своевременно начатая пожизненная терапия препаратами урсодезоксихолевой кислоты (Урсосаном) повышает качество жизни, улучшает биохимические показатели, способствует снижению гистологической активности обоих процессов; возможно уменьшение вероятности малигнизации сопряженных заболеваний и увеличение продолжительности жизни.








