Первое сообщение о возможной ассоциации целиакии с заболеваниями печени представлено медицинской общественности в 1977 г. D. J. Pollock на основании наблюдения за группой пациентов с общим диагнозом мальабсорбции [4]. Позже данные о взаимосвязи целиакии с аутоиммунным гепатитом и первичным склерозирующим холангитом были подтверждены в различных популяциях больных в разных странах. Сегодня однозначно установлено, что частота аутоиммунных болезней печени среди пациентов с целиакией выше средней в популяции, а среди больных аутоиммунным гепатитом и первичным склерозирующим холангитом выше заболеваемость целиакией [5–9].
Как правило, в остром периоде заболевания наблюдают изолированное повышение активности печеночных трансаминаз (АЛТ и АСТ), которая обычно нормализуется при назначении безглютеновой диеты (БГД) [10, 11]. По данным разных авторов, гипертрансаминаземию (ГТ) диагностируют у 8–47% пациентов с целиакией [12–17].
B. Zanini и соавт. провели метаанализ 638 историй болезни пациентов с характерной клинической картиной целиакии, подтвержденной результатами серологических и морфологических исследований. Показано, что при целиакии, сопровождавшейся формированием типичного синдрома мальабсорбции, активность трансаминаз повышалась существенно чаще и более значительно, чем при других нарушениях пищеварения без атрофических изменений слизистой оболочки тонкой кишки [18, 19]. Описаны также случаи изолированного повышения активности АЛТ и АСТ, в том числе у пациентов со стертыми и малосимптомными формами заболевания [20–23].
По результатам метаанализа всех публикаций в MEDLINE и EMBASE, посвященных ассоциации целиакии и повышения активности печеночных ферментов, целиакия служит потенциальной причиной криптогенной ГТ в 3–4% случаев [17].
M. A. Moghaddam и соавт. провели исследование взаимосвязи активности трансаминаз и соблюдения БГД [24] с участием 98 взрослых пациентов с серологически и морфологически подтвержденной целиакией. У 8% больных отмечено криптогенное повышение активности трансаминаз, причем по результатам биопсии ни у одного пациента не зарегистрирован стеатогепатит. Спустя 6 месяцев соблюдения БГД у всех пациентов активность АЛТ и АСТ нормализовалась.
Механизм вовлечения печени в патогенез целиакии, вероятно, обусловлен несколькими взаимосвязанными процессами [25–31]:
- мальабсорбция приводит к энергетическому и трофическому дефициту, в результате нарушается синтетическая функция печени, а также снижается проницаемость цитоплазматической мембраны гепатоцитов;
- развивается аутоиммунное повреждение печени, обусловленное, с одной стороны, образованием неспецифических антител к тканевой трансглутаминазе, а с другой — синтезом специфических антител к гепатоцитам у лиц, генетически предрасположенных к аутоиммунным заболеваниям;
- нарушение цитоархитектоники и обусловленное им снижение барьерной функции кишечной стенки способствуют поступлению инфекционных антигенов, вызывающих специфические реакции иммунной системы и, как следствие, повреждение паренхиматозных органов по механизму перекрестной реакции.
Цель исследования: анализ активности печеночных трансаминаз и особенностей клиникоанамнестической, серологической и морфологической картины в период клинической манифестации целиакии у детей и подростков.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены 222 ребенка с впервые диагностированной целиакией в возрасте от 8 мес до 17 лет (средний возраст — 5,0 ± 0,3 года), находившиеся на обследовании и лечении в краевом детском гастроэнтерологическом отделении ГДКБ им Г. К. Филиппского г. Ставрополя с 1996 по 2016 г. Среди детей были 116 (52,3%) мальчиков и 106 (47,7%) девочек. Типичная форма заболевания выявлена у 194 (87,4%), атипичная — у 28 (12,6%) пациентов.
Диагностику целиакии проводили в соответствии с клиникоанамнестическими, серологическими и морфологическими критериями ESPGHAN (1990, 2012). Серологическая диагностика включала определение титра антител IgA и IgG к тканевой трансглутаминазе (антиТТГ) и эндомизию.
Морфологическую диагностику повреждения слизистой оболочки тонкой кишки (СОТК) проводили в соответствии с классификацией Marsh — Oberhuber (1999) у 125 (56,3%) больных. Тип атрофии Marsh 3A диагностирован у 29 (23,2%), Marsh 3В — у 48 (38,4%) и Marsh 3C — у 48 (38,4%) пациентов.
Активность печеночных трансаминаз (АСТ и АЛТ) определяли кинетическим методом с помощью наборов реагентов HOSPITEX DIAGNOSTICS s.r.l. (Италия) на аппарате Screen Master Plus, референсные значения для активности АСТ и АЛТ — до 40 Ед/л; с 2011 г. применяли наборы реагентов Liquick Cor (Польша) и аппарат ACCENT 300 (Польша), референсные значения: активность АСТ — 0–31 Ед/л; АЛТ — 0–32 Ед/л.
На первом году жизни целиакия верифицирована у 10 (4,5%) детей, в 1–3 года — у 92 (41,5%), в 4–6 лет — у 70 (31,5%), 7–11 лет — у 24 (10,8%) и 12–17 лет — у 26 (11,7%) пациентов.
В зависимости от активности печеночных трансаминаз выделены две группы. Первую группу составили 105 (47,3%) больных с ГТ, из которых у 74 (70,5%) детей отмечено изолированное увеличение активности АСТ, у 5 (4,8%) — изолированное повышение активности АЛТ и у 26 (24,7%) — сочетанное повышение активности АСТ и АЛТ. У 91 (86,7%) ребенка активность АСТ превышала норму менее чем в 2 раза; у 9 (8,6%) — в 2–5 раз. Аналогичное превышение нормы для АЛТ обнаружено у 27 (25,7%) и 4 (3,8%) детей соответственно.
Во 2ю группу вошли 117 (52,7%) пациентов с нормальной активностью трансминаз. Средние показатели активности АСТ и АЛТ у детей 1й группы составили 49,2 ± 1,8 Ед/л и 32,9 ± 1,8 Ед/л соответственно, во 2й — 27,8 ± 0,6 Ед/л и 19,3 ± 0,6 Ед/л соответственно (p < 0,001 для обоих показателей при сравнении с 1й группой).
Статистическую обработку и анализ результатов проводили с использованием пакета программ Attestat, Statistica 10.0. Описательная статистика представлена как среднее ± стандартная ошибка среднего (M ± m). Параметрические показатели при нормальном распределении признаков оценивали с помощью tкритерия Стьюдента, при ненормальном распределении признака использовали Uкритерий Манна — Уитни. Для сравнения непараметрических показателей рассчитывали критерий χ2. Корреляционный анализ между количественными признаками проводили с помощью rкоэффициента корреляции Пирсона, между порядковыми признаками — коэффициента Кендалла. Различия считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
С возрастом активность трансаминаз у детей в остром периоде целиакии повышается реже. Так, на первом году жизни ГТ диагностирована у 8 (80,0%), в возрасте 1–3 лет — у 55 (59,8%), 4–6 лет — у 31 (44,3%), 7–11 лет — у 8 (33,3%) пациентов и лишь у 3 (11,5%) подростков 12–17 лет.
В возрасте до 3 лет ГТ выявлена у 63 (61,8%) детей, старше 3 лет — у 42 (35,0%) (p < 0,001). Средний возраст верификации диагноза у детей 1й и 2й групп составил 3,6 ± 0,3 года и 6,4 ± 0,4 года соответственно (p < 0,001). Корреляционный анализ обнаруживает обратную связь между возрастом диагностики целиакии и активностью АСТ (r = –0,33, p < 0,001).
Гендерных различий в частоте ГТ не зафиксировано: она диагностирована у 54 (46,6%) мальчиков и 51 (48,1%) девочки (p > 0,05). В то же время среди пациентов с типичной формой целиакии ГТ отмечена более чем в 2 раза чаще, чем при атипичной: 99 (51,0%) и 6 (21,4%) случаев соответственно (p < 0,01).
Средний возраст появления жалоб у детей 1й группы составил 1,4 ± 0,1 года, 2й — 2,7 ± 0,3 года (p < 0,001). У 98 (93,3%) из 105 детей с ГТ и 88 (75,2%) из 117 пациентов с нормальной активностью трансаминаз (p < 0,001) первые симптомы заболевания появились в возрасте до 3 лет. Выявлена отрицательная корреляция между возрастом появления жалоб и активностью АСТ (r = –0,22, p < 0,002).
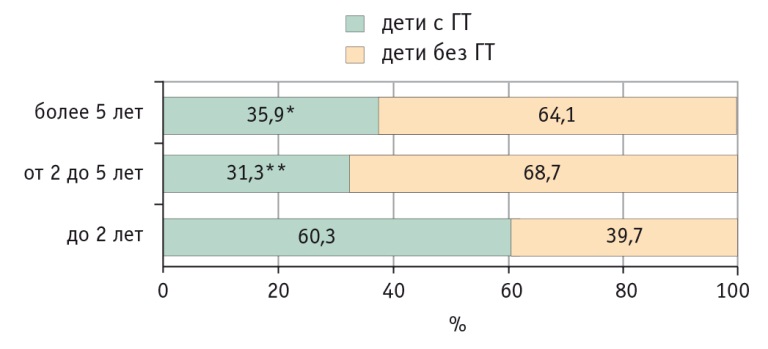
У 70 (66,7%) участников 1й и 46 (39,3%) 2й группы (p < 0,001) длительность латентного периода заболевания с момента появления симптомов до верификации диагноза не превысила 2 лет (рис. 1). У 21 (20,0%) ребенка 1й группы и 46 (39,3%) детей 2й группы этот показатель варьировал от 2 до 5 лет (p < 0,01). В частоте целиакии, не диагностированной более 5 лет, существенных различий между группами не выявлено: 14 (13,3%) и 25 (21,4%) пациентов соответственно (p > 0,05). Средняя длительность клинических проявлений заболевания у детей с ГТ составила 2,2 ± 0,2 года, а с нормальной активностью трансаминаз — 3,7 ± 0,3 года (p < 0,001). Корреляционный анализ продемонстрировал обратную связь между длительностью латентного периода целиакии и активностью АСТ (r = –0,27, p < 0,001).
Рис. 1. Частота гипертрансаминаземии (ГТ) у детей с целиакией в зависимости от длительности латентного периода, %.
Примечание. Отличие от детей с длительностью заболевания до 2 лет статистически значимо: (*) — р < 0,01; (**) — р < 0,001
Как показывает анализ клинической картины целиакии (табл. 1), у детей с ГТ статистически значимо чаще встречается типичный энтеральный синдром с диареей, полифекалией, неустойчивым стулом (p < 0,05) и вздутием живота (p < 0,05). В то же время участники 1й группы в 1,6 раза реже, чем во 2й группе (p < 0,01), жалуются на рецидивирующие боли в животе.
Таблица 1
Особенности клинической картины целиакии у детей и подростков в зависимости от активности печеночных трансаминаз, n (%)
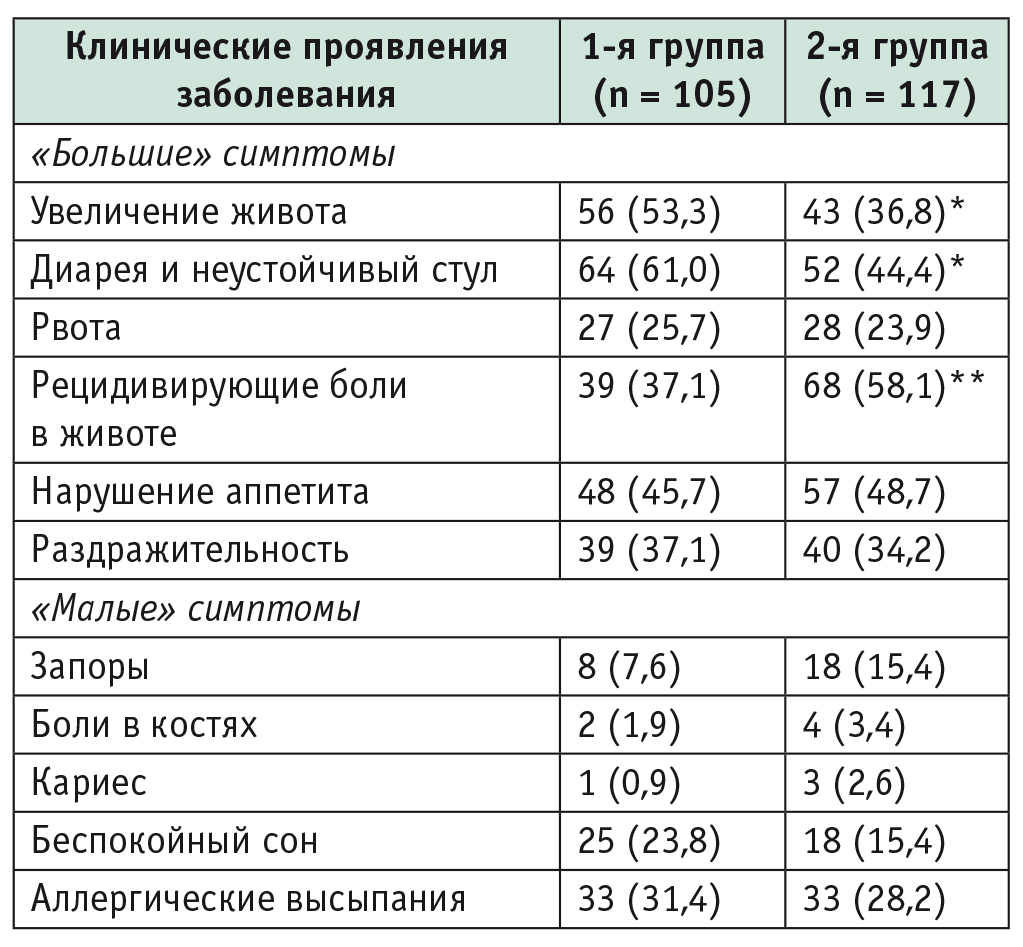
* Р < 0,05.
** Р < 0,01.
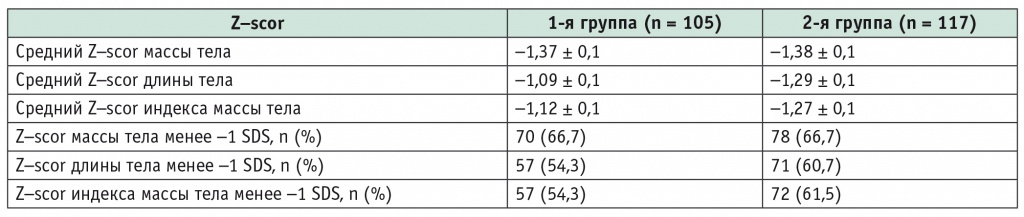
При сравнительном анализе антропометрических показателей в соответствии с критериями ВОЗ существенных различий в частоте дефицита массы тела, задержки роста и снижения ИМТ менее –1,0 SDS между пациентами с ГТ и без нее не выявлено (табл. 2).
Таблица 2
Показатели нутритивного статуса у детей и подростков в период клинической манифестации целиакии
По результатам лабораторных исследований (табл. 3), характеризующих состояние печени и билиарного тракта, активность лактатдегидрогеназы у детей с ГТ статистически значимо выше, чем у пациентов без нее (p < 0,001). У участников 2й группы больше содержание общего белка (p < 0,01), общего билирубина (p < 0,01) и непрямого билирубина (p < 0,001), чем у больных 1й группы, но в обеих группах эти показатели не выходят за рамки референсных интервалов.
Таблица 3
Результаты биохимического исследования крови у детей и подростков в период клинической манифестации целиакии (M ± m)
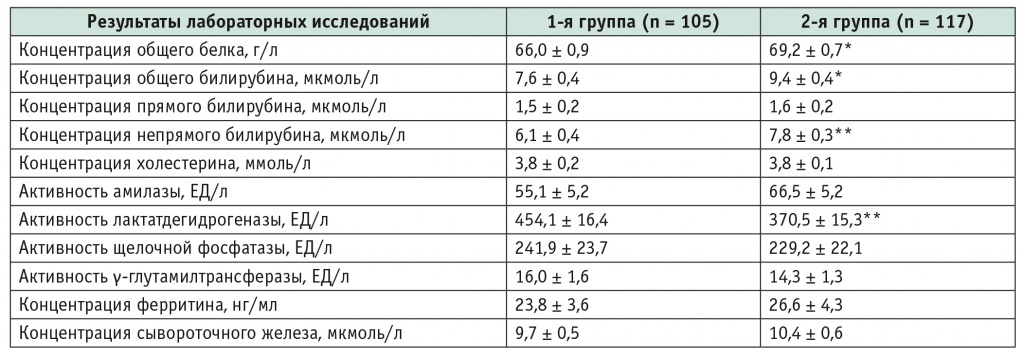
* Р < 0,01.
** Р < 0,001.
Сравнительный анализ серологических маркеров целиакии, проведенный у 112 пациентов, обнаружил положительный титр антиТТГ (более 10 Ед/мл) у 60 (98,4%) детей с ГТ при большей чувствительности антиТТГ IgA (табл. 4). Корреляционный анализ выявил прямую связь между титром антиТТГ IgA и активностью АЛТ (r = 0,26, p < 0,01).
Таблица 4
Титр антител к тканевой трансглутаминазе (анти-ТТГ) у детей и подростков с целиакией в зависимости от активности трансаминаз, n (%)
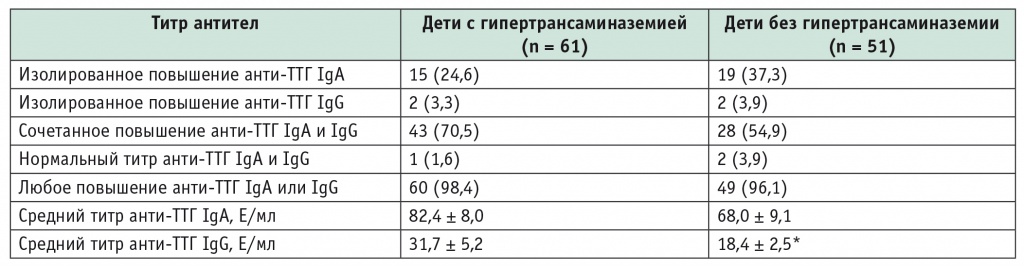
* Р < 0,05.
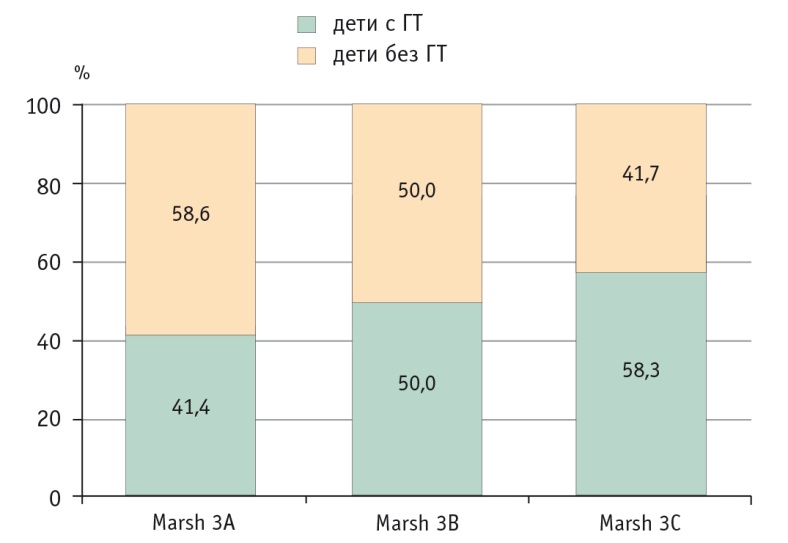
Согласно результатам анализа взаимосвязи между степенью повреждения СОТК и активностью печеночных ферментов (рис. 2), у пациентов с умеренной и тотальной атрофией, соответствующей степеням Marsh 3В и Marsh 3С, ГТ встречается несколько чаще, чем у больных с атрофией СОТК в стадии Marsh 3А. Обнаружена прямая корреляция между стадией атрофии СОТК по Marsh и активностью АЛТ (r = 0,60, p < 0,001) и АСТ (r = 0,53, p < 0,001).
Рис. 2. Частота гипертрансаминаземии (ГТ) у детей с целиакией в зависимости от степени атрофии слизистой оболочки тонкой кишки, %
ОБСУЖДЕНИЕ
Проведенное исследование позволило подтвердить рост активности печеночных трансаминаз у пациентов на момент установления диагноза. По нашим данным, повышение активности АЛТ и/или АСТ в момент верификации целиакии отмечено у 47,3% детей, что в целом вполне согласуется с результатами ранее проведенных исследований. В то же время в работах зарубежных авторов активность АЛТ чаще превышает таковую АСТ, а у наших пациентов соотношение показателей было обратным.
Полученные нами данные о взаимосвязи возраста пациентов с частотой ГТ не противоречат результатам других работ. По сведениям G. J. Lee и соавт., максимальное увеличение активности АСТ и АЛТ у детей с целиакией отмечено в более раннем возрасте. Авторы предлагают всех детей первых лет жизни с ГТ обследовать на целиакию при отсутствии других клинических предикторов повышения активности печеночных ферментов. В этом же исследовании показано, что активность трансаминаз у детей с целиакией не зависит от пола, антропометрических показателей и особенностей клинической картины [16].
Среди гастроэнтерологов всего мира достигнут консенсус по поводу тактики лабораторного обследования пациентов с целиакией, призванного не только выявить цитолитический синдром в остром периоде, но и исключить аутоиммунные поражения печени, ассоциированные с целиакией. Недавно в США исследовали активность печеночных ферментов в период установления диагноза и в динамике на фоне лечения. В большинстве случаев (78,6%) отмечена нормализация активности печеночных трансаминаз на фоне соблюдения БГД в течение 6–12 месяцев [14].
Необходимо определять активность АЛТ и АСТ в рутинной лабораторной практике у детей и взрослых с подозрением на целиакию, а также у пациентов с уже верифицированной целиакией на фоне соблюдения БГД при каждом посещении, но не реже раза в год. В случае стойкого повышения активности трансаминаз у больных целиакией на фоне соблюдения строгой БГД необходимо дальнейшее обследование с целью исключения других причин ГТ, среди которых наибольшую потенциальную угрозу представляют аутоиммунные заболевания печени.
ЗАКЛЮЧЕНИЕ
Целиакия как мультисистемное аутоиммунное заболевание, распространенность которого во всем мире неуклонно возрастает, привлекает внимание врачей многих специальностей. Современный алгоритм диагностики и мониторинга клиниколабораторных показателей на фоне лечения акцентирует внимание специалистов не только на анализе глубины морфологического повреждения кишечника, но и на выявлении ассоциированных поражений различных систем органов. Как правило, патологический процесс затрагивает печень.
Повышение активности печеночных трансаминаз в момент верификации диагноза отмечено нами у 47,3% пациентов с целиакией. Максимально часто гипертрансаминаземию (ГТ) наблюдают у детей раннего возраста (61,8%), а по мере взросления доля пациентов с повышенной активностью АЛТ и/или АСТ сокращается.
По нашим данным, у детей с ГТ несколько чаще встречаются диарейный синдром и увеличение живота, однако наиболее вероятным объяснением этого факта служит статистически значимо меньший возраст детей с ГТ, чем без нее. В то же время различий по полу и антропометрическим данным между пациентами с ГТ и без нее не выявлено.
Активность печеночных трансаминаз у детей и подростков с целиакией коррелирует с серологическими и морфологическими признаками заболевания, увеличиваясь по мере прогрессирования степени атрофии слизистой оболочки тонкой кишки и нарастания титра антител к тканевой трансглутаминазе.








