Установлено, что при наличии в анамнезе ХП риск развития рака поджелудочной железы (ПЖ) в течение 20 лет повышается в 5 раз. Анализ статистических данных, проведенный в США, выявил, что параллельно с ростом заболеваемости ХП имеет место троекратное увеличение смертности от рака ПЖ [8, 23]. При опухолях ПЖ выживаемость больных в экономически развитых и развивающихся странах различается незначительно [6].
Воспаление как защитно-приспособительный биологический механизм имеет значение для поддержания структурно-морфологического гомеостаза ткани ПЖ. Развитие воспалительной реакции — сложный комплексный процесс с участием продуктов активации ферментных систем, острофазных белков, молекул адгезии, медиаторов, вазоактивных аминов, эйкозаноидов, хемокинов, кининов, комплемента, системы свертывания крови и др. [5].
В норме гиперпролиферация направлена на восполнение полноценного и функционально зрелого участка пораженной ткани ПЖ. В условиях гипоксии и воспаления клетки изменяют свои физиологические параметры и со временем приобретают злокачественный потенциал. В дальнейшем возникает феномен субклонирования трансформированных клонов — формируются условия для иммунологической резистентности к опухолевым клеткам в зоне воспаления. Это приводит к росту опухолевого очага [12].
Взаимосвязь клеток друг с другом обеспечивается белками адгезии и целой системой матриксных металлопротеиназ (MMP). Регуляторами этой системы в норме являются тканеспецифические ингибиторы (тканевые ингибиторы металлопротеиназ — англ. tissue inhibitors of metalloproteinases, TIMPs). Процессы альтерации истощают клетки ПЖ и приводят к их дистрофии. Межклеточные контакты в зоне первично трансформированных клеток являются наиболее уязвимым компонентом при росте и развитии гиперпластического участка, и клетки легко теряют полноценную сцепленность друг с другом.
ММР — это 20 представителей семейства внеклеточных цинкзависимых эндопептидаз, способных разрушать все типы белков внеклеточного матрикса. Они необходимы для ремоделирования тканей, в процессе ангиогенеза, для поддержания нормальной интенсивности пролиферации, миграции и дифференциации клеток. ММР участвуют в ингибировании и активации апоптоза, сдерживая рост измененных клеток, задействованы в расщеплении мембранных рецепторов, выбросе апоптозных лигандов (таких как FasL), а также в активации и деактивации хемокинов и цитокинов [9, 15, 16].
Таким образом, получение более полной информации о роли MMP и их игибиторов при воспалительных и связанных с воспалением опухолевых процессах является актуальным направлением медико-биологических исследований.
Целью нашей работы являлись анализ изменения содержания ММР-2, ММР-9 и TIMP-2 в сыворотке крови больных ХП и раком ПЖ, а также оценка их возможного значения для диагностики данных заболеваний.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование количественного изменения ММР-2, ММР-9 и TIMP-2 было проведено на базе Московского клинического научно-практического центра Департамента здравоохранения г. Москвы сотрудниками отделения патологии поджелудочной железы и желчевыводящих путей, лабораторий научно-диагностических и доклинических исследований в период 2014-2016 гг.
Обследованы 75 больных ХП и раком головки ПЖ. Пациенты с раком головки ПЖ вошли в первую группу (n = 15). Больные ХП с постнекротическими кистами ПЖ (ПНКПЖ) были выделены во вторую группу (n = 23). Третья группа обследованных включала в себя 37 больных ХП и состояла из пациентов с хроническим кальцифицирующим панкреатитом (n = 16), хроническим билиарным панкреатитом с холицистэктомией в анамнезе (n = 11), хроническим идиопатическим панкреатитом (n = 10). Группу контроля, или четвертую группу, составили 13 человек без заболеваний органов пищеварения. Характеристика выделенных групп представлена в таблице 1.
Таблица 1
Характеристика обследованных групп
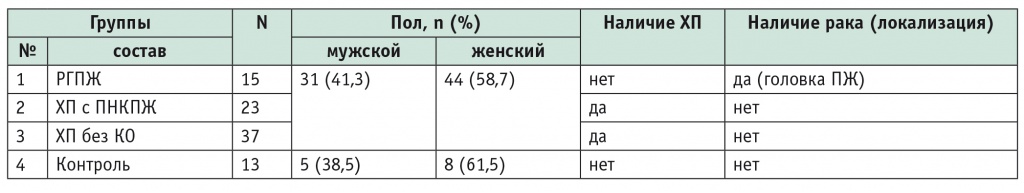
Примечание. В таблицах 1, 2, 4: КО — кистозные образования; ПНКПЖ — постнекротические кисты поджелудочной железы; РГПЖ — рак головки поджелудочной железы; ХП — хронический панкреатит.
Диагноз ХП и рака головки ПЖ был верифицирован на основании клинических, инструментальных и лабораторных данных. Рак головки ПЖ имел гистологическое подтверждение. Длительность ХП у больных с ПНКПЖ составляла от 2 до 5 лет, без кистозных образований — от 6 до 15 лет.
В крови, взятой натощак, определяли концентрации ММР-2, ММР-9 и TIMP-2 иммуноферментным методом с применением коммерческих наборов реактивов производства R&D Systems (США).
Статистический анализ различий медианных значений концентраций MMP-2, MMP-9 и TIMP-2 при различных заболеваниях и в контроле проводили с помощью теста Краскела — Уоллиса, для множественных попарных сравнений использовали post-hoc-тест Данна с поправкой Холма. Все расчеты и визуализацию результатов выполняли в компьютерной среде для статистических расчетов R (пакеты stats, PMCMR, ggplot2). Различия между группами считали статистически значимыми при значениях р ≤ 0,05.
РЕЗУЛЬТАТЫ
В ходе исследования была сформулирована гипотеза о том, что развитие ХП, формирование кисты и/или опухоли головки ПЖ являются динамическим процессом, связанным с воспалительной реактивностью ПЖ. Для уточнения правомочности данной гипотезы были отобраны наиболее значимые показатели перестройки межклеточного матрикса в области воспаления: ММР-2, ММР-9 и ингибитор (TIMP-2).
Полученные данные представлены в таблице 2 в виде медианы (Me) и 25-75%-го интервала.
Таблица 2
Уровни матриксных металлопротеиназ и ингибитора в сыворотке крови больных хроническим панкреатитом и раком поджелудочной железы, нг/мл
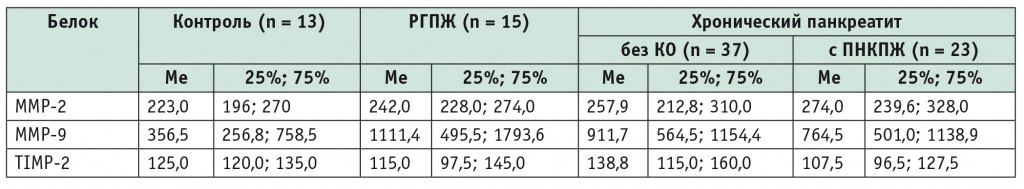
Учитывая данные литературы о возможности использования показателя ММР-9 в сыворотке крови в качестве маркера опухолевого роста в ПЖ [19], мы проанализировали пациентов с раком головки ПЖ (первая группа), больных ХП с ПНКПЖ и без кистозных образований (вторая и третья группы соответственно) и участников группы контроля. Как показало сравнение, изменения количества ММР-9 в сыворотке крови больных первой и третьей групп достоверно отличались от данных, полученных в группе контроля (р = 0,008 и р = 0,044 соответственно) (табл. 3, 4).
Таблица 3
Результаты теста Краскела — Уоллиса у больных групп исследования в сравнении с группой контроля
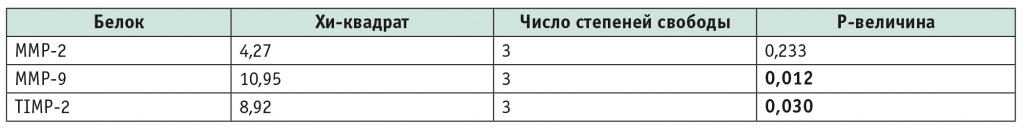
Таблица 4
Результаты post-hoc-теста Данна (Dunn's test) для попарного сравнения концентраций MMP-9 и TIMP-2 в группах больных хроническим панкреатитом и раком поджелудочной железы
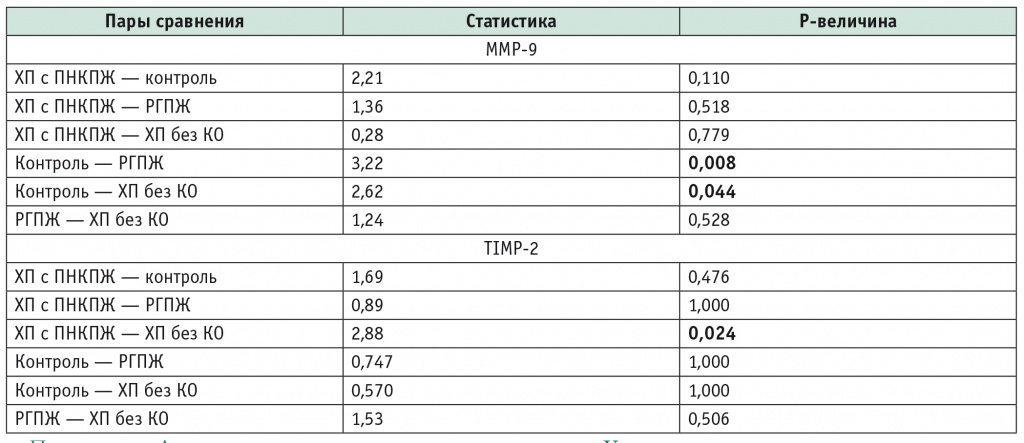
Примечание. Для коррекции p-величины использован метод Холма.
Статистически значимых различий между концентрациями ММР-2 при сравнении представленных групп найдено не было, однако изучение данного вопроса требует продолжения, так как в настоящее время серьезно обсуждается смена парадигмы разработки диагностических критериев при подозрении на рак ПЖ [24, 25]. В частности, рекомендуется проведение анализа цитологического и гистологического материалов, которые получают во время операции и/или эндоскопического обследования.
Наименьшая средняя концентрация TIMP-2 была выявлена в группе ХП и ПНКПЖ, затем в группе больных, страдающих раком головки ПЖ, а максимальная — в группе ХП без кистозных образований (см. табл. 2). При сравнении групп ХП с наличием постнекротических кист и без кист обнаружено статистически значимое уменьшение концентрации TIMP-2 у пациентов с ПНКПЖ (р = 0,024) (см. табл. 4). Сравнение остальных групп статистически значимых изменений концентрации не выявило.
ОБСУЖДЕНИЕ
Наши данные показывают закономерные изменения способности системы матриксных металлопротеиназ (ММР-2 и ММР-9) и их ингибирующих белков (TIMP-2) реагировать на процесс воспаления и опухолевого роста. С учетом результатов представленного исследования встает ряд вопросов общебиологического и медицинского значения:
1) что является первым этапом в процессе опухолевой трансформации клеток ПЖ: фактор воспаления (и связанная с ним первичная трансформация клеток) или опосредованный воспалением и связанный с ним иммунный ответ, развивающийся в самой ткани, обеспечивающий выживаемость первично трансформированных клеток и их защиту по типу «опухолевого ускользания»?
2) как происходит ремоделирование межклеточных контактов в ответ на стимулы со стороны иммунной и эндокринной систем, что обеспечивает опухолевым клеткам способность к инвазии и последующему движению?
3) каким образом изменяется активность системы тканеспецифических ингибиторов при различных типах повреждения паренхимы ПЖ и опухолевом росте в этом органе, существуют ли принципиальные различия в системе сигнальных путей этих белков при воспалении, опухолевой трансформации и на более позднем этапе развития опухоли?
Все эти вопросы носят фундаментальный характер, но их решение позволит создать стратегии ранней диагностики рака ПЖ для групп риска: лиц, страдающих ХП более 6 лет и имеющих тяжелые нарушения структуры органа.
MMP выполняют важную местную регуляторную функцию: они проводят гидролиз основных белков межклеточного матрикса. MMP-9 (76,2 kDa) способствует миграции лейкоцитов. А так как она является ключевым звеном в организации стромы опухоли, ее биологические характеристики обусловливают интерес исследователей к ней как к маркеру злокачественного фенотипа опухолей [9, 10, 21]. Учитывая, что синтез ММР-9 является индуцибельным и связан с системой белков — медиаторов острой фазы воспаления, в том числе IL-1β, IL-4, IL-10, и активаторами NKT-клеток через систему рецепторов к липополисахаридам [24], важно установить ее место в процессе опухолевого роста.
В нашем исследовании для ММР-9 статистически значимые различия были выявлены между группами контроля и рака головки ПЖ (первая группа), а также между группами контроля и ХП без кистозных образований длительностью от 6 до 15 лет (третья группа). Статистически значимых различий по этому показателю между первой и третьей группами найдено не было, что указывает на выраженные изменения межклеточного матрикса, связанные прежде всего с продолжительным хроническим воспалением. Данные о необходимости более детального изучения системы металлопротеиназ согласуются с опубликованными результатами исследований [11, 14, 17, 18], в которых указывается на диагностическую ценность и физиологическую значимость данной системы для прогнозирования исхода и течения заболеваний ПЖ.
ММР-2 (72 kDa) — представитель семейства желатиназ, отвечающий за поддержание клеточного гомеостаза в зоне хронического воспаления [13]. Благодаря этому белку формируется зона первичного роста соединительной ткани в ответ на альтерацию и хемокиновый сигнал стромальным компонентам матрикса. Динамику изменения концентрации MMP-2 рассматривают как возможный маркер рака предстательной железы [20]. Однако при работе с гистологическим материалом, полученным от больных раком желудка, была показана диагностическая ценность иммуногистохимического исследования образцов [3]. Таким образом, изучение ММР-2 как фактора межклеточного взаимодействия в большей степени информативно для иммуногистохимического исследования, что существенно осложнено при работе с ПЖ.
Учитывая наличие ELISA-технологии, существует возможность определять динамику изменения этого маркера межклеточного ремоделирования в сыворотке крови, что является предпочтительной лабораторной методикой. В нашей работе был использовании метод количественного определения ММР-2 у обследованных пациентов. Однако статистически значимых изменений выявлено не было.
Воспалительная реакция всегда связана с изменением синтеза интегринов [22]. Между интегринами, MMP-2 и MMP-9 существует тесная взаимосвязь через систему белков FAK/ILK/ERK/PI3K/NF-κB. В норме это защитный механизм, обеспечивающий постоянство клеточного состава в ткани. При воспалении происходит активация интегриновых рецепторов, что изменяет интенсивность синтеза клеткой молекул ММР-2 и ММР-9. В дальнейшем это приводит к росту новых клеточных элементов в очаге повреждения целостности ткани. При опухолевом процессе активация той же системы обусловливает биодеградацию нормальных защитных барьеров в зоне первичного опухолевого роста и способствует активной инвазии клеток. Таким образом, ММР-2 и ММР-9 являются маркерами, косвенно указывающими на степень активации системы белков FAK/ILK/ERK/PI3K/NF-κB, что позволяет оценить глубину изменения в очаге воспаления и степень трансформации клеток, в нем находящихся. Учитывая наши данные, требуется уточнить, что ХП всегда сопровождается динамическими изменениями как со стороны паренхимы, так и со стороны соединительной ткани, которая постепенно замещает паренхиматозную. Это явление формирует предпосылки к грубому изменению и самих клеток, и их микроокружения.
TIMP-2 является ингибитором ММР-2, он также связан с перестройками межклеточных контактов в процессе приспособления органа к условиям ненормального биохимического регулирования клеточного гомеостаза [4, 13]. Изменение содержания TIMP-2 в тканях определяют несколькими методами, из которых наиболее чувствителен белковый гельэлектрофорез материала, полученного из образца ткани. Логично предположить, что его количество напрямую зависит от активности воспаления и деструкции тканей ПЖ, степени фиброгенеза и организации участков трансформации, что показало выявленное в нашем исследовании различие между группами ХП с длительностью заболевания от 2 до 5 лет и от 6 до 15 лет.
ЗАКЛЮЧЕНИЕ
У больных с длительно текущим хроническим панкреатитом (ХП) повышается риск развития рака поджелудочной железы (ПЖ). Уровень матриксной металлопротеиназы 9-го типа можно использовать в качестве дополнительного критерия при определении индивидуального прогноза у больных ХП. Изменения данного показателя максимальны у пациентов с раком головки ПЖ.
Оценивая результаты проведенного исследования, можно заключить, что изучение таких показателей, как система матриксных металлопротеиназ и их ингибиторов, является актуальной и клинически значимой задачей в связи с возможностью их использования с диагностической и прогностической целью при раке и воспалительных заболеваниях ПЖ.







