Анемический синдром — наиболее раннее и частое проявление МДС. С увеличением стажа заболевания нарастает степень выраженности анемии, оказывающей крайне негативное влияние как на качество, так и на продолжительность жизни больных. МДС — это заболевание преимущественно пожилых людей: средний возраст пациентов составляет 60-65 лет [1, 4]. Снижение уровня гемоглобина усугубляет течение гипертонической болезни, ишемические кардиальные проблемы, значительно ухудшает прогноз выживаемости, увеличивая риск летальных исходов от сердечно-сосудистой недостаточности [6].
Для большинства пациентов единственным методом коррекции анемии остается гемотрансфузионная терапия, однако такое лечение может привести к осложнениям, связанным с избытком посттрансфузионного железа [1, 2, 4]. Избыток железа — это накопление его в различных органах в результате повышенной кишечной абсорбции и/или парентерального введения [3]. Гомеостаз железа крайне важен и регулируется сложной системой, которая включает абсорбцию, транспортировку и хранение железа с участием нескольких регуляторных белков. В организме человека отсутствуют физиологические механизмы выведения данного микроэлемента, вследствие чего нарушение механизмов регуляции его обмена быстро приводит к перегрузке железом. Каждая доза эритроцитарной массы содержит около 200 мг железа, которые высвобождаются макрофагами селезенки и печени и рециркулируют в организме реципиента. Больные с регулярными гемотрансфузиями не реже 4 раз в месяц за год получают более 40 доз эритроцитарной массы. Физиологическая потеря железа за счет слущивающегося эпителия составляет 1,2 мг/сут. Таким образом, количество не утилизированного организмом железа за год может превысить 8,0 г.
Как видно из рисунка 1, железо токсично для многих систем и органов, но основной причиной смерти пациентов, регулярно получающих гемотранcфузии, является гемосидероз печени и сердца [36, 43].
Рис. 1. Клинические изменения при перегрузке железом [43].
Примечание. ОМЛ — острый миелобластный лейкоз
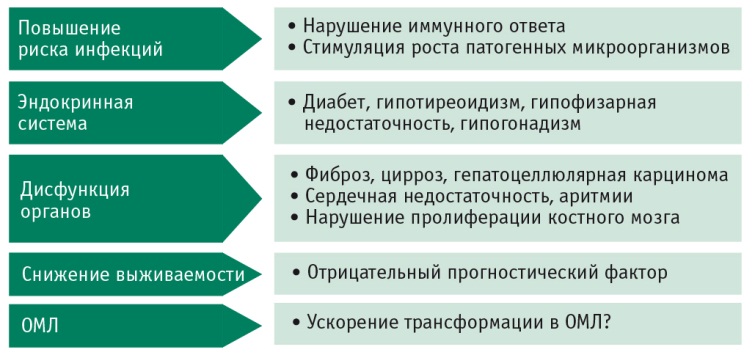
Негативное воздействие железа на эти органы при его чрезмерном поступлении и хранении проявляется в виде сердечной дисфункции и недостаточности, фиброза печени с возможным формированием цирроза. Патогенез токсичности железа, влияние его повышенного количества на печень и сердце с подробным обзором методов диагностики и лечения представлены в данной статье.
ПАТОГЕНЕЗ ТОКСИЧНОСТИ ЖЕЛЕЗА
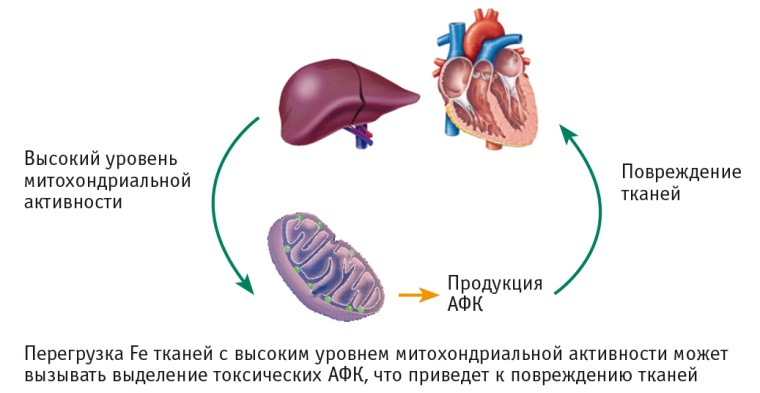
Притом что железо является жизненно важным элементом в нормальной физиологической деятельности клетки, чрезмерное его накопление в паренхиме печени и сердца приводит к появлению клеточной токсичности, повреждению тканей и развитию фиброзных изменений этих органов (рис. 2) [13, 26, 37].
Рис. 2. Прямое токсическое воздействие активных форм кислорода на печень и сердце [13, 26].
Примечание. АФК — активные формы кислорода
Будучи металлом, железо не растворяется ни в плазме, ни в цитозоле, поэтому во избежание токсических эффектов, которые могут развиться из-за способности железа генерировать активные формы кислорода (АФК), оно должно быть связано с другой молекулой [11]. Редокс-активное, или свободное, железо способствует образованию АФК, вызывающих преобразование двухвалентного железа в трехвалентное [23]. Этот процесс сопровождается генерацией токсичных гидроксильных радикалов, взаимодействующих с пероксидом водорода. Гидроксильные радикалы, которые образуются в результате реакций, катализируемых железом, атакуют полиненасыщенные жирные кислоты мембран. Накопление железа усиливает перекисное окисление липидов (ПОЛ) мембран внутриклеточных структур, что способствует повреждению клеток [18, 19].
В клеточных органеллах, таких как митохондрии, пероксисомы и микросомы, и при нормальном содержании железа образуются значительные количества АФК, но концентрация последних поддерживается на постоянном уровне ферментами супероксиддисмутазой, каталазой и глутатион-пероксидазой, разрушающими их до нетоксичных продуктов. При перегрузке железом этот баланс полностью деформируется [34], что также считается одной из основных причин повреждения клеток и органов.
В результате клетки гибнут, а стимулированный железом синтез коллагена способствует развитию соединительной ткани в печени, сердце, эндокринных железах [11, 20].
На рисунке 3 показаны механизмы патогенеза посттрансфузионного гемосидероза печени [45].
Рис. 3. Патогенетические механизмы развития посттрансфузионного синдрома перегрузки железом печени [45].
Примечание. IK+ — (выходящий) калиевый ток; INa+ — (входящий) натриевый ток; Na-K ATPase — Na-K-adenosine triphosphatase (Na+/K+-аденозинтрифосфатаза); NTBI — non-transferrin bound iron (железо, не связанное с трансферрином); DMT1 — divalent metal transporter 1 (мембранный белок — переносчик двухвалентных катионов); LVDC — L-type Ca2+ voltage dependent channel (кальциевый потенциалзависимый канал L-типа); Tf-FE — transferrin-bound iron (железо, связанное с трансферрином)
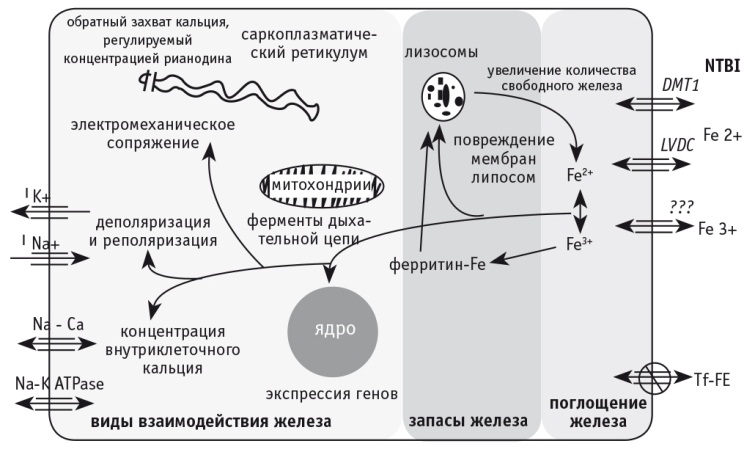
В условиях излишнего внутриклеточного железа избыток АФК обусловливает оксидантное повреждение макромолекул, легко нарушает структуру ДНК [28]. Показано, что у пациентов с гемохроматозом 200-кратно увеличивается риск развития гепатоцеллюлярной карциномы, — это говорит о значимости железа в повреждении ДНК [42, 51]. Наблюдается также накопление железа в лизосомах. Это приводит к развитию их хрупкости и дисфункции с последующим повреждением клеток путем высвобождения депонированного железа и гидролитических ферментов в цитоплазму, вызывая цитолиз.
ПОЛ, как полагают, играет важную роль в развитии хрупкости лизосом. Кроме того, ПОЛ влияет на мембраны других клеточных структур, включая митохондрии, эндоплазматический ретикулум и цитоплазматическую мембрану. Дисфункция митохондрий при перегрузке железом может быть также вызвана снижением секвестрации и увеличением высвобождения Ca2+, повреждением митохондриальной ДНК [48]. При этом активации ПОЛ способствует как избыток ферритина, так и гемосидерин [19].
Все эти внутриклеточные процессы приводят к развитию функциональной дестабилизации, повреждению и некрозу гепатоцитов и кардиомиоцитов [20, 50].
ПАТОЛОГИЯ ПЕЧЕНИ, АССОЦИИРОВАННАЯ С ПОСТТРАНСФУЗИОННЫМ ГЕМОСИДЕРОЗОМ
Печени принадлежит существенная роль в обмене железа. В физиологических условиях в ней синтезируются трансферрин, отвечающий за транспорт железа в крови, церулоплазмин, проявляющий свою активность в качестве ферроксидазы, и основной регулятор системного гомеостаза железа — гепсидин. Печень первой получает железо из кишечника и селезенки и в связи с этим чрезвычайно подвержена перегрузке железом при избыточном его содержании в плазме, особенно благодаря своей высокой способности поглощать железо плазмы, не связанное с трансферрином [11].
При посттрансфузионном гемосидерозе печени происходят некроз гепатоцитов, избыточное образование коллагена, что в будущем приводит к циррозу [8, 35]. Сначала печень увеличивается в размерах, становится плотной, болезненной при пальпации. Затем, на фоне формирования цирроза, она уменьшается, развивается симптоматика печеночно-клеточной недостаточности и портальной гипертензии. В печени железо депонируется в перипортальных клетках. Позже развивается перилобулярный фиброз, железо начинает откладываться в эпителиоцитах желчных протоков, купферовских клетках и фиброзных перегородках, истощается возможность выработки гепсидина [14, 17]. Достаточно быстро агрессивность свободного железа приводит к функциональным нарушениям печени, фиброзу и, в итоге, к циррозу с высоким риском формирования гепатоцеллюлярной карциномы [38].
Наиболее частым изменением со стороны печени является гепатомегалия, в то время как активность печеночных ферментов — аланин-, аспартатаминотрансферазы (АЛТ, АСТ) — часто долго остается на нормальном уровне, так как данное состояние не является воспалительным процессом [28, 29].
Для развития фиброза, как предполагается, требуется значительная перегрузка железом с накоплением его в клетках Купфера. В норме синтез и разрушение коллагена в печени сбалансированы. Фиброз развивается в случае нарушения этого баланса, в результате чего происходит аккумулирование интрацеллюлярного матрикса. Для синтеза последнего определенное значение имеют звездчатые клетки (клетки Ито).
Роль звездчатых клеток печени в состоянии перегрузки железом до сих пор остается не до конца изученной. Показано, что в культуре клеток, выделенных из печени крыс с перегрузкой железом, активность синтеза коллагена в 2 раза превышает таковую в клетках, взятых у животных с нормальным обменом железа. Еще в 1997 г. G. A. Ramm и соавт. опубликовали данные исследования, продемонстрировавшие статистически значимую связь между концентрацией железа в печени при гемохроматозе и количеством активированных перисинусоидальных звездчатых клеток. После венесекции количество этих клеток значительно уменьшалось [45]. Таким образом, звездчатые клетки печени играют важную роль в развитии фиброза печени, так как они могут быть активированы в коллагенпродуцирующие клетки. По всей видимости, данный процесс регулируется целым рядом механизмов, а начальные звенья его может активировать избыточное железо, депонируемое в клетках [22].
Более чем у 80% пациентов с гемохроматозом печени отмечаются эндокринопатии: поражаются гипофиз и эпифиз, щитовидная, поджелудочная и половые железы. У многих пациентов с эндокринопатиями развивается сахарный диабет, зачастую инсулинозависимый. Очень часто поражаются суставы, центральная нервная система [44, 46].
За последние годы проведено достаточно большое количество клинических исследований, в которых изучалась зависимость формирования и прогрессирования фиброза печени от интенсивности гемотрансфузионной терапии. Так, при изучении влияния посттрансфузионной перегрузки железом на развитие печеночной недостаточности японскими гематологами (M. Takatoku и соавт.) были обследованы 292 пациента с МДС, апластической анемией, остеомиелофиброзом [48]. Длительность наблюдения составила 5 лет. Средний период трансфузионной зависимости был около 32 месяцев.
Уровень ферритина определили у 78% пациентов. Величина этого маркера статистически значимо коррелировала с частотой трансфузий, с уровнями АЛТ, АСТ и риском дисфункции печени, а также с летальностью от перегрузки железом. Среди пациентов, у которых оценивалась функция печени (МРТ печени), в 84,6% случаев были выявлены отклонения от нормы. При наличии печеночных нарушений в 91,9% случаев уровень ферритина превышал 1000 нг/мл. Зарегистрировано 75 летальных исходов. Причинами последних часто были инфекции и лейкоз. Наряду с этим от сердечной и печеночной недостаточности умерли 38 пациентов (24,0% и 6,7% соответственно). Пациенты, причиной смерти которых была сердечная и печеночная недостаточность, получили больше трансфузий, чем те, кто умер от других причин (число трансфузий — 289,2 и 160,7 соответственно). Кроме того, почти все больные (37 пациентов, или 97,4%) умерли с показателем ферритина ≥ 1000 нг/мл. У 24 человек уровень ферритина превышал 5000 нг/мл [48].
Данное исследование подтвердило, что ферритин — маркер для «предсказания» коморбидных состояний печени при перегрузке железом. А риск развития печеночной дисфункции у гемотрансфузионно-зависимых пациентов с МДС имеет прямую корреляцию с интенсивностью гемотрансфузионной нагрузки [48].
ПАТОЛОГИЯ СЕРДЦА, АССОЦИИРОВАННАЯ С ПОСТТРАНСФУЗИОННЫМ ГЕМОСИДЕРОЗОМ
Снижение концентрации гемоглобина в периферической крови инициирует развитие гемодинамических нарушений, которые постепенно приводят к увеличению размеров сердца и гипертрофии миокарда левого желудочка (ЛЖ). Используемая для коррекции анемического синдрома гемотрансфузионная терапия способствует перегрузке железом миокарда [7].
В условиях избытка железа двухвалентное железо входит в миоциты по вольтзависимым кальциевым каналам L-типа. Железо поглощается миокардом значительно медленнее, чем печенью, соответственно, избыток железа в миокарде развивается на более поздней стадии в сравнении с печенью [17, 41]. Процесс отложения железа происходит сначала в вентрикулярном миокарде, затем в миокарде предсердия, а также затрагивает проводящую систему. Концентрация железа в эпикардиальной железе, как правило, выше, чем в субэндокардиальной, но согласно недавним исследованиям никаких различий в отложении железа в разных сегментах ЛЖ нет. Железо хранится в миоцитах в виде ферритина, гемосидерина и лабильного клеточного железа (свободного железа), причем последнее является наиболее активным [35]. Увеличение транспортировки двухвалентного железа через кальциевые каналы L-типа приводит к расстройству транспортировки кальция, что, в свою очередь, может стать причиной развития диастолической и систолической дисфункций желудочков, которые наблюдаются при избытке железа. Конечным результатом этого процесса является развитие кардиомиопатии, которая характеризуется дисфункцией ЛЖ [32, 39].
Термин «избыток железа при кардиомиопатии» был введен для описания вторичной формы кардиомиопатии с ремоделированием ЛЖ, камерной дилатацией и уменьшением фракции выброса ЛЖ (ФВЛЖ). Пострансфузионный гемосидероз сердца классически классифицировался как инфильтративная причина рестриктивной кардиомиопатии, приводящая к серьезной диастолической дисфункции ЛЖ на ранних стадиях заболевания, еще до уменьшения ФВЛЖ. Позднее были определены два типа избытка железа: дилатационный тип, отличающийся процессом ремоделирования ЛЖ, что характерно для ранних сроков перегрузки железом, а также рестриктивный тип, при котором отмечается диастолическая дисфункция ЛЖ с рестриктивным заполнением, легочной гипертензией и последующей правой вентрикулярной дилатацией. Рестриктивная дисфункция ЛЖ, особенно у пациентов старшей возрастной группы, приводит к развитию легочной гипертензии, дилатации правого желудочка и крайне опасной правосторонней сердечной недостаточности [31]. Аномалии сердечной проводимости, тахиаритмии, перимиокардиты ухудшают течение ишемической болезни сердца и обусловливают системный атеросклероз сосудов, приводя к ранней смерти при МДС. Таким образом, у больных МДС значительно возрастает частота кардиальных проблем, вызванных нарушением проводящей системы сердца, повреждением кардиомиоцитов, с итоговым летальным исходом [9, 41, 49].
Исследованием, убедительно доказавшим, что перегрузка миокарда железом нарушает функцию миокарда у больных МДС с регулярными трансфузиями, стала работа L. Pascal и соавт. с участием 75 гемотрансфузионно-зависимых пациентов с МДС [42]. Пациенты были распределены по трем группам в зависимости от общего числа полученных трансфузионных единиц: с низким количеством трансфузий (≤ 50), с промежуточным (> 50 и ˂ 150) и с высоким (≥ 150). Кардиальный Т2 оценивался методом МРТ, функция сердца дополнительно изучалась путем оценки ФВЛЖ при проведении рутинной Эхо-КГ. Перегрузку миокарда железом определяли при Т2 ≤ 20 мс, а тяжелую перегрузку — при Т2 < 10 мс. ФВЛЖ ˂ 55% рассматривали как отклонение от нормы, а серьезную кардиальную дисфункцию диагностировали при ФВЛЖ ˂ 35%.
Средний уровень ферритина составил 467 нг/мл в момент диагностирования заболевания и 1743 нг/мл через 12 месяцев. У 14/75 пациентов (18,7%), которые получили в среднем 202 трансфузии, кардиальный Т2 был ≤ 20 мс, у троих из них Т2 был очень низким (< 10 мс). Была найдена обратная зависимость между числом полученных единиц трансфузий и Т2. Т2 ≤ 20 мс выявлен у 1/21 пациента (4,8%) из группы с низкой трансфузионной зависимостью, у 4/37 (10,8%) — со средней и 9/17 (52,9%) — с высокой. Одновременно с МРТ-оценкой ФВЛЖ была измерена у 57/75 пациентов. Среднее значение ФВЛЖ составило 66%. У 13/57 пациентов (23,1%) обнаружена ФВЛЖ ≤ 55%, у 4/57 (7,0%) — ФВЛЖ ≤ 35%. У 3/4 пациентов (75,0%) с ФВЛЖ ≤ 35% Т2 был ≤ 20 мс [42].
Таким образом, доказано, что перегрузка железом ухудшает систолическую функцию у пациентов с регулярными переливаниями крови. Данное исследование достоверно продемонстрировало: перегрузка железом может быть значительным аггравантным фактором в формировании сердечной недостаточности при МДС наряду с хронической анемией и другими коморбидными состояниями [42].
Помимо прямого повреждения миокарда избыток железа может влиять на сердце косвенно — через другие органы. Нарушение функции печени, сахарный диабет, гипотиреоз, гипопаратиреоз и иммунодефицит при посттрансфузионном гемосидерозе вносят свой вклад в патофизиологию поражения миокарда.
Избыток железа способствует возникновению и прогрессии специфического типа кардиомиопатии, требующего мультидисциплинарного подхода к диагностике и лечению [33, 39].
ДИАГНОСТИКА ПОСТТРАНСФУЗИОННОГО ГЕМОСИДЕРОЗА ПЕЧЕНИ И СЕРДЦА
Повышенное отложение железа в организме можно выявить непосредственно при проведении биопсии органа или косвенно по результатам различных исследований.
Лабораторные признаки перегрузки железом включают в себя:
- снижение уровня сывороточного трансферрина, общей железосвязывающей способности сыворотки;
- повышение коэффициента насыщения трансферрина железом;
- увеличение экскреции железа с мочой (десфераловый тест);
- самый главный лабораторный показатель, свидетельствующий о перегрузке железом, — уровень сывороточного ферритина свыше 800-1000 мкг/л.
Биопсия печени в настоящее время не считается решающей опцией для постановки диагноза печеночной перегрузки железом. Однако она дает возможность клинически оценить количество железа и серьезность повреждения гепатоцитов и долек, степень фиброза печени, а также выявить сопутствующие заболевания печени, которые невозможно определить неинвазивными методами. Биопсия печени с последующим морфологическим и гистохимическим исследованием достаточно информативна, но сопряжена с опасными кровотечениями при нарушенной функции печени.
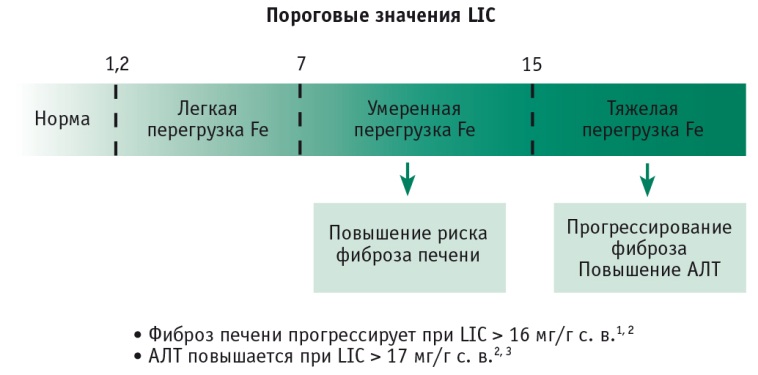
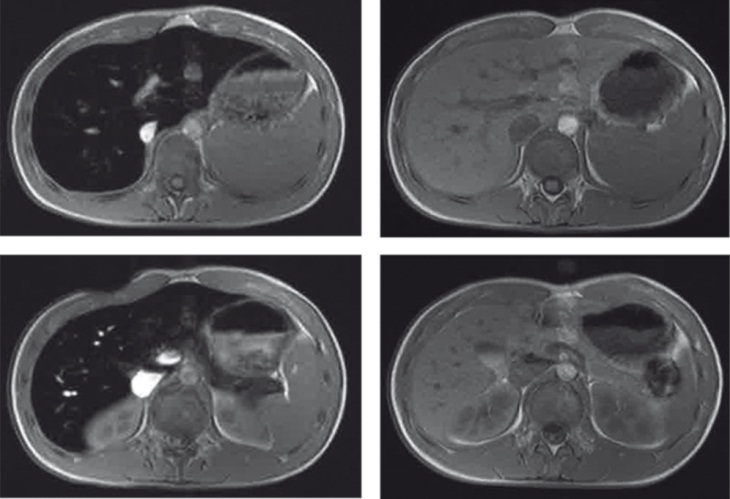
Cогласно данным рисунка 4 нормальный уровень свободного железа печени (СЖП) — 0,6-1,2 мг/г сухого вещества (с. в.). Перегрузка СЖП более 7 мг/г с. в. часто сопровождается повышенным риском осложнений, таких как фиброз печени, с последующим формированием цирроза. А при уровне СЖП выше 15 мг/г с. в. риск смерти от печеночной и сердечно-сосудистой недостаточности увеличивается многократно [2, 3].
Рис. 4. Степень перегрузки железом печени по данным магнитно-резонансной томографии.
1 Angelucci E., Muretto P., Nicolucci A., Baronciani D. et al. Effects of iron overload and hepatitis C virus positivity in determining progression of liver fibrosis in thalassemia following bone marrow transplantation // Blood. 2002. Vol. 100. N 1. P. 17-21.
2 Olivieri N. F., Brittenham G. M. Iron-chelating therapy and the treatment of thalassemia // Blood. 1997. Vol. 89. N 3. P. 739-761.
3 Jensen P. D., Jensen F. T., Christensen T., Nielsen J. L. et al. Relationship between hepatocellular injury and transfusional iron overload prior to and during iron chelation with desferrioxamine: a study in adult patients with acquired anemias // Blood. 2003. Vol. 101. N 1. P. 91-96.
Примечание. АЛТ — аланинаминотрансфераза; с. в. — сухое вещество; LIC — концентрация железа в печени, мг/г сухого вещества
С появлением МРТ печени в Т2-режиме получен реальный и высокоинформативный метод диагностики посттрансфузионного гемосидероза (рис. 5) [28].
Рис. 5. Посттрансфузионный гемохроматоз печени по данным магнитно-резонансной томографии у пациента с миелодиспластическим синдромом. Слева патология, справа норма. Фото автора
Прямая корреляция между изменениями кардиального статуса больных МДС по данным ЭКГ и Эхо-КГ и степенью посттрансфузионного гемосидероза миокарда отсутствует [31]. Прямое измерение уровня железа в сердце клинически затруднено, а биопсия миокарда не используется из-за риска осложнений и возможности ошибки в связи с неоднородностью распределения миокардиального железа на микроскопическом уровне.
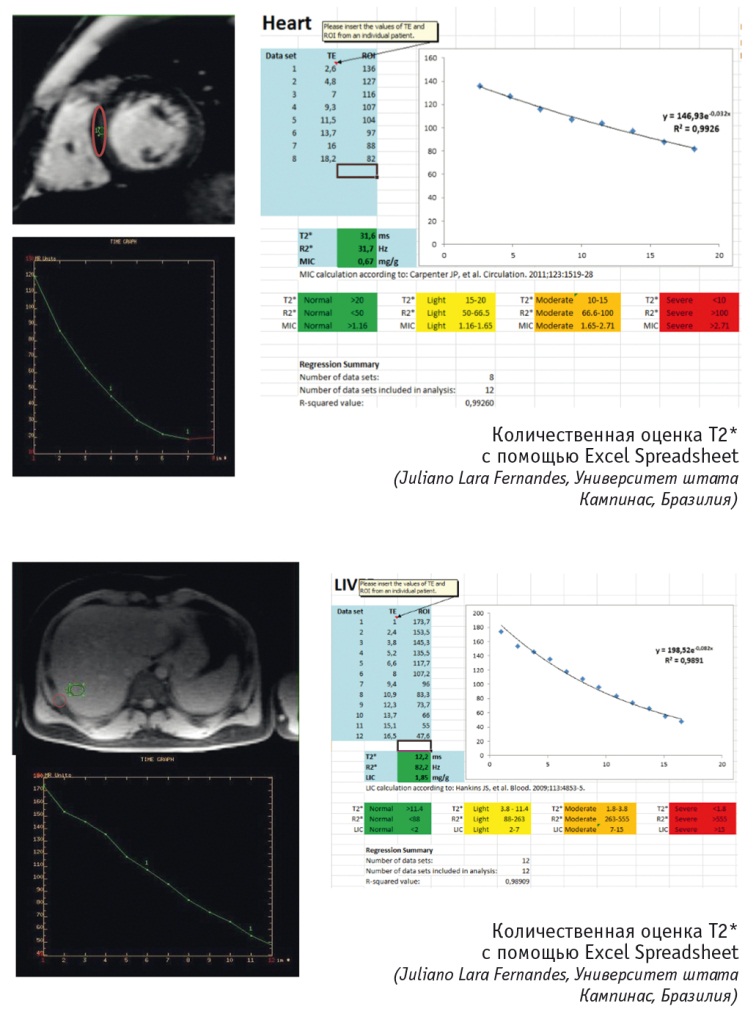
Современным неинвазивным методом диагностики перегрузки железом миокарда также является МРТ в Т2-режиме [14, 16]. МРТ сердечно-сосудистой системы и T2*-релаксометрия позволили количественно оценить избыток железа и подтвердили корреляцию между фракцией выброса и накоплением железа в миокарде. Гемосидерин — продукт распада ферритина — существует в его главной форме как ферригидрит, являющийся ферромагнетиком, и может быть обнаружен при МРТ сердца. Оценка содержания железа в сердце с использованием миокардиального параметра релаксации Т2 основана на микроскопическом возмущении магнитного поля, вызываемого частицами гемосидерина. Нормальный миокардиальный Т2 составляет 40 секунд. Менее чем 20-секундные величины Т2 могут указывать на миокардиальный гемосидероз (рис. 6). У большого количества пациентов с гемохроматозной сердечной недостаточностью Т2 не достигает 10 секунд. Это значение является пороговым для определения тяжелой миокардиальной перегрузки железом [4, 15, 28].
Рис. 6. Количественная оценка степени перегрузки железом по результатам магнитно-резонансной томографии печени и сердца. Собственные данные
ЛЕЧЕНИЕ ПОСТТРАНСФУЗИОННОГО ГЕМОСИДЕРОЗА
У пациентов с гемотрансфузионно-зависимой формой МДС лечение, состоящее из регулярных и многократных трансфузий эритроцитарной массы, достаточно быстро приводит к развитию перегрузки железом [40]. Назначение препаратов, выводящих железо (хелаторов), позволяет избежать серьезных осложнений, в первую очередь поражений сердца и печени. Хелаторы железа связывают внутриклеточные и внеклеточные атомы железа и ускоряют его экскрецию [12]. Основная цель лечения — снижение концентрации железа, депонированного в тканях. Выведение железа осуществляется достаточно медленно, поэтому для снижения концентрации микроэлемента до субтоксического уровня крайне важна высокая комплаентность пациентов, обеспечивающая длительность и регулярность приема хелаторов [46].
С момента появления в клинической практике в 1960 г. хелатора железа дефероксамина продолжительность жизни трансфузионно-зависимых пациентов значительно увеличилась. Однако низкая биодоступность при пероральном приеме, короткий период полувыведения препарата из плазмы крови требуют длительного парентерального введения [38]. Содержание железа при приеме хелаторов железа должно контролироваться ежемесячно путем измерения уровня ферритина. Кроме этого, рекомендована регулярная оценка концентраций креатинина, печеночных ферментов [30].
В 2005 г. в качестве средства для лечения пациентов с хронической посттрансфузионной перегрузкой железом был зарегистрирован пероральный хелатор железа деферазирокс (Эксиджад) [11]. Деферазирокс — современный хелаторный препарат. Ввиду длительного периода полувыведения его назначают для перорального приема 1 раз в сутки. Деферазирокс связывает железо, не связанное с трансферрином, и выводит его преимущественно с калом. Он способен проникать внутрь клеток (в том числе в гепатоциты и кардиомиоциты) [29]. Согласно последним рекомендациям Экспертного совета российских гематологов по лечению посттрансфузионного гемосидероза у пациентов с МДС, препарат показан больным низкого и промежуточного 1 риска, которым требуются постоянные гемотрансфузии, при уровне ферритина в сыворотке крови более 1000 нг/мл. За годы применения деферазирокс показал достаточно высокую эффективность при хорошей переносимости и удобстве приема [10, 27]. Препарат характеризуется благоприятными показателями пероральной биодоступности, комплекс «железо + деферазирокс» не абсорбируется в кишечнике [30].
Высокую эффективность деферазирокса подтверждают результаты многочисленных клинических исследований. Так, проведенное в 2010 г. годичное исследование ЕРIC с участием 1744 гемотрансфузионно-зависимых пациентов показало стойкое снижение уровня ферритина сыворотки крови на фоне приема деферазирокса со среднего значения в начале лечения 1200 нг/мл до 606 нг/мл через 12 месяцев [27]. Степень снижения зависела от дозы препарата и скорости поступления микроэлемента в организм. Отмечено статистически значимое уменьшение активности АЛТ, причем выраженность этого процесса коррелировала с уменьшением показателя ферритина. У пациентов со снижением уровня ферритина до 500 нг/мл активность АЛТ восстанавливалась до референсных значений 20-31 МЕ/л с 59-76 МЕ/л в начале терапии.
В 2012 г. были опубликованы данные российского многоцентрового трехлетнего открытого проспективного исследования по оценке безопасности и эффективности деферазирокса у больных МДС низкого и промежуточного 1 риска, талассемией. Основными критериями включения в исследование считались уровень ферритина выше 1000 мкг/л и сохранявшаяся потребность в переливаниях эритроцитарной массы. Медиана концентрации ферритина на фоне приема деферазирокса снизилась с 3837 мкг/л на нулевом визите до 2269 мкг/л на визите № 12. Уменьшение концентрации ферритина коррелировало с улучшением биохимических печеночных тестов [3]. Самые частые нежелательные явления, отмеченные при приеме препарата, — функциональные нарушения ЖКТ (диспепсия, тошнота, снижение аппетита) и сыпь на коже. Побочные эффекты имели слабую или умеренную степень выраженности с достаточной возможностью компенсации [3].
Таким образом, терапия деферазироксом должна быть скорректирована в соответствии с потребностями пациента. При этом основополагающими факторами при выборе дозы являются трансфузионная потребность, тяжесть перегрузки железом, а также цель лечения — поддержание баланса или снижение содержания железа в организме [1, 2, 25].
ОБСУЖДЕНИЕ
Основным методом лечения пациентов с МДС низкого и промежуточного 1 риска являются трансфузии эритроцитарной массы [24, 47]. В многочисленных ретроспективных исследованиях установлена обратная связь между зависимостью от гемотрансфузий и общей выживаемостью больных МДС [1, 2, 4, 12, 40]. Отмечается объективная связь между гемотрансфузионной зависимостью и поражением сердца и печени [9]. У большинства пациентов с МДС, умерших не от лейкемизации, а вследствие сердечно-сосудистой и печеночной недостаточности, отмечались значительная перегрузка железом и высокая потребность в переливаниях эритроцитарной массы [1-3].
Сывороточный ферритин является суррогатным маркером перегрузки железом. Средняя сывороточная концентрация более 1000 нг/мл и уровень сывороточного железа выше 40 мкмоль/л оказывают значительное неблагоприятное воздействие на функции печени и сердца. Клетки этих органов имеют повышенную экспрессию рецепторов к трансферрину, основная роль которого состоит в переносе железа из сыворотки в цитоплазму. Свободное железо участвует в окислительно-восстановительных реакциях. Свободнорадикальное окисление приводит к окислению липидов, белков, к гибели клеток печени и миокарда. При МДС указанные эффекты усиливаются, так как свободнорадикальное окисление активируется и в ходе патологических изменений, свойственных самому заболеванию.
Проблема избытка железа в организме при МДС имеет возрастающее клиническое значение, однако достаточно узко исследована. Для ее изучения требуются особые диагностические и терапевтические подходы.
ЗАКЛЮЧЕНИЕ
В настоящее время появились возможности точной лабораторной и магнитно-резонансной идентификации и эффективной борьбы с осложнениями посттрансфузионного гемосидероза. Следует уделять большое внимание риску развития перегрузки железом у гемотрансфузионно-зависимых пациентов с миелодиспластическим синдромом, проводя регулярный скрининг ферростатуса, инструментальные исследования функционального состояния сердца и печени. Анализ результатов такого обследования позволит предупредить токсическое поражение гепатобилиарной и сердечно-сосудистой систем и в последующем снизить риск развития летальных печеночных и сердечно-сосудистых событий своевременным назначением препаратов — хелаторов железа.








