Доля коморбидных пациентов, страдающих различными хроническими заболеваниям, прежде всего с поражением опорно-двигательного аппарата, и нуждающихся в НПВП, ныне неуклонно растет. Боль, являющаяся основным клиническим проявлением наиболее распространенных заболеваний суставов и позвоночника, значительно снижает качество жизни пациентов. Следовательно, максимально полное и быстрое купирование болевого синдрома — первоочередная задача терапии, в связи с чем больным рекомендуется прием НПВП. Вместе с тем около 75% пациентов предпочитают вообще не обращаться к врачу и решать проблему самостоятельно либо получить помощь в аптеке у фармацевта-провизора [1].
НПВП являются доступным и обоснованным средством не только анальгетической, но и патогенетической терапии острой или хронической боли. Общеизвестно, что в основе действия НПВП лежит угнетение синтеза простаноидов, которое обусловлено торможением активности циклооксигеназы (ЦОГ) — основного фермента, участвующего в метаболизме арахидоновой кислоты. НПВП не только обеспечивают значимый анальгетический эффект и способны влиять на периферический и центральный механизм ноцицепции, но и оказывают противовоспалительное действие.
Негативное влияние на верхние отделы ЖКТ объясняется способностью НПВП воздействовать на функцию слизистой оболочки пищеварительного тракта через блокаду ЦОГ-1, приводящую к уменьшению локального синтеза физиологических простагландинов, к стимуляции моторики ЖКТ и усилению секреции соляной кислоты и т. д., что существенно снижает защитный потенциал слизистой ЖКТ и ее устойчивость к повреждающему действию факторов агрессии.
При выборе любого лекарственного средства большое значение имеет не только его высокая эффективность, но и безопасность, которая чрезвычайно актуальна для коморбидных пациентов с хронической болью, вынужденных принимать НПВП ежедневно и зачастую длительно. Данные обстоятельства диктуют необходимость более пристального внимания к вопросам безопасности и правильного использования препаратов из группы НПВП.
Наиболее часто встречающиеся нежелательные эффекты применения НПВП со стороны ЖКТ: НПВП-индуцированная диспепсия, НПВП-эзофагопатия, гастродуодено- и энтеропатия [2].
ДИСПЕПСИЯ, СВЯЗАННАЯ С ПРИЕМОМ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ПРЕПАРАТОВ
Прием НПВП может ассоциироваться с возникновением различных неприятных ощущений со стороны верхних отделов ЖКТ (чувство жжения и тяжести в эпигастральной области, тошнота и др.), часто при отсутствии определяемого при эндоскопическом исследовании повреждения слизистой оболочки [3]. По данным эпидемиологических исследований, НПВП вызывают диспепсию гораздо чаще, чем препараты иных фармакологических групп (ГКС, метилксантины, блокаторы кальциевых каналов и ингибиторы АПФ) [2, 3].
Патогенез диспепсии в большей степени связан с контактным действием НПВП, способностью в определенной степени ускорять или замедлять моторику ЖКТ. Влияние инфицированности слизистой оболочки желудка бактерией Helicobacter pylori на развитие НПВП-ассоциированной диспепсии не доказано.
Неприятные ощущения со стороны ЖКТ, возникающие при приеме НПВП, носят неспецифический характер. Диспепсию способны вызывать все НПВП, включая низкие дозы ацетилсалициловой кислоты (АСК).
НПВП-ИНДУЦИРОВАННАЯ ЭЗОФАГОПАТИЯ
Известно, что прием НПВП (в т. ч. низких доз АСК) может существенно (примерно в 2 раза) увеличивать вероятность развития пептического эзофагита с риском образования язв, кровотечения или формированием стриктуры [4].
Патогенетические механизмы, опосредующие развитие НПВП-индуцированного поражения пищевода, включают:
• усиление желудочной секреции и снижение рН;
• контактное раздражающее действие НПВП на слизистую оболочку пищевода (локальную абсорбцию лекарственных препаратов слизистой оболочкой пищевода, внутрислизистое накопление в токсических концентрациях);
• снижение выработки бикарбонатов и изменение поверхностных свойств слизи;
• торможение перистальтики желудка, провоцирование гастроэзофагеального рефлюкса и увеличение его частоты.
В целом повреждающее действие НПВП в большей мере обусловлено опосредованным снижением эффективности защитных антирефлюксных механизмов и устойчивости слизистой пищевода к повреждающему действию данного класса препаратов.
Прием НПВП также может считаться независимым фактором риска развития гастроэзофагеальной рефлюксной болезни (ГЭРБ).
НПВП-ГАСТРОДУОДЕНОПАТИИ
Механизмы возникновения НПВП-индуцированных побочных эффектов обусловлены ульцерогенным действием препаратов на слизистую оболочку ЖКТ. Механизм действия всех НПВП основывается на ингибировании фермента ЦОГ, что нарушает синтез простагландинов, которые являются важными физиологическими и патологическими медиаторами [5].
Известны две основные изоформы ЦОГ — ЦОГ-1 и ЦОГ-2. Выделение в экспериментальных условиях третьей изоформы ЦОГ-3 как варианта ЦОГ-1 остается дискутабельным.
Посредством ингибирования ЦОГ-1 и ЦОГ-2 обеспечиваются основные фармакодинамические свойства НПВП: обезболивающее, противовоспалительное, жаропонижающее. ЦОГ-1 («конститутивная» изоформа) постоянно присутствует в большинстве тканей, функционирует как постоянный клеточный фермент и регулирует физиологические эффекты простаноидов в тканях и органах (в первую очередь простагландина Е1), контролирующих желудочную секрецию и защищающих слизистую оболочку ЖКТ. Следовательно, ингибирование данного фермента обусловливает развитие нежелательных реакций со стороны ЖКТ [6].
Существенная роль в патогенезе НПВП-гастропатии отводится индивидуальным особенностям пациента. У большинства людей через несколько часов после приема НПВП отмечается появление геморрагий и эрозий слизистой оболочки желудка. Дальнейшее зависит от индивидуальной реакции организма. Либо происходит заживление ранних повреждений, либо они сохраняются в виде эрозий, либо разрушение слизистой продолжается вплоть до появления истинной пептической язвы.
НПВП-ИНДУЦИРОВАННАЯ ЭНТЕРОПАТИЯ
В последние годы накоплены данные о том, что поражение тонкой кишки на фоне приема НПВП встречается достаточно часто. Так, у 44–70% пациентов, принимающих НПВП, развиваются те или иные поражения тонкой кишки, даже при кратковременном, в течение 7–14 дней, лечении НПВП [7, 8].
Выделяют три основных патогенетических механизма негативного воздействия НПВП на кишечный эпителий:
1) местное контактное воздействие препарата на слизистую оболочку после его перорального приема (особо актуальное при использовании кишечнорастворимых форм препаратов, например АСК), повреждение митохондрий, нарушение связей между энтероцитами, приводящее к повышению проницаемости слизистой оболочки кишечника для потенциальных патогенных факторов (бактерий и их токсинов, желчных кислот) и к нейтрофильной активации;
2) системные побочные эффекты НПВП после абсорбции препарата из просвета кишки (ингибирование ЦОГ-1);
3) повторное местное проявление токсического влияния препарата на эпителиоциты после прохождения его метаболитов через энтерогепатический путь рециркуляции [9].
Важную роль играет нарушение микроциркуляции в слизистой оболочке кишечника вследствие подавления синтеза не только простагландинов, но и оксида азота.
ФАКТОРЫ РИСКА РАЗВИТИЯ НПВП-ГАСТРОДУОДЕНО- И ЭНТЕРОПАТИИ
Побочное действие НПВП проявляется не у всех пациентов. Объяснение данного феномена связано с наличием факторов риска развития повреждений слизистой оболочки ЖКТ, среди которых можно назвать пожилой возраст (старше 65 лет), язвенный анамнез (желудочно-кишечное кровотечение в анамнезе), прием высоких доз НПВП или одновременный прием нескольких препаратов этой группы (в том числе низких доз АСК), тяжелые сопутствующие заболевания (застойная сердечная недостаточность и др.), сопутствующий прием ГКС, антикоагулянтов. К дополнительным факторам риска относят курение, употребление алкоголя, инфекцию H. рylori. Оценка факторов риска производится с учетом их градации для каждого пациента индивидуально [10]:
1) умеренный риск: пожилой возраст, язвенный анамнез (редкие рецидивы), прием ГКС, курение и употребление алкоголя, инфицированность H. pylori;
2) высокий риск: язвенный анамнез, прием препаратов, влияющих на свертываемость крови (антиагрегантов, антикоагулянтов);
3) максимальный риск: осложненные язвы (кровотечение, перфорация), часто рецидивирующие язвы (особенно НПВП-индуцированные), комбинация двух и более факторов риска.
Среди факторов риска, ассоциированных с повышенной частотой НПВП-индуцированной патологии пищевода, выделяют пожилой возраст, мужской пол, прием ГКС, алендроната, низких доз АСК. Эрозивный эзофагит значительно чаще выявляется у больных с наличием язв желудка и двенадцатиперстной кишки, а также при наличии грыжи пищеводного отверстия диафрагмы [11].
В отличие от НПВП-гастропатии при поражении тонкой кишки факторы риска до конца не изучены. Вместе с тем к наиболее вероятным из них относят пожилой возраст, сопутствующий прием ГКС и антикоагулянтов, хронические заболевания кишечника (целиакию, болезнь Уиппла, болезнь Крона).
НПВП-индуцированные эрозивно-язвенные поражения пищевода, желудка и двенадцатиперстной кишки
Клинически НПВП-ассоциированные повреждения пищевода проявляются симптоматикой ГЭРБ. При этом важно подчеркнуть значимость внепищеводных проявлений ГЭРБ у коморбидных пациентов, в том числе с избыточной массой тела или ожирением, когда, например, наряду с изжогой или регургитацией отмечаются возникновение приступов кашля и/или удушья, преимущественно в ночное или утреннее время, реже после еды, а также утренняя осиплость голоса, халитоз и др. [12]. Данный факт может быть обусловлен увеличением градиента давления нижнего пищеводного сфинктера на фоне приема НПВП.
Нельзя не отметить, что НПВП-ассоциированные эзофагиты зачастую сопровождаются выраженными клиническими симптомами и риском развития опасных осложнений: пептической язвы, кровотечения и стриктуры нижней трети пищевода.
НПВП-гастродуоденопатия может проявляться в разных клинических вариантах, таких как желудочная диспепсия (10–50% случаев), клиническая картина гастрита, эрозивно-язвенного поражения слизистой оболочки желудка и двенадцатиперстной кишки, в том числе острых язв, кровотечений из эрозий и язв желудка и двенадцатиперстной кишки, реже — перфорации язв [13].
Отмечается несоответствие симптоматики и эндоскопической картины поражения желудка и двенадцатиперстной кишки. Так, например, при наличии у пациента выраженных жалоб (боли или чувства тяжести в эпигастральной области, тошноты, рвоты, изжоги и других признаков диспепсии) эндоскопические проявления могут быть минимальными, а при наличии эрозивно-язвенных изменений слизистой оболочки желудка клиническая картина может быть стертой. Стертая клиническая картина у пациентов старших возрастных групп отмечается чаще, чем у лиц более молодого возраста, и обусловлена в первую очередь аналгезирующим эффектом самих НПВП.
При этом в пожилом возрасте может наблюдаться более тяжелое течение НПВП-гастродуоденопатий (ослабление защитных свойств слизистой оболочки гастродуоденальной зоны), которое проявляется прежде всего в более значительных размерах язвенного дефекта и высоком риске развития осложнений: кровотечения или перфорации [13].
НПВП-энтеропатия
Клиническая симптоматика НПВП-ассоциированных энтеропатий неспецифична: признаки данной патологии могут быть мало выражены либо вовсе отсутствуют, однако наличие черного жидкого стула (пусть даже однократного) должно всегда настораживать. Чаще всего НПВП-энтеропатия манифестирует осложнениями: хронической железодефицитной анемией, не поддающейся коррекции препаратами железа, и потерей белка (альбумина) через поврежденную слизистую оболочку («протеинтеряющая» энтеропатия), реже — тонкокишечной непроходимостью [9].
ДИАГНОСТИКА НПВП-ЭЗОФАГО- И ГАСТРОДУОДЕНОПАТИЙ
Специфических лабораторных маркеров НПВП-эзофаго- и гастродуоденопатий нет. Однако из-за возможных осложнений (кровотечения, перфорации) необходима оценка общего анализа крови, анализа кала на скрытую кровь.
Фиброэзофагогастродуоденоскопия является основным методом диагностики или исключения НПВП-гастропатии. Обязательна диагностика инфекции H. рylori. При необходимости выполняется суточная рН-импедансометрия пищевода и желудка.
Проведение диагностических мероприятий для выявления НПВП-энтеропатии показано больным, регулярно принимающим НПВП, в случае наличия у них клинических симптомов (диареи, метеоризма, абдоминальной боли), признаков кишечного кровотечения или железодефицитной анемии, гипоальбуминемии. Для диагностики поражения слизистой тонкой кишки используют эндоскопические методы, позволяющие визуализировать тощую и подвздошную кишку, — капсульную энтероскопию, для диагностики стриктур применяют энтерографию с контрастным веществом, для диагностики воспаления — анализ кала на кальпротектин. Обязательным является исследование кала на скрытую кровь.
ПРОФИЛАКТИКА И ЛЕЧЕНИЕ НПВП-ИНДУЦИРОВАННЫХ ПОРАЖЕНИЙ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
Поскольку НПВП отличаются по степени негативного действия на органы и системы организма, при назначении рекомендуется использовать более безопасные препараты при наличии факторов риска. В соответствии с отечественными клиническими рекомендациями, при наличии факторов риска ЖКТ-осложнений показано назначение селективных НПВП [2 10]. Среди последних хорошо известен и активно применяется в клинической практике препарат нимесулид (Найз), имеющий заслуженную клиническую репутацию, фармакологические особенности которого хорошо изучены и известны [14-16]. Нимесулид оказывает меньшее влияние на ингибирование ЦОГ-1, поэтому его прием сопровождается более низким риском развития гастроинтестинальных осложнений, чем прием неселективных НПВП.
Показательными в отношении риска НПВП-индуцированных поражений на фоне приема нимесулида и некоторых других НПВП являются данные масштабного эпидемиологического исследования J. Laporte и соавт., в котором анализировались причины 2813 эпизодов ЖКТ-кровотечения (7193 пациента в качестве группы контроля). Нимесулид оказался более безопасен, чем многие другие популярные в Европе НПВП: ОР кровотечения для нимесулида составил 3,2, для диклофенака — 3,7, мелоксикама — 5,7, рофекоксиба — 7,2 [17].
Нельзя не отметить и вклад отечественных ученых. Так, за период с 1995 по 2009 г. в России проведено 21 испытание, в которых нимесулид назначался в дозах от 200 до 400 мг/сут на срок от 7 дней до 12 мес (всего 1590 больных) при различных нозологических профилях: пациентам с ревматическими заболеваниями, острыми травмами, после стоматологических операций, страдающим урологической патологией. Группу контроля составляли больные, которые принимали другие НПВП (преимущественно диклофенак, парацетамол), трамадол и гомеопатический препарат Артрофоон (n = 526).
Полученные данные подтвердили как эффективность (не уступал или превосходил препараты группы контроля), так и безопасность нимесулида (количество больных с диспепсией при применении нимесулида составило 9,1%, препаратов сравнения — 10,8%; язвы ЖКТ развились у 1,6% и 10,6% соответственно, р < 0,001) [18].
К преимуществам нимесулида (Найза) относятся высокая биодоступность, сильное и быстрое обезболивание, хорошее проникновение в синовиальную жидкость, мощный противовоспалительный эффект, низкая частота побочных эффектов. Высокая скорость реализации анальгетического воздействия при использовании Найза связана с так называемым 3D-эффектом, который заключается в быстрой дезинтеграции таблетки [19].
Интересно отметить, что существенную роль в быстром и продолжительном анальгетическом влиянии нимесулида играет широкий спектр свойств, не связанных с ингибированием ЦОГ-2. Так, нимесулид уменьшает синтез провоспалительных цитокинов, в их числе ФНО-α, ИЛ-6 и ИЛ-8, и лейкотриена В4, уровень алгогенной субстанции Р, а за счет снижения синтеза фосфодиэстеразы IV он уменьшает активность макрофагов и нейтрофильных гранулоцитов, играющих ключевую роль в патогенезе острой воспалительной реакции [16, 20, 21].
Кроме того, нимесулид ингибирует продукцию реактивных кислородных радикалов и лейкотриена С4, продуцируемого эозинофилами. Нимесулид ингибирует секрецию гистамина тучными клетками, связанную как с иммунными, так и с неиммунными стимулами, что облегчает болевой синдром и что важно для минимизации поражений ЖКТ. В эксперименте показано, что нимесулид уменьшал стимулированную гистамином секрецию соляной кислоты в желудке опытных животных [22].
Для профилактики при наличии факторов риска развития НПВП-эзофаго- и гастродуоденопатии, а также их лечения в современной клинической практике наиболее действенными являются ингибиторы протонной помпы (ИПП) [2, 10, 13]. При выявлении эрозивно-язвенных изменений прекращение приема НПВП само по себе не приводит к рубцеванию язв, но может повышать эффективность противоязвенной терапии.
Терапевтическая тактика ведения пациентов с НПВП-индуцированными поражениями пищевода аналогична терапии ГЭРБ. ИПП — это препараты выбора для лечения проявлений данной патологии, при этом предпочтение отдается ИПП, обладающему не только высокой эффективностью (выраженным антисекреторным и цитопротективным действием), но и безопасностью, например рабепразолу.
Среди ИПП с учетом коморбидного фона и возможной полипрагмазии предпочтение стоит отдавать препаратам с наименьшим риском межлекарственного взаимодействия, например пантопразолу или рабепразолу, в том числе и при совместном назначении с клопидогрелом [23]. Эффективность противоязвенной терапии может быть повышена комбинацией ИПП с препаратами висмута [24].
Важно подчеркнуть также, что, согласно консенсусу Маастрихт V, H. pylori и НПВП являются независимыми факторами риска развития язвенной болезни и связанных с ней кровотечений. Пациентам, планирующим длительный прием НПВП (в том числе и низких доз АСК), необходимо обязательное обследование на H. pylori и, при наличии инфекции, проведение антихеликобактерной терапии с последующим назначением ИПП [25].
ЛЕЧЕНИЕ НПВП-ЭНТЕРОПАТИИ
Применение ИПП не уменьшает риск НПВП-энтеропатии. Использование селективных НПВП снижает вероятность развития или рецидива патологии тонкой кишки [9]. По некоторым данным, прием сульфасалазина и коллоидного субцитрата висмута может способствовать уменьшению кровопотери при приеме НПВП. Одновременное назначение НПВП и сульфасалазина в дозе 2 г/сут редуцирует увеличенную проницаемость кишечного эпителия (индуцированную приемом индометацина).
Дополнительное назначение метронидазола (с целью санации кишечника) способствует редукции изменений кишечной проницаемости, вызванной приемом индометацина. Могут быть также назначены препараты нитрофуранового ряда (нифурател) или невсасывающийся антибиотик рифаксимин. Кроме того, потенциальными энтеропротективными эффектами при НПВП-индуцированной энтеропатии обладает ребамипид. Ребамипид стимулирует продукцию простагландинов и гликопротеинов слизи, обладает противовоспалительными и антиоксидантными свойствами [26]. Имеются данные об эффективности ребамипида при язвенной болезни, хроническом гастрите, ассоциированном с инфекцией H. pylori [27].
Возможная тактика ведения коморбидного пациента с целью профилактики ЖКТ-осложнений при приеме НПВП, а также терапевтические подходы к коррекции НПВП-эзофаго- и гастроэнтеропатии представлены в таблицах 1 и 2.
Таблица 1
Возможная тактика ведения коморбидного пациента с целью профилактики осложнений со стороны желудочно-кишечного тракта при приеме нестероидных противовоспалительных препаратов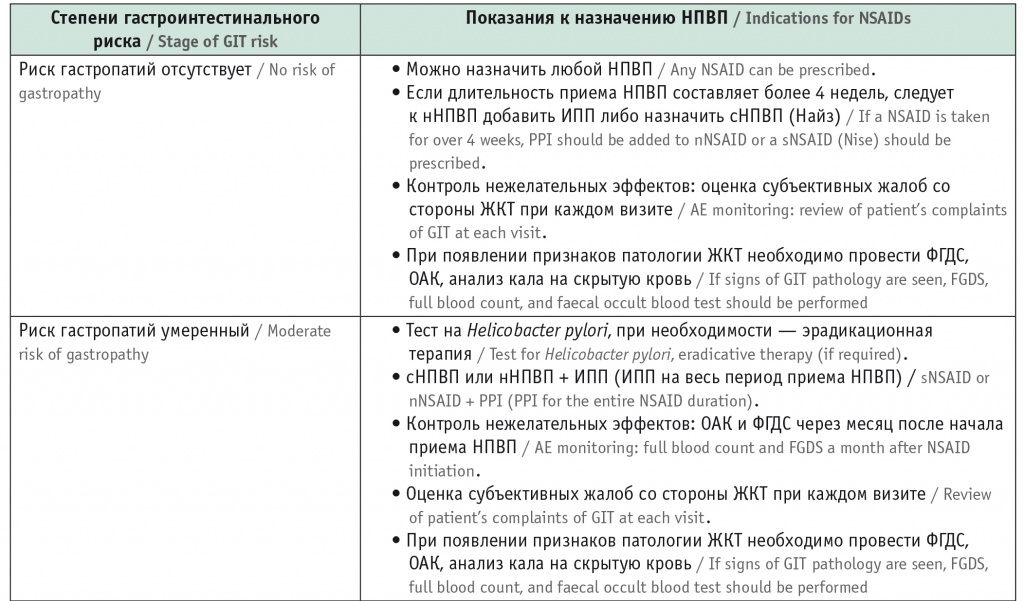
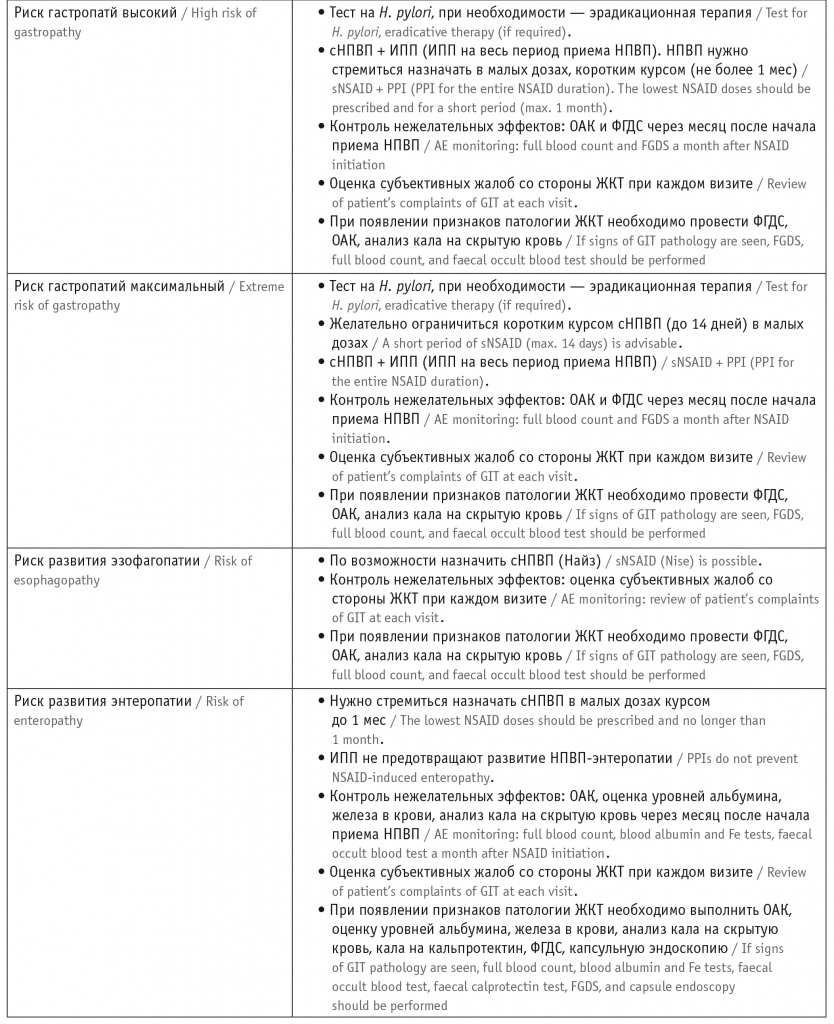
Примечание. Здесь и в таблице 2: ИПП — ингибиторы протонной помпы, ЖКТ — желудочно-кишечный тракт, нНПВП — неселективные нестероидные противовоспалительные препараты, ОАК — общий анализ крови, сНПВП — селективные нестероидные противовоспалительные препараты, ФГДС — фиброгастродуоденоскопия.
Таблица 2
Возможная лечебная тактика у коморбидных пациентов при приеме нестероидных противовоспалительных препаратов 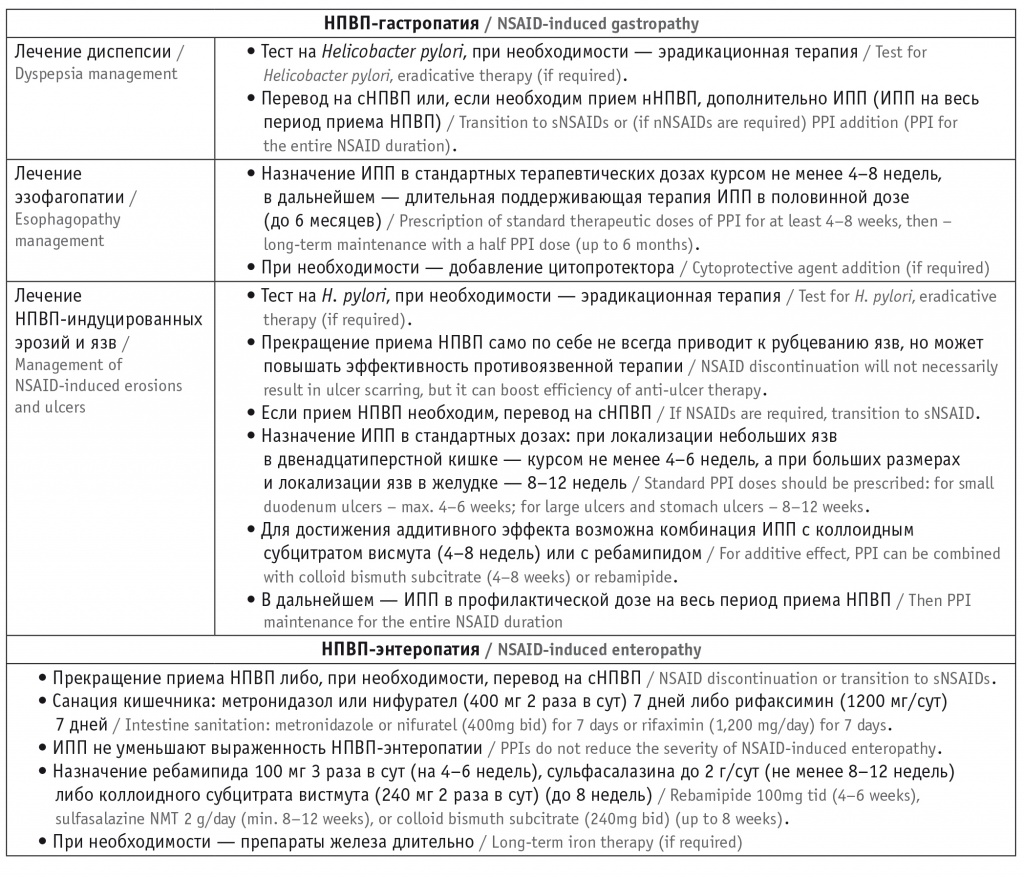
ЗАКЛЮЧЕНИЕ
Резюмируя вышесказанное, необходимо еще раз подчеркнуть, что проблема НПВП-индуцированных поражений ЖКТ остается актуальной и может усугубляться при наличии коморбидной патологии. Первостепенное значение имеют своевременная профилактика и диагностика НПВП-индуцированных повреждений слизистой гастроинтестинальной зоны, а также рациональный и индивидуальный подход к назначению НПВП.
Поступила: 07.10.2020
Принята к публикации: 20.10.2020








