Применение лапароскопии в гепатобилиарной хирургии ограничивается не только анатомическими особенностями, богатой васкуляризацией, высокой стоимостью оборудования, но и тяжелыми инфекционными осложнениями в послеоперационном периоде [1, 2, 5-10]. Иммунные реакции после хирургического вмешательства могут иметь решающее значение в патогенезе послеоперационных осложнений и для потенциальной долгосрочной выживаемости. Иммунологический статус является достоверным показателем выраженности операционного стресса при сравнении резекций печени, выполняемых лапароскопическим и традиционным открытым доступом [3, 4, 11-25].
Цель исследования: проведение сравнительного анализа параметров операционного стресса при выполнении открытых резекций печени (ОРП) и ЛРП различного объема в эксперименте и клинической практике.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на экспериментальной базе (виварий) Московского государственного медико-стоматологического университета им. А. И. Евдокимова Минздрава России, отделения хирургии печени и поджелудочной железы Московского клинического научно-практического центра Департамента здравоохранения г. Москвы и хирургического отделения Федерального научно-клинического центра специализированных видов медицинской помощи и медицинских технологий ФМБА России в период 2012-2015 гг.
Критерий включения: пациенты с образованиями печени от 3 до 8 см в диаметре. Критерии исключения: невозможность дать письменное информированное согласие; образования печени более 8 см в диаметре; наличие внепеченочных метастазов, исключая резектабельные метастазы в легких и надпочечниках; радикально неизлечимое заболевание.
Исследование имело экспериментальную и клиническую составляющую. В экспериментальной части объектами изучения были 40 кроликов, на клиническом этапе обследовали 38 пациентов с различными очаговыми патологиями печени (доброкачественной и злокачественной природы). На каждом этапе оценивали две группы: основную (ЛРП) и контрольную (ОРП). Выполняли резекции печени малого объема (до 3 сегментов и атипичные), а также обширные резекции (гемигепатэктомии).
Экспериментальное исследование включало кроликов породы шиншилла обоих полов весом до 3 кг.
В предоперационном периоде выполнялся забор крови из вены ушной раковины по 5 мл в гепаринизированные и негепаринизированные стерильные пробирки для сравнения показателей иммунологического статуса. Забор крови производили путем венесекции.
Оперативное вмешательство выполняли под общей анестезией, зафиксировав животное на операционном столе. В контрольной группе после подготовки операционного поля в положении на спине делали косой разрез передней брюшной стенки по срединной линии, затем параллельно правой реберной дуге и выполняли резекцию левой доли печени или гемигепатэктомию. Гемостаз осуществлялся при помощи биполярной коагуляции. После извлечения резецированного фрагмента послеоперационная рана ушивалась послойно.
В основной группе производили лапароскопические резекции левой доли печени при использовании трех операционных троакаров по стандартной методике с созданием пневмоперитонеума, при этом для рассечения паренхимы применяли пятимиллиметровый инструмент LigaSure (Covidien Medtronic, США). После извлечения резецированного фрагмента послеоперационные раны ушивались послойно.
Заключительный этап состоял из трехкратных последовательных заборов крови (по вышеприведенной методике) через 4-6 часов, 24 часа и на 7-е сутки после вмешательства соответственно в гепаринизированные и негепаринизированные стерильные пробирки с последующей лабораторной диагностикой.
Клиническая часть исследования заключалась в сравнительной оценке параметров операционного стресса у пациентов, перенесших резекции печени открытым и лапароскопическим доступом, по схеме, ранее отработанной в эксперименте.
Пациентам с образованиями, удовлетворявшими критерию включения, в условиях стационара и после осуществления необходимого объема обследований проводили хирургическое лечение. Оперативные вмешательства выполнялись под общей анестезией. Выбор оперативного доступа к печени был продиктован локализацией и характером патологического процесса, а также объемом предполагавшегося оперативного вмешательства. Применялись преимущественно трансабдоминальные оперативные доступы. Основные моменты операции: перевязка сосудов удаляемой части паренхимы в воротах печени; перевязка печеночных вен в кавальных воротах печени; рассечение печени по междолевым щелям, ограничивающим резецируемую часть; окончательное выделение и удаление резецируемой части печени и закрытие ее раневой поверхности.
Забор крови выполняли по ранее отработанной методике в предоперационный период, через 6 часов, 24 часа и на 7-е сутки после вмешательства в гепаринизированные и негепаринизированные стерильные пробирки с последующей лабораторной диагностикой.
Методы исследования
На экспериментальном этапе оценивались показатели цитотоксической, пролиферативной и фагоцитарной активности (врожденного иммунитета).
При определении фагоцитарной активности мононуклеарных лейкоцитов периферической крови (МЛПК) кроликов микробную культуру Streptococcus pneumoniae серотипа 14 убивали нагреванием и окрашивали флуоресцеинизотиоцианатом (ФИТЦ). Цельную кровь смешивали с бактериями в соотношении 1 : 1, инкубировали 20 минут при 37 °С, отмывали центрифугированием (250 g, 10 минут) в среде RPMI-1640 («НПП "ПанЭко"», Россия). Затем определяли поглотительную способность макрофагов на проточном цитометре Cytomics FC 500 (Beckman Coulter, Inc., США). Гейт (окно) клеточной популяции устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 10 000 клеток в гейте.
Для оценки пролиферативной активности МЛПК кроликов был использован морфологический метод — реакция бласттрансформации лимфоцитов традиционным способом. Суспензию МЛПК в обогащенной среде RPMI-1640 (с 10%-ной фетальной сывороткой) вносили в 96-луночные планшеты в количестве 10 × 103 клеток на лунку и инкубировали в течение 3 суток в стандартных условиях культивирования. По окончании 72-часовой инкубации часть клеточной суспензии собирали в пробирки, осаждали центрифугированием (200 g, 10 минут), отмывали 10%-ной уксусной кислотой и снова центрифугировали. Осадок ресуспендировали в 20 мкл метанола и переносили на предметные стекла. Препараты высушивали и окрашивали по Романовскому. Учет результатов проводили в световом микроскопе JENAMED-2 (Carl Zeiss Jena, ФРГ) путем подсчета процента бластных клеток при просматривании 300-500 клеток. Итог выражали индексом стимуляции, представляющим собой отношение процента бластных клеток в стимулированной митогеном и исследуемыми препаратами культуре лимфоцитов к проценту спонтанных бластных форм в контрольной культуре без добавления митогена.
Для выявления цитотоксической активности МЛПК использовали тест восстановления 3-(4,5-диметилтиазол-2-ил)-2,5-дифенилтетразолия бромида (МТТ), в основе которого лежит способность живых клеток превращать растворимый желтый бромид МТТ в нерастворимые пурпурно-синие внутриклеточные кристаллы МТТ-формазана. Цитотоксическую активность МЛПК определяли на линии опухолевых клеток К562. Опухолевые клетки (3 × 104 в 1 мл) инкубировали в культуральной среде с МЛПК в соотношениях 1 : 10, 1 : 5 и 1 : 2 в плоскодонных 96-луночных микропланшетах 18 часов при 37 °С и 4% СО2. Затем в лунки добавляли 20 мкл рабочего раствора витального красителя МТТ (Honeywell Fluka, США) в концентрации 5 мг/мл. После 3-4-часовой инкубации в СО2-инкубаторе планшеты центрифугировали при 200 g (5 минут), удаляли супернатант и в лунки добавляли по 150 мкл диметилсульфоксида (Serva, ФРГ). По оптической плотности при длине волны 540 нм, измерявшейся на мультискане МS (LabSystems, Израиль), рассчитывали процент лизиса опухолевых клеток (процент цитотоксичности):
ЦИ (%) = [1 - (ОПЭ + М - ОПэ)/ОПМ] × 100,
где ОПЭ + М — оптическая плотность в опытных сериях,
ОПэ — оптическая плотность в лунках с эффекторами,
ОПМ — оптическая плотность в лунках с мишенями.
На клиническом этапе определяли общее содержание лейкоцитов и субпопуляций лимфоцитов, Толл-подобных рецепторов (TLR). Цитокиновый профиль оценивали по содержанию про- и противовоспалительных цитокинов: IL-1b, IL-2, фактора некроза опухоли альфа (ФНО-α), интерферона гамма (ИНФ-γ), IL-12p70, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, IL-17a, IL-22.
При оценке содержания субпопуляций лимфоцитов (изучении иммунофенотипа лейкоцитов) экспрессию поверхностных маркеров мононуклеаров определяли при помощи моноклональных антител против соответствующих антигенов. Клетки отмывали холодным фосфатно-солевым буфером (ФСБ) с 1%-ной эмбриональной телячьей сывороткой (ЭТС) и окрашивали антителами, меченными ФИТЦ и фикоэритрином (PE), согласно инструкции производителя. Отмывали 2 раза холодным ФСБ с 1%-ной ЭТС. Клетки фиксировали ФСБ, содержавшим 1% параформальдегида. Результаты учитывали на проточном цитометре FACSCalibur (BD Biosciences, США) с арго-ионным лазерным (488 нм) и дискриминационным (585/42 нм, FL2) фильтрами мощностью 15 мВт каждый. На мононуклеарных лейкоцитах исследовали уровни экспрессии дифференцировочных антигенов CD3, CD4, CD8, CD20, NK1.1; активационных антигенов CD25, HLA-DR. Данные изучали после выделения логического гейта клеточной популяции в dot/plot-распределении клеток по их линейному переднему и боковому светорассеянию. При учете результатов анализировали минимум 10 000 событий в гейте.
Оценку экспрессии TLR на МЛПК осуществляли методом проточной цитометрии с применением моноклональных антител против соответствующих антигенов. Клетки отмывали холодным ФСБ с 1%-ной фетальной телячьей сывороткой (ФТС), окрашивали ФИТЦ- и PE-меченными антителами согласно инструкции производителя, а затем дважды отмывали холодным ФСБ с 1%-ной ФТС. Результаты учитывали на проточном цитометре Cytomics FC 500 (Beckman Coulter, Inc., США). На МЛПК исследовали, в частности, уровни экспрессии TLR2, TLR4, TLR9. Гейт популяции клеток устанавливали на основе комбинации прямого и бокового светорассеяния и размера клеток. При учете результатов подсчитывали 5000 клеток в гейте.
Содержание цитокинов оценивали в сыворотке/плазме крови больных при помощи тест-системы FlowCytomixHumanThl/Th2 14 plex (Bender MedSystems, Австралия), используя шарики, сенсибилизированные моноклональными антителами к цитокинам (гранулоцитарно-макрофагальный колониестимулирующий фактор, ИНФ-γ, IL-1β, IL-2, IL-4, IL-5, IL-6, IL-10, IL-17, ФНО-α). Определение уровня цитокинов проводили согласно инструкции производителя с применением проточного цитометра Cytomics FC 500.
Уровень белков теплового шока (БТШ) устанавливали в сыворотке крови методом твердофазного иммуноферментного анализа (HSP79 high sensitivity ELISA kit) в диапазоне детектируемых концентраций от 1 до 13 пкг/мл согласно инструкции производителя (Enzo Life Sciences (ELS) AG, Швейцария).
Статистическую значимость определяли при помощи t-критерия Стьюдента. Различия показателей считали достоверными при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
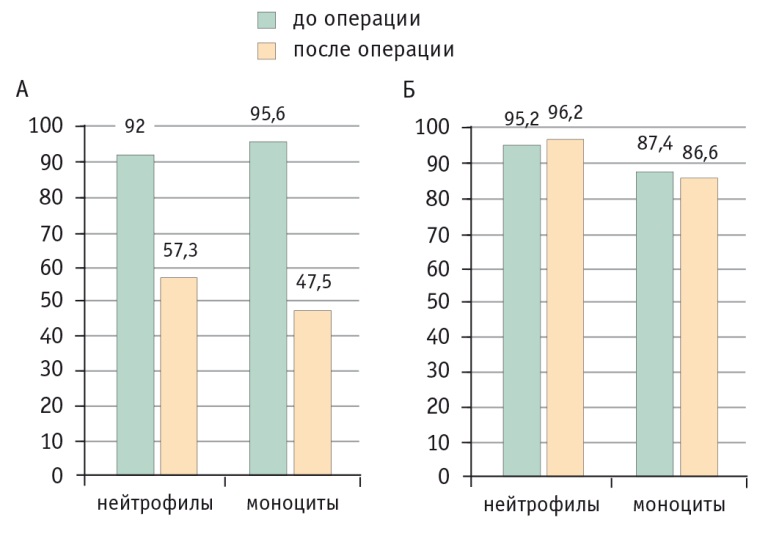
Первыми были проанализированы результаты экспериментального исследования. При изучении фагоцитарной активности МЛПК кроликов в отношении S. aureus сравнение показателей нейтрофилов и моноцитов выявило достоверно больший эффект стрессирующего воздействия в группе ОРП (в обоих случаях p < 0,05) (рис. 1).
Рис. 1. Динамика фагоцитарной активности мононуклеарных лейкоцитов периферической крови кроликов в отношении S. aureus при открытых (А) и лапароскопических (Б) резекциях печени, %.
Примечание. Различия между группами по изменению показателей нейтрофилов и моноцитов статистически значимы: p < 0,05
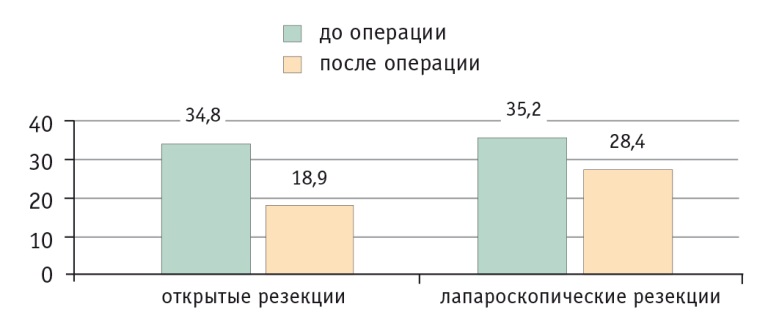
Сравнение показателей цитотоксической активности МЛПК кроликов против линии клеток К562 при соотношении мишень/эффектор 1 : 10 до и после операции показало ее падение в послеоперационном периоде в группе ОРП. При ЛРП снижение цитотоксической активности было достоверно менее выраженным (p < 0,05) (рис. 2).
Рис. 2. Динамика цитотоксической активности мононуклеарных лейкоцитов периферической крови кроликов против линии клеток К562 при открытых и лапароскопических резекциях печени, %.
Примечание. Различия между группами по изменению показателя статистически значимы: p < 0,05
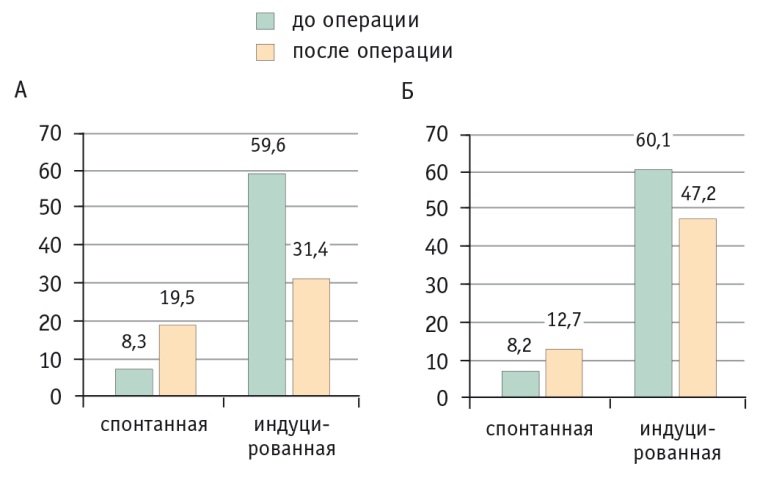
Пролиферативная активность оценивалась как спонтанная, так и индуцированная фитогемагглютинином. Можно отметить высокие показатели спонтанной активности и сниженные уровни индуцированной активности после оперативного вмешательства в обеих группах (в обоих случаях p < 0,05) (рис. 3).
Рис. 3. Динамика спонтанной и индуцированной пролиферативной активности мононуклеарных лейкоцитов периферической крови кроликов при открытых (А) и лапароскопических (Б) резекциях печени, %.
Примечание. В обеих группах изменения показателей спонтанной и индуцированной активности статистически значимы: p < 0,05
На клиническом этапе выявлен достоверно больший (p < 0,05) прирост показателей лейкоцитов в послеоперационном периоде в группе ОРП (с 4,6 ± 1,6 до 9,1 ± 4,4 × 109) в сравнении с группой ЛРП (с 4,8 ± 1,5 до 7,8 ± 4,7 × 109). Этот результат обусловлен бо’льшим приростом послеоперационных результатов при обширных резекциях, тогда как вмешательства «малого» объема демонстрировали лучшие значения в группе ЛРП (> 30%).
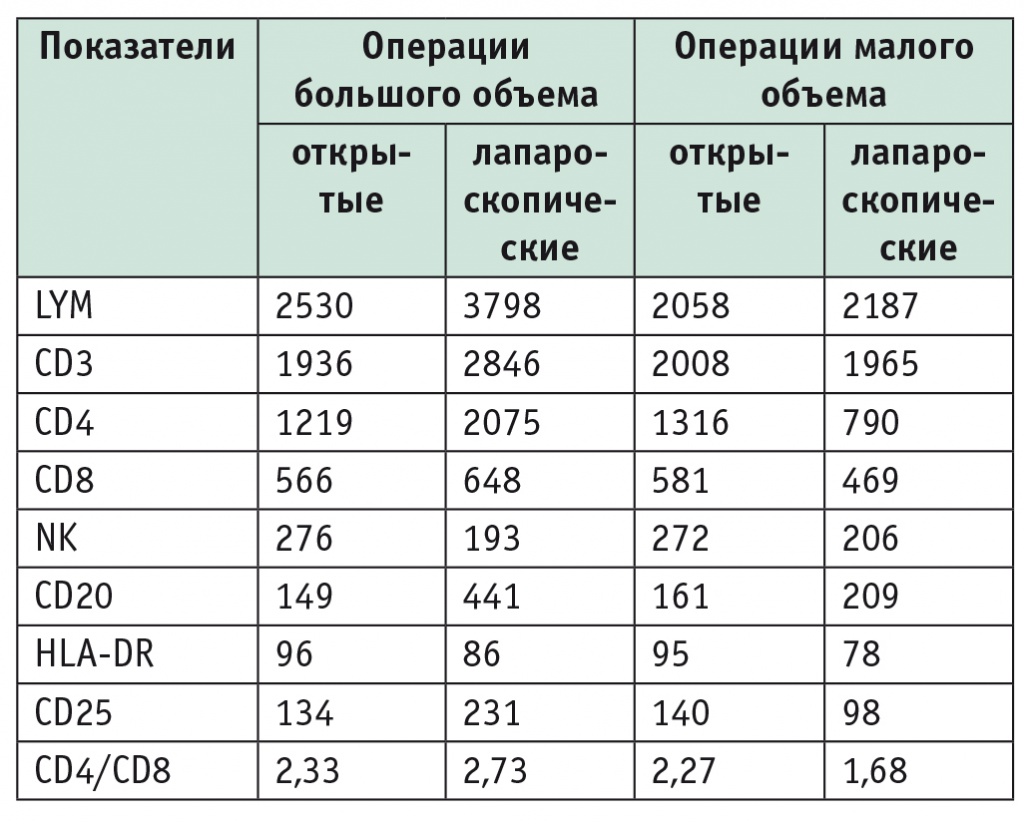
При сравнении данных по популяциям лейкоцитов наиболее информативными проявили себя показатели CD4 и CD8. В контрольной группе изменения в послеоперационном периоде характеризовались бо’льшим проявлением операционного стресса, чем в группе ЛПР. Динамика изменений отражена в таблицах 1-3.
Таблица 1
Показатели лейкоцитов и субпопуляций при открытых и лапароскопических резекциях печени большого и малого объема через 6 часов после вмешательства, клеток/мл
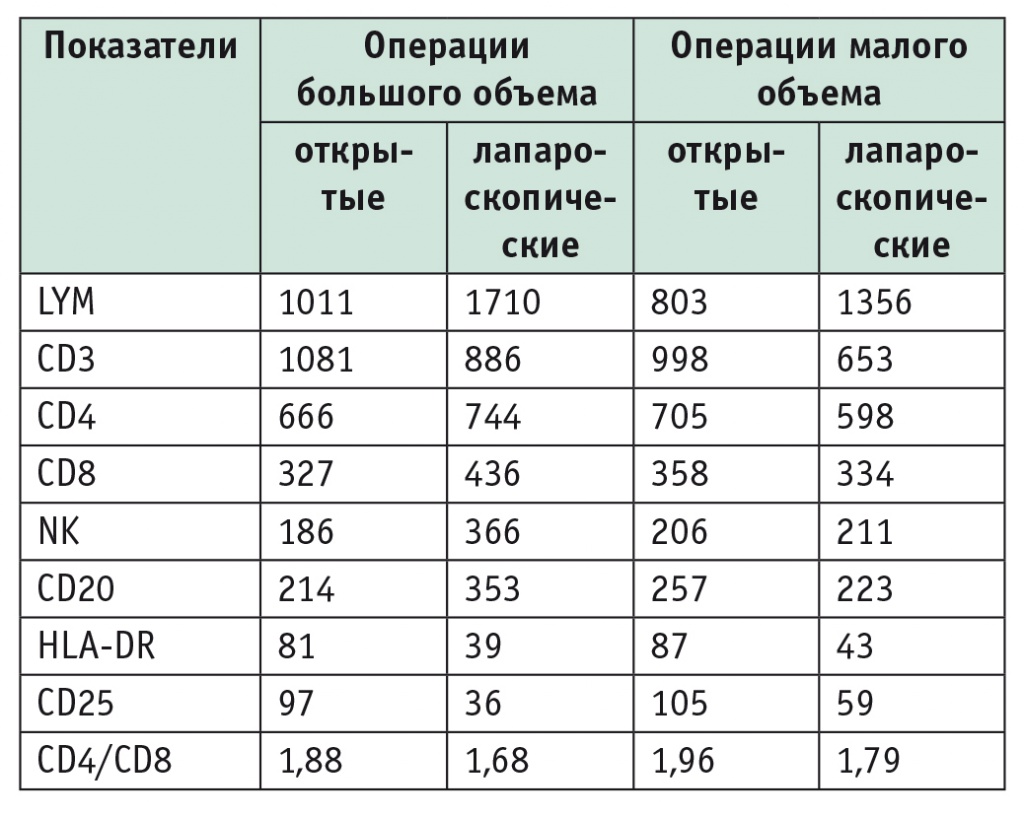
Таблица 2
Показатели лейкоцитов и субпопуляций при открытых и лапароскопических резекциях печени большого и малого объема через 24 часа после вмешательства, клеток/мл
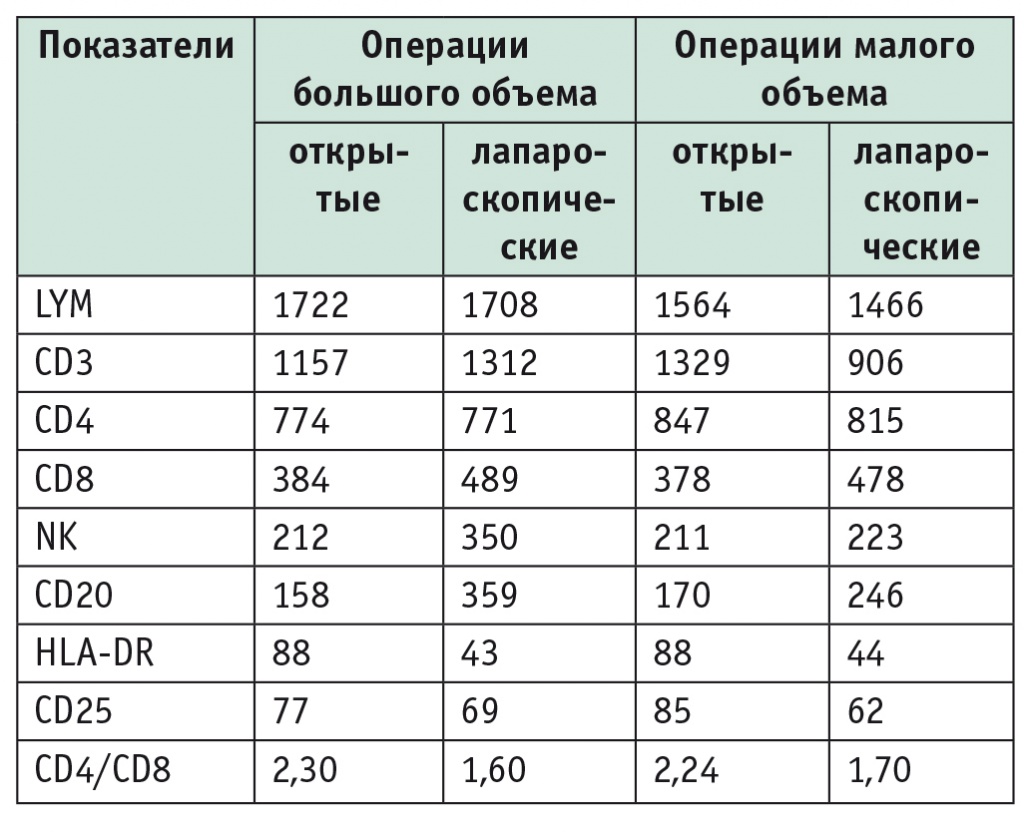
Таблица 3
Показатели лейкоцитов и субпопуляций при открытых и лапароскопических резекциях печени большого и малого объема на 7-е сутки после вмешательства, клеток/мл
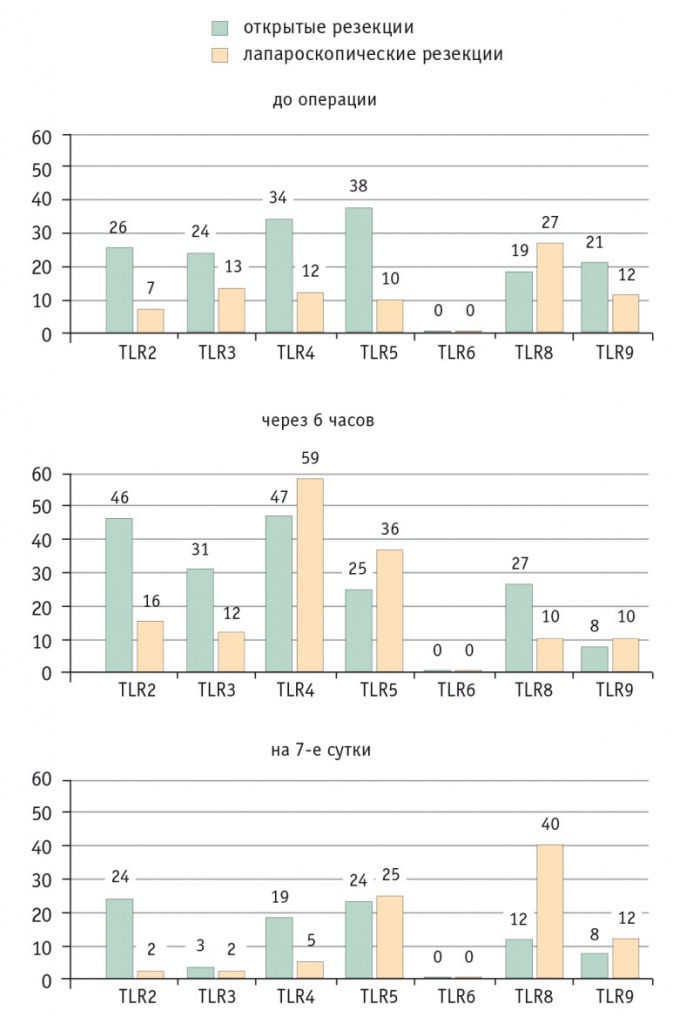
TLR в ответ на инфекцию обеспечивают передачу сигналов, необходимых для активации адаптерного белка MyD88 и транскрипционных факторов (NF-κB), запускающих транскрипцию генов ключевых эффекторов врожденного иммунитета. Эти сигнальные пути осуществляют первичное распознавание патогена, важное для управления процессом развития неспецифической резистентности и адаптивного иммунитета. По результатам тестов, проведенных в ходе определения экспрессии TLR на клетках крови (гранулоцитах), через 6 часов после операции в контрольной группе отмечено повышение уровней TLR2, TLR3, TLR4 и TLR8, в то время как показатели TLR5 и TLR9 снизились. На 7-е сутки все показатели, кроме TLR2, были ниже дооперационных значений. В группе ЛРП через 6 часов после оперативного вмешательства также наблюдалось увеличение ряда показателей, выявлен высокий уровень TLR4, играющего немаловажную роль в реализации врожденного иммунитета и участвующего в активации цитокинов. На 7-е сутки в основной группе уровни TLR8, TLR9 превысили данные контрольной группы, значения остальных рецепторов снизились (p < 0,05) (рис. 4).
Рис. 4. Динамика уровней Толл-подобных рецепторов при открытых и лапароскопических резекциях печени до и после операции, клеток/мл
Уровни БТШ в сыворотке крови при ОРП в динамике показали статистически значимый (p < 0,05) прирост (58,8 ± 1,4 — 124,6 ± 9,1 — 217,5 ± 8,3 — 115,9 ± 11,4 нг/мл) в сравнении с группой ЛРП (59,0 ± 2,6 — 93,9 ± 7,0 — 128,1 ± 3,5 — 83,9 ± 5,9 нг/мл), изменения в которой демонстрировали меньшую реактивность. При сравнении обширных и «малых» резекций выявлено преимущество последних в группе с лапароскопическим доступом. В случае обширных вмешательств приоритет также имела основная группа с ЛРП, но результаты были более сопоставимы с контролем.
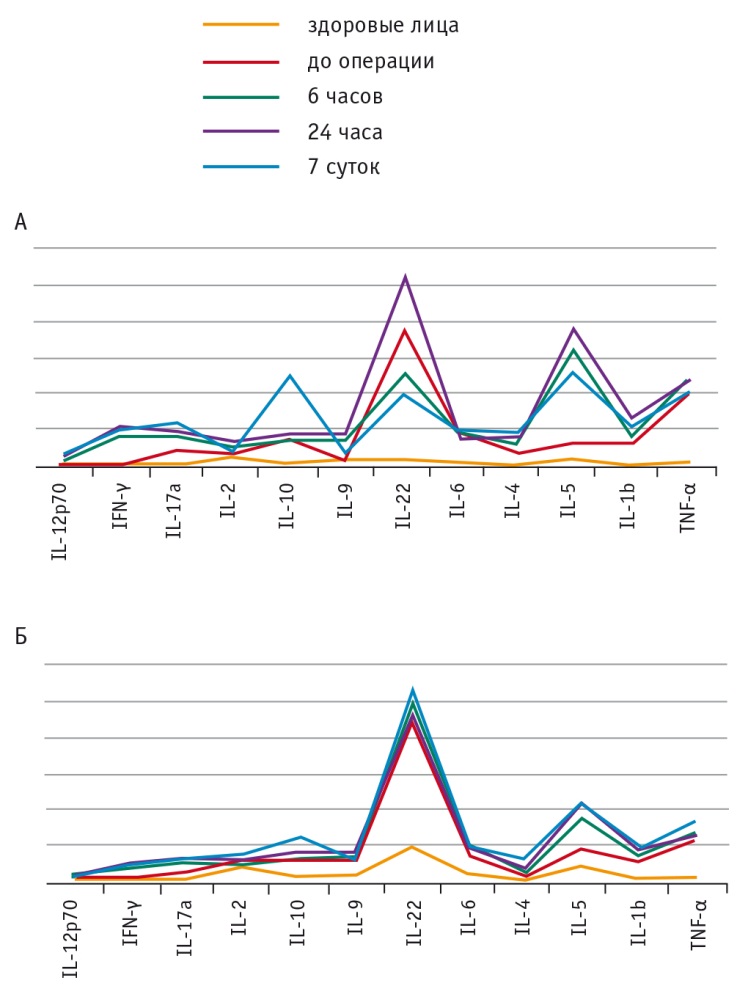
Уровни практически всех цитокинов у больных как до операции, так и после нее были достоверно выше, чем у здоровых лиц (p < 0,05). ЛРП имела преимущества над традиционными (лапаротомия) операциями, однако дисперсия показателей не имела статистической значимости. Как видно из графиков, обширные резекции демонстрировали больший разброс данных в сравнении с «малыми» вмешательствами (рис. 5).
Рис. 5. Динамика уровней цитокинов при открытых и лапароскопических резекциях печени большого (А) и малого (Б) объема
Согласно экспериментальным данным, фагоцитарная активность сохранилась практически неизменной в основной группе и снизилась в послеоперационном периоде в группе контроля. Цитотоксическая активность мононуклеарных лейкоцитов снизилась по отношению к NK-чувствительной линии К562 эритробластного лейкоза в контрольной группе более чем на 45%, тогда как в основной группе снижение составило около 20%. Эти данные косвенно демонстрируют уменьшение противовирусного и противоопухолевого потенциала NK-клеток. При сравнении пролиферативной активности мононуклеарных лейкоцитов отмечены усиление спонтанной пролиферации и уменьшение пролиферации, индуцированной фитогемагглютинином, в обеих группах, что обусловлено стрессирующим воздействием. Это означает, что лейкоциты не могут адекватно реагировать на дополнительную стимуляцию ввиду истощения их скрытых резервов.
На клиническом этапе исследования при сравнении резекций печени с лапаротомическим и лапароскопическим доступом показатели не отражали столь значимых различий. Можно отметить, что уровни лимфоцитов в ближайшем послеоперационом периоде имели небольшую разницу, спустя 6 часов после операции отмечалось снижение показателей гранулоцитов в обеих группах, однако через сутки после вмешательства показатели возвращались к дооперационным числам. Выявлено статистически значимое преобладание уровня моноцитов в контрольной группе исследования. Учитывая тот факт, что моноциты характеризуются выраженной фагоцитарной функцией и осуществляют противоопухолевый, противовирусный, противомикробный иммунитет, а также активируют цитотоксины, интерлейкин (IL-1), ФНО, ИНФ, можно предположить больший стрессирующий эффект лапаротомии в сравнении с лапароскопическим доступом.
В нашем исследовании определялись повышенные уровни экспрессии TLR в контрольной группе в сравнении с группой ЛРП, что указывало на наличие инфекционных агентов и распознавание липополисахаридов грамотрицательных бактерий. TLR распознают патогенассоциированные молекулярные паттерны, которые экспрессируются на инфекционных агентах, и опосредуют продукцию цитокинов, необходимых для выработки эффективного иммунитета. Таким образом, можно предположить что развитие послеоперационных инфекционных осложнений, вызванных бактериальной инфекцией, превалировало в группе ОРП.
По результатам клинических исследований уровни практически всех цитокинов (за исключением IL-4 и IL-12) у больных как до операции, так и после нее были статистически значимо выше, чем у здоровых лиц. Уровень IL-4 в послеоперационном периоде постепенно повышался и на 7-е сутки наблюдения достигал максимального значения. Показатель IL-22 (или Т-клеточного индуцированного фактора) также поэтапно повышался, данный интерлейкин играет важную роль в аутоиммуных и онкозаболеваниях. Резюмируя вышеизложенное, следует отметить, что уровни всех цитокинов — Th1/Th2/Th9/Th17/Th22 — у больных были повышены уже до операции в результате физического стресса, обусловленного наличием опухолевого процесса, инфекции или сопутствующей патологии, что свидетельствует о наличии воспаления, связанного с активацией эффекторов иммунной системы. Оперативное вмешательство более интенсивно индуцировало повышение уровней данных цитокинов, обусловливая дисбаланс системы цитокинов хелперных клеток, который может приводить к функциональным и органическим нарушениям через индукцию «цитокинового шторма» и усугублять состояние пациентов.
Уровни БТШ в нашем исследовании были достоверно повышены в группе с ОРП в сравнении с ЛРП. Следует отметить, что дооперационные показатели пациентов также значительно отличались от нормативных (19,9-25,7 нг/мл в норме и 57,8-60,0 нг/мл у больных). Наблюдался статистически значимый прирост показателей в точках забора через 6 часов, 24 часа после операции, при этом средние значения в контрольной группе на всех этапах превышали соответствующие значения лапароскопической группы. На 7-е сутки показатели несколько снижались. Высокие уровни БТШ в клетке наблюдают после воздействия различных стрессирующих факторов: при инфекциях, воспалительных процессах, внешних воздействиях токсинов при ультрафиолетовом облучении, голодании, гипоксии. Внеклеточные и связанные с плазматической мембраной БТШ, и особенно Hsp70, участвуют в связывании и презентации антигенов. Так как повышение экспрессии БТШ наблюдают как ответ на стресс, рост их уровня позволяет рассматривать белки как один из факторов эндогенной защиты.
ЗАКЛЮЧЕНИЕ
Лапароскопические резекции печени имеют преимущество перед открытыми резекциями печени, что подтверждается лабораторными и клиническими исследованиями врожденного иммунитета. В сравнении с лапароскопией лапаротомия при резекции печени у пациентов приводит к большему повышению показателей иммунного ответа, активации эффекторов врожденного и приобретенного иммунитета.
При выполнении «малых» резекций печени выраженность операционного стресса в группе лапароскопических операций была достоверно ниже, чем при открытых вмешательствах. В случаях обширных резекций печени отмечена меньшая зависимость выраженности операционного стресса от выбора оперативного доступа. Повсеместное применение лапароскопии в хирургии печени требует проведения дальнейших рандомизированных и ретроспективных анализов экспертных центров.








