Стеатоз печени — достаточно распространенное состояние, которое в большинстве случаев считается доброкачественным, обратимым и бессимптомным[8, 35]. С другой стороны, в настоящее время есть убедительные доказательства того, что стеатоз печени — это одна из стадий общего патологического процесса, которая независимо от этиологии может приводить при определенных обстоятельствах к стеатогепатиту, а в дальнейшем — к формированию фиброза[13, 37].
В последнее время проблеме стеатоза печени уделяется все больше внимания. В первую очередь следует отметить, что данная категория больных имеет повышенный риск смерти от сердечно-сосудистых заболеваний, а также от осложнений, ассоциированных с болезнями печени, в целом по сравнению с референсной популяцией (15,5% и 7,5% соответственно, р = 0,04)[15]. В последние годы появились доказательства того, что неалкогольная жировая болезнь печени (НАЖБП) может рассматриваться как фактор риска гепатоцеллюлярной карциномы. Кумулятивная частота гепатоцеллюлярной карциномы у пациентов с НАЖБП-ассоциированным циррозом печени составляет 2,6% случаев в год, а, например, при HCV-ассоциированных циррозах — 4,0% с медианой наблюдения 3,2 года[3, 40].
Следует отметить, что по данным открытого многоцентрового проспективного эпидемиологического исследования DIREG распространенность НАЖБП среди взрослого населения Российской Федерации составила 27,0%, в том числе 80,3% случаев приходилось на стеатоз печени, у 16,8% больных НАЖБП был диагностирован неалкогольный стеатогепатит и у 2,9% — цирроз печени[1]. Кроме того, показано, что распространенность НАЖБП очень высока в группах риска. Так, частота НАЖБП среди лиц с ожирением составляет более 80–90%; при сахарном диабете 2 типа — около 70% по данным УЗИ, а при морфологическом исследовании — 87,0%; у пациентов с дислипидемией НАЖБП выявляется примерно в 50% случаев[2, 8, 13, 21, 24]. Кроме того, следует ожидать, что высокая степень стеатоза является отражением активности накопления жира в печени.
Таким образом, в условиях высокой распространенности НАЖБП своевременное выявление стеатоза печени и его количественная оценка становятся актуальными задачами не только гепатологии, но и здравоохранения в целом.
СОВРЕМЕННЫЕ МЕТОДЫ ОЦЕНКИ СТЕАТОЗА ПЕЧЕНИ
Наиболее широко используемый в клинической практике метод оценки стеатоза — это УЗИ печени, которое, по мнению ряда авторов, позволяет определять стеатоз при наличии жира более чем в 20% гепатоцитов[10]. При этом УЗИ является скорее качественным методом определения стеатоза, оно не дает возможности оценить его степень, а также имеет низкую чувствительность[38].
Высокочувствительным методом является магнитно-резонансная спектроскопия, с помощью которой можно определить наличие стеатоза при вовлечении 5% гепатоцитов и более. Однако ее высокая стоимость и отсутствие общепризнанной стандартизации не позволяют использовать данный метод в рутинной клинической практике[32].
Золотым стандартом диагностики и определения тяжести стеатоза является пункционная биопсия печени. У НАЖБП имеются характерные гистологические критерии:
- стеатоз, который обычно является макровезикулярным, но может быть микровезикулярным или смешанным; гистологически это накопление жира в перицентральной (центролобулярной) зоне;
- баллонная дистрофия гепатоцитов;
- воспалительные инфильтраты, состоящие из смешанных нейтрофильных и мононуклеарных клеток, обычно без портальной инфильтрации (в отличие от хронического гепатита С);
- фиброз[5, 22].
В таблице 1 представлены все характеристики, позволяющие оценить индекс активности НАЖБП с учетом индекса стеатоза по системе, предложенной Brunt, индекса гистологической активности и индекса фиброза печени по шкале METAVIR[14].
Таблица 1
Гистологический индекс активности неалкогольной жировой болезни печени
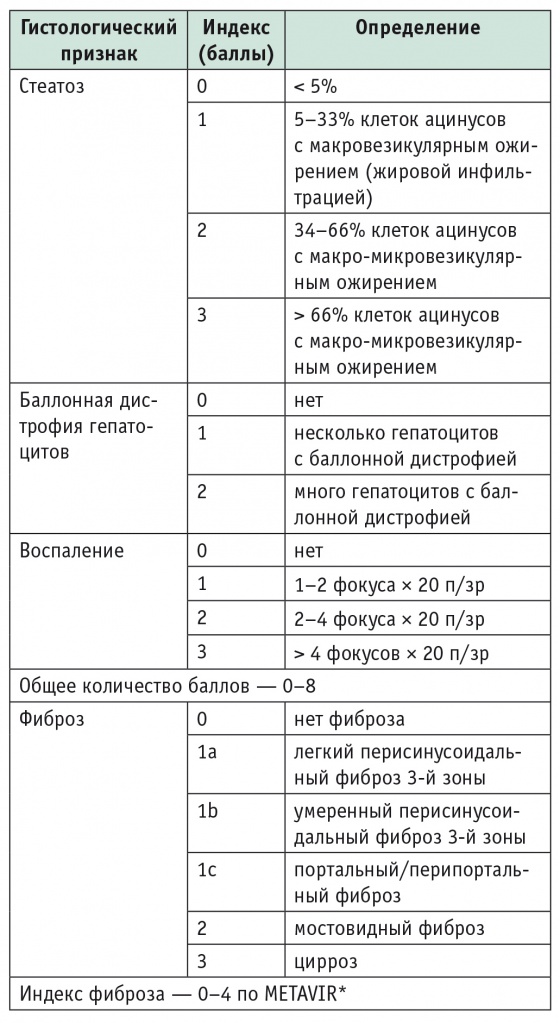
* 1 — только перипортальный/портальный фиброз; 2 — перисинусоидальный фиброз 3-й зоны + перипортальный/портальный фиброз; 3 — мостовидный фиброз; 4 — цирроз.
Вместе с тем пункционная биопсия печени при всех положительных моментах является инвазивным и дорогостоящим методом, имеющим потенциальные ограничения и осложнения: к ним относятся неудовлетворительная воспроизводимость и возможные ошибки при недостаточном количестве материала; отсутствие мотивации у пациентов с НАЖБП к проведению исследования, в том числе в динамике, риск кровотечений и др.[7, 28, 29].
В последнее время интерес клиницистов сместился в сторону неинвазивных методов исследования, примером чего является оценка фиброза с помощью транзиентной эластометрии и фибротестов. Транзиентная эластометрия печени базируется на физическом методе и соотносится с истинными внутренними физическими показателями паренхимы печени — определяет эластичность печени. Фибротесты — это биологический метод, при котором проводится количественная оценка сывороточных (серологических) биомаркеров. Серологические биомаркеры представляют собой несколько неспецифичных для печени клинических и серологических параметров, которые ассоциируются с различными стадиями фиброза. Согласно последним практическим рекомендациям Европейской ассоциации по изучению заболеваний печени, транзиентная эластометрия может считаться стандартом неинвазивного теста для измерения эластичности печени (уровень доказательности — A1), имеет высокую достоверность при вирусных гепатитах (A1), чуть менее достоверна при НАЖБП и других хронических заболеваниях печени (A1), обладает большей чувствительностью при обнаружении цирроза, чем при обнаружении «продвинутых» стадий фиброза (A1). Алгоритм сочетания транзиентной эластометрии и серологических биомаркеров представляется наиболее привлекательным и достоверным (A2). Однако данная стратегия требует дополнительной доказательной базы для пациентов с НАЖБП (A1). Рекомендуется проведение скрининга фиброза печени всем больным НАЖБП, особенно при метаболическом синдроме или сахарном диабете 2 типа, когда риск фиброза печени повышен (A1). Но для диагностики тяжелых стадий фиброза применение неинвазивных методов является менее точным методом, чем пункционная биопсия печени (A1)[16].
Длительное время основным нерешенным вопросом неинвазивной диагностики являлось отсутствие возможности оценить выраженность стеатоза печени. Поэтому появление в клинической практике метода, позволяющего определять не только наличие, но и степень стеатоза, вызвало огромный интерес.
ТЕОРЕТИЧЕСКОЕ ОБОСНОВАНИЕ ПРИМЕНЕНИЯ КОНТРОЛИРУЕМОГО ПАРАМЕТРА ЗАТУХАНИЯ УЛЬТРАЗВУКА
Современным подходом в определении стеатоза печени является метод оценки контролируемого параметра затухания ультразвука (КПЗУ) (англ. Сontrolled Аttenuation Рarameter — CAP). КПЗУ — недавно разработанный неинвазивный метод, базирующийся на технологии эластографии на основе контролируемой вибрации (англ. Vibration-Controlled Transient Elastography — VCTE), встроенной в фиброскан (FibroScan, Echosens, Франция). КПЗУ позволяет измерить степень ослабления в жировой ткани ультразвукового сигнала, излучаемого вибрационным зондом с частотой 3,5 МГц. Таким образом, метод КПЗУ основан на свойстве ультразвуковых сигналов «затухать» в тканях, содержащих жир, при этом ослабление сигнала происходит пропорционально степени стеатоза. Результаты выражаются в децибелах на метр (дБ/м) и ранжируются от 100 до 400 дБ/м с определением степени стеатоза: S0 — стеатоз менее 10% гепатоцитов, S1 — стеатоз более 10%, S2 — стеатоз более 33%, S3 — стеатоз более 66% гепатоцитов[30].
ЭФФЕКТИВНОСТЬ КОНТРОЛИРУЕМОГО ПАРАМЕТРА ЗАТУХАНИЯ УЛЬТРАЗВУКА В ОЦЕНКЕ СТЕАТОЗА ПЕЧЕНИ
КПЗУ зарекомендовал себя как быстрый и простой неинвазивный метод, позволяющий определять степень стеатоза, и к сегодняшнему дню уже накопился определенный опыт его применения при хронических заболеваниях печени различной этиологии. Кроме того, по данным A. Berzigotti, КПЗУ не зависит от оператора и может проводиться операторами без опыта. Важно, что на показатели КПЗУ не влияет наличие фиброза или цирроза. При этом отмечается, что пока точно не известны факторы, которые могут влиять на значения КПЗУ, по причине небольшой выборки в исследованиях. Вместе с тем указано еще одно важное преимущество — возможность определять и стеатоз, и фиброз с помощью одного метода[4].
По опыту ряда исследователей из разных стран, значения КПЗУ коррелируют со степенью стеатоза при сравнении с данными биопсии печени[9, 11, 18, 26, 30, 39]. Исследователями из Румынии проведена сравнительная оценка применения методов КПЗУ и биопсии печени у 201 пациента с различными хроническими заболеваниями печени. Максимальная диагностическая точность была показана для стеатоза S2 и S3 — 82,1% и 81,6% соответственно, при S1 — 76,1%. Прогностическая ценность отрицательного результата при исключении стеатоза S2 и S3 достигала 93,5% и 98,7% соответственно. Значения AUROC (англ. Area Under а Receiver Operating Characteristic (ROC) Curve — площадь под кривой операционной характеристики диагностического метода), рассчитанные между каждыми двумя степенями стеатоза, составили: 0,772 (S0/S1), 0,874 (S0/S2), 0,904 (S0/S3), 0,659 (S1/S2), 0,777 (S1/S3) и 0,665 (S2/S3)[25].
Интересными представляются сравнительные данные о диагностической эффективности метода КПЗУ (выполненного двумя датчиками — М и XL) и биопсии печени у 57 пациентов с НАЖБП. Была показана статистически значимая корреляция между методом КПЗУ и биопсией печени (r = 0,49, p < 0,001)[18].
При обследовании 317 пациентов с хроническими заболеваниями печени (НАЖБП — у 63 человек, хронический гепатит С — у 108, хронический гепатит В — у 146) M. Kumar и соавт. показали, что при оценке стеатоза метод КПЗУ статистически значимо коррелирует с данными биопсии во всех трех группах пациентов независимо от этиологии[23].
Очень внушительными выглядят данные проспективного сравнительного исследования среди 5323 пациентов с хроническими заболеваниями печени различной этиологии, из них у 440 была выполнена биопсия печени. Метод КПЗУ показал высокую диагностическую точность при обнаружении стеатоза: AUROC составила 0,914 (95%-й ДИ: 0,90–0,93). Среди 440 пациентов, которым была выполнена биопсия печени, значения AUROC для выявления стеатоза S1, S2 и S3 составили 0,79 (95%-й ДИ: 0,74–0,84, p < 0,001), 0,84 (95%-й ДИ: 0,80–0,88, p < 0,001) и 0,84 (95%-й ДИ: 0,80–0,88, p < 0,001) соответственно. Неудачи при применении метода КПЗУ (около 7,7% случаев) имели статистически значимую связь с женским полом, повышенным ИМТ и наличием метаболического синдрома. Важным для практики является выявление факторов, с которыми, согласно многофакторному анализу, ассоциировано повышение значений КПЗУ: ИМТ > 30 кг/м2, метаболический синдром, прием алкоголя более 14 доз/нед и эластичность печени > 6 кПа[12].
Однако полученный опыт поставил ряд вопросов, и главный среди них, на наш взгляд, — вопрос о пограничных значениях КПЗУ для корректной оценки наличия и степени стеатоза как у здоровых лиц, так и у пациентов с хроническими заболеваниями печени. Кроме того, по мнению ряда авторов, необходимо понять, возможно ли будет использовать метод КПЗУ для определения стеатоза в динамике, что было бы важным, например, для принятия КПЗУ в качестве референсного метода для оценки эффективности новых препаратов в клинических исследованиях при НАЖБП[4].
Что касается первого вопроса, данные, предлагаемые рядом авторов, могут различаться, причем порой существенно (табл. 2). Следует иметь в виду, что разработчиками метода в качестве пограничных предложены следующие значения КПЗУ: для S1 — 230–249,9 дБ/м, для S2 — 250–276,9 дБ/м, для S3 — 277 дБ/м и более.
Таблица 2
Пограничные значения контролируемого параметра затухания ультразвука (КПЗУ) при определении степени стеатоза, предлагаемые разными авторами
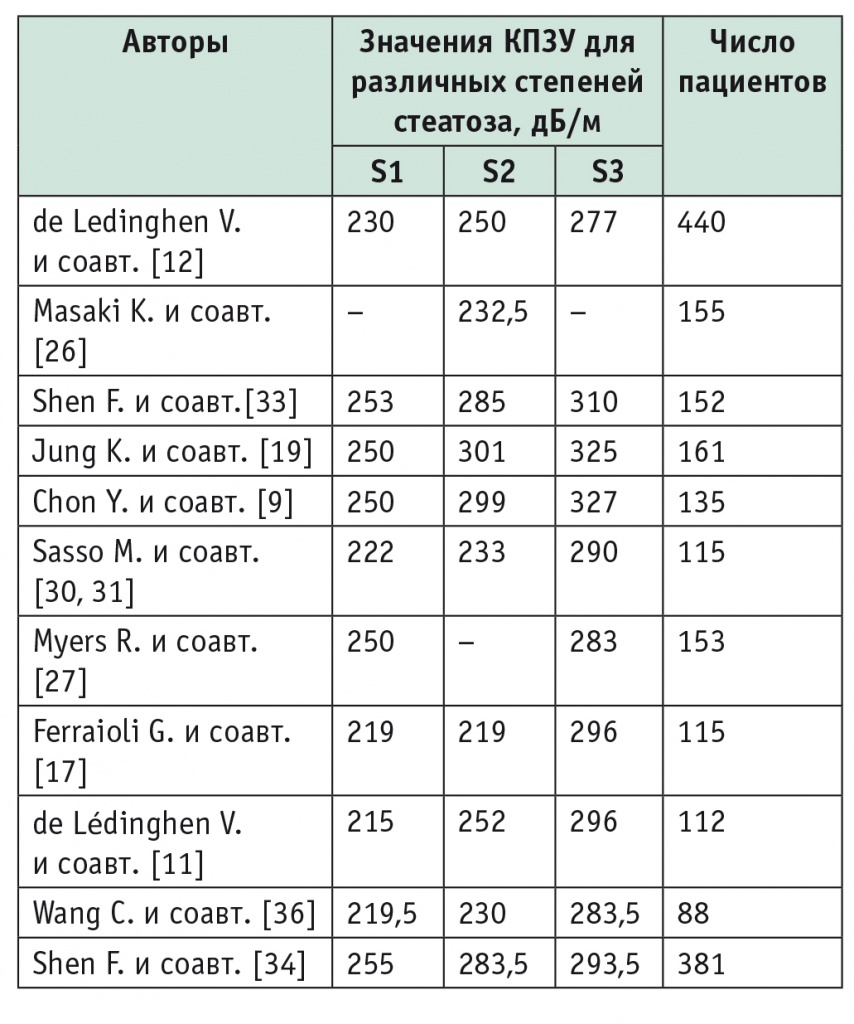
K. Masaki и соавт. провели исследование в японской популяции среди 155 пациентов с хроническими заболеваниями печени. Они показали статистически значимые различия между стеатозом легкой и умеренной степени (p < 0,0001) и предложили в качестве пограничного уровня КПЗУ для умеренного стеатоза значение 232,5 дБ/м и более[26].
M. Sasso и соавт. при сравнительном исследовании применения метода КПЗУ и биопсии печени у 115 пациентов показали, что значения КПЗУ статистически значимо коррелируют с данными морфологии (коэффициент Спирмена ρ = 0,81, p < 10–16). При этом величина AUROC составила 0,91 и 0,95 для S2 и S3 соответственно. В качестве пограничных критериев для степеней стеатоза S1, S2 и S3 этими авторами были предложены значения КПЗУ 222 дБ/м, 233 дБ/м и 290 дБ/м соответственно[30, 31]. При обследовании 152 пациентов с хроническими заболеваниями печени (из них у 52 человек диагностировали НАЖБП и у 100 — хронический гепатит В) в трех центрах Китая F. Shen и соавт. предложили для степеней стеатоза S1, S2 и S3 значения 253 дБ/м, 285 дБ/м и 310 дБ/м соответственно[33]. K. S. Jung и соавт. при обследовании 161 пациента с хроническими заболеваниями печени предложили для S1, S2 и S3 значения 250 дБ/м, 301 дБ/м и 325 дБ/м соответственно. Ими было также показано, что пациенты с выраженным стеатозом имеют больший риск несоответствия между КПЗУ и биопсией печени[19]. Y. E. Chon и соавт. при обследовании 135 пациентов с хроническими заболеваниями печени в корейской популяции предложили для S1, S2 и S3 значения КПЗУ 250 дБ/м, 299 дБ/м и 327 дБ/м соответственно[9].
Учитывая различия в оценке значений КПЗУ разными авторами, можно предположить, что пограничные значения могут зависеть от популяционных особенностей. Кроме того, как часто происходит при внедрении нового метода, методические подходы могут различаться. Так, не всегда учитывается или указывается, какой из датчиков (М или XL) применялся в исследовании, что затрудняет обсуждение результатов и тиражирование данного метода. Вместе с тем использование XL-датчика для КПЗУ является предпочтительным для пациентов с ожирением.
С другой стороны, не все авторы пользуются единой шкалой индекса стеатоза. Так, при обследовании 219 здоровых лиц в качестве оптимальных пограничных критериев для S2 и S4 (по шкале Hamaguchi) были предложены значения КПЗУ 243 и 303,5 дБ/м; при этом величина AUROC для S ≥ 2 и S ≥ 4 составила 0,91 и 0,93 соответственно[6].
Другие исследователи считают необходимым в первую очередь диагностировать тяжелый стеатоз. Так, R. P. Myers и соавт. при сравнительном исследовании стеатоза печени (КПЗУ при эластометрии с М-датчиком и биопсия печени) у 153 пациентов с хроническими заболеваниями печени и ИМТ ≥ 28 кг/м2 показали, что метод КПЗУ статистически значимо коррелирует и с содержанием жировой ткани, и со степенью стеатоза (в обоих случаях p < 0,0005). Однако авторы указывают лишь на необходимость использовать пограничный критерий 283 дБ/м для выраженного стеатоза. Чувствительность и специфичность при применении данного значения — 76% и 79%, а предсказательная ценность положительного и отрицательного результатов — 87% и 64% соответственно[27].
Таким образом, на наш взгляд, нужны крупные когортные исследования, выполненные по одному дизайну, с помощью одного и того же оборудования, которые позволили бы предложить единую шкалу оценки степени стеатоза в зависимости от значений КПЗУ.
В условиях научно-исследовательского отдела гепатологии Московского клинического научно-практического центра (МКНЦ) нами получен собственный опыт применения неинвазивного метода с определением степени стеатоза у пациентов с хроническими заболеваниями печени. Ниже представлены клинические случаи сравнительной оценки степени стеатоза печени с помощью различных методов (КПЗУ при фиброэластометрии в сравнении с пункционной биопсией печени).
КЛИНИЧЕСКИЙ СЛУЧАЙ № 1
Пациентка Б., 60 лет. Поступила в отделение хронических заболеваний печени МКНЦ с жалобами на общую слабость, дискомфорт и чувство тяжести в правом подреберье. Из анамнеза заболевания: пациентка имеет избыточную массу тела в течение 10 лет, сахарный диабет 2 типа в течение 12 лет. По данным УЗИ, на протяжении последних 7 лет диагностируется стеатоз печени с гепатомегалией, в течение 3 лет — увеличение селезенки. Физикальные данные: пациентка повышенного питания (ИМТ — 33 кг/м2); край печени выступает из-под реберной дуги на 2 см. Лабораторные данные: повышение уровня АСТ до 3 норм, АЛТ — до 3,5 нормы, общего билирубина — до 1,5 нормы, ЩФ — до 1,5 нормы, глюкозы — до 7,8 ммоль/л, триглицеридов — до 2,1 ммоль/л, холестерина — до 5,8 ммоль/л. УЗИ органов брюшной полости: размеры печени увеличены (косой вертикальный размер правой доли — 15,5 см, толщина левой доли — 7,0 см), структура паренхимы неоднородная, эхогенность повышена; воротная вена — 12 мм; селезенка увеличена (размеры — 13,5 × 5,2 см, площадь — 70 см2, селезеночная вена — 7 мм).
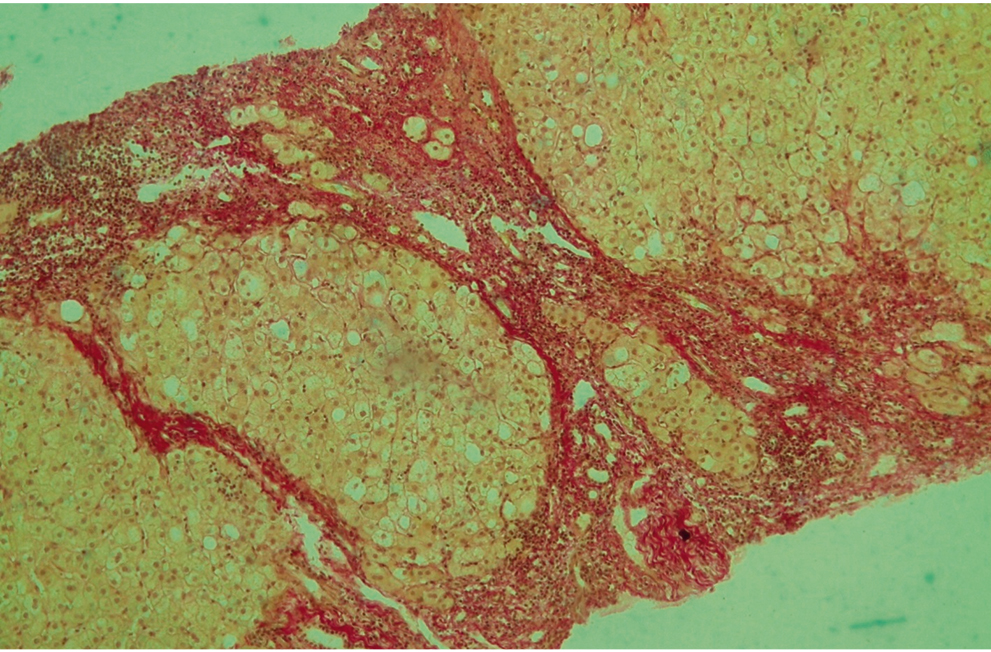
По данным фиброэластометрии с функцией КПЗУ выявлен стеатоз печени, соответствующий степени S2 (262 дБ/м); стадия фиброза по шкале METAVIR соответствует F4 (13,3 кПа) (рис. 1). По данным фибротеста (ФиброМакс): F4 (0,81), A3 (0,84), S3 (0,85), N1 (0,50), H0 (0,03) (рис. 2). Пункционная биопсия печени: дольково-трабекулярное строение нарушено за счет различной толщины и величины фиброзных септ, соединяющих портальные тракты между собой. Портальные тракты и центральные вены с выраженной лимфоидной инфильтрацией и признаками васкуляризации. Гепатоциты с очаговой жировой смешанной инфильтрацией и белковой дистрофией. Выраженная гиперплазия ретикулоэндотелиальной системы. Заключение: мелкоузловой активный цирроз печени. Индекс стеатоза — S2. METAVIR — A2F4 (рис. 3, 4).
Рис. 1. Результаты обследования пациентки Б. на аппарате FibroScan с функцией оценки контролируемого параметра затухания ультразвука. Степень стеатоза — S2 (262 дБ/м). Стадия фиброза — F4 по METAVIR (13,3 кПа).
Примечание. CAP — контролируемый параметр затухания (Controlled Attenuation Parameter); Е — эластичность печени; IQR — интерквартильный размах, отражающий вариабельность измерений; IQR/медиана — соотношение интерквартильного размаха и медианы значения эластичности печени
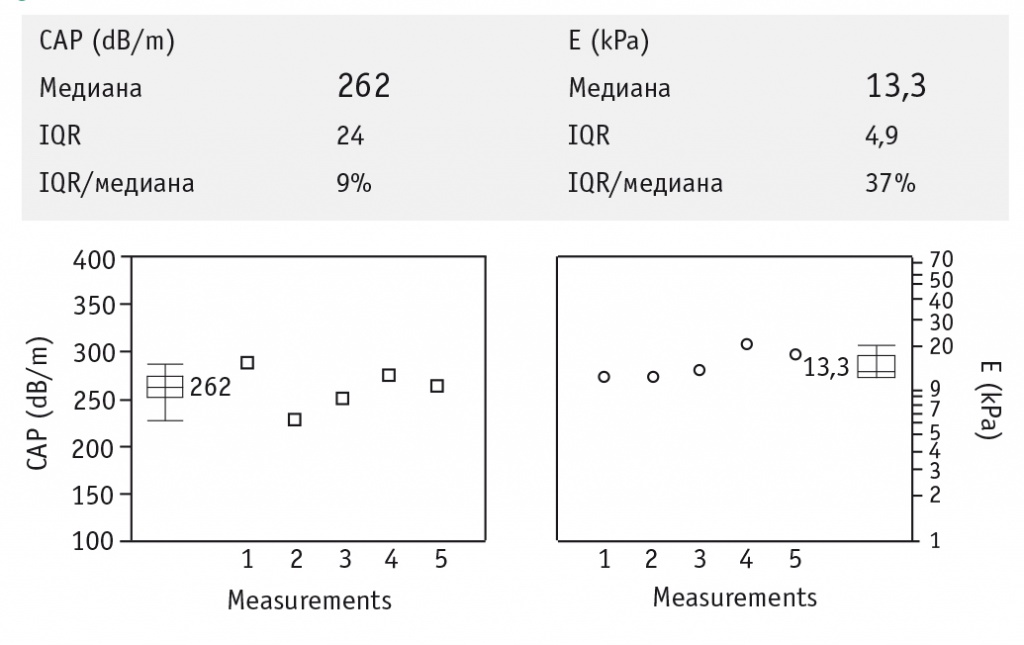
Рис. 2. Результаты обследования пациентки Б. c помощью комплекса тестов ФиброМакс: cтадия фиброза — F4 по METAVIR, активность некровоспалительного процесса высокая — А3, степень стеатоза — S3, наличие факторов метаболического синдрома N1
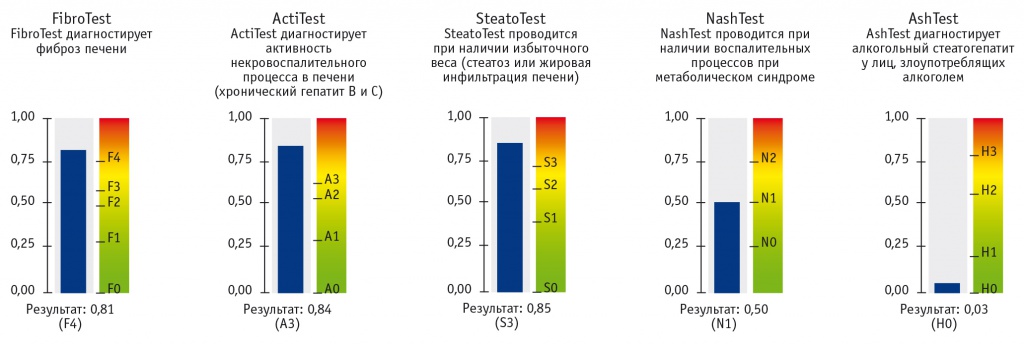
Рис. 3. Гистологическая картина фиброза и стеатоза пациентки Б. Стадия фиброза — F4 по METAVIR. Cтепень стеатоза — S2 по Brunt. Окраска гематоксилин-эозином, увеличение × 200. Фото авторов
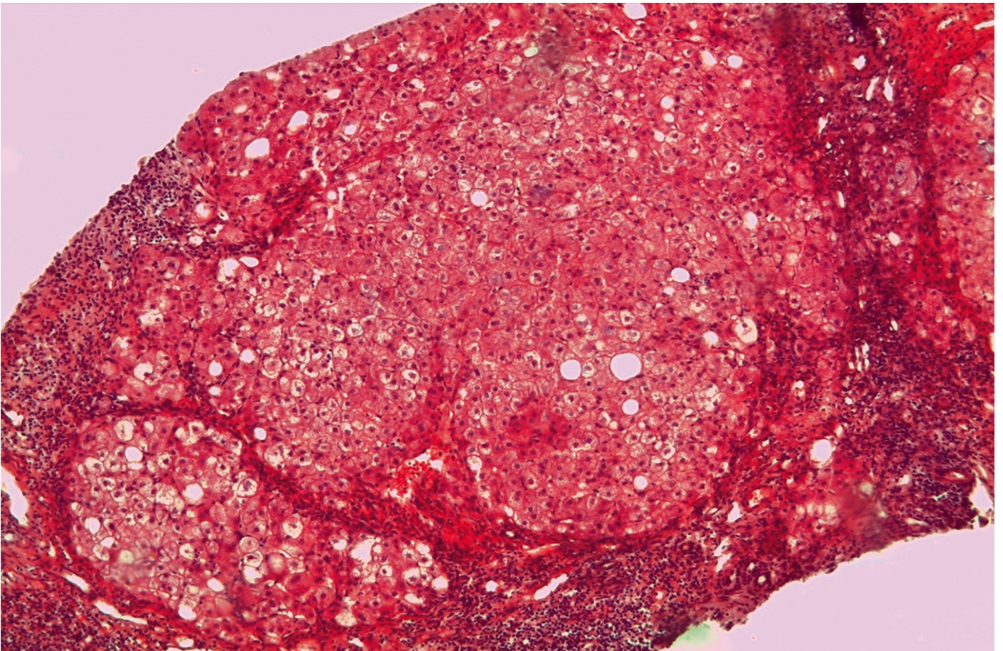
Рис. 4. Гистологическая картина фиброза и стеатоза пациентки Б. Стадия фиброза — F4 по METAVIR. Cтепень стеатоза — S2 по Brunt. Окраска по методу Ван-Гизона. Увеличение × 200. Фото авторов
Заключительный клинический диагноз: Цирроз печени в исходе неалкогольной жировой болезни печени, класс А по Чайлду — Пью (5 баллов), умеренная биохимическая активность. Спленомегалия. Сахарный диабет 2 типа. Алиментарно-конституциональное ожирение 1-й степени. Дислипидемия. Стеатоз печени 2-й степени (S2 по данным КПЗУ, S2 по данным пункционной биопсии печени).
КЛИНИЧЕСКИЙ СЛУЧАЙ № 2
Пациенка Т., 58 лет. Поступила в отделение хронических заболеваний печени МКНЦ с жалобами на общую слабость, чувство тяжести в правом подреберье, одышку при умеренной физической нагрузке. Из анамнеза заболевания: пациентка имеет избыточный вес в течение 5 лет. В 2009 г. выявлены маркеры гепатита С (a-HCV+, HCV РНК — 8 × 105 МЕ/мл, 3а-генотип). Противовирусная терапия не проводилась. Сопутствующие заболевания: ИБС, атеросклеротический кардиосклероз. Артериальная гипертония 3-й степени, 2-й стадии, риск сердечно-сосудистых осложнений 4. Физикальные данные: пациентка повышенного питания (ИМТ — 34,7 кг/м2). При пальпации край печени выступает из-под реберной дуги на 2,5 см. Лабораторные данные: минимальный цитолитический синдром (повышение уровня АЛТ до 2,5 нормы АСТ — до 1,5 нормы, холестерин — 5,9 ммоль/л, триглицериды — 2,75 ммоль/л). УЗИ органов брюшной полости: размеры печени увеличены (косой вертикальный размер правой доли — 16 см, толщина левой доли — 7,5 см), эхогенность повышена, воротная вена — 10 мм.
По данным фиброэластометрии с функцией КПЗУ выявлен стеатоз печени степени S2 (262 дБ/м); стадия фиброза по шкале METAVIR соответствует F1 (6,7 кПа) (рис. 5). По данным фибротеста (ФиброМакс): F0–1 (0,25), A1 (0,33), S3 (0,83), N1 (0,50), H0 (0,04) (рис. 6). Пункционная биопсия печени: дольково-трабекулярное строение сохранено. Центральные вены не расширены. Портальные тракты с небольшим фиброзом, несколько расширены, с лимфоидной инфильтрацией, не выходящей за пределы пограничной пластинки. Очаговые скудные внутридольковые инфильтраты. Гепатоциты преимущественно 3-й зоны ацинуса с крупнокапельной жировой инфильтрацией около 35–45% от общего числа гепатоцитов всех зон. Гиперплазия клеток ретикулоэндотелиальной системы. Заключение: портальный и лобулярный гепатит минимальной активности. Индекс стеатоза — S2. METAVIR — A1F1 (рис. 7).
Рис. 5. Результаты обследования пациентки Т. на аппарате FibroScan с функцией оценки контролируемого параметра затухания ультразвука. Степень стеатоза — S2 (262 дБ/м). Стадия фиброза — F1 по METAVIR (6,7 кПа).
Примечание. CAP — контролируемый параметр затухания (Controlled Attenuation Parameter); Е — эластичность печени; IQR — интерквартильный размах, отражающий вариабельность измерений; IQR/медиана — соотношение интерквартильного размаха и медианы значения эластичности печени
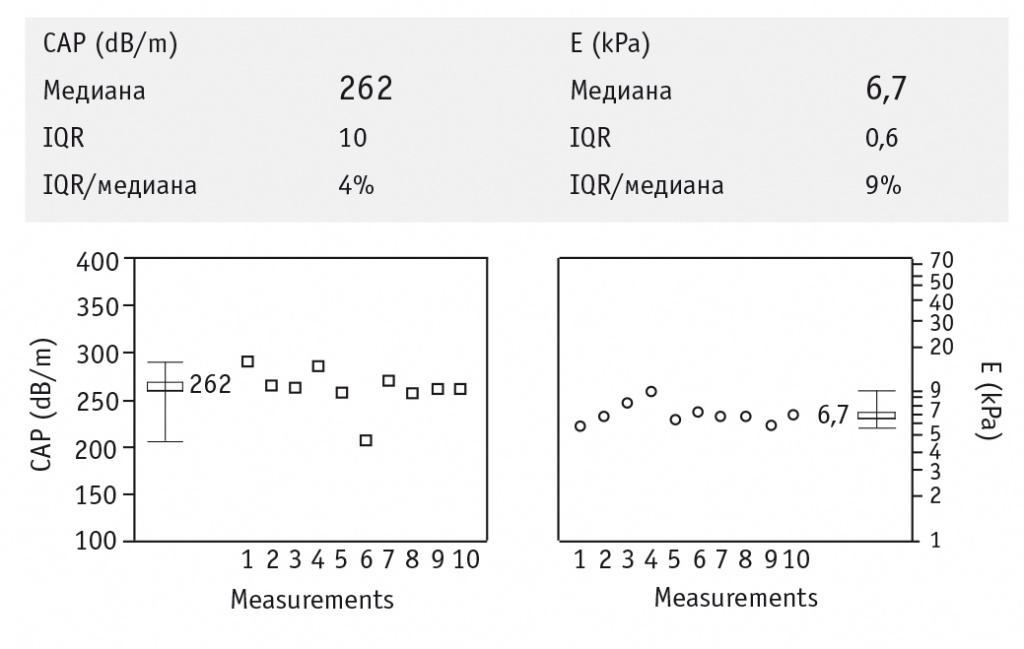
Рис. 6. Результаты обследования пациентки Т. с помощью комплекса тестов ФиброМакс: стадия фиброза — F0–1 по METAVIR, активность некровоспалительного процесса — А1, степень стеатоза — S3, наличие факторов метаболического синдрома N1
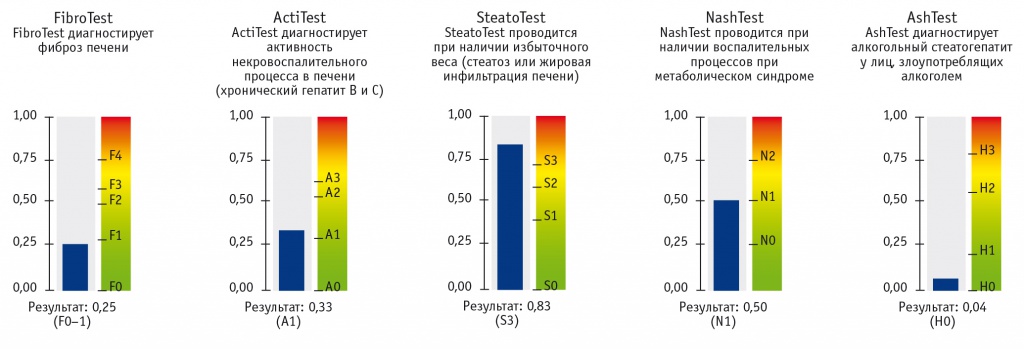
Рис. 7. Гистологическая картина фиброза и стеатоза пациентки Т. Стадия фиброза — F1 по METAVIR. Cтепень стеатоза — S2 по Brunt. А — макро-микровезикулярный стеатоз; Б — преобладает макровезикулярный стеатоз. Окраска по методу Ван-Гизона. Увеличение × 200. Фото авторов
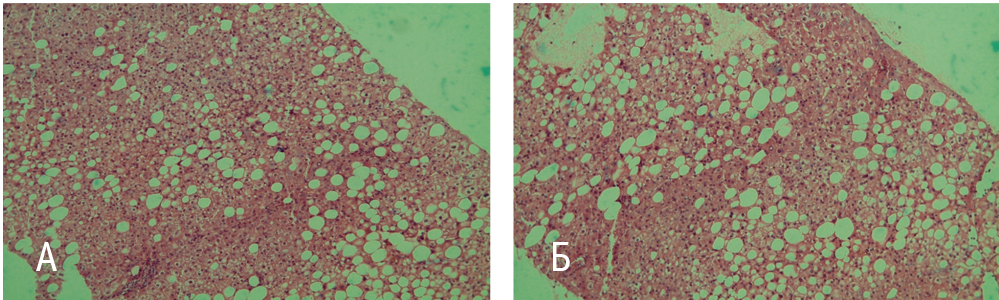
Заключительный клинический диагноз: Хронический гепатит С, 3а-генотип, высокая вирусная нагрузка, умеренная биохимическая активность. Стадия фиброза — F1 (А1F1 — по данным пункционной биопсии печени; F1 — по данным фиброэластометрии печени). Стеатоз печени 2-й cтепени по Brunt. Алиментарно-конституциональное ожирение 1-й степени. Дислипидемия. ИБС, атеросклеротический кардиосклероз. Артериальная гипертония 3-й степени, 2-й стадии, риск сердечно-сосудистых осложнений 4.
Таким образом, представленные клинические случаи демонстрируют высокую точность метода КПЗУ в сопоставлении с пункционной биопсией в оценке степени стеатоза печени вне зависимости от этиологии заболевания, стадии фиброза и степени ожирения.
ЗАКЛЮЧЕНИЕ
Опыт использования метода оценки контролируемого параметра затухания ультразвука (КПЗУ) поставил перед клиницистами и исследователями ряд вопросов:
- будут ли ультраструктурные особенности макро- и микровезикулярного стеатоза печени влиять на корректность его определения?
- насколько активно будет влиять на качество результата при применении метода КПЗУ прием алкоголя, пищи или определенной группы лекарственных препаратов?
- имеет ли значение для оценки степени стеатоза методом КПЗУ применение М- и XL-датчика, насколько совпадают данные в зависимости от исходных характеристик пациента?
- насколько степень определяемого методом КПЗУ стеатоза зависит от этиологии заболевания печени?
Вместе с тем полученные нами результаты показали необходимость более тщательного изучения КПЗУ в качестве метода неинвазивной диагностики стеатоза печени в сопоставлении с морфологическим методом у пациентов с хроническими заболеваниями печени различной этиологии. Требуются накопление большего количества наблюдений и последующий анализ с целью оценки диагностической точности КПЗУ и выбора точных количественных параметров соответствия при выполнении данного метода исследования.








