Алкогольная болезнь печени (АБП) является наиболее распространенным видом поражения печени и известна с древних времен. Предполагают, что «ферментированные» напитки — предшественники алкогольных напитков в современном понимании — существовали еще 10 тыс. лет до н. э. Алкоголь до сегодняшнего дня остается одной из ведущих причин заболеваний печени во всем мире. По данным ВОЗ, он является этиологическим фактором 60 заболеваний и играет роль в патогенезе 200 заболеваний.
Выделяют три клинико-морфологические формы АБП — алкогольный стеатоз, стеатогепатит и цирроз печени. Количество потребляемого этанола выступает решающим фактором развития АБП, но оно не всегда коррелирует с тяжестью заболевания. У подавляющего большинства пациентов, злоупотребляющих алкоголем, развивается алкогольный стеатоз печени, у 10–35% — алкогольный стеатогепатит (АСГ), и только у 8–20% заболевание прогрессирует в цирроз печени. Считается, что 40–80 г этанола в день для мужчин и 20–40 г для женщин, принимаемые в течение 10–12 лет, являются пороговыми дозами, которые с высокой вероятностью приводят к АБП [10].
Патогенез алкогольного поражения печени продолжает изучаться, требуют уточнения разрешающие факторы его прогрессирования. Многие «игроки» патологического процесса сегодня хорошо известны: на развитие и прогрессирование заболевания, помимо этанола, могут влиять сопутствующие заболевания, пол, социальные и генетические факторы[10]. Однако не до конца ясно, почему у одних пациентов развиваются гепатит и цирроз печени, а у других заболевание остается на стадии стеатоза.
Разрабатываются диагностические и прогностические модели заболевания в зависимости от индивидуальных молекулярно-генетических и метаболических характеристик, а также возможные направления лечения на основе патогенетических подходов.
ОБЩИЕ ФАКТОРЫ РИСКА РАЗВИТИЯ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
Наиболее четкой генетической детерминантой развития АБП является женский пол. Точные причины повышенной чувствительности женской популяции к алкоголю неясны, но предполагается, что существенное значение могут иметь особенности фармакокинетики этанола. В частности, у женщин в связи со спецификой распределения жировой ткани, меньшей массой тела и концентрацией воды в организме происходит объемное перераспределение и при равных с мужчинами количествах потребляемого алкоголя концентрация этанола в крови выше. Важную роль играют эстрогены. К эстрогениндуцированным эффектам относятся повышение кишечной проницаемости, портальная эндотоксемия, рост чувствительности клеток Купфера к эндотоксинам за счет увеличения экспрессии рецептора CD14, повышение экспрессии гена ФНО-α[5, 9]. У представительниц женского пола в печени выше экспрессия остеопонтина — матрикс-целлюлярного протеина, способствующего инфильтрации печени нейтрофилами и повышающего риск развития АБП[2].
Ожирение является важным фактором риска, который ускоряет прогрессирование фиброза и развитие цирроза печени при АБП. Синергические эффекты ожирения и длительного приема алкоголя заключаются в формировании ответной реакции эндоплазматического ретикулума на клеточной стресс, активации макрофагов 1-го типа и резистентности адипонектина[18].
Вирусный гепатит С ухудшает прогноз заболевания при АБП. Доказано, что алкоголь не только усиливает экспрессию вирусного генома на уровне матриксной РНК, но и активирует ядерный фактор (NF-кB) и эндогенные опиоидные рецепторы, что может служить дополнительным фактором экспрессии HCV. Комбинация токсических эффектов HCV, алкоголя и активированных ими противовоспалительных цитокинов приводит к ускоренному некрозу гепатоцитов[23]. Данные о взаимодействии HBV и алкоголя противоречивы.
Дефицит питательных веществ играет роль как в развитии, так и в прогрессировании АБП. Мальнутриция y пациентов, злоупотребляющих алкоголем, объясняется заменой «питательных» калорий пищевых продуктов «пустыми» калориями этанола. К мальнутриции приводят также нарушение пищеварения и липидного обмена, усиление катаболизма соматических и висцеральных белков. Белково-энергетическая недостаточность повышает окислительный стресс путем истощения антиоксидантной системы (глутатиона, витаминов А, Е и С). Кроме того, пациенты с АБП страдают дефицитом фолиевой кислоты, тиамина и пиридоксина, повышающим вероятность развития анемии. Таким образом, с одной стороны, мальнутриция является фактором риска быстрого прогрессирования АБП, а с другой стороны, алкоголь приводит к белковому истощению, ухудшая прогноз заболевания[11].
Следует отметить метионин, который является незаменимой аминокислотой и дефицит которого может приводить к развитию стеатоза печени, а в дальнейшем — к прогрессированию собственно АБП. В настоящее время известно, что метионин участвует в восстановлении запасов внутриклеточного антиоксиданта глутатиона, являясь его предшественником, это крайне важно при преобладании оксидативных реакций в организме. В условиях окислительного стресса при АБП потребность в эндогенных антиоксидантах резко возрастает, что может быть обоснованием для мероприятий по компенсации дефицита метионина в организме при алкогольных поражениях печени.
Какова роль метионина в организме и какими могут быть пути его восполнения? Метильная группа в метионине химически активна, и более 50 метаболических реакций требуют ее переноса от S-аденозилметионина (адеметионина) на такие субстраты, как нуклеиновые кислоты, белки и липиды. Метаболизм метионина происходит в основном в печени. Метионин при участии ферментов превращается в адеметионин, но последний в дальнейшем потребляется как субстрат в различных реакциях через последовательное образование S-аденозилгомоцистеина, гомоцистеина и вновь метионина — формируется так называемый цикл адеметионина.
Следует предположить, что при АБП метаболизм метионина нарушается: оказывается нарушенным весь цикл адеметионина, снижаются активность и эффективность всех метаболических реакций в печени, протекающих с участием метильной группы. Поэтому уже на ранних стадиях АБП крайне важным является нутритивное обеспечение метаболизма метионина.
ГЕНЕТИЧЕСКИЕ ФАКТОРЫ РИСКА РАЗВИТИЯ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
Гены, которые кодируют ферменты, метаболизирующие этанол и ацетальдегид, влияют на предрасположенность к алкогольной зависимости и развитию АБП. В частности, это гены алкогольдегидрогеназы (АДГ), альдегиддегидрогеназы и CYP2E1 (CYP — цитохром P450; 2 — семейство 2; E — подсемейство E; 1 — изоформа 1). Предполагается, что генотипы, программирующие функционально менее активные ферменты, приводят к уменьшению образования ацетальдегида, способствуют расщеплению этанола через CYP2E1 и другие неокислительные пути; это может увеличить риск развития АБП.
Полиморфизм гена АДГ повышает чувствительность к алкоголю в определенных популяциях, например в ряде азиатских этносов, у женщин. В этом случае АБП развивается при значительно более низких дозах алкоголя.
Полиморфизм гена CYP2E1 (аллеля С2) существенно различается между популяциями, в том числе у пациентов с АБП. Алкоголь активирует CYP2E1, и индивиды с аллелем C2 способны активнее метаболизировать алкоголь, вследствие этого увеличивается образование свободных радикалов, усиливается перекисное окисление липидов, что способствует развитию жирового гепатоза.
Доказана корреляция между уровнем эндотоксемии и степенью алкогольиндуцированного поражения печени[10]. Хроническое потребление алкоголя увеличивает экспрессию CD14 на клетках Купфера и повышает чувствительность этих клеток к эндотоксинам. У носителей Т-аллеля CD14-рецептора увеличен риск развития цирроза печени.
Хронический прием алкоголя также приводит к образованию свободных радикалов, которые не только повреждают ДНК, но и нарушают ее репарацию (в норме эксцизионная репарация ДНК препятствует поражению гепатоцитов)[10].
ЭПИГЕНЕТИЧЕСКИЕ ЭФФЕКТЫ ЭТАНОЛА
Эпигенетика изучает наследственные варианты фенотипа и экспрессии генов, обусловленные изменениями некодирующей части ДНК. Эпигенетические модификации, возникающие под влиянием этанола, включают:
- метилирование ДНК;
- модификацию гистонов;
- изменения на уровне РНК.
Исследования выявили, что этанол влияет на метаболизм метионина и тем самым на метилирование ДНК. Продолжительное метилирование ДНК увеличивает экспрессию генов, регулирующих стресс-ответ эндоплазматического ретикулума[8].
Этанол и его метаболит ацетат регулируют ацетилирование гистонов в макрофагах, способствуя выработке провоспалительных цитокинов, которые приводят к развитию AСГ. Клетки содержат множество некодирующих РНК, включая компоненты механизма генетической экспрессии. Они не кодируют белки и в большинстве случаев действуют как репрессоры трансляции. МикроРНК участвуют в росте клеток, их дифференциации и апоптозе. В последние годы активно изучается роль микроРНК в патогенезе заболеваний печени, особенно гепатоцеллюлярной карциномы (ГЦК). Доказано, что алкоголь усиливает экспрессию miR-34a, miR-103, miR-107 и miR-122, принимающих участие в регуляции липидного обмена.
MiR-217, экспрессия которой также меняется под действием алкоголя, способствует развитию стеатоза. Изменения на уровне микроРНК, инициированные этанолом, затрагивают не только гепатоциты, но и другие клетки печени и кишечника. Например, этанол меняет экспрессию miR-135, 199, 132, 155, 212 в синусоидальных эндотелиальных клетках, клетках Купфера, эпителиоцитах кишечника, а эти микроРНК, в свою очередь, способны влиять на экспрессию эндотелина, рецептора эндотелина, ФНО-α, белка zonula occludens 1. Указанные изменения нарушают проницаемость кишечной стенки, активируют иммуновоспалительные процессы и приводят к АБП[8].
АЛКОГОЛЬНЫЙ СТЕАТОЗ ПЕЧЕНИ
Стеатоз печени является ранним и наиболее распространенным видом поражения печени в ответ на хроническое потребление этанола и характеризуется накоплением жира (главным образом триглицеридов, фосфолипидов и сложных эфиров холестерина) в гепатоцитах. В настоящее время доказано, что алкогольиндуцированная жировая дистрофия, ранее считавшаяся относительно безвредной, повышает готовность печени к развитию более тяжелой патологии, такой как АСГ, фиброз, цирроз печени и ГЦК. Причины, по которым у части больных происходит прогрессирование от стеатоза к более продвинутым формам заболевания, до конца не ясны.
В патогенезе алкогольиндуцированного стеатоза можно выделить несколько факторов (рис. 1).
Рис. 1. Этиопатогенетические факторы алкогольного стеатоза.
Примечание. AMPK — аденозинмонофосфат-активируемая протеинкиназа (AMP-activated protein kinase); EGR-1 — фактор транскрипции (early growth response)
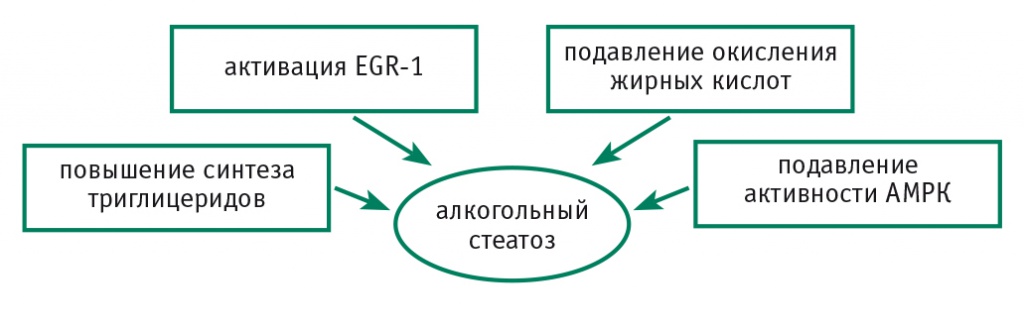
Во-первых, под влиянием этанола происходит повышение синтеза триглицеридов и фосфолипидов. Стимуляция липогенеза происходит за счет воздействия на факторы транскрипции, которые стимулируют липогенез и тормозят окисление жирных кислот. Одним из таких факторов является белок SREBP-1c (sterol regulatory element-binding protein 1c), активирующий липогенные гены. Продукт метаболизма алкоголя ацетальдегид способствует транскрипции гена SREB-1с либо непосредственно, либо опосредованно — через аденозин и каннабиноиды. В результате повышается уровень липогенных энзимов. Таким образом, этанол преображает печень из «жиросжигающего» в «жиронакопляющий» орган.
Во-вторых, этанол подавляет окисление жирных кислот в гепатоцитах, главным образом путем инактивации рецепторов, активируемых пероксисомными пролифераторами (PРAR-α) и вовлеченных в регуляцию транспортировки и окисления жирных кислот. Следует отметить, что этанолиндуцированное подавление окисления жирных кислот — обратимый процесс: в экспериментальных исследованиях, в которых крысам одновременно давали этанол и агонисты PPAR-α, индукция PPAR-α, ускорявшая окисление жирных кислот, одновременно предотвращала жировую инфильтрацию печени. Эти данные подчеркивают важность окисления жирных кислот в элиминации стеатоза и подчеркивают терапевтический потенциал агонистов PPAR-α.
Под влиянием этанола происходит также подавление активности аденозинмонофосфатактивируемой протеинкиназы (англ. сокращение — AMPK). Этот фермент участвует в регуляции липидного обмена в печени: активирует АТФ-генерирующие катаболические пути, такие как окисление жирных кислот и гликолиз, и блокирует этанолиндуцированную активацию SREB-1с (активатора липогенных генов). Под влиянием этанола у мышей наблюдается снижение уровня AMPK в печени и повышается активность ацетил-КоА-карбоксилазы — фермента, участвующего в синтезе жирных кислот[4]. Эти данные открывают возможность использования метформина (активатора AMPK) в целях предотвращения и/или реверсии жировой дистрофии при АБП.
Еще одним важным «игроком» в алкогольиндуцированном стеатозе является фактор транскрипции EGR-1 (early growth response 1). Он активируется под влиянием факторов роста. Некоторые гены, имеющие отношение к алкогольному поражению печени, имеют промоутерные регионы, которые связывают EGR-1. Среди этих генов имеются те, которые кодируют тромбоцитарный фактор роста (platelet-derived growth factor — PDGF), трансформирующий фактор роста бета (transforming growth factor beta — TGF-β), молекулы межклеточной адгезии 1 (intercellular adhesion molecule 1 — ICAM-1), ФНО-α. Особенно примечательно влияние на синтез ФНО-α, который является липогенным цитокином, вызывающим активацию SREBP-1с и повышающим биосинтез липидов. Возможно, одно из убедительных доказательств роли EGR-1 в развитии этанолиндуцированного стеатоза представлено M. R. McMullen и соавт., в чьих работах показано, что, в отличие от мышей дикого типа, у которых в ответ на хроническое введение этанола развивается жировая дистрофия печени, EGR-1-«нулевые» мыши не демонстрируют ни стеатоза печени, ни повышения уровня ФНО-α в ответ на этанол[4, 15].
Кроме того, алкоголь увеличивает отношение NADH/NAD (никотинамидадениндинуклеотид восстановленный/окисленный), тем самым нарушая митохондриальное β-окисление жирных кислот и подавляя глюконеогенез, что также может приводить к стеатозу.
За счет аутофагии происходит устранение липидных капель в гепатоцитах. Долгосрочное потребление алкоголя снижает аутофагию (см. ниже). Тем не менее исследования показали, что кратковременное воздействие этанола может активизировать аутофагию путем создания активных форм кислорода, при этом острая этанолиндуцированная аутофагия может иметь компенсаторное значение, предотвращая развитие стеатоза на ранних стадиях АБП[3].
При АБП стеатоз, как правило, бывает макровезикулярным или смешанным микро- и макровезикулярным (рис. 2).
Рис. 2. Алкогольный стеатоз печени. Крупнокапельная жировая инфильтрация гепатоцитов во всех зонах ацинуса. Индекс стеатоза — 3. Портальный тракт без воспалительной инфильтрации. Окраска гематоксилином и эозином. Увеличение: ×120 (препарат С. Г. Хомерики). Фото авторов
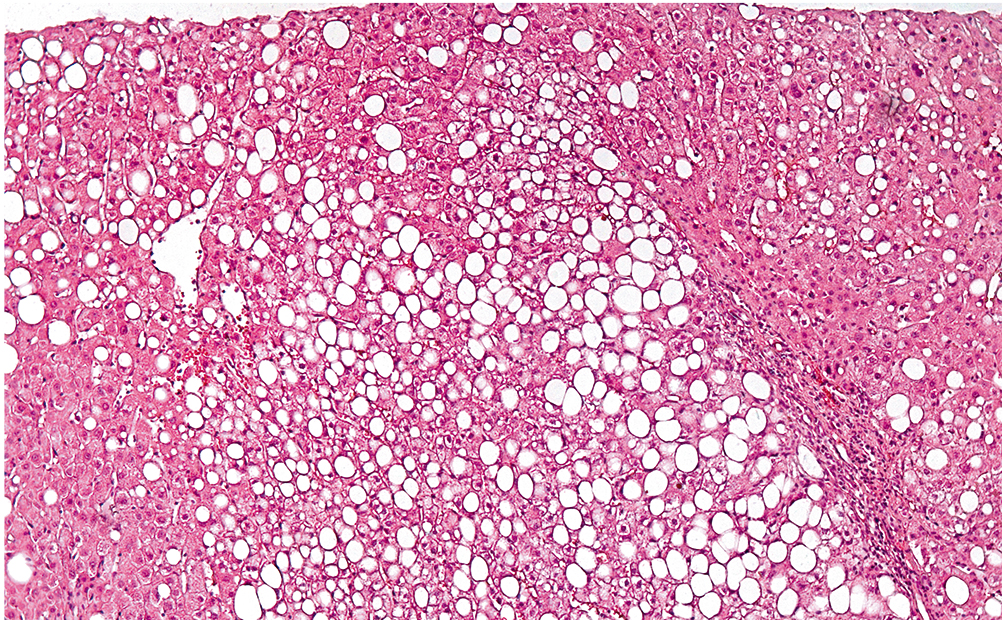
Накопление жира начинается в центролобулярной зоне 3 и прогрессирует к перипортальной зоне 1. Сначала жир накапливается в виде мелких капелек, потом они сливаются, образуя более крупные капли, вытесняющие ядра к периферии гепатоцита. Синусоиды при этом обычно расширены, в их просветах встречаются единичные нейтрофилы. Признаки воспалительной инфильтрации портальных трактов отсутствуют, а в дольках не удается выявить компактных скоплений воспалительных клеток. В ряде случаев может наблюдаться картина каналикулярного холестаза с образованием желчных тромбов в канальцах[1].
Таким образом, алкогольный стеатоз представляет собой результат нарушения липидного обмена. Основными событиями при этом являются усиление липогенеза путем активации липогенных генов и подавление окисления жирных кислот в печени, и алкоголь выступает в роли их триггерного фактора.
АЛКОГОЛЬНЫЙ СТЕАТОГЕПАТИТ
АСГ развивается у 10–35% пациентов, злоупотребляющих алкоголем. В отношении этанолиндуцированной иммуновоспалительной реакции можно выделить несколько этиопатогенетических факторов (рис. 3).
Рис. 3. Этиопатогенетические факторы алкогольного стеатогепатита.
Примечание. NADH/NAD — никотинамидадениндинуклеотид восстановленный/окисленный
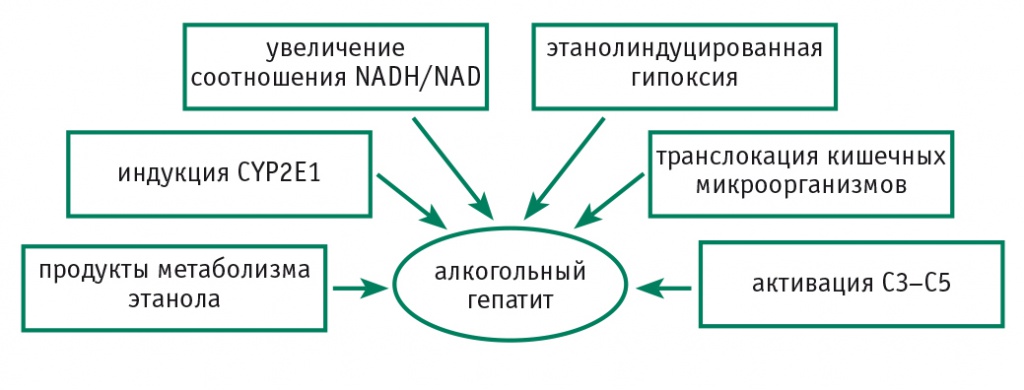
Роль продуктов метаболизма этанола. Этанол метаболизируется в ацетальдегид при участии АДГ в цитозоле, цитохрома Р450 в микрохромосомах и каталазы в пероксисомах. В процессе метаболизма этанола генерируются активные формы кислорода, вызывающие перекисное окисление липидов, истощение митохондриального глутатиона и S-аденозилметиониндекарбоксилазы. Все эти процессы в совокупности приводят к повреждению печеночной ткани.
Ацетальдегид наряду с малондиальдегидом (продуктом метаболизма липидов) ковалентно связывается с белками на мембранах гепатоцитов, в результате образуются белковые комплексы, которые являются потенциальными иммуногенами (неоантигены). Эти неоантигены запускают иммунную реакцию с синтезом антител и/или активацией Т-клеток. Антитела к белковым комплексам находят в сыворотке мышей с алкогольным поражением печени и у «тяжело» пьющих пациентов[13]. Более того, сыворотка крови пациентов с АБП проявляет антителозависимую токсичность к гепатоцитам, подверженным воздействию этанола. Мононуклеарные Т-клетки периферической крови пациентов с АБП проявляют гораздо бо́льшую активность по отношению к комплексу альбумин/малондиальдегид по сравнению с Т-клетками «тяжело» пьющих пациентов, но без АБП.
Ацетальдегид быстро метаболизируется в ацетат с участием альдегиддегидрогеназы в митохондриях. Хотя ацетат не обладает прямой гепатотоксичностью, как полагают, он участвует в регуляции воспалительных реакций у пациентов с АСГ путем усиления экспрессии провоспалительных цитокинов в макрофагах[13].
Соотношение NADH/NAD. Увеличение соотношения NADH/NAD не только приводит к стеатозу, нарушая митохондриальное β-окисление жирных кислот, но и является предпосылкой образования свободных радикалов и формирования воспалительного процесса в печени.
В норме реакция NAD→NADH регулируется циклом Кребса. Смещение в сторону NADH, вызванное чрезмерным потреблением алкоголя, нарушает углеводный и липидный обмен, глюконеогенез и в результате активирует кетогенез и синтез жирных кислот. Встраивание NADH в митохондрии приводит к трансферу электронов к молекулам кислорода с образованием активных форм кислорода и окислительному стрессу[10].
Индукция CYP2E1. При чрезмерном потреблении алкоголя происходит ферментативная индукция CYP2E1 – альтернативного пути метаболизма алкоголя. В процессе взаимодействия CYP2E1 и цитохромредуктазы происходит «утечка» электронов респираторной цепи и генерируются свободные радикалы. Синтезируемые в этом каскаде метаболиты могут взаимодействовать с железом (реакция Фентона), образуя еще более мощные гидроксифенил- и перферилрадикалы, которые приводят к необратимым поражениям печени[21].
Этанолопосредованная гипоксия. Метаболизм этанола — «энергозатратный» процесс, требующий повышенной оксигенации печеночной ткани, особенно центролобулярной части. Печеночный кровоток усиливается, но не настолько, чтобы компенсировать повышенную потребность в кислороде. В результате возникает центролобулярная гипоксия, которая постепенно усиливается из-за этанолопосредованного нарушения печеночного кровоснабжения, в частности внутрипеченочной вазоконстрикции. Алкогольиндуцированное нарушение перфузии печеночной ткани наглядно продемонстрировано в экспериментальных исследованиях на крысах, где этанол приводил к дозозависимому увеличению давления в воротной вене как следствию внутрипеченочной вазоконстрикции[7].
Таким образом, гипоксия печеночной ткани является результатом повышения потребности в кислороде, с одной стороны, и уменьшения перфузии печеночной ткани — с другой. Это дозозависимый процесс: после снижения концентрации этанола в крови происходит реперфузия печени, что может стать дополнительным повреждающим фактором[7].
Роль эндотоксинов. Одним из наиболее важных алкогольиндуцированных процессов, приводящих к активации иммунных механизмов, является эндотоксемия. В роли эндотоксинов выступают липополисахариды (ЛПС) — части стенок грамотрицательных бактерий. В норме только небольшая часть их всасывается из кишечника и попадает в систему воротной вены. В условиях длительного приема алкоголя происходит более интенсивное высвобождение эндотоксинов.
Какие факторы обусловливают эндотоксемию? Исследования показывают, что этанол приводит к дисбиозу — нарушению гомеостаза кишечной микробиоты[20]. Помимо повышения уровня грамотрицательных бактерий — источника эндотоксинов, — происходит нарушение проницаемости кишечной стенки, что является непременным фактором бактериальной транслокации. Ацетальдегид воздействует на белки плотного и адгезивного контакта, нарушение которого увеличивает проницаемость кишечной стенки и приводит к «утечке» бактериальных эндотоксинов. Эндотоксины и эндотоксининдуцированные макрофаги, в свою очередь, повышают проницаемость кишечной стенки, тем самым замыкая порочный круг[20].
Эндотоксемия приводит к активации печеночных и внепеченочных макрофагов. Эндотоксины активируют клетки Купфера за счет рецепторов двух типов: CD14 (рецептор без цитоплазматического домена) и TLR4 (трансмембранный протеин с цитоплазматическим доменом). СD14 связывается с ЛПС, и только после этого комплекс распознается TLR4. Взаимодействие TLR4 и ЛПС ведет к включению противовоспалительного каскада путем активации ядерного фактора NF-κB — универсального фактора транскрипции, контролирующего экспрессию генов иммунного ответа. В результате этого происходит высвобождение провоспалительных цитокинов (ИФН-γ, ФНО-α, ИЛ-6, ИЛ-1), хемокинов, активных форм кислорода, которые приводят к развитию воспаления в печени[20].
Активация системы комплемента С3–С5. Алкоголь воздействует на систему комплемента С3–С5, которая, связываясь с соответствующими рецепторами на клетках Купфера, активирует их. Активация системы комплемента приводит также к продукции ФНО-α. Интересно, что активация TLR4 и системы комплемента не только вызывает повреждение гепатоцитов, но и способствует выработке клетками Купфера гепатопротекторных цитокинов (таких как ИЛ-6) и противовоспалительных цитокинов (таких как ИЛ-10), тем самым уменьшая алкогольиндуцированное поражение печени[8].
Роль аутофагии
Аутофагия — катаболический процесс, в результате которого происходит освобождение клеток от «устаревших» белков и органелл. Аутофагия обычно активируется в ответ на дефицит нутриентов и другие виды стресса как ответная защитная реакция. Помимо поддержания клеточного гомеостаза, она играет роль защитного механизма против бактериальных инфекций. Исследования последних лет указывают на роль аутофагии в гибели гепатоцитов, в патогенезе стеатогепатита, вирусных гепатитов, ГЦК. Дефицит аутофагии (Atg7-нокаут) приводит к накоплению убиквитин-положительных белковых агрегатов, поврежденных митохондрий, стеатозу и воспалению печени (в норме меченные убиквитином белки направляются для протеолитической деградации в протеосомы).
Почему нарушение аутофагии и поврежденные митохондрии являются предпосылками гибели гепатоцитов и какую роль в этом процессе играет этанол? Аутофагия не только обеспечивает питательными веществами клетки во время голодания, но и выборочно освобождает клетки от поврежденных митохондрий, которые играют центральную роль в регуляции апоптоза. Многие из апоптотических стимулов индуцируют и аутофагию, что свидетельствует о том, что судьба клетки определяется балансом между аутофагией и поврежденными митохондриями: если объем поврежденных митохондрий соответствует аутофагическому потенциалу клетки, гибели клетки можно избежать. Таким образом, фармакологическое ингибирование аутофагии значительно увеличивает гибель клеток (апоптоз).
Промежуточные продукты метаболизма этанола и этанолиндуцированные активные формы кислорода индуцируют аутофагию. Это подтверждено экспериментальными исследованиями, согласно которым этанол вызывает аутофагию в культивированных гепатоцитах и клетках гепатомы, экспрессирующих АДГ и CYP2E1 (рис. 4)[3].
Рис. 4. Гепатоциты мышей, инфицированные аденовирусом: A, С — не подверженные воздействию алкоголя; B, D — подверженные воздействию алкоголя[3].
Примечание. N — ядра; М — митохондрии; маленькие стрелки указывают на фагосомы, большие стрелки — на аутолизосомы
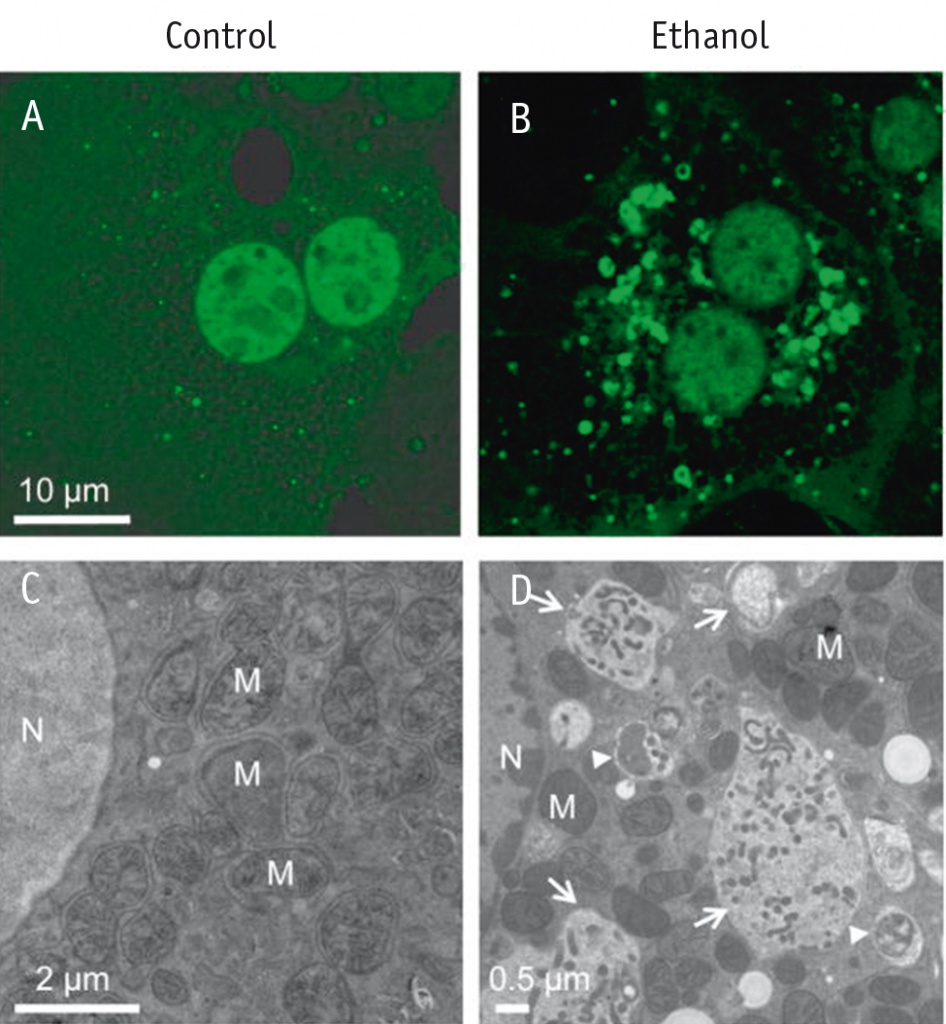
Алкогольиндуцированная аутофагия подразумевает лизис, в первую очередь, митохондрий и липидных капель. Такая селективная митохондрио- и липидофагия предотвращает повреждение печени, вызванное алкоголем, так как нарушение функции митоходрий и накопление липидов являются ключевыми патогенетическими факторами АБП. Возможно, этой протективной ролью аутофагии можно объяснить тот факт, что только у 1/3 лиц, злоупотребляющих алкоголем, развивается АСГ. Но существует некое пороговое состояние, когда интенсивность апоптотических сигналов настолько велика, что гибель клеток неизбежна даже при наличии аутофагии.
Экспериментальные исследования показывают, что искусственное усиление аутофагии можно использовать в лечении алкогольиндуцированного поражения печени, которое по сей день остается нерешенной проблемой. Например, индукция аутофагии рапамицином (иммунодепрессант) уменьшает этанолиндуцированный стеатоз и воспаление при остром алкогольном поражении печени[3].
Апоптоз гепатоцитов
Важным патологическим признаком алкогольного поражения печени является апоптоз гепатоцитов — запрограммированная гибель клеток. Апоптоз — результат опосредованной этанолом гепатотоксичности, окислительного стресса, ингибирования генов выживаемости (с-Met) и индукции проапоптотических сигнальных молекул (ФНО-α и Fas-лиганда).
В апоптозе гепатоцитов задействованы два основных механизма — дисфункция митохондрий под влиянием окислительного стресса и активация «рецепторов смерти». Повреждение митохондрий связано с активными формами кислорода, источниками которых под воздействием алкоголя становятся клетки Купфера и CYP2E1. Полиненасыщенные жирные кислоты, которые в большом количестве содержатся в мембранах митохондрий, особенно уязвимы к воздействию активных форм кислорода.
Пораженные митохондрии, в свою очередь, участвуют в индукции Fas-лиганда — трансмембранного белка, соединение которого с соответствующим рецептором приводит к апоптозу клеток. Окислительный стресс у пациентов с АСГ ассоциируется с повышенным уровнем Fas-лиганда, который, наряду с уровнем ФНО-α, является предиктором смерти при АБП. В ряде исследований продемонстрировано, что алкоголь приводит к повышенной экспрессии Fas-рецепторов на гепатоцитах[6].
Если поражение митохондрий тяжелое и распространяется на их бо́льшую часть, происходит энергетическое истощение клеток с онкотическим некрозом[6].
Нарушение регенерации
В норме печень может регенерировать за счет оставшихся зрелых гепатоцитов, эндотелиальных клеток и эпителиальных клеток желчных протоков. Хотя исследования в человеческой популяции отсутствуют, можно предположить, что этанол приводит не только к потере гепатоцитов, но и к нарушению их компенсаторной пролиферации. В этом случае регенераторную функцию берут на себя клетки-предшественники (овальные клетки) печени. Увеличение количества овальных клеток, которое происходит при АБП, повышает риск развития ГЦК[17, 22]. С восстановлением регенераторной функции, возможно, связан положительный эффект введения аутологических стволовых клеток (CD34+) костного мозга взрослого человека при АБП.
Гистологическими признаками стеатогепатита являются воспаление и некроз, наиболее выраженные в центролобулярной части ацинуса. Липогранулемы и внутридольковые некрозы гепатоцитов являются первым признаком трансформации стеатоза печени в стеатогепатит (рис. 5). Нарастание количества и увеличение размера липогранулем в печени свидетельствуют об усилении активности воспаления и являются предикторами неблагоприятного развития патологического процесса[11].
Рис. 5. Алкогольный стеатогепатит. Сформированная липогранулема. Стрелкой отмечен очаг смешанноклеточной инфильтрации вокруг некротизированных гепатоцитов с признаками жировой дистрофии. Окраска гематоксилином и эозином. Увеличение: ×500 (препарат С. Г. Хомерики)
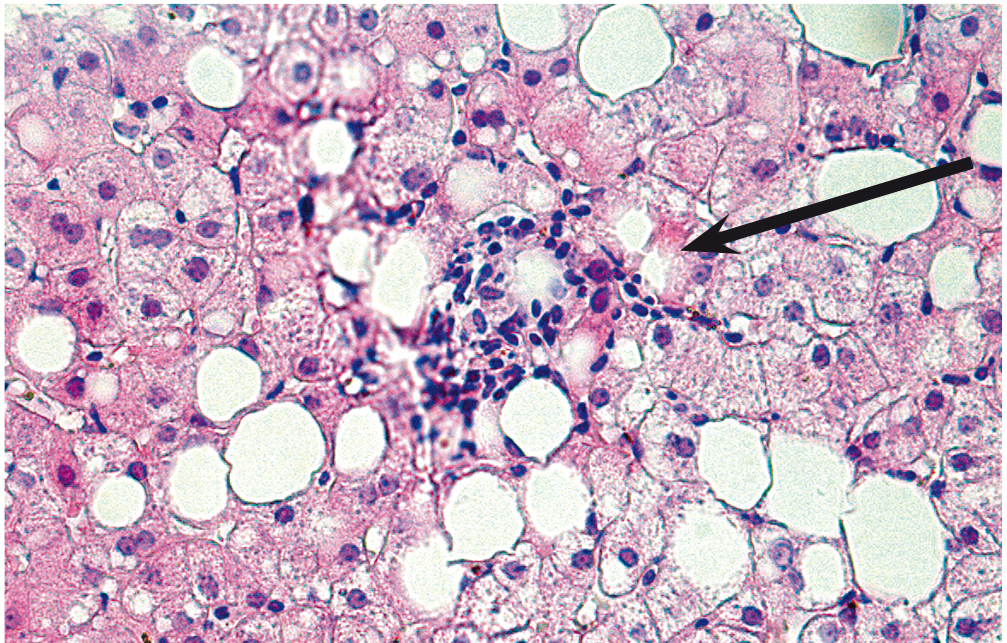
Воспалительный инфильтрат, состоящий из полиморфонуклеарных и мононуклеарных клеток, расположен в синусоидах, в непосредственной близости от некротических гепатоцитов. Помимо воспаления и некроза, при АСГ можно наблюдать жировую инфильтрацию и тельца Мэллори (внутриклеточные перинуклеарные скопления промежуточных филаментов). Однако ни жировая инфильтрация, ни тельца Мэллори не являются специфичными для АСГ.
Таким образом, отличительная черта АСГ состоит в присоединении воспалительного процесса. Активные формы кислорода и окислительный стресс, активирующие кетогенез при стеатозе, впоследствии приводят к синтезу провоспалительных цитокинов, наиболее важным из которых является ФНО-α. Синтез медиаторов воспаления активируется также эндотоксинами, попадающими в кровоток вследствие нарушения проницаемости кишечной стенки. Повреждение печеночной ткани усиливается за счет этанолопосредованной центролобулярной гипоксии. Компенсаторный механизм аутофагии, активируемый в ответ на воспаление, играет защитную роль при АБП.
АЛКОГОЛЬНЫЙ ЦИРРОЗ ПЕЧЕНИ
В настоящее время хорошо известно, что фиброз — универсальная реакция на любой тип хронического поражения печени, характеризующаяся избыточным содержанием коллагена и других внеклеточных белков матрикса. Активированные звездчатые клетки — основной источник матриксных белков наряду с портальными фибробластами и миофибробластами. Звездчатые клетки активируются цитокинами, хемокинами, нейрогуморальными сигналами и факторами ангиогенеза, индуцированными этанолом.
В формировании фиброза при АБП можно выделить несколько основных факторов: активацию TLR4-рецепторов бактериальными ЛПС, активацию звездчатых клеток ацетальдегидом и «профибротические» эффекты этанола.
Бактериальные эндотоксины способствуют ангио- и фиброгенезу путем воздействия на TLR4-рецепторы клеток Купфера, на звездчатые клетки Ито и эндотелиальные клетки синусоидов[12, 19, 20].
Ацетальдегид, являясь промежуточным продуктом метаболизма этанола, способен не только активировать звездчатые клетки (повышая экспрессию коллагена 1-го типа), но и поддерживать их в активированном состоянии[16].
В норме NK-клетки напрямую либо посредством продуцируемого ими ИФН приводят к гибели звездчатых клеток, что, в конечном счете, препятствует развитию фиброза. «Профибротический» эффект этанола заключается в подавлении эффектов NK-клеток[13].
Таким образом, развитие и прогрессирование фиброза при АБП являются результатом активации звездчатых клеток (доноров внеклеточных матриксных белков) под влиянием алкогольиндуцированной эндотоксемии, промежуточных продуктов метаболизма этанола и его свойства подавлять «профибротические» эффекты NK-клеток.
ГЕПАТОЦЕЛЛЮЛЯРНАЯ КАРЦИНОМА
Циррозы любой этиологии, в том числе алкогольной, являются фактором риска развития ГЦК. В число известных механизмов, способствующих развитию ГЦК при циррозе печени, входят: укорочение теломер (приводит к нестабильности хромосом), изменения микро- и макросреды, при которых становятся возможными выживание и пролиферация опухолевых клеток, подавление пролиферации гепатоцитов, потеря контроля клеточного цикла и активация онкогенных сигнальных путей.
Есть некоторые уникальные факторы, присущие только алкогольным циррозам. К ним относятся образование ацетальдегида, который является канцерогеном с выраженными мутагенными свойствами, этанолстимулированная индукция CYP2E1, который метаболизирует канцерогенные соединения, содержащиеся в алкогольных напитках, а также иммунодепрессивное действие алкоголя. При наличии сопутствующей HCV-инфекции уровень бактериальных эндотоксинов повышается, что может способствовать канцерогенезу путем повышения экспрессии раковых стволовых клеток[14].
ЗАКЛЮЧЕНИЕ
Заболеваемость и смертность от алкогольной болезни печени (АБП) остаются в настоящее время одной из серьезных проблем здравоохранения. Патогенез алкогольного поражения печени продолжает изучаться, требуют уточнения разрешающие факторы прогрессирования патологического процесса.
К сегодняшнему дню известно, что патогенез АБП — динамичный процесс, в основе которого лежит иммуновоспалительная реакция на промежуточные продукты метаболизма алкоголя. Синтез свободных радикалов и окислительный стресс, нарушения метаболизма метионина, «утечка» кишечных эндотоксинов, активация системы комплемента и, как результат, активация клеток Купфера, этанолопосредованная центролобулярная гипоксия, этанолиндуцированная аутофагия, индукция цитохрома Р450, нарушение регенерации и этанолопосредованная гепатотоксичность, приводящая к апоптозу гепатоцитов, — все это основные составляющие патогенеза АБП. Согласно результатам последних исследований, алкоголь способен индуцировать эпигенетические изменения, которые играют свою, пока до конца не изученную, роль в патогенезе алкогольных поражений.
Несмотря на серьезный прогресс в теоретическом изучении АБП, следует отметить, что современные представления о ее патогенезе еще далеки от полного понимания, а значит будут продолжены работы не только по поиску новых «участников» патологического процесса и уточнению их роли, но и, что не менее важно, по изучению эффективных и адресных фармакоагентов для воздействия на различные звенья и факторы патогенеза АБП.








