Алкоголь относят к лидирующим факторам риска плохого состояния здоровья и преждевременной смерти населения трудоспособного возраста (25–60 лет) от таких неинфекционных заболеваний, как злокачественные опухоли и болезни сердечно-сосудистой системы[9, 10]. Прием в течение недели более 21 порции алкоголя (1 порция = 10 г этанола) у мужчин и более 14 порций — у женщин считается злоупотреблением алкоголем[23]. Являясь токсичным веществом, он оказывает прямое или косвенное отрицательное воздействие на многие органы и системы жизнеобеспечения человека и вызывает около 60 заболеваний. Проблемы, связанные с алкоголем, — это колоссальное социальное, медицинское и экономическое бремя для любой страны мира.
Высокие показатели заболеваемости и смертности от цирроза печени (ЦП), зарегистрированные в США и экономически развитых европейских странах, имеют прямую зависимость от уровня потребления алкоголя. Так, в США алкогольный ЦП занимает восьмое место среди всех причин преждевременной смерти и второе — в спектре причин летальных исходов в связи с заболеваниями органов пищеварения[21]. В европейских странах с высоким экономическим уровнем употребление алкоголя в больших дозах также приводит к развитию ЦП алкогольной этиологии, которому принадлежит девятое место в структуре факторов летальности[25].
В России в настоящее время (Росстат, 2013) насчитывается около 5 млн больных хроническим алкоголизмом, от употребления алкоголя сразу после его приема умирают 75 200 человек в год, а ежегодная летальность от причин, связанных с его употреблением, составляет около 500 тыс. случаев.
Хроническая алкогольная интоксикация (ХАИ) является прямой или косвенной причиной смерти 15% женщин и трети мужчин. Злоупотребление алкоголем сопровождается также повышенным риском несчастных случаев, травм, отравлений[4].
Несмотря на психическую и физическую зависимость от алкогольсодержащих напитков, поражение печени развивается в 12–20% случаев[10]. Течение соматической патологии, обусловленной ХАИ, усугубляется при наличии гепатотропной инфекции, вызванной HBV и HCV. Тяжелые поражения печени имеют преимущественно алкогольную этиологию. Значительно реже, по данным А. Н. Боброва и соавт. (2011), ЦП развивается в исходе хронической HBV-инфекции[4]. До 80% летальных исходов связаны с избыточным употреблением алкоголя и его токсичных суррогатов, приводящих к тяжелой соматической патологии (печеночная кома, острая сердечная недостаточность, желудочно-кишечные кровотечения, инфекции и др.)[10].
По данным ВОЗ, в 2011 г. Россия была четвертой из 188 стран по потреблению алкоголя на душу населения (15,76 литра), уступив по этому показателю только Молдавии, Чехии и Венгрии. В Великобритании, Германии и Франции годовое потребление этанола на человека старше 15 лет составило 13,5 литра[27]. Каждый литр алкоголя, выпитого сверх «нормы» (согласно ВОЗ, допустимый объем абсолютного алкоголя, т. е. чистого этанола, равен 12 литрам в год против регламентированных ранее 8 литров), сокращает жизнь мужчин на 11 месяцев, женщин — на 4 месяца[13].
Злоупотребление алкоголем является одной из наиболее частых причин поражения печени и приводит к развитию алкогольной болезни печени (АБП). В клинической практике выделяют несколько нозологических форм АБП по МКБ-10: алкогольную жировую дистрофию печени (К70.0), алкогольный гепатит (острый или хронический) — АГ (К70.1), фиброз (К70.2) и алкогольный цирроз печени (К70.3). В отечественной литературе традиционно принято выделять острую и хроническую форму АГ. Однако в последних рекомендациях Европейской ассоциации по изучению печени (European Association for the Study of the Liver, 2012) отмечена нецелесообразность применения термина «острый», поскольку АГ представляет собой обострение АБП, имеющей хроническое течение[24]. В настоящее время для определения лечебной тактики важным является выделение лишь двух форм АГ — тяжелой и нетяжелой.
ЛАБОРАТОРНАЯ ДИАГНОСТИКА АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
Для выявления ХАИ при массовом обследовании используются хорошо известные в мире опросники GAGE и AUDIT. С целью уточнения этиологии стеатогепатита клиникой Мейо (Mayo Clinic, США) предложен индекс ANI — «алкоголь-не-алкоголь»[35]. В формулу для его расчета входят ИМТ, средний объем эритроцитов, соотношение активностей аспарагиновой и аланиновой аминотрансфераз (АCT/АЛТ), пол. Калькулятор расчета ANI представлен на сайте клиники Мейо[35]. При положительном значении ANI с высокой вероятностью выставляется диагноз АБП.
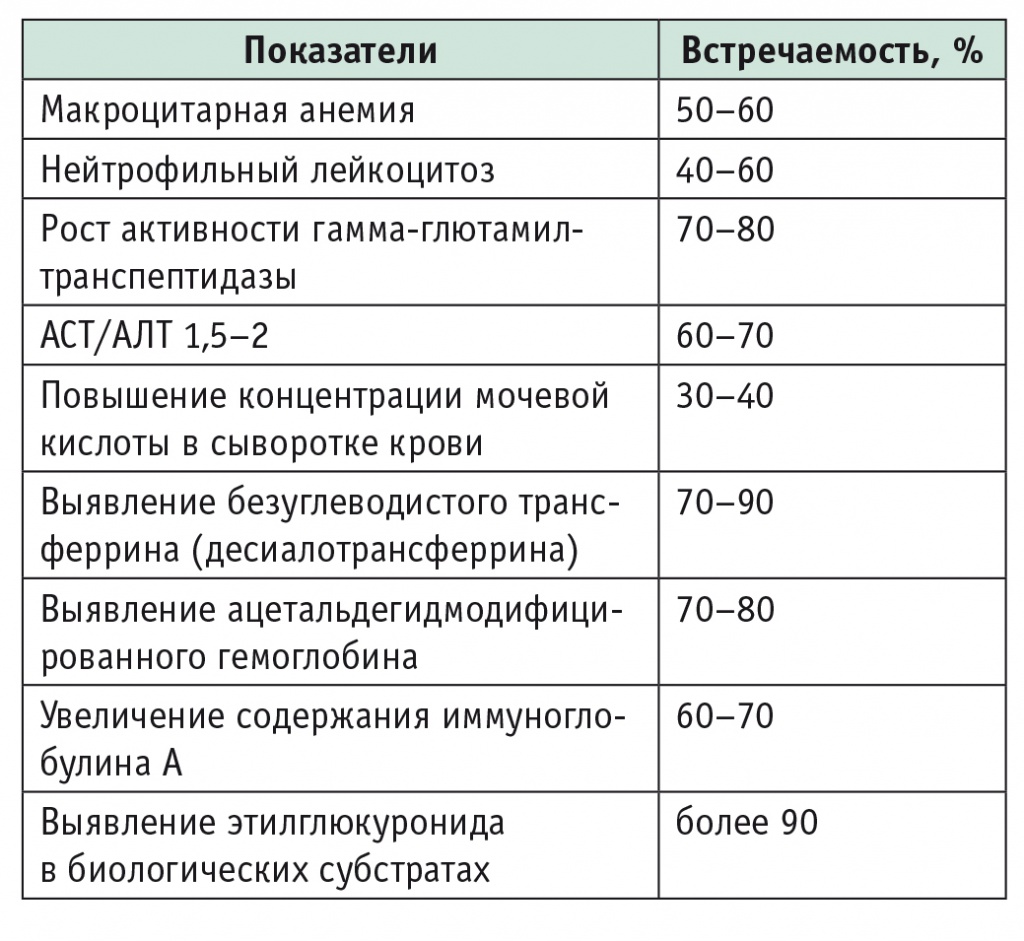
Показатели, наиболее часто применяемые в клинической практике и научных лабораториях для выявления ХАИ, представлены в таблице.
Таблица
Лабораторные маркеры хронического злоупотребления алкоголем
ОСНОВНЫЕ НАПРАВЛЕНИЯ В ЛЕЧЕНИИ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
Целью терапии АБП является предотвращение формирования фиброза и ЦП: ингибирование воспаления и фиброза в ткани печени, снижение активности процессов перекисного окисления липидов, выведение токсических метаболитов, уменьшение эндотоксемии, улучшение функционального состояния печени и регенерации гепатоцитов, подавление аутоиммунных и иммунопатологических реакций[6, 9, 10, 24].
Кроме того, решение этих задач направлено на обеспечение выживаемости в случаях тяжелой формы АГ и на повышение качества и продолжительности жизни при развитии стеатогепатита и ЦП алкогольной этиологии. Существенное значение приобретает также лечение ассоциированных с АБП состояний: хронического холецистита, панкреатита, язвенной болезни желудка и двенадцатиперстной кишки и др.
Основу лечения при АБП составляет полное прекращение приема алкоголя, которое эффективно на любой стадии заболевания. Именно этот фактор прежде всего определяет длительный позитивный прогноз у пациентов, переживших эпизод тяжелой формы АГ[12, 17, 24].
В многолетних исследованиях профессора А. И. Хазанова убедительно продемонстрирована взаимосвязь приема алкоголя, ЦП и исходов АБП. Было установлено трехкратное снижение летальности, связанной с ЦП, в период ограничения свободной продажи алкоголя в 1985–1989 гг.[19]. Эти данные позволили сделать вывод о том, что безопасных доз алкоголя не существует, а устранение причин и условий ХАИ — основа первичной профилактики ЦП, и особенно ЦП алкогольной этиологии[3, 16].
При АБП целесообразно назначение диеты, богатой белками (не менее 1,0–1,5 г/кг массы тела), с высокой энергетической ценностью (не менее 2000 ккал/сут, 35–40 ккал/кг/сут), с достаточным содержанием витаминов (особенно группы В, фолиевой и липоевой кислот), восполняющей дефицит жирорастворимых витаминов (А, Е) и микроэлементов — магния, селена, цинка. Для восстановления нутритивного статуса предпочтителен энтеральный путь введения лекарственных средств и питательных смесей, поскольку он более экономичен, позволяет стабилизировать целостность слизистой оболочки ЖКТ, снизить риски бактериальной транслокации и инфекционных осложнений.
У больных с тяжелыми формами АГ при использовании кортикостероидов и пентоксифиллина достигается 50%-я выживаемость[24]. Однако на сегодня существует острая необходимость в разработке новых, более эффективных, медикаментозных средств лечения АБП, направленных на восстановление барьерной функции слизистой оболочки кишечника, активацию неспецифического иммунитета в печени, ингибиторов апоптоза, некроза и дистрофии гепатоцитов[28, 30, 33].
В связи с ограниченностью специфических средств и их недостаточной эффективностью особое значение приобретает вторичная профилактика АБП, направленная на прекращение прогрессирования хронического поражения печени, развития цирроза и его осложнений[3, 16]. В российской клинической практике ведения АБП нашли применение различные метаболические препараты, относенные к группе гепатопротекторов, с которыми связывают возможность уменьшать образование высокоактивных повреждающих соединений и воспаление, подавлять фиброгенез, стимулировать регенерацию гепатоцитов и др. Их список уже превышает 40 наименований. Однако бо́льшая часть этих средств не имеет подтверждения эффективности и безопасности результатами рандомизированных мультицентровых двойных слепых плацебоконтролируемых исследований. В то же время многие из них представляют собой биологически активные добавки или средства растительного происхождения. Для разрешения их применения не требуется тщательно спланированных клинических исследований, в связи с чем их эффективность и безопасность изучались в основном в экспериментальных условиях.
Среди гепатопротекторов с доказанной эффективностью при АБП одно из первых мест занимает адеметионин. В настоящее время получены сведения о повышении выживаемости больных компенсированным и субкомпенсированным ЦП при его применении[20].
ФАРМАКОЛОГИЧЕСКИЕ ЭФФЕКТЫ АДЕМЕТИОНИНА
S-аденозил-L-метионин (адеметионин) образуется в печени из метионина и аденозина при помощи фермента метионинаденозилтрансферазы. Адеметионин обнаруживается во всех живых клетках и играет центральную роль в клеточных реакциях. Химическая структура адеметионина впервые была описана в 1952 г. В странах Европы в качестве коммерческого препарата он доступен с 1975 г. и сначала использовался для терапии артритов и депрессии.
Адеметионин имеет ключевое значение в обмене по трем метаболическим направлениям[11, 34]. Это трансметилирование — биосинтез фосфолипидов, определяющих состояние клеточной мембраны; транссульфурирование — синтез глутатиона, таурина, сульфатов, играющих основную роль в выполнении антитоксической, антиоксидантной функций, и аминопропилирование, необходимое для образования путресцина, спермина, которые важны для формирования рибосом, осуществления регенерации гепатоцитов.
Адеметионин является предшественником глутатиона, участвующего во всех механизмах клеточной защиты, и основным донатором метильной группы. Низкие уровни глутатиона, в свою очередь, ведут к снижению защиты от окислительного стресса, увеличивающего синтез провоспалительных цитокинов и, таким образом, усугубляющего поражение печени. Наряду с этим при хронических заболеваниях печени также угнетается синтез адеметионина, что может усилить повреждение гепатоцитов.
В экспериментальных работах на животных адеметионин продемонстрировал способность модулировать баланс между про- и противовоспалительными цитокинами, ингибировать апоптоз в нормальных гепатоцитах и индуцировать его в линиях раковых клеток. На этом основании было предложено применять адеметионин в качестве терапевтического средства при различной патологии печени с целью снижения накопления и ослабления отрицательного воздействия токсических метаболитов на печень, стабилизации вязкости клеточных мембран, повышения активности связанных с ними ферментов, предотвращения внутрипеченочного канцерогенеза. Эффективность адеметионина показана не только in vitro или в экспериментальных моделях на лабораторных животных[26, 29], но и в ходе клинических исследований у пациентов с поражениями печени[20, 32].
Адеметионин занимает особое место в комплексном лечении пациентов с АБП. Это обусловлено тем, что механизм токсического действия ацетальдегида как продукта метаболизма этанола тесно связан с метаболизмом адеметионина. Препарат восполняет дефицит эндогенного адеметионина, стимулирует его выработку в организме, в первую очередь в печени (месте образования) и мозге (основном месте потребления) — главных органах-мишенях, которые поражаются при АБП.
Так, J. M. Mato и соавт. в мультицентровом рандомизированном двойном слепом плацебоконтролируемом исследовании у пациентов с алкогольным ЦП, принимавших в течение 2 лет адеметионин (1200 мг/сут), получили статистически значимое снижение смертности от причин, связанных с поражением печени, в сравнении с таковой у больных, получавших плацебо (29% vs 12%; p = 0,025). При этом число пациентов, прекративших и продолживших употреблять алкоголь, в обеих группах было сопоставимым[31].
Нарушения процесса адеметионинзависимого метилирования могут вызвать метаболические и структурные изменения, способные иметь серьезные функциональные последствия для ЦНС. Кроме того, в результате аминопропилирования, в котором участвует адеметионин, синтезируются полиамины, представляющие собой важные метаболиты для регенерации нервов. Адеметионин обладает антинейротоксическими свойствами и, проникая через гематоэнцефалический барьер, способствует улучшению функции рецепторного аппарата нейронов, а также стабилизации миелиновой оболочки и росту активности фосфалинергических и серотонинергических систем. Сочетание гепатопротективных и антидепрессантных свойств позволяет эффективно применять его при депрессивных расстройствах[22].
Глутатион, синтезируемый из цистеина, источником которого является адеметионин, в качестве одной из ферментных систем печени участвует в метаболизме лекарственных веществ, обмене тиосульфида, хранении и переносе цистеина, конъюгации и нейтрализации реактивных электрофильных метаболитов при биотрансформации ксенобиотиков. Напротив, нарушение транссульфурирования приводит к дефициту глутатиона, что снижает устойчивость гепатоцитов к повреждающему действию свободных радикалов, постоянно образующихся вследствие метаболизма экзогенных и эндогенных веществ. В связи с эти целесообразным является использование адеметионина при лекарственно индуцированных поражениях печени, связанных с токсическим действием метаболитов, а также при дефиците глутатиона, возникающем в случаях токсического поражения печени[20, 32].
Для получения быстрого «гепатотропного» эффекта первоначально рекомендуется парентеральное введение препарата в насыщающей дозе (не менее 800 мг/сут в течение 10–14 дней), в последующем — длительный прием per os (1600 мг/сут). Поступление в организм избыточного количества метионина с пищей не оказывает терапевтического воздействия, но обладает токсическим влиянием у пациентов с ЦП.
ПРИМЕНЕНИЕ ОТЕЧЕСТВЕННОГО ПРЕПАРАТА АДЕМЕТИОНИНА (ГЕПТОР) ПРИ АЛКОГОЛЬНОЙ БОЛЕЗНИ ПЕЧЕНИ
С 2005 г. в клинической практике у больных с различными формами АБП применяется отечественный препарат адеметионина Гептор (ЗАО «Верофарм»).
В ЦНИИ гастроэнтерологии (г. Москва) было проведено первое открытое клиническое исследование по изучению эффективности и безопасности препарата Гептор (второй этап терапии: 1600 мг/сут per os 18 дней) у пациентов с АБП. На первом этапе терапии пациенты получали оригинальное лекарственное средство — Гептрал внутривенно капельно (800 мг/сут 10 дней). После завершения курса терапии, составившего 4 недели, получены уменьшение клинических проявлений и снижение показателей биохимической активности, значения которых практически приблизились к нормальным. Гептор и Гептрал имели сходный профиль безопасности. Нежелательные явления (НЯ) — единичные случаи головной боли и невыраженной тошноты после приема Гептора — не требовали снижения дозы или отмены препарата. Частота НЯ, зарегистрированных при использовании Гептора, не отличалась от таковой при терапии Гептралом. Хорошая переносимость позволяла рекомендовать его повторные курсы[6, 11].
В 2012 г. на базе трех клинических центров проводилось открытое сравнительное рандомизированное исследование (IV фаза) эффективности и безопасности препарата Гептор (лиофилизат для приготовления раствора для внутривенного и внутримышечного введения; ООО «ЛЭНС-Фарм», Россия) и препарата Гептрал (лиофилизат для приготовления раствора для внутривенного и внутримышечного введения; Abbott/Hospira S.p.A., Италия) у больных АБП. В исследовании приняли участие 84 пациента с АБП на стадии алкогольного стеатогепатита и ЦП (класс А–В по Чайлду — Пью; дискриминантная функция Маддрея менее 32), которые были рандомизированы в две группы. В течение 14 дней первая группа больных получала Гептор (800 мг/сут внутривенно капельно), а вторая группа — Гептрал (800 мг/сут внутривенно капельно).
В качестве критериев эффективности лечения изучали динамику выраженности клинических проявлений, а также депрессии по шкале Бека; проводили мониторинг функционального состояния печени по изменению основных биохимических показателей: активности АЛТ, АСТ, ЩФ и гамма-глютамилтранспептидазы (ГГТП), содержания билирубина и протромбинового индекса (ПИ). В процессе исследования оценивали профиль безопасности и фиксировали все НЯ.
После завершения курса терапии АБП в группе больных, получавших Гептор, и в группе больных, лечившихся Гептралом, выявлено статистически значимое снижение выраженности и частоты патологических клинических симптомов. В обеих группах достоверно улучшилось общее состояние пациентов, снизилась интенсивность желтушности кожи и склер, а также уменьшились или исчезли диспепсические проявления (чувство тяжести в правом подреберье, боли в верхней половине живота, метеоризм, анорексия, тошнота).
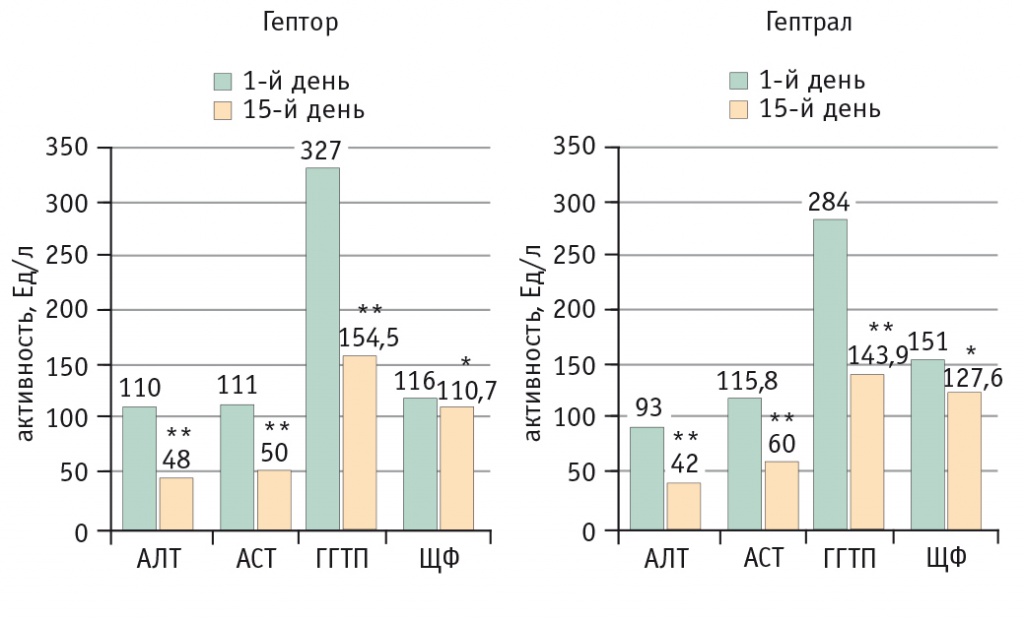
У пациентов обеих групп отмечено статистически значимое снижение уровней лабораторных показателей в динамике (АЛТ, АСТ, ЩФ, ГГТП, билирубина) и повышение изначально сниженного ПИ. Причем более чем в 40% случаев зарегистрировано уменьшение активности ферментов цитолиза (АЛТ и АСТ) (рис. 1).
Рис. 1. Динамика биохимических показателей крови.
* Р < 0,02.
** Р < 0,001.
Примечание. АЛТ — аланинаминотрансфераза, АСТ — аспартатаминотрансфераза, ГГТП — гамма-глютамилтранспептидаза, ЩФ — щелочная фосфатаза
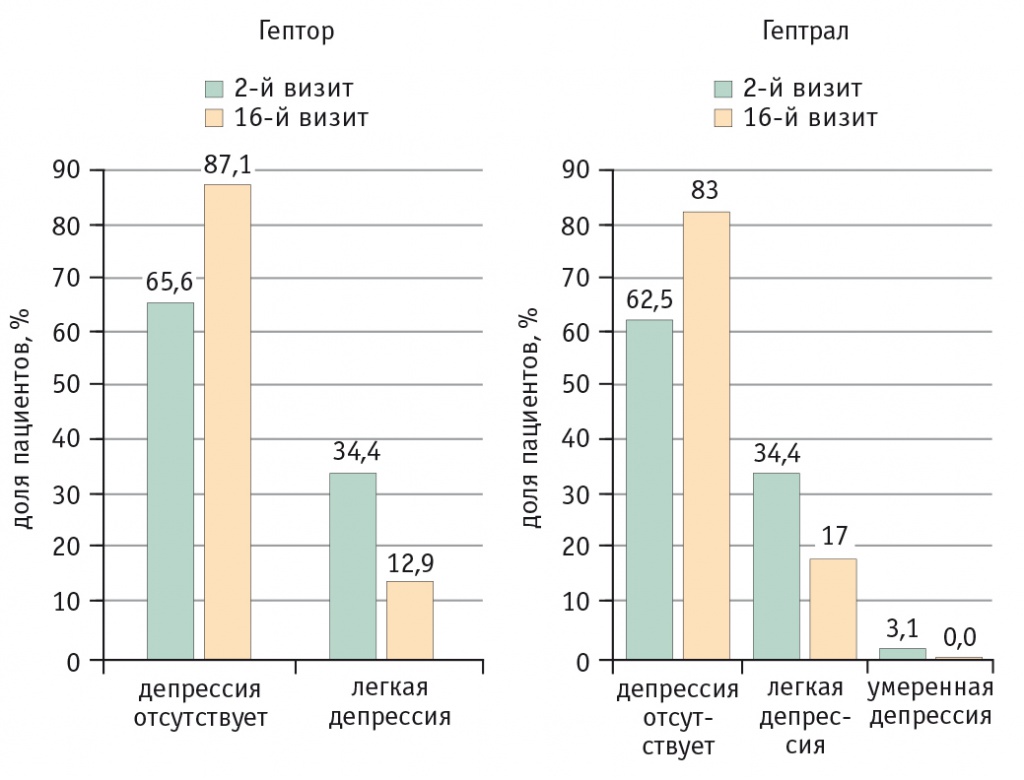
Кроме того, в результате проведенного лечения АБП у пациентов обеих групп зарегистрировано достоверное снижение выраженности депрессии. При анализе шкалы Бека статистически значимое уменьшение показателей отмечено по всей выборке по пунктам 1, 4, 5, 8, 10–13, 15–18, 21, а также по общей сумме баллов (рис. 2). В течение 14-дневного курса внутривенных инфузий Гептора и Гептрала в дозе 800 мг/сут не было зарегистрировано ни одного случая НЯ, у обоих препаратов отмечен хороший профиль безопасности.
Рис. 2. Динамика уровня депрессии по шкале Бека.
Примечание. Сравнение эффективности лечения в группах исследования проведено при помощи критерия χ2. Для второго визита p = 0,058, для 16-го визита p = 0,195
Таким образом, результаты статистического анализа показали наличие выраженных гепатопротективного и антидепрессивного механизмов у отечественного препарата Гептор, сопоставимых по эффективности с аналогичными механизмами Гептрала. Проведенное исследование продемонстрировало эквивалентность отечественного адеметионина (Гептор) оригинальному препарату адеметионина (Гептрал).
В ряде исследований проводился анализ качества жизни больных АБП. Так, Е. И. Ткаченко и соавт. (2008) оценивали качество жизни у пациентов с алкогольным стеатогепатитом, получавших лечение препаратом Гептор, с помощью анкеты SF-36[18]. Анализ выявил улучшение показателей, характеризующих физический компонент здоровья: рост уровня физического функционирования, снижение интенсивности болевого синдрома. Повысился уровень ролевого функционирования, обусловленного физическим состоянием, и, соответственно, улучшилось общее состояние здоровья. Кроме того, была получена положительная динамика по шкалам, характеризующим психологический компонент здоровья: возросли показатели жизненной активности, социального и ролевого функционирования, психического здоровья.
ЗАКЛЮЧЕНИЕ
Гептор обладает уникальными поливалентными свойствами: гепатотропностью с антитоксическим эффектом в сочетании с антидепрессивной активностью, антиоксидантным воздействием (благодаря повышению содержания глутатиона в гепатоцитах), — а также хорошим профилем безопасности, что позволяет широко применять препарат в обеих его формах (пероральной и парентеральной) в лечении пациентов с алкогольной болезнью печени[5, 7, 8, 14, 15, 18], лекарственными[1] и токсическими поражениями печени[2].








