Первичный билиарный холангит (ПБХ) — хроническое, медленно прогрессирующее холестатическое заболевание печени аутоиммунной природы, характеризующееся негнойным деструктивным холангитом с поражением в первую очередь внутридольковых и септальных желчных протоков, приводящее при естественном течении к билиарному циррозу печени.
ИСТОРИЯ ВОПРОСА
Одним из самых ранних упоминаний о билиарном циррозе принято считать наблюдение итальянского врача и патологоанатома Джованни Морганьи в 1761 г., описавшего плотную зеленую печень при длительно протекавшей многолетней желтухе. В 1851 г. английские врачи T. Аддисон and В. Галл впервые описали 5 случаев болезни, клинически проявлявшейся ксантомами и ксантелазмами, и сделали выводы о причастности печени к развитию заболевания, обозначив синдром как необструктивный билиарный цирроз, позднее он получил название синдрома Аддисона — Галла [1].
В дальнейшем предлагались различные номенклатурные названия, такие как гипертрофический цирроз печени с хронической желтухой [2], подострый холангит [3], интерстициальный хронический гепатит с гипертрофией печени, холангиолитический гепатит и цирроз, ксантоматозный билиарный цирроз [4], перихолангиолитический билиарный цирроз, хронический негнойный деструктивный холангит [5].
Спустя столетие, в 1950 г., был принят к широкому применению термин «первичный билиарный цирроз», предложенный Е.Х. Ареном и соавт. [6].
Уже в 1959 г. Шейла Шерлок выступала против этого термина, поскольку у многих пациентов не было цирроза [7].
К середине 1960-х гг. сформировались теории об участии иммунной системы в развитии заболевания. В дальнейшем серия работ Д. Дониак, Ш. Шерлок и соавт. позволила утвердить идею аутоиммунных реакций как важных звеньев патогенеза; начался поиск специфических антител [8, 9].
В 1967 г. была доказана роль антимитохондриальных антител (АМА) [10], позднее, в 1988 г., выявлены АМА М2, а в 1989 г. — субтипы Е2 [11].
Прогноз выживаемости пациентов значительно улучшился после того, как в 80-х годах прошлого столетия начали применять урсодезоксихолевую кислоту (УДХК). Термин «первичный билиарный цирроз» постоянно подвергался критике в связи с неточностью и неправильным отражением сути, предпринимались попытки его переосмысления [5].
Предложение о смене названия первичного билиарного цирроза на первичный билиарный холангит было одобрено Советом управляющих Европейской ассоциацией по изучению болезней печени в ноябре 2014 г., Советом управляющих Американской ассоциацией по изучению печени в апреле 2015 г. и Советом управляющих Американской гастроэнтерологической ассоциации в июле 2015 г.
РАСПРОСТРАНЕННОСТЬ И ЗАБОЛЕВАЕМОСТЬ
В последние годы отмечается тенденция к увеличению заболеваемости и распространенности ПБХ [12-14]. Вероятно, этот рост вызван повышением точности диагностики, появлением новых методов лабораторного скрининга, формированием больших баз данных благодаря развитости системы здравоохранения некоторых стран и доступности медицинского обслуживания в отдельных регионах.
По данным многочисленных исследований, ПБХ встречается преимущественно среди женщин. Результаты исследований показывают, что по всему миру примерно 1 из 1000 женщин старше 40 лет имеет ПБХ [12]. Соотношение женщин и мужчин варьируется, в среднем оно составляет 10 : 1. Распространенность и заболеваемость ПБХ имеют неравномерное распределение по всему миру. Заболеваемость ПБХ колеблется от 0,33 до 5,8 на 100 000 жителей в год, а коэффициент распространенности варьирует от 1,91 до 40,2 на 100 000 жителей [13]. Среди населения стран Европы средняя заболеваемость ПБХ составляет 1-2 на 100 000 человек в год, в странах Азии более низкие показатели заболеваемости и распространенности, чем в западных странах [15-17].
Данные по распространенности и заболеваемости ПБХ в Российской Федерации в настоящий момент отсутствуют.
Следует отметить, что эпидемиологические исследования могут представлять собой только верхушку айсберга, поскольку имеются сведения, что АМА-позитивные люди без заболевания печени встречаются в два раза чаще, чем АМА-позитивные с заболеванием печени [16].
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
ПБХ считается многофакторным заболеванием. В последнее время ведущую роль в возникновении ПБХ отводят взаимодействию генетических и эпигенетических факторов риска с экологическими триггерами, приводящему к иммуноопосредованному повреждению желчных протоков с последующим развитием холестаза, дуктопении. Все это в итоге вызывает фиброз и цирроз печени.
В пользу аутоиммунного генеза ПБХ свидетельствует ряд фактов. Основной комплекс гистосовместимости человека HLA вовлечен в патогенетические механизмы ПБХ, как и при многих других аутоиммунных заболеваниях. Для классических генов HLA наиболее сильная связь выявлена с DRB*08 [17]. Широкомасштабные исследования генома (GWAS) ПБХ находят самую сильную связь с однонуклеотидными полиморфизмами (SNP) в области HLA [18].
ПБХ часто сочетается с другими аутоиммунными заболеваниями, включая синдром Шегрена и хронический тиреоидит [19, 20]; специфические AMA обнаруживаются в сыворотке более 90% пациентов с ПБХ и почти не выявляются у лиц без ПБХ [21, 22]. Кроме того, эпидемиологические данные указывают на увеличение распространенности ПБХ среди родственников первой линии, а также братьев и сестер. Индекс конкордантности у монозиготных близнецов составляет 63% — он один из самых высоких среди таковых у прочих аутоиммунных заболеваний [23]. Наконец, при гистологическом исследовании плотные инфильтраты, состоящие из Т- и В-лимфоцитов, обнаруживаются вблизи пораженных внутрипеченочных желчных протоков [24].
Однако последние исследования выявили специфические генетически опосредованные предпосылки развития ПБХ. Как выяснилось, взаимодействие между генетикой и факторами окружающей среды является более сложным, чем казалось раньше. Например, были найдены специфические экологические факторы, которые могут приводить к потере толерантности к пируватдегидрогеназному комплексу (ПДК-Е2). Они представляют собой ксенобиотики, которые могут либо имитировать, либо модифицировать липоевую кислоту. К ним относятся 2-октиновая кислота и 6,8-бис-ацетилтиооктановая кислота (метаболит ацетаминофена), часто используемые при производстве косметики. AMA-положительная сыворотка от пациентов с ПБХ выражено перекрестно реагирует с этими ксенобиотиками [25, 26].
Патогенетические механизмы ПБХ в настоящий момент остаются не полностью изученными. ПБХ является хроническим холестатическим аутоиммунным заболеванием, поражающим эпителиальные клетки внутрипеченочных желчных протоков. Его «визитная карточка» — выявляемые в крови специфичные АМА, а также характерная гистологическая картина поражения желчных протоков [27].
Морфологически ПБХ характеризуется как хронический деструктивный холангит с образованием гранулем в печени, а дегенерация и некроз холангиоцитов вызывают деструктивные изменения и приводят к исчезновению внутрипеченочных желчных протоков малого или среднего размера [28].
AMA представляют собой специфические для данной патологии аутоантитела, обнаруживающиеся среди всех трех классов иммуноглобулинов, синтезирующиеся плазмоцитами, которые могут проходить через эпителий желчных протоков и нарушать митохондриальную функцию холангиоцитов [29]. Это происходит путем повреждения молекул липоевой кислоты, присутствующей на 2-оксокислых дегидрогеназных комплексах, расположенных на внутренней мембране митохондрий [29]. Кроме потери гуморальной толерантности наблюдается повышение уровня аутореактивного кластера дифференцировки: CD4+, CD8+, ПДК-Е2-специфических Т-клеток в печени [29]. Под действием триггерных факторов происходит активация иммунных клеток (включая макрофаги), воздействующих на Т-лимфоциты, которые продуцируют ФНО-α, индуцирующий старение и апоптоз холангиоцитов, а также ИФН-γ, стимулирующий дальнейшее образование цитотоксических Т-лимфоцитов, и ИЛ-4, способствующий активации В-клеток и дальнейшей продукции антител, специфичных для ПДК-Е2.
Одним из возможных патофизиологических механизмов патогенеза ПБХ является гипотеза желчного бикарбонатного (HCO3) зонтика, базирующаяся на данных экспериментальных, клинических и генетических исследований, в основе которой лежит положение о том, что холангиоциты (и гепатоциты) создают защитный апикальный щелочной барьер, стабилизирующий гликокаликс, путем секреции бикарбоната (HCO3) в просвет желчного протока. Этот щелочной барьер сохраняет соли желчных кислот (ЖК) в их полярном, непроницаемом для мембраны состоянии [30, 31].
Желчная секреция при ПБХ нарушается в связи с возникающими дефектами в работе переносчиков и каналов, расположенных на апикальной и базолатеральной мембране холангиоцитов, задействованных в образовании HCO3. Неисправный апикальный бикарбонатный (HCO3)-секреторный аппарат ослабляет щелочной барьер, что приводит к частичному протонированию глицин-конъюгированных (pKa 4) вместо таурин-конъюгированных (pKa 1-2) желчных солей, в результате чего образующиеся глицин-конъюгированные ЖК становятся аполярными и приобретают способность пересекать мембрану холангиоцитов независимо от активности транспортеров солей желчи, тем самым индуцируя апоптоз в холангиоцитах [32].
Разрушающиеся клетки желчных протоков секретируют медиаторы, воздействующие на синусоидальные клетки, среди которых выделяют клетки Ито (звездчатые) — основные клетки, синтезирующие экстрацеллюлярный матрикс в поврежденной печени [33]. В здоровой ткани печени звездчатые клетки находятся в пространстве Диссе и являются основным депо витамина А, участвуют в регуляции фиброгенеза. В результате прогрессирующего хронического повреждения клетки Ито активируются, дифференцируются в миофибробластоподобные клетки, приобретая сократительные, провоспалительные и профибротические свойства [34]. В последующем это приводит к нарушению взаимодействия фибротических и антифибротических механизмов, избыточному синтезу экстрацеллюлярного матрикса и формированию фиброза печени.
ДИАГНОСТИКА ПЕРВИЧНОГО БИЛИАРНОГО ХОЛАНГИТА
Диагноз основан на сочетании клинических симптомов, биохимической картины холестаза, сохраняющейся более шести месяцев, и наличии в сыворотке АМА. Ряд антинуклеарных антител (ANA) связаны с ПБХ, из них специфичны для заболевания gp210, sp100, которые необходимо определять в случае отрицательных АМА. Всем пациентам с холестазом и отрицательными АМА следует проводить магнитно-резонансную холангиопанкреатографию. Биопсия печени должна выполняться, когда описанные выше диагностические мероприятия не выявили причину хронического внутрипеченочного холестаза. Биопсия адекватного качества должна содержать не менее 11 портальных полей [14, 34, 35]. Диагноз ПБХ может быть установлен, когда имеются два из следующих трех критериев:
-
биохимические данные холестаза, а именно повышение уровня щелочной фосфатазы (ЩФ);
-
наличие AMA- или ANA-специфических антител (sp100, gp210);
-
гистологические признаки невоспалительного деструктивного холангита и разрушения междольковых желчных протоков (уровень доказательства III, сила рекомендаций 1) [14, 34, 35].
ПБХ следует подозревать у всех пациентов с персистирующим синдромом холестаза и такими симптомами, как кожный зуд и усталость (табл. 1).
Таблица 1
Рекомендации Европейской ассоциации по изучению болезней печени (2017) по диагностике первичного билиарного холангита [14]
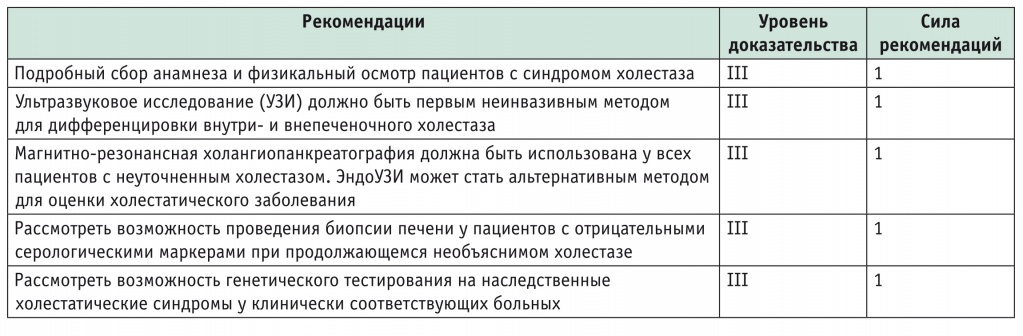
И еще немаловажное положение: наличие изолированного повышения титра АМА недостаточно для диагностики ПБХ. Европейская ассоциация по изучению болезней печени рекомендует пациентам с нормальными биохимическими показателями цитолиза и холестаза и позитивными AMA ежегодное наблюдение с биохимической оценкой (уровень доказательства III, сила рекомендаций 1).
Более 60% больных при постановке диагноза не имеют клинических проявлений заболевания. Типичные проявления ПБХ:
-
усталость;
-
кожный зуд;
-
остеопороз;
-
ксантелазма, ксантомы;
-
дефицит витаминов А, D, Е, К;
-
инфекции мочевых путей;
-
портальная гипертензия;
-
гепатоцеллюлярная карцинома.
ПБХ часто ассоциируется с другими аутоиммунными синдромами: тиреоидитом Хашимото и болезнью Грейвса, ксерофтальмией, синдромом Шегрена, CREST-синдромом, синдромом Рейно, ревматоидным артритом, целиакией, почечным канальцевым ацидозом. Около 20-40% пациентов имеют одно или несколько из этих сопутствующих заболеваний. Наиболее частыми являются заболевания щитовидной железы и синдром Шегрена.
ПБХ даже при лечении может оставаться прогрессирующим заболеванием, поэтому у всех больных необходимо оценивать риск прогрессирования болезни до начала терапии, а также через год лечения УДХК с определением потенциальной потребности в применении дополнительных методов (табл. 2).
Таблица 2
Рекомендации по стратификации рисков прогрессирования первичного билиарного холангита [14]
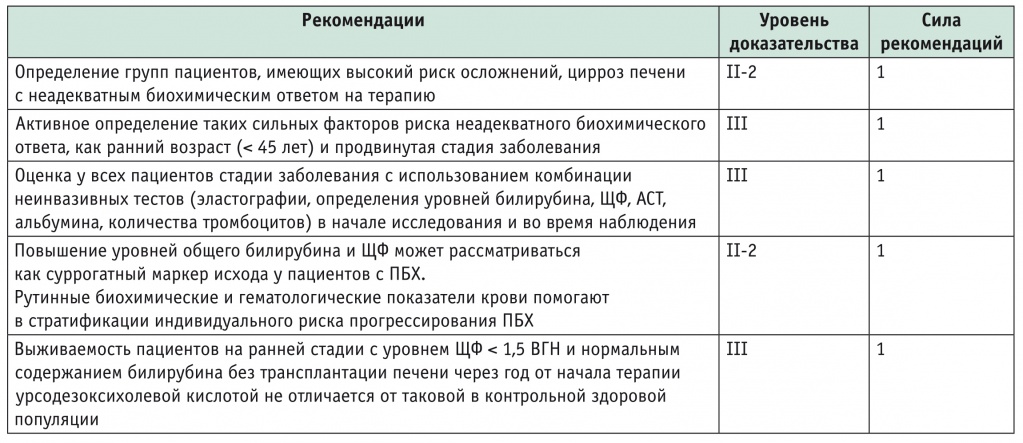
Примечание. Здесь и в таблице 3: АСТ — аспартатаминотрансфераза, ВГН — верхняя граница нормы, ПБХ — первичный билиарный холангит, ЩФ — щелочная фосфатаза.
ЛЕЧЕНИЕ ПЕРВИЧНОГО БИЛИАРНОГО ХОЛАНГИТА
В 70-х годах прошлого века была впервые предложена терапия ПБХ с применением естественных ЖК, в частности УДХК.
Предпосылкой терапевтического подхода к лечению холестаза с использованием УДХ послужило предположение о патогенетическом токсическом влиянии ЖК при холестазе, которое может быть минимизировано заменой их на менее токсичные, что окажет гепатопротективный эффект, замедляя прогрессирование заболевания.
Урсодезоксихолевая кислота
До последнего времени единственным лекарственным препаратом, используемым в лечении ПБХ, являлась УДХК. УДХК в дозе 13-15 мг/кг в сутки — препарат первой линии во всех случаях ПБХ и обычно применяется всю жизнь (уровень доказательства I, сила рекомендаций 1) [14].
УДХК — третичная ЖК, синтезируется из 7-кетолитохолевой кислоты, образующейся в результате бактериального окисления хенодезоксихолевой кислоты. В силу своей высокой гидрофильности и слабого мицеллообразования УДХК практически не токсична. Около 50-70% препарата выводится с желчью в виде литохолевой кислоты, до которой УДХК расщепляется и дегидрооксилизируется в кишечнике. УДХК воздействует на основные звенья патогенеза ПБХ по нескольким направлениям [36, 37].
Первое — защищает холангиоциты от токсического воздействия гидрофобных ЖК:
-
за счет вытеснения пула токсичных гидрофобных ЖК при помощи конкурентного захвата рецепторами в подвздошной кишке;
-
за счет стимуляции экзоцитоза в гепатоцитах путем активации Са-зависимой a-протеинкиназы, что приводит к уменьшению концентрации гидрофобных ЖК;
-
за счет усилениия билиарной секреции с целью предотвращения задержки в гепатоцитах гидрофобных ЖК и других токсических веществ.
Второе — обладает антиапоптотическим эффектом (снижение концентрации ионизированного кальция в клетках, предотвращающее выход цитохрома С из митохондрий и блокирующее активацию каспаз и апоптоз холангиоцитов) [37].
Третье — оказывает иммуномодулирующий эффект: уменьшает экспрессию молекул HLA 1-го класса на гепатоцитах и HLA 2-го класса на холангиоцитах, продукцию провоспалительных цитокинов, взаимодействие с ядерными рецепторами глюкокортикоидов [36].
УДХК имеет химическое и структурное сходство со стероидными гормонами и может взаимодействовать с ядерными рецепторами глюкокортикоидов, влияя на их активность, имитируя в какой-то мере действие глюкокортикоидных гормонов [36]. Ядерные рецепторы стероидов представляют собой активируемые лигандом транскрипционные факторы и играют важную роль в целом ряде физиологических процессов, включая реакции на гормоны и апоптоз. Доказано, что УДХК может подавлять зависимую от нуклеарного фактора κB транскрипцию. Эти данные объясняют клинические наблюдения, в которых внезапное прекращение поступления УДХК приводило к результатам, сходным с синдромом отмены стероидных гормонов с повышением уровня сывороточного билирубина и активности трансаминаз, а при повторном назначении УДХК — к исчезновению этих явлений [37].
В реальной клинической практике нередко наблюдается неполный ответ на проводимую терапию препаратами УДХК, около трети пациентов не отвечают адекватно на терапию [14].
Разработан целый ряд критериев оптимального ответа на лечение УДХК. Наиболее широко известны Барселонские и Парижские критерии, а также ряд других (табл. 3).
Таблица 3
Критерии оценки ответа на терапию урсодезоксихолевой кислотой [14]
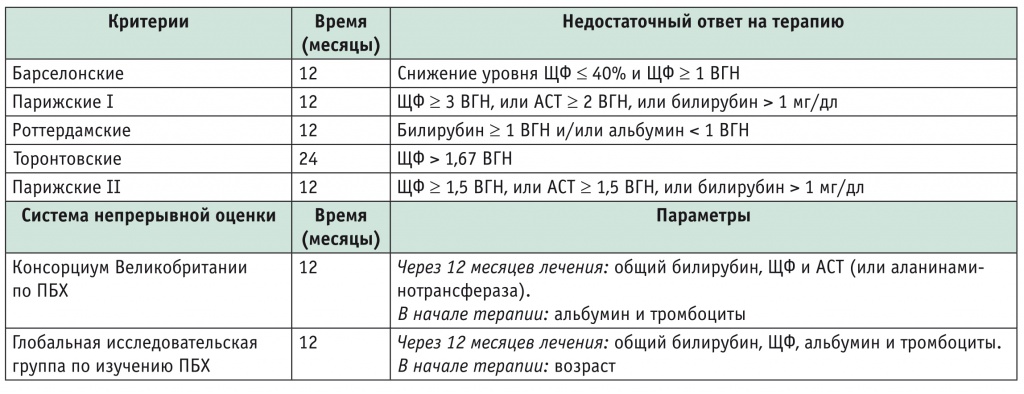
По нашим данным наблюдения за пациентами с ПБХ, проведенного в Московском клиническом научно-практическом центре им А.С. Логинова в 2017-2018 гг., из 247 больных, получавших УДХК, у 47% не был достигнут полный клинический ответ ни по Торонтовским, ни по Парижским критериям II.
Ограниченная эффективность УДХК у трети больных ПБХ требует разработки новых терапевтических подходов.
В настоящее время проводится целый ряд клинических исследований препаратов. Наиболее изучены лекарственные средства, действие которых направлено на снижение токсического воздействия ЖК, ограничение холестатического повреждения печени при ПБХ. По механизму действия выделяют препараты:
-
способствующие увеличению скорости выведения желчи (УДХК и norУДХК);
-
подавляющие скорость синтеза ЖК: агонисты фарнезодного Х-рецептора (farnesoid X-activated receptor, FXR) — 21-обетихолевая кислота (21-ОК);
-
ингибирующие обратный захват ЖК в кишечнике (Ileal bile acid transporter, IBAT).
Несмотря на то что ЖК не являются основными инициирующими факторами в патогенезе ПСХ, их воздействие может способствовать прогрессированию болезни и наоборот: снижение повреждающего влияния ЖК приводит к положительным результатам [38].
Апикальная поверхность гепатоцита, в норме резистентная к токсическому, детергентному воздействию ЖК, может терять эти свойства под влиянием иммунноопосредованных воздействий.
Потенциальным повреждающим эффектом могут обладать такие элементы желчи, как холестеролы, цитокины, измененные липиды и протеины.
С другой стороны, снижение резистентности мембран или разрушение пластинки, объединяющей эпителиальные клетки, способно повысить чувствительность к повреждающему воздействию даже нормальной, неизмененной желчи. Поэтому возможно успешно использовать такие методы терапевтического воздействия, как протекция клеток усилением оттока желчи с целью «промывания» желчных протоков, повышение образования смешанных мицелл, а также рН желчи путем изменения бикарбонатной, фосфолипидной и желчнокислотной секреции.
21-ОК — первый в своем классе агонист FXR (фарнезол — промежуточный продукт синтеза холестерина), который недавно был рассмотрен Управлением по контролю за продуктами и лекарствами США для лечения ПБХ, одобрено применение 21-ОК для терапии взрослых пациентов с ПБХ. Рекомендован пероральный прием препарата в составе комплексной терапии с УДХК (в случае отсутствия адекватного ответа у пациента на монотерапию УДХК) или в качестве средства монотерапии (при непереносимости УДХК) с начальной дозой 5 мг и титрованием до 10 мг через 6 месяцев (уровень доказательства I, сила рекомендаций 2) [14].
Патогенетический эффект 21-ОК направлен на подавление скорости синтеза ЖК за счет стимуляции FXR. Безопасность и эффективность 21-ОК продемонстрированы в клинических исследованиях. В 3 фазу двойного слепого плацебо-контролируемого исследования POISE были рандомизированы 216 пациентов с неполным ответом на прием УДХК или развитием на нее нежелательных лекарственных реакций. Показано, что 21-ОК, назначаемая совместно с УДХК или в качестве средства монотерапии на 12 месяцев, у больных ПБХ значимо снижает уровни ЩФ и общего билирубина по сравнению с плацебо. В качестве наиболее распространенных побочных эффектов, связанных с приемом препарата, отмечены кожный зуд, усталость, боль в животе и суставах, головокружение, запоры [14, 39].
Кроме того, в настоящее время идут клинические исследования препаратов, которые достаточно условно подразделяются по патогенетической направленности на иммуномодуляторы, модуляторы кишечной микробиоты, антифибротические/фибролизирующие препараты.
ЗАКЛЮЧЕНИЕ
Проблема первичного билиарного холангита (ПБХ) за последние 200 лет не раз меняла свои очертания: от полного непонимания и безнадежности, когда средняя продолжительность жизни больного ПБХ составляла 8 лет, и заболевание сопровождалось нестерпимым кожным зудом, суицидальными мыслями и исходом в декомпенсированный цирроз печени, до радужного осмысления полной победы над этим недугом с появлением урсодезоксихолевой кислоты (УДХК). Действительно, раннее назначение УДХК кардинально изменило клиническую картину ПБХ. Мягкое течение заболевания существенно улучшило качество и продолжительность жизни пациентов с ПБХ.
Тем не менее значительное количество больных резистентно к УДХК. Разработка новых препаратов, позволяющих проводить таргетную терапию, и терапевтических стратегий, направленных на ингибирование или изменение определенных молекул или межмолекулярных взаимодействий, занимающих ключевые позиции в патогенезе ПБХ, позволит окончательно решить проблему и у этой трудной категории пациентов.








