ВВЕДЕНИЕ
Инфекция Helicobacter pylori является одной из наиболее распространенных хронических бактериальных инфекций человека. Несмотря на то что заражение происходит обычно в детском возрасте, клинические проявления чаще развиваются у взрослых. Тем не менее H. pylori-ассоциированные заболевания, такие как хронический гастрит и язвенная болезнь, встречаются и у детей[1, 2]. Особенности течения инфекции H. pylori у детей изучены недостаточно. С одной стороны, высокая колонизационная активность H. pylori в детском возрасте может приводить к более тяжелым последствиям инфекции в будущем; с другой стороны, активный иммунный ответ и быстрая регенерация слизистой оболочки у детей могут ограничивать повреждение тканей желудка и двенадцатиперстной кишки[3]. Актуальными задачами являются изучение механизмов хронической персистенции H. pylori у детей, поиск новых диагностических подходов, а также оптимизация схем эрадикационной терапии с учетом врожденных и приобретенных особенностей иммунного реагирования[3].
Врожденный иммунитет является первой линией защиты от вторжения патогенов и играет важнейшую роль в иммунной системе. Он отвечает за распознавание и реакцию на патогены с помощью паттерн-распознающих рецепторов и активацию воспалительных путей, способствующих элиминации патогенов и поврежденных клеток хозяина. Коллектины (mannose-binding lectin (MBL), печеночный и почечный коллектины) и фиколины являются уникальными паттерн-распознающими рецепторами, которые способны образовывать комплексы с углеводными компонентами патогенов и поврежденных клеток хозяина[4–6]. Эти комплексы вместе со специфическими маннозосвязывающими лектин-ассоциированными сериновыми протеазами (mannose-binding lectin-associated serine protease, MASP) активируют систему комплемента и вызывают воспалительную реакцию, что приводит к элиминации патогенов и поврежденных клеток путем фагоцитоза. Этот путь активации комплемента называется лектиновым, в отличие от двух других путей — классического и альтернативного.
MBL представляет собой наиболее изученный паттерн-распознающий рецептор С-типа, состоящий из нескольких субъединиц и склонный к олигомеризации в димеры, тримеры и тетрамеры. Свойства олигомеризации генетически детерминированы и критически повышают активность MBL в отношении связывания бактериальных полисахаридов и активации комплемента[7]. Известно, что доминантные мутации в экзоне 1 гена MBL2, расположенного на хромосоме 10 (10q21.1), приводят к нарушению способности MBL к олигомеризации и, соответственно, к снижению концентрации и функциональной активности в плазме крови. К аналогичным последствиям приводят мутации в кодонах 52 (rs5030737; A/D), 54 (rs1800450; A/B) и 57 (rs1800451; A/C). Аллели, содержащие мутации в кодонах 52, 54 и 57, обозначены как D, B и C соответственно, в отличие от аллеля дикого типа (A). Мутации D, B и C принято объединять под общим обозначением «O» в связи с однотипными физиологическими последствиями. Помимо кодирующих мутаций в экзоне 1, на иммунологическую функцию MBL влияют и промоторные мутации гена: диморфизмы в локусах rs11003125 (H/L) и rs7096206 (Y/X) модулируют транскрипционную активность, тем самым существенно влияя на концентрацию MBL в плазме крови (H > L и Y > X)[7]. Установлено, что гаплотип HY ассоциирован с самой высокой концентрацией MBL в плазме крови, гаплотип LY — со средней, а LX — с низкой. Кроме того, обнаружен диморфизм в некодирующей области экзона 1 (rs7095891; P/Q).
У человека описаны три вида фиколинов: ficolin-1 (M-фиколин), ficolin-2 (L-фиколин) и ficolin-3 (H-фиколин). Фиколин-1 вырабатывается только в определенных тканях, таких как легкие, моноциты и селезенка, и имеет очень низкую концентрацию в крови. Фиколин-2 производится в печени и циркулирует в крови, а фиколин-3 экспрессируется в печени и легких и имеет наибольшую концентрацию в крови. Описаны различные полиморфизмы генов фиколинов[6], но они не оказывают такого сильного влияния на концентрацию фиколинов в крови, как полиморфизмы гена MBL2.
Одним из важных участников процесса активации комплемента через лектиновый путь является семейство MASPs, в котором выделены 3 протеазы (MASP-1, MASP-2, MASP-3) и 2 родственных неферментативных белка (MAp19 и MAp44). Специфический фермент, способный активировать как MBL, так и фиколины, — это протеаза 2-го типа, известная как MASP-2. Ген MASP2 расположен на хромосоме 1p36 и кодирует 2 белка: MASP-2 и MAp19. Одной из наиболее значимых мутаций MASP2 является замена аспарагиновой кислоты на глицин (rs72550870), которая приводит к потере способности белка активировать комплемент из-за невозможности формирования комплексов с лектинами, включая MBL. Если мутация rs72550870 находится в гомозиготном состоянии (GG), то это может привести к врожденному дефициту MASP-2, который характеризуется полным отсутствием активности протеазы в крови[8, 9].
Роль различных факторов врожденного иммунитета при H. pylori-инфекции широко обсуждается[10]. Основные исследования связи хронической H. pylori-инфекции с лектиновым путем активации комплемента ранее были сконцентрированы на изучении роли MBL. Получены довольно противоречивые результаты[11–15], что, вероятно, связано с узким спектром исследованных полиморфизмов и невозможностью рассчитать частоты высоко- и низкопродуцирующих MBL2-гаплотипов. К тому же, насколько нам известно, связь полиморфизмов других важных генов лектинового пути активации комплемента — FCN2 и MASP2 — с гистологическими особенностями H. pylori-инфекции изучена не была.
Целью исследования было изучение связи 6 полиморфных регионов гена MBL2 (rs11003125, rs7096206, rs7095891, rs1800450, rs1800451, rs5030737), 2 регионов гена FCN2 (rs7851696, rs17549193) и 1 региона гена MASP2 (rs72550870) c H. pylori-инфицированностью и выраженностью нейтрофильного воспаления в слизистой оболочке желудка у детей с рецидивирующими болями в животе.
МАТЕРИАЛЫ И МЕТОДЫ
В гастроэнтерологическом отделении клиники НИИ медицинских проблем Севера — обособленного подразделения ФИЦ КНЦ СО РАН было обследовано 96 подростков-европеоидов в возрасте 12–17 лет, которые предъявляли жалобы на рецидивирующую абдоминальную боль. В рамках обследования были проведены сбор анамнеза, фиброгастроскопия, использованы общеклинические методы обследования. Биопсии слизистой оболочки желудка были получены во время фиброгастродуоденоскопии из антрума и тела желудка. Биоптаты фиксировали в 10% нейтральном буферизованном формалине и затем обрабатывали стандартным методом, включая дегидратацию, формировали парафиновые блоки, делали срезы толщиной 4 мкм. Срезы окрашивали гематоксилином и эозином для оценки нейтрофильной инфильтрации и по методу Гимза для детекции H. pylori. Подсчитывали число микроорганизмов в поле зрения при увеличении 400. Результаты интерпретировали согласно Сиднейской системе[16]: I степень обсеменения — единичные бактерии; II степень — умеренное количество; III степень — обильная бактериальная колонизация. Для оценки выраженности нейтрофильной инфильтрации слизистой оболочки подсчитывали число нейтрофилов в поле зрения при увеличении 400. Результаты также интерпретировали согласно Сиднейской системе: I степень — нейтрофилы встречаются единично; II степень — умеренная инфильтрация; III степень — выраженная инфильтрация.
Материалом исследования послужила ДНК, выделенная из цельной крови с использованием набора «DIAtom DNAPrep100» (ООО «Изоген»). Генотипирование двух полиморфизмов rs1800450 и rs1800451 гена MBL2 и полиморфизмов rs7851696 и rs17549193 гена FCN2 произведено с помощью рестрикционного анализа продуктов амплификации специфических участков генома. Фрагмент из 349 bp гена MBL2 был амплифицирован с использованием пары праймеров: forward 5'-TAGGACAGAGGGCATGCTC-3' и reverse 5'-CAGGCAGTTTCCTCTGGAAGG-3' (температура отжига 60°C). Эндонуклеазы рестрикции AccB1 I (rs1800450) и Mbo II (rs1800451) применяли для гидролиза амплификатов и далее фрагменты разделяли в 2% агарозном геле с этидиумом бромидом для визуализации результатов. В случае полиморфизма rs1800450 использовали рестриктазу AccB1 I: фрагмент 349 bp соответствовал аллелю B, а фрагменты 260 и 89 bp — аллелю A. В случае rs1800451 использовали Mbo II эндонуклеазу: фрагмент 349 bp соответствовал аллелю A, а фрагменты 270 и 79 bp — аллелю C. Фрагмент из 237 bp гена FCN2 был амплифицирован с использованием пары праймеров: 5'-CTGCCTGTAACGATGCTCAC-3’ и 5'-ATCCTTTCCCCGACTTCCAG-3’ (температура отжига 60°C). Эндонуклеазы рестрикции Mro XI (rs7851696) и HpySE526 I (rs17549193) применяли для гидролиза амплификатов и далее фрагменты разделяли в 2% агарозном геле с этидиумом бромидом для визуализации результатов. В случае полиморфизма rs7851696 использовали рестриктазу Mro XI: фрагмент 237 bp соответствовал аллелю G, а фрагменты 110 и 127 bp — аллелю T. В случае rs17549193 использовали HpySE526 I эндонуклеазу: фрагмент 237 bp соответствовал аллелю T, а фрагменты 189 и 48 bp — аллелю C.
Генотипирование однонуклеотидных полиморфизмов MBL2 rs11003125, rs7096206, rs7095891 и rs5030737, а также MASP2 rs72550870 осуществляли при помощи полимеразной цепной реакции в режиме реального времени с использованием специфических олигонуклеотидных праймеров и флуоресцентно-меченных зондов (TagMan, ООО «ДНК-синтез»).
Связи между H. pylori-статусом/нейтрофильной инфильтрацией и генотипом проверяли по критерию χ2. Сравнивали распределение генотипов и аллелей каждого полиморфизма между группами пациентов. Рассчитывали отношение шансов (ОШ) с 95% доверительным интервалом (ДИ).
РЕЗУЛЬТАТЫ
В табл. 1 и табл 2 представлены данные о распределении генотипов генов MBL2, FCN2 и MASP2 в зависимости от статуса инфицированности бактерией H. pylori, верифицированного на основании микроскопии биоптатов слизистой оболочки желудка у обследованных детей. Установлено, что H. pylori-инфицированность была ассоциирована с большей частотой аллеля L полиморфного региона rs11003125 (0,63 vs 0,47; p = 0,04; ОШ = 1,86; 95% ДИ: 1,03–3,37) и тенденцией к большей частоте встречаемости аллеля B региона rs1800450 (0,18 vs 0,08; p = 0,06) гена MBL2. Различий в распределении генотипов генов FCN2 и MASP2 не выявлено.
Таблица 1. Распределение MBL2 генотипов в зависимости от статуса инфицированности Helicobacter pylori (НР), n (%)
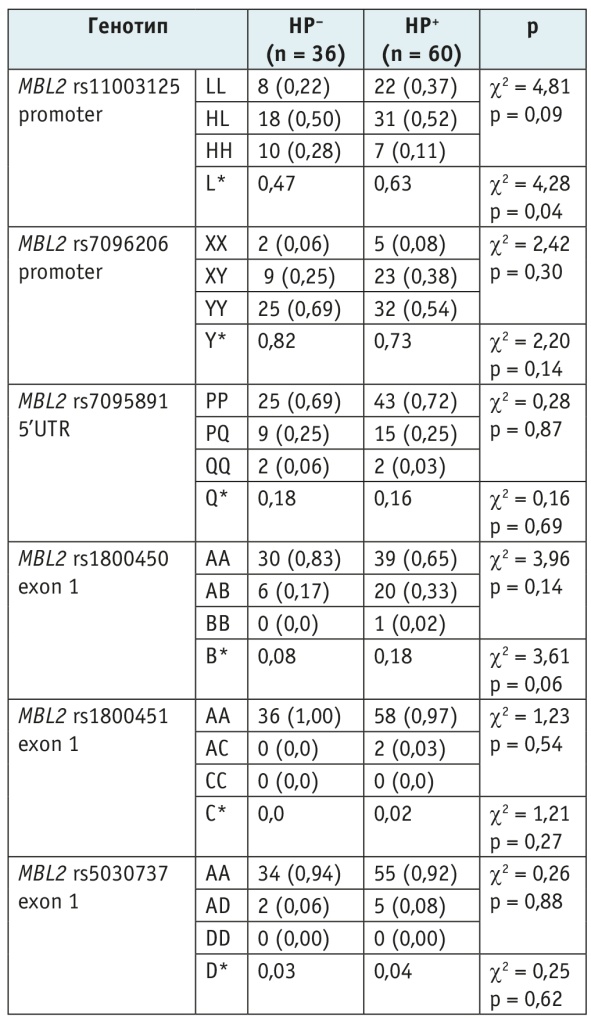
Примечание. *В строке представлены частоты вариантных аллелей в обследованных группах.
Таблица 2. Распределение FCN2 и MASP2 генотипов в зависимости от статуса инфицированности Helicobacter pylori (НР), n (%)
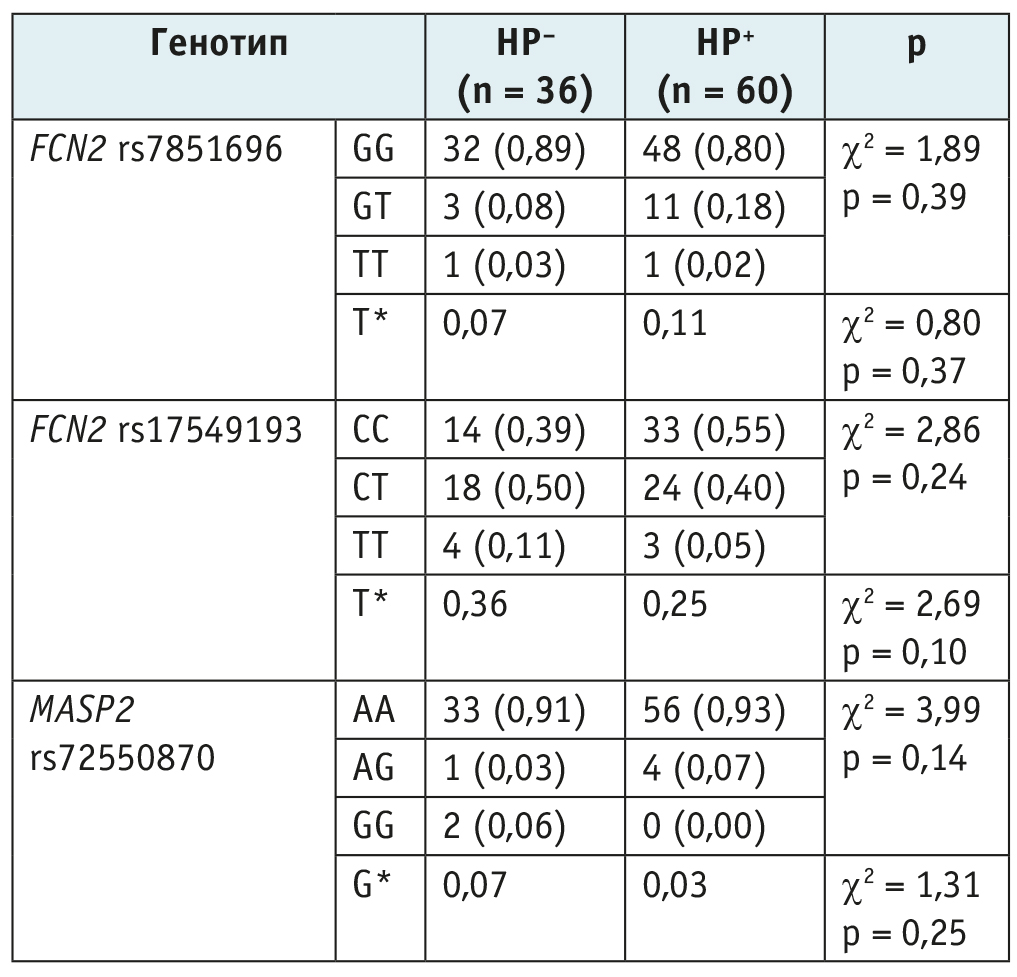
Примечание. *В строке представлены частоты вариантных аллелей в обследованных группах.
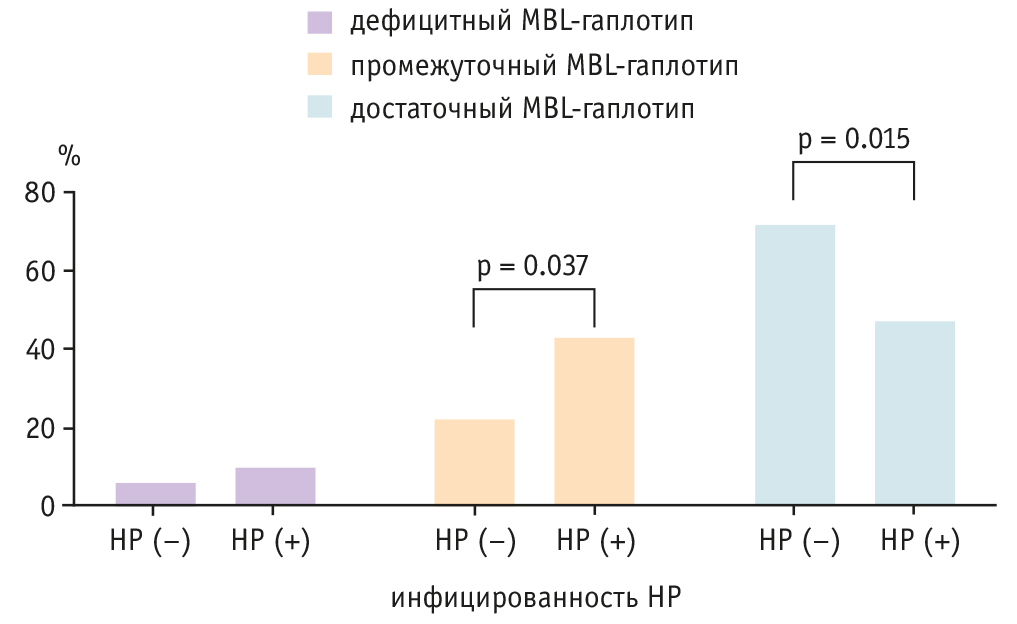
Дополнительно, в соответствии с ранее предложенным подходом[17–19], для оценки клинических последствий генетически обусловленных различий в экспрессии MBL нами выделены MBL-дефицитный (YO/YO или XA/YO), MBL-промежуточный (YA/YO или XA/XA) и MBL-высокоэкспрессирующий (YA/YA или XA/YA) гаплотипы. Результаты распределения выделенных генетических вариантов в зависимости от статуса H. pylori-инфицированности представлены на рис. 1. Из представленных данных следует, что у детей, инфицированных H. pylori, реже встречались генотипы, характеризующиеся высокой экспрессией MBL (47% vs 75%; p = 0,015), что происходило за счет увеличения долей промежуточного и дефицитного гаплотипов. Таким образом, хроническая инфицированность бактерией H. pylori была ассоциирована с генетически-детерминированной низкой продукцией MBL.
Рис. 1. Распределение гаплотипов MBL в зависимости от статуса H. pylori-инфицированности
В табл. 3 и табл. 4 представлены данные о распределении генотипов генов MBL2, FCN2 и MASP2 в зависимости от степени инфильтрации слизистой оболочки желудка нейтрофилами, свидетельствующей о степени активности воспалительного процесса. Как следует из представленных данных, не было выявлено различий в распределении MBL2-генотипов, за исключением полиморфного участка rs7095891. Дополнительные расчеты показали, что при использовании рецессивной модели наследования носительство аллеля Q обладает протективным эффектом в отношении выраженности нейтрофильного воспаления: частота суммарного генотипа PQ+QQ составила 0,06% при наличии нейтрофильной инфильтрации III степени и 0,34% при инфильтрации I–II степени (ОШ = 0,12; 95% ДИ: 0,02–0,96; p = 0,02).
Таблица 3. Распределение генотипов MBL2 в зависимости от степени нейтрофильной инфильтрации слизистой оболочки желудка, n (%)
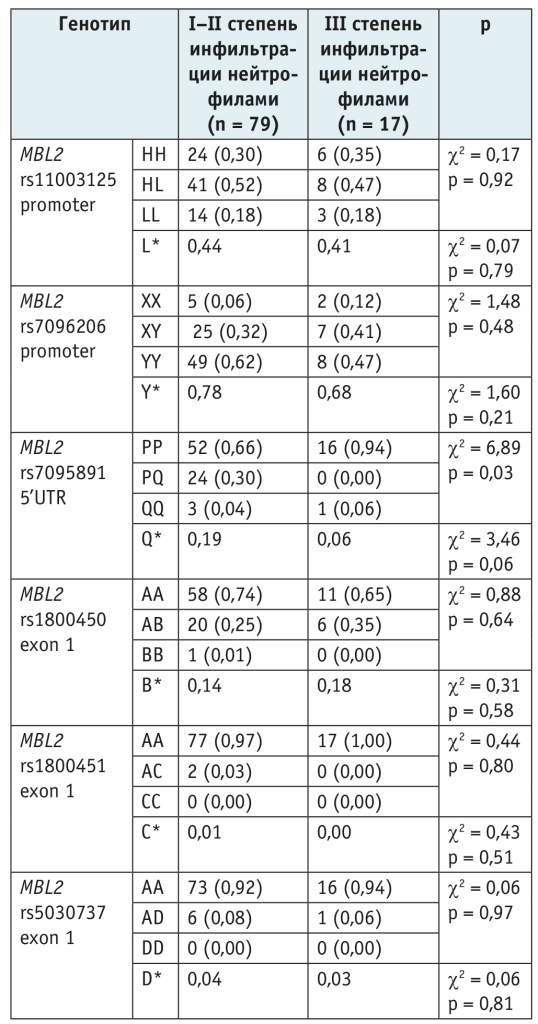
Примечание. *В строке представлены частоты вариантных аллелей в обследованных группах.
Таблица 4. Распределение генотипов FCN2 и MASP2 в зависимости от степени нейтрофильной инфильтрации слизистой оболочки желудка, n (%)
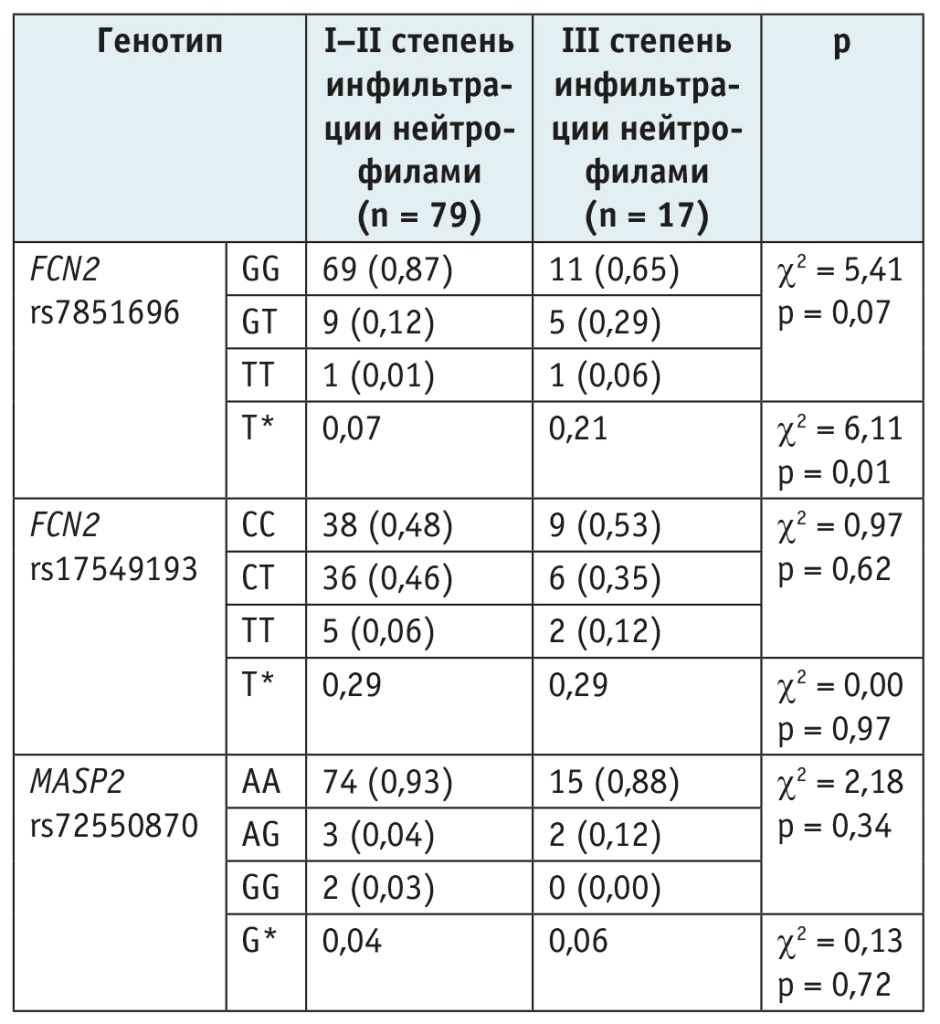
Примечание. *В строке представлены частоты вариантных аллелей в обследованных группах.
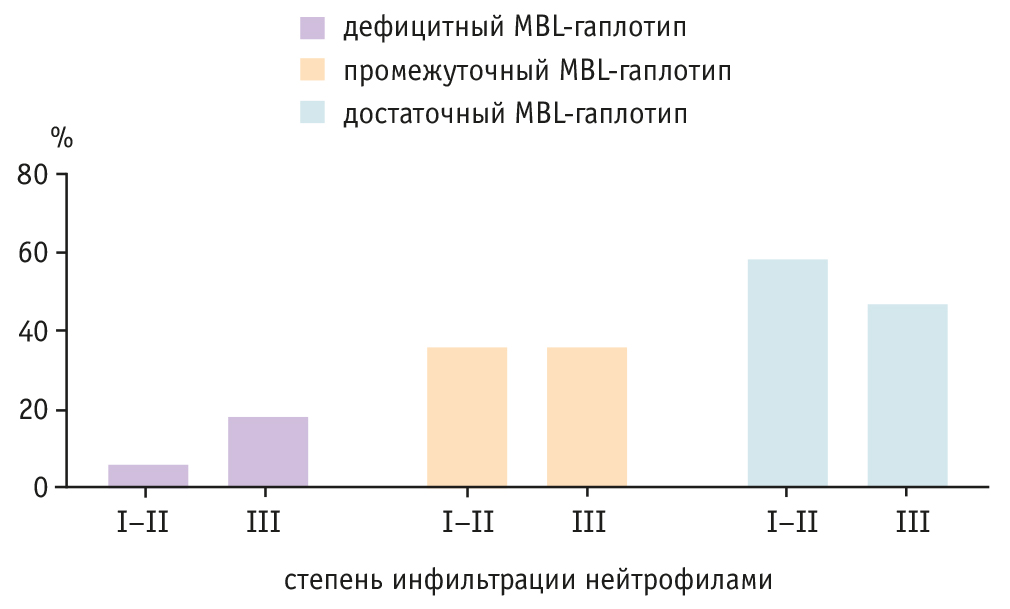
Результаты распределения гаплотипов MBL2 с разной экспрессией протеина в зависимости от степени нейтрофильной инфильтрации слизистой оболочки желудка представлены на рис. 2. Статистически значимых различий в распределении генотипов не выявлено, однако обращает на себя внимание тенденция к большей частоте встречаемости дефицитных гаплотипов при высокой степени нейтрофильного воспаления: 18% при наличии нейтрофильной инфильтрации III степени и 6% при инфильтрации I–II степени; p = 0,1.
Рис. 2. Распределение гаплотипов MBL2- с разной экспрессией протеина в зависимости от степени нейтрофильной инфильтрации слизистой оболочки желудка
Кроме того, нами было установлено, что высокая степень нейтрофильной инфильтрации ассоциирована с большей частотой встречаемости минорного аллеля T полиморфного участка rs7851696 гена FCN2, ассоциированного с низкой продукцией фиколина-2 (0,21 vs 0,07; ОШ = 3,46; 95% ДИ: 1,23–9,73; p = 0,01).
ОБСУЖДЕНИЕ
Полученные в исследовании данные свидетельствуют о наличии ассоциаций полиморфных вариантов генов MBL2 и FCN2 с особенностями течения H. pylori-инфекции у детей.
В частности, было показано, что хроническая инфицированность H. pylori ассоциирована с высокой частотой аллеля L полиморфного региона rs11003125 гена MBL2 и со снижением доли MBL-высокоэкспрессирующих генотипов. Это согласуется с данными о том, что дефицит MBL, обусловленный полиморфизмом гена MBL2, сопряжен с повышенным риском инфицирования внеклеточными патогенами[20–23].
Известно, что носительство аллеля L участка rs11003125 гена MBL2 нарушает синтез протеина и проявляется его более низкими концентрациями в плазме крови[24, 25]. В ряде исследований было показано, что полиморфизм MBL2 rs11003125, а именно носительство аллеля L, ассоциировано с риском формирования кариеса[26–29]. Авторы связывают эти находки с более высоким риском оральных бактериальных инфекций в результате снижения тканевых концентраций MBL, обусловленным носительством аллеля L. Кроме того, было показано, что носительство аллеля L ассоциировано с ранним инфицированием Pseudomonas aeruginosa у пациентов с муковисцидозом[30]. Указанные данные корреспондируют с выявленной нами провокативной ролью носительства аллеля L в отношении инфицирования бактерией H. pylori. Обращает на себя внимание и тенденция к большей частоте встречаемости вариантного аллеля B региона rs1800450, ассоциация которого с низкой активностью MBL и большей подверженностью инфекциям, включая COVID-19, показана некоторыми исследователями[31, 32]. Наконец, снижение доли MBL-высокоэкспрессирующих гаплотипов у детей, инфицированных H. pylori, также может свидетельствовать о защитной роли MBL при H. pylori-инфекции (рис. 1).
Нами выявлена ассоциация носительства аллеля Q участка rs7095891 гена MBL2 с менее выраженной нейтрофильной инфильтрацией слизистой оболочки желудка. В исследовании А. Rantala и соавт. продемонстрировано, что у носителей аллеля Q наблюдаются более высокие концентрации MBL в плазме крови в сравнении с носителями аллеля P[24]. Хотя статистически значимых различий в распределении MBL2-гаплотипов в зависимости от выраженности воспаления не обнаружено, отмечалась тенденция к увеличению доли MBL-дефицитных генотипов при высокой степени нейтрофильной инфильтрации (рис. 2). Эти данные могут косвенно указывать на протективную роль высокой экспрессии MBL в отношении выраженности воспалительных изменений слизистой при хеликобактериозе.
Кроме того, продемонстрировано, что выраженная нейтрофильная инфильтрация ассоциирована с более высокой частотой аллеля T полиморфного участка rs7851696 гена FCN2. Ранее было показано, что носительство вариантного аллеля T приводит к более низким концентрациям фиколина-2 в плазме крови у детей, чем носительство дикого аллеля G[33, 34], и сопряжено с большей частотой инфекций у недоношенных новорожденных[35]. Было показано, что подобно полиморфизму MBL2 rs11003125, носительство минорного аллеля T участка rs7851696 FCN2 сопряжено с ранней колонизацией Pseudomonas aeruginosa у пациентов с муковисцидозом[36]. Наши данные показывают, что генетически детерминированная низкая способность к продукции фиколина-2 сопряжена с более агрессивным течением H. pylori-инфекции у детей.
Таким образом, все выявленные нами значимые генетические вариации образуют однонаправленную тенденцию — генотипы и гаплотипы, ассоциированные с дефицитной активностью лектинового пути активации комплемента, предрасполагают как к хроническому инфицированию H. pylori, так и к более выраженному воспалительному ответу в виде высокого уровня нейтрофильной инфильтрации слизистой оболочки желудка. В то же время полученные результаты предполагают, что высокопродуцирующие генетические варианты могут обладать протективным действием.
Лектиновый путь активации комплемента может быть вовлечен в патогенез H. pylori-ассоциированного гастрита различными путями. Протеины лектинового пути активации комплемента (MBL и фиколины) связываются с гликопротеинами патогенов, включая бактерии, которые могут инфицировать желудок, такие как H. pylori, что приводит к активации системы комплемента и воспалению, способствуя ее эрадикации. Показано, что H. pylori может связывать и прямо активировать MBL[15]. Кроме того, протеины лектинового пути активации комплемента могут связываться с гликопротеинами и гликолипидами на эпителиальных клетках желудка, когда они повреждены или находятся в апоптозе, что может влиять на выраженность и характер воспаления. Так, L. Ba̧k-Romaniszyn и соавт. обнаружили повышенную продукцию MBL2-специфичной мРНК при H. pylori-ассоциированном гастрите у детей, что показывает его вовлеченность в механизмы инфицированности и воспаления[15].
Наши данные согласуются с некоторыми ранее проведенными исследованиями. Так, у детей с гастритом выявлено снижение плазменного уровня MBL (независимо от статуса H. pylori-инфицированности), что может иметь первичную, генетически-опосредованную природу[11]. О. Scudiero и соавт. обнаружили, что носители аллеля A rs7851696 гена MBL2, ассоциированного с низкой концентрацией MBL в плазме крови, имели более высокий риск развития рака желудка, чем носители аллеля G; этот риск был особенно высоким у пациентов, инфицированных H. pylori[12]. А. Baccarelli и соавт. показали, что MBL-дефицитные гаплотипы ассоциированы с риском рака желудка, что, по их мнению, связано с большей предрасположенностью к агрессивному течению H. pylori-инфекции[37]. F.Y. Wang и соавт. обнаружили, что вариант В кодона 54 MBL2 в большей степени встречается у молодых японских пациентов с диагнозом рака желудка, что также может быть связано с большим риском инфицирования агрессивными штаммами H. pylori[13]. Интересны в этой связи данные E. Mortazavi и соавт. о том, что среди пациентов с диабетом 2-го типа носители низкопродуцирующего генотипа MBL2 rs1800450 BB в 4 раза чаще заражаются штаммом H. pylori, продуцирующим CagA, чем лица, не имеющие такой генетической особенности[38].
Имеются и исследования с негативными результатами. Исследование японских ученых показало, что полиморфизм rs1800450 гена MBL2 связан с выраженной атрофией слизистой оболочки, вызванной наличием бактерии H. pylori[14]. Однако не обнаружено связи между этим полиморфизмом и самим фактом инфицирования H. pylori, а также с развитием эрозий и язв. В исследованиях А. Baccarelli и соавт., D.L. Worthley и соавт., Y.W. Chang и соавт. не установлено ассоциации H. pylori-инфицированности с MBL2-генотипами у пациентов с раком желудка[37, 39, 40]. В уже упомянутых работах L. Ba̧k-Romaniszyn и соавт. также не было выявлено подобных связей у детей с хроническим гастритом[11, 15]. Т. Tahara и соавт. не обнаружили связи между полиморфизмами в 54-м кодоне гена MBL2 и функциональной диспепсией или инфицированием H. pylori в японской популяции[41]. Отличия от полученных нами результатов могут быть связаны с относительно узким спектром исследованных полиморфизмов в этих исследованиях. В нашей работе впервые были одновременно протестированы 6 MBL2-полиморфизма, что позволило рассчитать частоты дефицитных и высокопродуцирующих гаплотипов. Кроме того, мы впервые в связи с H. pylori-инфекцией и степенью нейтрофильного воспаления в слизистой оболочке желудка проанализировали генотипы FCN2 и MASP2.
Возможные механизмы включения выявленных врожденных нарушений лектинового пути активации комплемента в сложный механизм развития эрозивно-язвенных поражений желудка и двенадцатиперстной кишки у детей:
1. Нарушение процессов опсонизации и фагоцитоза бактерии H. pylori, которые способствуют переходу от первичной инфекции к хронической персистенции. Вероятно, такое нарушение более характерно для случаев инфицирования высокопатогенным штаммом бактерии CagA[37].
2. Имеются доказательства возможности внутриклеточной персистенции H. pylori в клетках слизистой оболочки желудка, что позволяет предположить участие лектин-ассоциированного фагоцитоза в механизмах клининга инфицированных клеток[42, 43]. Нарушение этого процесса может приводить к распространению бактерии внутри слизистой и усилению воспалительного процесса.
3. Снижение функциональной активности лектинового пути активации комплемента может изменить про- и противовоспалительные механизмы, которые опосредованы другими иммунными и неиммунными механизмами.
4. Неэффективный/неполный лектин-ассоциированный фагоцитоз экстрацеллюлярных бактерий и инфицированных клеток может привести к избыточному притоку нейтрофилов в очаг воспаления, более выраженному воспалительному процессу, образованию эрозий и язв слизистой оболочки желудка и двенадцатиперстной кишки и ее атрофии.
ЗАКЛЮЧЕНИЕ
Полученные результаты свидетельствуют о вовлеченности основных белков лектинового пути активации комплемента — MBL и фиколина-2, в модуляцию воспалительного ответа и течение хеликобактериоза у детей. Дальнейшее изучение роли этих белков при данной патологии представляется перспективным для выявления новых подходов к терапии и профилактике осложнений хеликобактерной инфекции у детей.
Поступила: 30.10.2023
Принята к публикации: 15.02.2024








