ВВЕДЕНИЕ
Муковисцидоз (МВ), или кистозный фиброз, — одно из наиболее часто встречающихся наследственных заболеваний, резко сокращающее продолжительность и качество жизни пациентов без адекватного лечения. МВ распространен среди населения всей Земли, но чаще встречается среди европеоидов[1].
Продолжительность жизни больных с МВ значительно увеличилась в последние годы благодаря достижениям в области новых технологий терапии хронической болезни легких микробно-воспалительного характера, цирроза и других осложнений и проявлений МВ[2]. Из фатальных болезней МВ перешел в разряд хронических, при этом медиана продолжительности жизни пациентов в развитых странах колеблется от 20 до 40 лет и более[3].
Причина этого аутосомно-рецессивного заболевания идентифицирована в 1989 г., когда был обнаружен ген CFTR (cystic fibrosis transmembrane conductance regulator) — муковисцидозный трансмембранный регулятор проводимости (МВТР). К настоящему времени известны более 2000 вариантов нуклеотидной последовательности гена CFTR: в CFTR1 — 2090, в ClinVar — 2156, а в Genome aggregation database (GnomAD) — 19123[1]. Из них на 28.01.2023 г. (на веб-сайте международного проекта CFTR2) представлен 401 клинически значимый патогенный вариант нуклеотидной последовательности гена МВТР, по степени функциональных последствий на формирование белка данные варианты разделены на 7 классов[4, 5].
Схема базисной терапии, общедоступная для всех пациентов, независимо от их типа нуклеотидной последовательности гена МВТР, направлена на замедление прогрессирования патологического процесса, минимизацию последствий хронического воспаления, но она не позволяет восстановить функцию нарушенного белка-транспортера.
Последние десятилетия ознаменовались интенсивными исследованиями гена CFTR и разработкой персонализированной терапии больных с МВ[2, 4–7]. Однако следует учитывать, что из-за большого разнообразия выявленных патогенных вариантов гена CFTR отсутствует универсальный патогенный механизм, определяющий функцию хлорного канала, что диктует разные подходы к таргетной терапии[5] с несколькими вариантами используемых препаратов.
С 2022 г. благодаря фонду «Круг добра» появилась возможность оказания медицинской помощи пациентам с МВ с включением в схему стандартной терапии таргетных препаратов, разработанных для коррекции функции белка, изначально приводящего к формированию клинических проявлений этого тяжелого хронического заболевания. Результаты проведенных за рубежом исследований по оценке эффективности применения таких препаратов свидетельствуют о возможности повысить качество и продолжительность жизни пациентов с МВ еще на 20 лет при раннем начале таргетной терапии[8].
Учет пациентов с МВ в Оренбургской области ведется с 1990 г. За это время отмечено существенное увеличение количества больных — с 6 до 74 человек — за счет улучшения диагностики заболевания и повышения качества оказываемой помощи, что позволило увеличить возраст пациентов с 18 до 43 лет.
В 2022 г. в пределах Оренбургской области таргетную терапию получали 14 пациентов — 19% от всех больных МВ. Среди них есть как дети, так и взрослые (12 против 2). Их возраст — от 3 до 43 лет (рис. 1). Преимущественно это жители областного центра.
Рис. 1. Распределение пациентов с муковисцидозом по возрастам
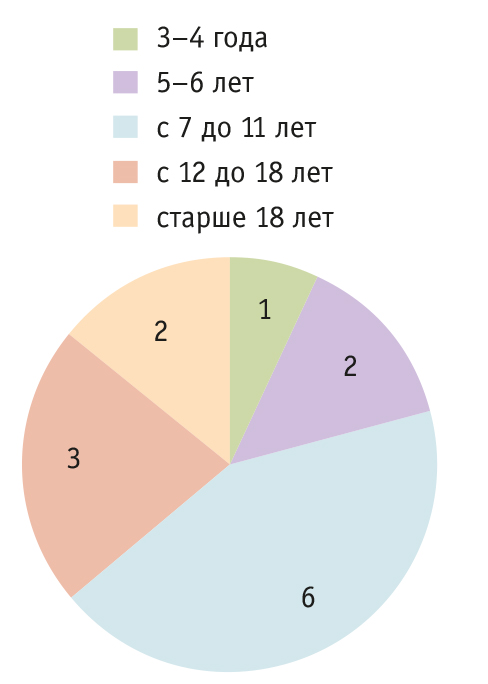
Все пациенты в возрасте до 18 лет обеспечивались таргетными препаратами за счет средств благотворительного фонда «Круг добра», старше 18 лет — за счет средств регионального бюджета. Назначение препаратов проведено в соответствии с видом последовательности нуклеотидов в гене CFTR, перечень которых приведен на рисунке 2.
Рис. 2. Генотипы пациентов, получающих таргетную терапию
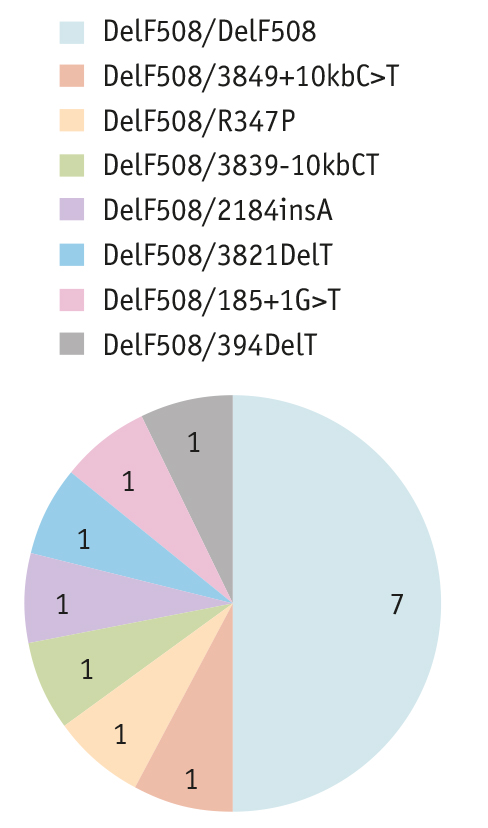
Больные с гомозиготой по DelF508, без комплексного аллеля L467F получали двойную терапию препаратом ивакафтор/лумакафтор (потенциатор/корректор: Оркамби). Пациенты, получающие тройную терапию комбинацией ивакафтор/тезакафтор/элексакафтор (потенциатор/корректор/корректор: Трикафта), являются носителями двух мутаций, по которым возможно назначение этого препарата. Препарат ивакафтор/тезкафтор (потенциатор/корректор: Симдеко) был назначен больному старше 18 лет с F508Del/3849+10kbC>T (рис. 3).
Рис. 3. Количество пациентов, получающих различные таргетные препараты
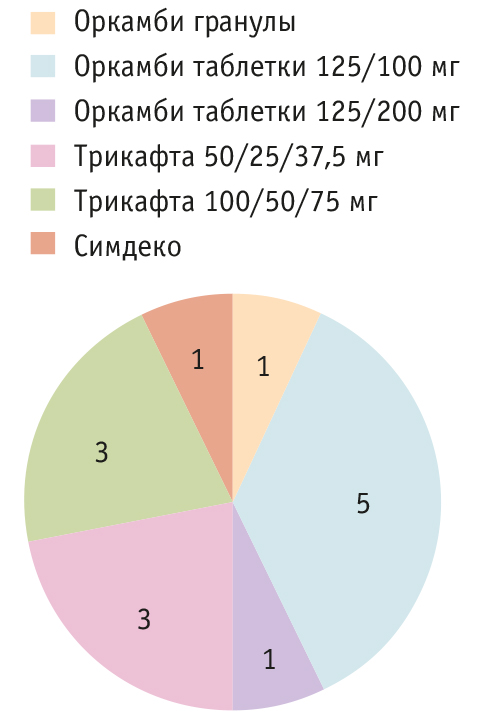
Цель исследования: оценить переносимость, безопасность и эффективность таргетных препаратов, применяемых для терапии детей с МВ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе кафедры госпитальной педиатрии ФГБОУ ВО «Оренбургский государственный медицинский университет» Минздрава России под руководством д. м. н., профессора М.А. Скачковой с апреля 2022 г. по май 2023 г. В исследование включили 12 больных (6 мальчиков и 6 девочек) от 3 до 18 лет с полным генетическим диагнозом МВ, подходящего для таргетной терапии, и наличием хронического бронхолегочного процесса. Семь детей получали двухкомпонентный препарат Оркамби, пять — трехкомпонентный препарат Трикафта.
В качестве контрольной группы выбраны также 12 пациентов с МВ, но не получающие таргетную терапию, — они сопоставимы с участниками основной группы по возрасту и полу, имеют мутации соответствующих классов. Однако следует учитывать, что у больных с одинаковым генотипом клиническая картина часто существенно различается, она определяется генами-модификаторами и факторами окружающей среды. Поэтому контрольная группа носит условный характер. Более достоверные показатели можно получить по отдельно взятым пациентам, а именно при оценке динамики их состояния до таргетной терапии и на ее фоне.
Нами проведены клинические наблюдения и специальные исследования с применением общеклинических, клинико-лабораторных, биохимических, генетических, инструментальных и бактериологических методов.
Для изучения анамнестических данных использовались как данные медицинской документации (амбулаторных карт формы № 112 и историй болезни формы № 003/у), так и опрос детей и их родителей перед стартом терапии, а также в динамике — в первые 2 недели ежедневно, затем через 1, 3 и 6 месяцев.
Проведен клинический осмотр всех детей, включавший оценку общего состояния, показателей физического развития, признаков хронической гипоксии, костных деформаций, изменений со стороны дыхательной, сердечно-сосудистой и пищеварительной систем. Физическое развитие оценивали с применением непараметрического метода по центильным таблицам, а также программ Anthro и Anthro+ для детей старше 5 лет, разработанных Всемирной организацией здравоохранения.
Генетическое обследование пациентов, получающих таргетную терапию двойным препаратом, включало исследование, доказавшее гомозиготность носительства последовательности нуклеотидов DelF508 и исключавшее наличие комплексного аллеля L467F. У детей, получающих таргетную терапию тройным препаратом, производили секвенирование по Сэнгеру.
В комплексное лабораторно-инструментальное обследование пациентов входили общие анализы крови и мочи, потовая проба (проводимость на аппарате Macroduct фирмы Wescor, CША), биохимический анализ крови (определение уровней аспартатаминотрансеразы (АСТ), аланинаминотрансферазы (АЛТ), щелочной фосфатазы, холестерина, билирубина). Ферментативную активность поджелудочной железы определяли по уровню панкреатической эластазы кала. Микрофлора дыхательных путей оценивалась по результатам бактериологического исследования с идентификацией видовой принадлежности выделенных штаммов бактерий и их чувствительности к антибиотикам.
Оценка состояния дыхательной системы больных проводилась с учетом таких критериев, как жалобы пациента, результаты осмотра, данные инструментального исследования методом флоуметрии (компьютерной пневмотахометрии на приборе «Спиротест-РС»).
Всем пациентам, помимо таргетных препаратов, назначено общепринятое комплексное базисное лечение МВ: муколитическая, ферментозаместительная, холеретическая и холекинетическая терапия, витамины.
Математическая обработка данных проведена на компьютере Pentium с использованием методов вариационной статистики. Статистическая обработка включала вычисление отдельных и средних величин, их ошибок и отклонений. Статистическую значимость результатов определяли по критерию T (парному критерию Вилкоксона) и U-критерию Вилкоксона — Манна — Уитни и с использованием точного метода Фишера. При анализе данных применялся пакет программ Stadia и Statistica 10.0. Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
На старте терапии у большинства пациентов отмечались незначимые побочные эффекты, купировавшиеся самостоятельно. В основном они были связаны с активным действием препарата: увеличение объема мокроты, усиление и учащение кашля, периодические боли в области грудной клетки и живота, головные боли, эмоциональная лабильность (рис. 4).
Рис. 4. Побочные эффекты при старте таргетной терапии, число детей
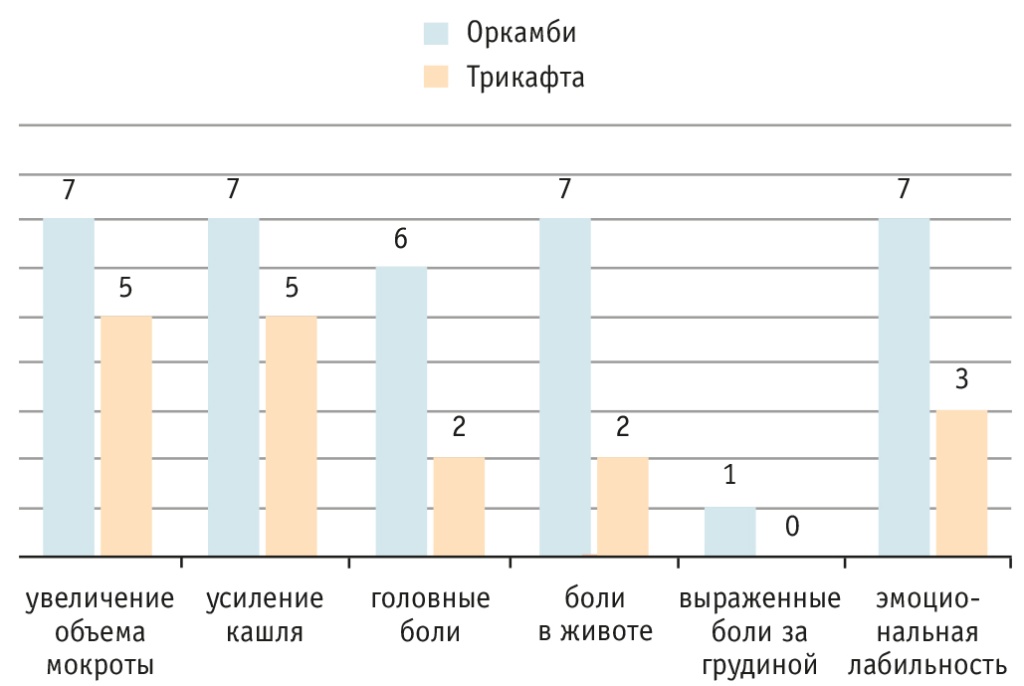
За время лечения у всех детей, принимающих таргетные препараты, отмечена положительная динамика нутритивного статуса: у некоторых — прибавка только массы тела, у других — и роста, и массы (табл. 1, 2).
Таблица 1. Показатели нутритивного статуса детей, получающих препарат Оркамби
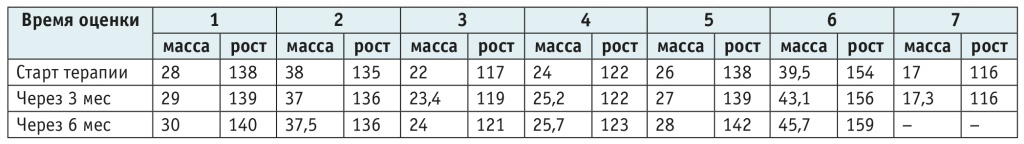
Примечание: Здесь и далее в таблицах единица измерения массы тела — кг, роста — см.
Таблица 2. Динамика нутритивного статуса детей, получающих препарат Трикафта
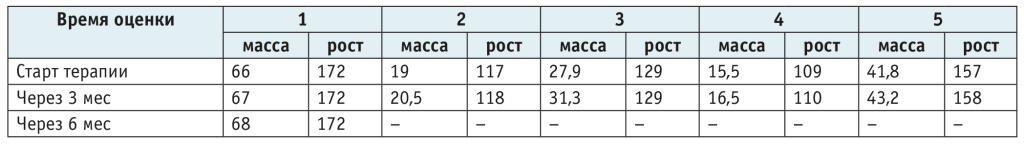
В контрольной группе (табл. 3, 4) у абсолютного большинства детей динамика массы и роста крайне незначительна, иногда отмечалась отрицательная тенденция из-за обострений.
Таблица 3. Динамика показателей нутритивного статуса детей контрольной группы, соответствующих получающим препарат Оркамби
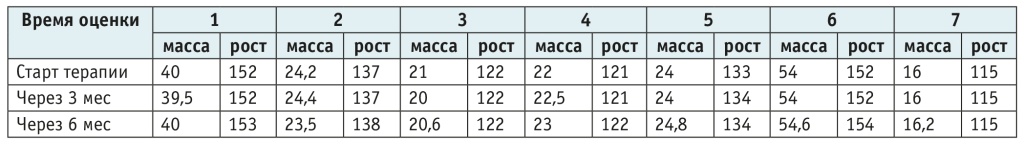
Таблица 4. Динамика показателей нутритивного статуса детей контрольной группы, соответствующих получающим препарат Трикафта
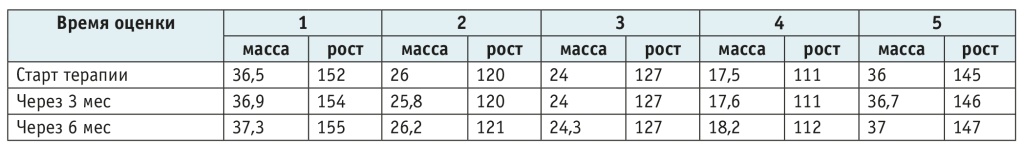
У всех детей, принимающих таргетные препараты, существенно улучшились показатели нутритивного статуса за счет массы тела по сравнению с таковыми у участников контрольной группы (0,01 < рU < 0,05 для Оркамби; рU < 0,01 для препарата Трикафта). Динамика роста не соответствовала критериям статистической значимости и свидетельствовала о естественном росте детей.
Динамика потовой пробы как показателя восстановления функции поврежденного белка-транспортера представлена на рисунке 5.
Рис. 5. Потовая проба пациентов, получающих таргетную терапию
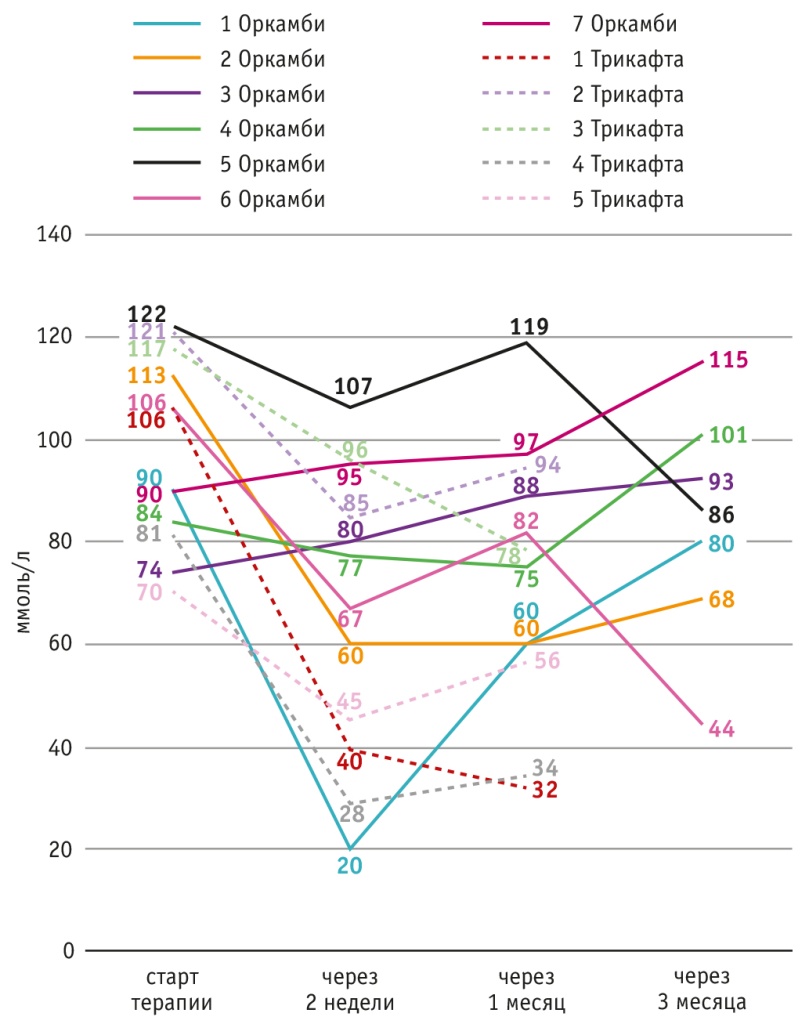
Потовая проба у детей, получающих трехкомпонентную таргетную терапию, показывала более значимое и стойкое снижение содержания хлоридов в потовой жидкости (рt < 0,05), а следовательно, более полное восстановление функции поврежденного белка-транспортера, ответственного за развитие МВ.
Восстановление функции поврежденного белка приводит на первых этапах к увеличению объема мокроты, усилению кашля, что в равной степени наблюдалось на фоне лечения обоими препаратами. Данный симптом сохранялся в среднем 3–7 (±3) дней. Примерно через неделю пациенты субъективно отмечали уменьшение одышки, количества мокроты и кашлевых толчков, более быстрое откашливание. Улучшение отхождения мокроты при условии умеренно выраженного пневмосклероза должно приводить к улучшению показателей функции внешнего дыхания (ФВД). Результаты этого исследования у детей старше 6 лет приведены в таблицах 5 и 6.
Таблица 5. Показатели объема форсированного выдоха за 1-ю секунду (ОФВ1) и функции жизненной емкости легких (ФЖЕЛ) у пациентов, получающих таргетную терапию, в динамике, %
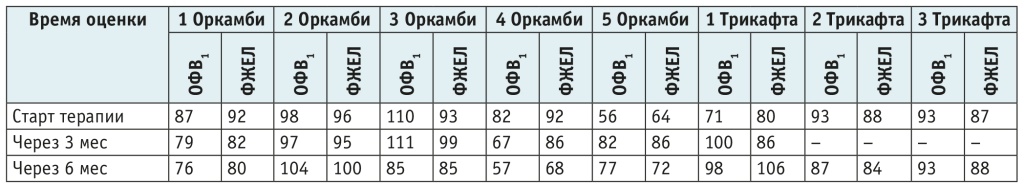
Таблица 6. Показатели объема форсированного выдоха за 1-ю секунду (ОФВ1) и функции жизненной емкости легких (ФЖЕЛ) у детей контрольной группы, соответствующих получающим таргетную терапию, в динамике, %
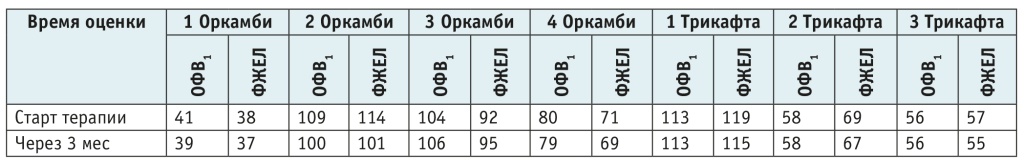
Следует отметить, что у некоторых пациентов отмечалось снижение показателя ФВД в динамике, однако при сравнении с контрольной группой различия были статистически не значимыми (рt > 0,05). У детей на фоне таргетной терапии исследования проводились в строго ограниченные сроки, в том числе во время интеркуррентных заболеваний, с чем связано снижение показателей. У участников контрольной группы показатели ФВД уменьшались более постепенно, что связано с прогрессированием заболевания, и лишь в одном случае зафиксирована обратная тенденция — нужно отметить, что исследования проведены на разных аппаратах, с разной степенью комплаентности пациентов к нему. Кроме того, выборка больных, как и длительность наблюдения, крайне малы.
Различная длительность наблюдения за пациентами, принимающими разные таргетные препараты (в группе препарат Трикафта длительность наблюдения у большинства — 3 месяца, в группе Оркамби — 6 месяцев), не позволяет оценивать эффективность таргетной терапии по частоте респираторных инфекций, нередко являющихся пусковым механизмом в развитии обострения при МВ. Следует также отметить, что условия жизни пациентов в 2021 г. существенно отличались от условий в 2022 г.: массовое соблюдение режима самоизоляции во время пандемии COVID-19 и существенный рост количества контактов в 2022 г.
Изучен бактериологический пейзаж бронхов наших пациентов. Среди получающих трехкомпонентную таргетную терапию на старте исследования у четырех зафиксирована хроническая синегнойная инфекция, у двух — Acinetobacter. В динамике у двух больных из четырех были отрицательные посевы на синегнойную палочку (через 3 и 6 месяцев). Среди получающих двухкомпонентную таргетную терапию у трех детей отмечалась на старте хроническая синегнойная инфекция, у двух — золотистый стафилококк, у одного — Aspergillus fumigatus. Существенная динамика состояния флоры пациентов, получающих двухкомпонентный препарат, отсутствовала.
Среди всех наблюдаемых нами больных с МВ, получающих таргетные препараты, у одного дважды регистрировались симптомы, требующие отмены препарата (Оркамби): подъем артериального давления и носовые кровотечения, гепатомегалия и нарастание активности АЛТ и АСТ.
ЗАКЛЮЧЕНИЕ
На фоне проводимой таргетной терапии у детей с МВ в Оренбургской области только у одного пациента возникли симптомы, потребовавшие отмены препарата, однако данный факт требует дополнительного анализа.
Благодаря включению в терапию препаратов, изменяющих функцию поврежденного белка МВТР, даже за короткий период лечения улучшаются показатели нутритивного статуса (за счет массы тела).
Субъективные ощущения пациентов по улучшению дыхания не получили подтверждения по результатам ФВД, что требует дальнейшего наблюдения на большей выборке.
Более значимые изменения (прибавка массы, субъективное улучшение состояния, тенденция к нормализации показателей потовой пробы) отмечены в группе пациентов, получающих трехкомпонентную таргетную терапию.
Поступила: 11.09.2023
Принята к публикации: 18.01.2024








