В настоящее время «золотым стандартом» диагностики состояния легких новорожденного ребенка остаются инвазивные методы, такие как микробиологическая оценка лаважа из воздушных путей и/или трахеального аспирата, иммунологическая диагностика с использованием биомаркеров крови [3, 4]. Ввиду трудностей, связанных с проведением таких обследований, особенно у новорожденных, родившихся преждевременно [5], многих специалистов привлекает возможность использования легкодоступных биологических жидкостей и современных омиксных технологий для мониторинга состояния интубированных младенцев. В работе R. Torrazza и соавт. предложены в качестве источника биомаркеров щечные соскобы [6], еще в нескольких исследованиях — моча новорожденных [7–10].
В последние годы анализ летучих и нелетучих компонентов конденсата выдыхаемого воздуха (КВВ) привлекает все больше внимания ученых как новое средство для неинвазивного исследования состояния респираторной системы человека. Многочисленные работы по поиску биомаркеров в КВВ были выполнены для взрослых с различными респираторными патологическими состояниями, такими как астма, ХОБЛ, рак легкого, легочная АГ, идиопатический легочный фиброз, интерстициальные заболевания легких, обструктивное апноэ сна [11–13]. Клиническое применение исследования КВВ в педиатрии было продемонстрировано в работах [14–21]. В исследовании [14] авторы показали, что сбор КВВ у маленьких детей и младенцев (1–30 месяцев) возможен и безопасен, тем не менее проведены лишь отдельные исследования КВВ интубированных новорожденных с ограниченным количеством рассматриваемых соединений [22–24].
В настоящем исследовании нами была разработана система для сбора КВВ интубированных новорожденных.
Цель работы: сопоставление данных о составе КВВ интубированных новорожденных с врожденной пневмонией и левосторонней врожденной диафрагмальной грыжей (ЛВДГ) для определения специфичных протеомных и метаболомных профилей заболеваний.
МАТЕРИАЛЫ И МЕТОДЫ
Реактивы. Использовали реактивы и растворители, предназначенные для высокоэффективной жидкостной хроматографии (ВЭЖХ), производитель — SigmaAldrich (Gillingham, Великобритания). Для ферментативного гидролиза белков применяли модифицированный свиной трипсин (Promega, США).
Доноры конденсата выдыхаемого воздуха. Образцы КВВ собирали с января по сентябрь 2016 г. у новорожденных, находящихся на ИВЛ в отделениях реанимации и интенсивной терапии новорожденных и хирургии, реанимации и интенсивной терапии новорожденных Научного центра акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова Минздрава России (директор — Сухих Геннадий Тихонович, академик РАН, доктор медицинских наук, профессор).
Информированное согласие было получено от родителей всех детей. Исследование было одобрено комиссией по исследовательской деятельности Научного центра акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова в соответствии с Федеральным законом об основах охраны здоровья граждан в Российской Федерации (принят Государственной Думой 1 ноября 2011 г., одобрен Советом Федерации 9 ноября 2011 г.).
В исследовании приняли участие 24 интубированных новорожденных в возрасте 4–20 дней, у 12 из них была врожденная пневмония и у 12 ЛВДГ. Группы новорожденных сравнимы по половозрастному составу (гестационный возраст при рождении: 32,1 ± 4,3 недели в группе пневмонии, 35,3 ± 2,8 недели в группе ЛВДГ), этнической принадлежности и возрасту матерей (32,5 ± 5,7 года в группе пневмонии, 29,1 ± 4,2 года в группе ЛВДГ). Недоношенных среди детей с пневмонией было 50,0%, среди младенцев с ЛВДГ — 16,7% (табл. 1). Здоровые новорожденные не принимали участия в исследовании, поскольку разработанный метод сбора КВВ мог быть применен только к младенцам, находящимся на ИВЛ.
Таблица 1
Демографические и клинические характеристики пациентов, n (%)
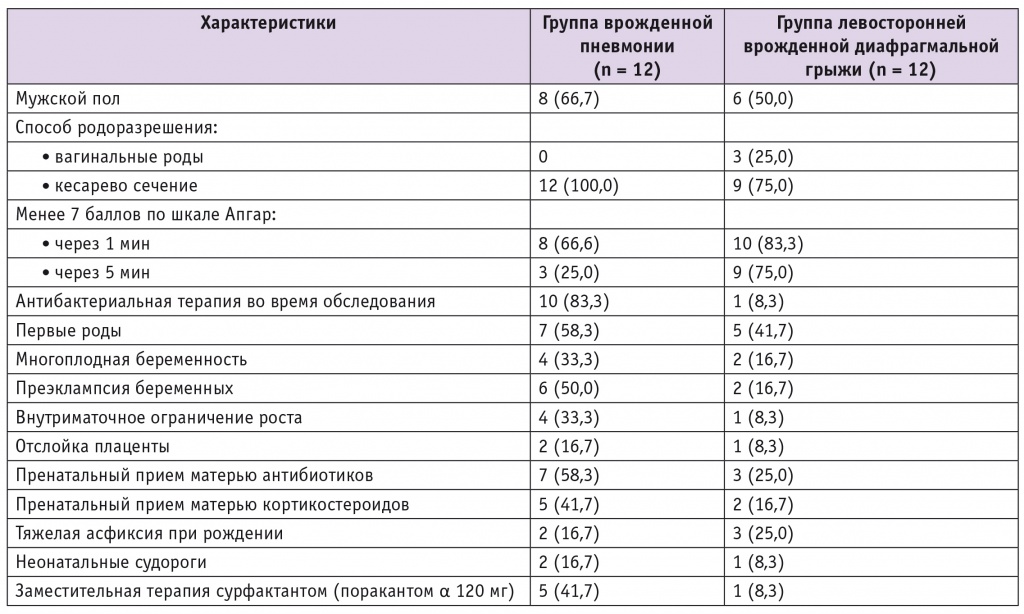
Сбор конденсата выдыхаемого воздуха. Все новорожденные находились на ИВЛ (система AVEA) при постоянном контроле основных жизненных показателей: осуществляли оценку температуры тела, ЭКГ, инвазивное измерение кровяного давления, измерение дыхательного объема и скорости дыхания, определение сатурации артериальной крови кислородом. Данные параметры не изменялись в течение всего времени сбора пробы КВВ. Его производили после клинической стабилизации в течение первого дня после рождения.
Сбор КВВ осуществляли в течение 20 минут, использовали специально разработанный в рамках данного исследования прибор (рис.). Собранный конденсат немедленно переносили в термоустойчивые полипропиленовые пробирки (Corning, США) с низкосорбирующей поверхностью и хранили при температуре –85 °С не более месяца. Для достижения воспроизводимости результатов протеомного и метаболомного анализов проб, полученных разработанным методом, образцы КВВ трех новорожденных из группы ЛВДГ собирали повторно на второй день после рождения, а еще у одного новорожденного из группы — на второй и третий день после рождения.
Рис. Схема установки по сбору конденсата выдыхаемого воздуха с подключением к аппарату искусственной вентиляции легких (ИВЛ)
Пробоподготовка. Образцы КВВ лиофилизовали и провели ферментативный гидролиз трипсином в соответствии с описанным ранее протоколом [25].
Масс-спектрометрический анализ. Анализ с использованием ВЭЖХ в сочетании с тандемной массспектрометрией проводился по ранее описанному протоколу [25] на системе, состоящей из хроматографа Agilent 1100 (Agilent Technologies Inc., США) и гибридного массспектрометра LTQFT Ultra (Thermo, Германия) — массспектрометр ионного циклотронного резонанса, совмещенный с линейной квадрупольной ионной ловушкой, использующейся для накопления ионов и измерения спектров столкновительноиндуцированной фрагментации ионов.
Список из точных масс пептидов и масс их фрагментов использовали для поиска и идентификации белков при помощи программы Mascot, version 2.0.04 (Matrix Science, Великобритания) по базе данных UniProt Knowledgebase (UniProtKB, revision 16.05.2014) [25]. Автоматическую фильтрацию списка белков и пептидов и полуколичественный анализ на основании суммарной интенсивности пиков осуществляли с применением программы Scaffold 4.0, version Scaffold01_07_00 (Proteome Software Inc., США). Считали, что пептид идентифицирован верно, если вероятность его определения была более 95% согласно алгоритму Peptide Prophet. Белок считали идентифицированным при вероятности определения более 99% согласно алгоритму Peptide Prophet и если для него нашли два и более уникальных триптических пептида [26].
Обнаружение метаболитов осуществляли с помощью программы Elements, version 1.2.1 (Proteome Software Inc., США) в диапазоне масс 100–1400 m/z и на всем диапазоне времени удерживания. Порог шума был установлен на 10 000 отн. ед. Для поиска исходной идентификации использовали базу данных метаболомов человека (The Human Metabolome Database) в соответствии с опубликованным ранее протоколом [25]. Идентификацию принимали, если она была определена с ID Score 0.9 или выше.
Статистический анализ полученных результатов. Для поиска статистических различий в протеомном/метаболомном составе КВВ новорожденных использовали Uтест Манна — Уитни с коррекцией Бонферрони. Статистически значимыми считали различия при р < 0,05.
РЕЗУЛЬТАТЫ
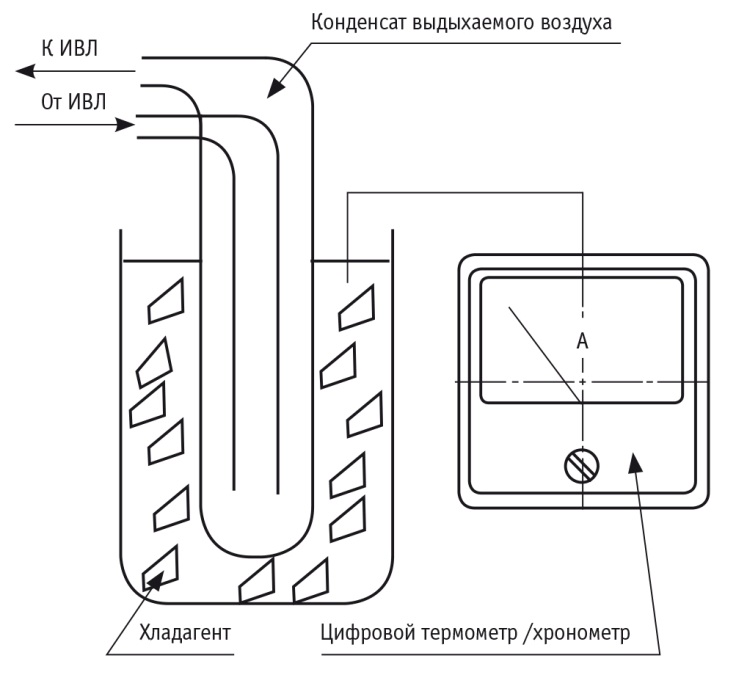
Для реализации заявляемого способа сбора КВВ мы использовали концентрический стеклянный сосуд типового производства (Lenz Laborglasinstrumente, Германия). Стеклянный сосуд подсоединяли с использованием тефлоновых трубок к типовым соединениям ИВЛ. Во время процедуры сбора сосуд помещался в термос с охлаждающей жидкостью (хладагентом), как показано на рисунке. При потоке воздуха в контуре ИВЛ от 1 до 10 л/мин время, необходимое для сбора требуемого количества конденсата (0,5–1 мл), — 12–20 мин.
В таблице 2 описаны условия экспериментов с использованием различных хладагентов: льда с добавлением соли (NaCl), просто льда, этанола (–80 °С).
Таблица 2
Условия экспериментов по забору пробы конденсата выдыхаемого воздуха (КВВ) при использовании различных хладагентов и варьировании времени сбора
Протеомный анализ КВВ недоношенных новорожденных, находящихся в отделении интенсивной терапии, выявил 119 различных белков. Инвариантными для всех образцов оказались цитоскелетные кератины I (9, 10, 12, 16, 18, 24) и II (1, 1b, 2, 5) типа. Список некератиновых белков, идентифицированных в пробах обследованных новорожденных, приведен в таблице 3.
Таблица 3
Некератиновые белки конденсата выдыхаемого воздуха пациентов
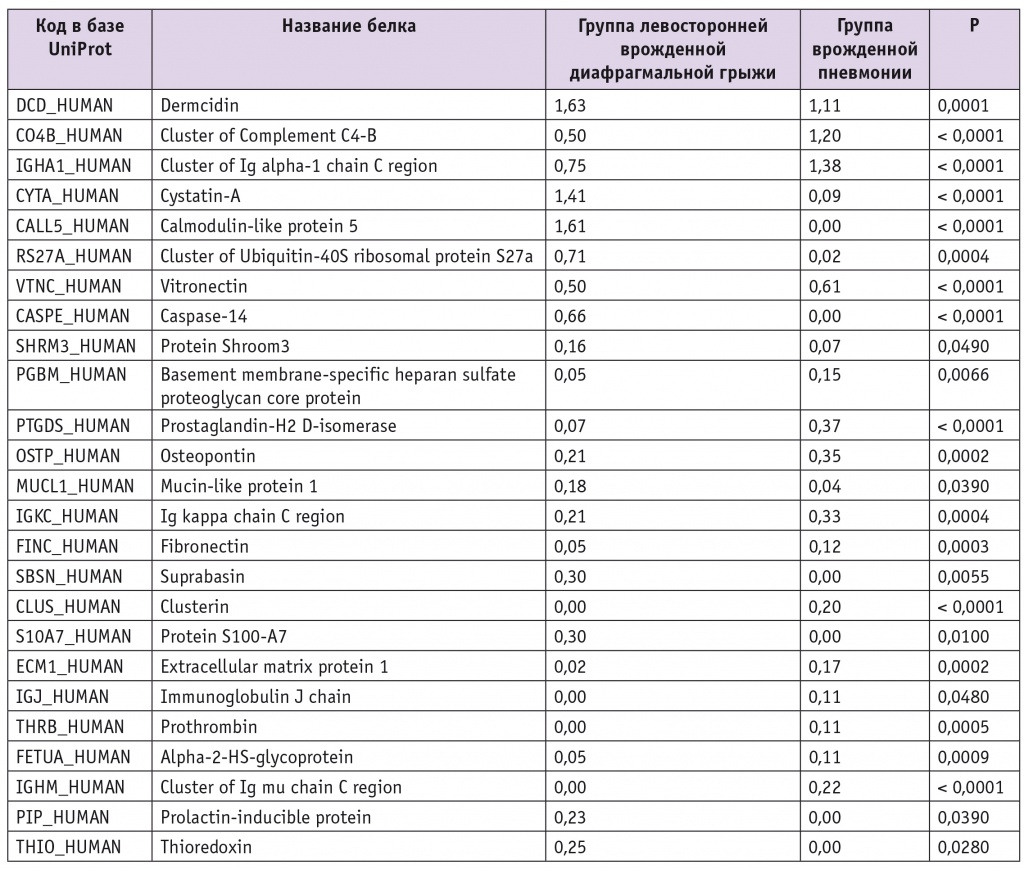
Примечание. Средние значения интенсивности по группам даны на основании нормализованной суммарной интенсивности спектров для каждой группы.
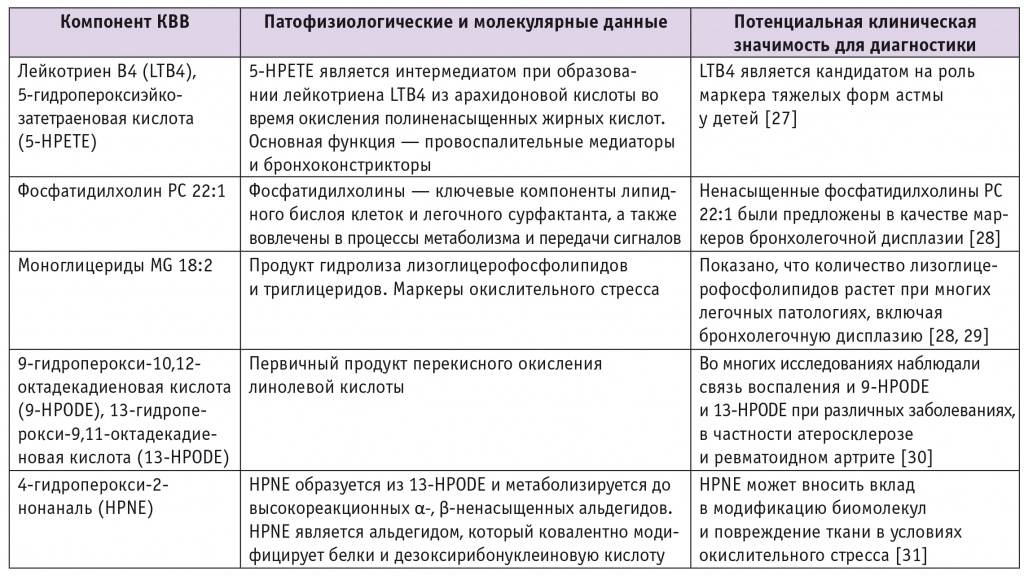
В таблице 4 представлены данные по липидным компонентам КВВ участников исследования, значимо различающимся (p < 0,05) в составе метаболома больных сравниваемых групп.
Таблица 4
Патофизиологические/молекулярные/клинические данные по липидным компонентам конденсата выдыхаемого воздуха (КВВ) новорожденных
ОБСУЖДЕНИЕ
В ходе данного исследования было разработано устройство для сбора КВВ новорожденных, находящихся на ИВЛ. Показано (см. табл. 2), что лучше всего использовать этанол, охлажденный до низкой температуры (–80 °С). Наиболее подходящим является время сбора 20 мин. За данный период удается собрать пробу объемом более 1 мл, что оптимально для дальнейшего анализа состава пробы КВВ [32].
Предыдущие исследования показали, что цитоскелетные кератины — это основные белковые компоненты КВВ [12, 27, 32, 33]. В настоящей работе мы не обнаружили существенных различий в частоте идентификации и нормализованной суммарной интенсивности пиков группы цитокератинов в рассматриваемых группах интубированных новорожденных.
Как можно видеть по приведенным данным по идентифицированным некератиновым белкам (см. табл. 3), для группы новорожденных с врожденной пневмонией идентифицировали расширенную группу Ig (Cluster of Ig alpha1 chain C region, Ig J chain, Cluster of Ig mu chain C region, Ig kappa chain C region). Ig, идентифицированные в группе пневмонии, характеризовались более высокой нормализованной суммарной интенсивностью пиков, в этой группе также идентифицировался комплемент С4 (Cluster of Complement C4B). Ig в организме человека, как и компоненты комплемента, связаны с иммунным ответом и воспалением, поэтому полученные результаты анализа коррелируют с клинической картиной заболевания.
Уровень нормализованной суммарной интенсивности пиков некоторых других белков в группе пневмонии, напротив, оказался понижен (Dermcidin, CystatinA, Calmodulinlike protein 5) по сравнению с таковым в группе ЛВДГ. Примечательно, что результаты данного исследования совпали с результатами анализа КВВ взрослых пациентов с диагнозом внебольничной пневмонии [12]. Так, показано, что при сравнении групп здоровых людей и больных ХОБЛ дермцидин являлся практически инвариантным (частота встречаемости в пробах — 96% и 94% соответственно), а у пациентов с пневмонией частота идентификаций этого белка резко упала — до 60%. Цистатин А, характерный для КВВ большинства обследованных доноров, включая здоровых некурящих и курильщиков, отсутствовал в пробах больных пневмонией, взамен этого «нормального» цистатина появились два других: цистатин B и цистатин M.
Пики эйкозанойдов (простагландинов, лейкотриенов, липоксинов) присутствовали в массспектрах более 60% образцов КВВ. Эти вещества относятся к окисленным производным полиненасыщенных жирных кислот и функционируют главным образом как провоспалительные медиаторы и бронхоконстрикторы [34].
Интенсивность пиков лейкотриена B4 и 5гидропероксиэйкозатетраеновой кислоты была значимо выше (p < 0,05) в образцах КВВ новорожденных с врожденной пневмонией в сравнении с группой ЛВДГ (см. табл. 4). Интенсивность пика полиненасыщенного фосфатидилхолина и полиненасыщенного моноглицерида была, напротив, значительно снижена (p < 0,05) в образцах КВВ группы врожденной пневмонии по сравнению с группой ЛВДГ. S. Carraro и соавт. [35] предложили использовать полиненасыщенный фосфатидилхолин как маркер бронхолегочной дисплазии, при которой нарушения структуры альвеоли легочных сосудов имеют много общего с таковыми при ЛВДГ [36]. Свободные моноглицериды попадают в КВВ в основном как продукты гидролиза лизоглицерофосфолипидов и триглицеридов. Как показали проведенные исследования, уровни лизоглицерофосфолипидов повышены при многих легочных патологиях, включая бронхолегочную дисплазию [35, 37].
На основании полученных данных о белковом и липидном составе КВВ новорожденных с врожденной пневмонией и ЛВДГ и их сопоставления с результатами ранее опубликованных работ можно заключить, что анализ КВВ является информативным методом оценки состояния респираторной системы и позволяет дифференцировать группы пациентов с инфекционным и неинфекционным респираторным заболеванием. Однако эти выводы требуют подтверждения в ходе дополнительных исследований более многочисленной группы пациентов.
ЗАКЛЮЧЕНИЕ
В данном исследовании нами были получены протеомы и метаболомы конденсатов выдыхаемого воздуха (КВВ) интубированных новорожденных с врожденной пневмонией и левосторонней врожденной диафрагмальной грыжей. При сопоставлении данных о составе КВВ пациентов с инфекционным и неинфекционным характером заболевания были выявлены существенные отличия на уровне идентифицируемых пептидов и липидного компонента. При дальнейших исследованиях полученные результаты могут помочь дифференцировать профили заболеваний респираторного тракта инфекционной и неинфекционной природы.
Работа выполнена при финансовой поддержке РФФИ и Правительства Москвы в рамках научного проекта № 153870039 «мол_а_мос».








