Врожденная кистозноаденоматозная мальформация легких (КАМЛ) является редким пороком развития легочной ткани. При этой патологии происходит разрастание терминальных бронхиол с образованием кист разного размера, не затрагивающих альвеолы. Вовлеченная в патологический процесс ткань легкого снабжается воздухом из магистральных дыхательных путей через узкие поры Кона, а кровоснабжается из легочной артерии.
Секвестры легочной ткани могут быть связаны с легким (интралобарная секвестрация) и располагаться изолированно от него (экстралобарная секвестрация) в плевральной полости или за ее пределами в забрюшинном пространстве.
Пренатальная диагностика пороков развития легочной ткани возможна уже с 20й недели внутриутробного развития плода при выявлении в ткани легкого неправильной формы кист различного диаметра либо участков легочной ткани повышенной эхогенности. Ультразвуковая картина обоих пороков очень схожа, однако в ряде случаев доплерографическое исследование кровотока пораженной зоны позволяет обнаружить аномальный питающий сосуд из грудного или брюшного отдела аорты, что является главным дифференциальным признаком БЛС.
БЛС и КАМЛ относятся к редким врожденным аномалиям. Частота их выявления, по данным литературных источников, значительно варьирует — от 1 : 8000 до 1 : 35 000 живорожденных детей [1–4].
Врожденные пороки развития легочной ткани чаще всего бывают изолированными. КАМЛ наблюдается в пределах ткани одной доли легкого. Хромосомные аномалии не встречаются. По данным литературы, частота сочетания БЛС и КАМЛ не более 5%, а комбинации с пороками развития других органов являются исключительной редкостью [1, 3, 4–6]. Лечение врожденных пороков развития легких — преимущественно хирургическое, в современных условиях эндоскопические способы проведения операций предпочтительны для любых возрастных категорий [6].
Сочетание этих пороков, поражение нескольких долей легкого у одного ребенка, а также комбинации с врожденными пороками сердца (ВПС), скелета, врожденной диафрагмальной грыжей (ВДГ) и поражениями других органов встречаются крайне редко, требуют дополнительного диагностического поиска и разработки индивидуальной хирургической тактики.
Цель работы: провести анализ собственного опыта наблюдения и лечения пациентов с врожденными пороками развития легочной ткани, определить частоту сочетанных (в пределах дыхательной системы) и комбинированных (затрагивающих разные системы органов) пороков, обосновать диагностическую и хирургическую тактику.
МАТЕРИАЛЫ И МЕТОДЫ
На базе ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. акад. В. И. Кулакова» Минздрава России с января 2006 г. по декабрь 2016 г. наблюдали 113 новорожденных с пороками развития легочной ткани.
Предварительный диагноз порока легкого был установлен на различных сроках внутриутробного развития во всех случаях и подтвержден на пренатальном консилиуме профильных специалистов Центра.
После рождения дети были госпитализированы в отделение хирургии, реанимации и интенсивной терапии новорожденных, им проводили общеклинические, инструментальные и лабораторные исследования в течение периода ранней адаптации, дополненные обзорной рентгенографией органов грудной клетки и УЗИ плевральных полостей в 1е сутки жизни.
УЗИ выполняли на аппарате Siemens ACUSON S2000 (Германия — США) с использованием линейных датчиков 7–14 МГц и 18–20 МГц по оригинальной, разработанной специалистами ФГБУ «НЦАГиП им. акад. В. И. Кулакова» методике, с определением в Врежиме участков уплотнения и нарушения структуры легочной ткани, наличия кист, локализации и размеров патологических очагов, а также с выявлением реактивного выпота в плевральной полости. В режимах цветового доплеровского картирования и импульсноволновой доплерографии прослеживали наличие аномального кровоснабжения из грудного или брюшного отдела аорты с регистрацией типа кровотока.
Выбор методов дальнейшего обследования был основан на результатах рентгеновского и ультразвукового скрининга и оценке тяжести состояния больного. При подозрении на экстралобарный секвестр легкого методом выбора служила МРТ изза ее высокой диагностической ценности при оценке мягкотканных образований, во всех остальных случаях предпочтение отдавали КТ для лучшей оценки структуры ткани легкого. В одном особенно сложном для диагностики случае прибегли к комбинации визуализационных методов с целью уточнения характера заболевания.
МРТ проводили на томографе GE Signa 1.5T (США) с использованием режимов Т1ВИ и Т2ВИ. Сосудистое русло и аномальное кровоснабжение секвестра легкого оценивали с помощью магнитнорезонансной ангиографии с внутривенным болюсным контрастированием разрешенным для применения у новорожденных препаратом гадотеровой кислоты в возрастных дозировках. КТ выполняли на аппарате Toshiba Aquilion Prime (Япония) с программой низкодозового объемного сканирования и контрастированием сосудов препаратом йопромида по показаниям.
В ряде случаев тяжесть состояния при комбинированных пороках развития не позволила транспортировать ребенка для дополнительного обследования, диагноз был окончательно установлен во время хирургического вмешательства.
Показания к хирургическому лечению и его объем были определены по результатам обследования и с учетом тяжести состояния младенца.
Катамнестическое наблюдение детей осуществляли на базе научноклинического педиатрического отделения ФГБУ «НЦАГиП им. акад. В. И. Кулакова» с проведением контрольных УЗИ и обзорной рентгенографии грудной полости 3кратно в течение первого года жизни.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среди 113 пациентов с пороками развития легких (БЛС и КАМЛ) у 13 детей (11,7%) — 11 мальчиков и 2 девочек — обнаружены редкие сочетания заболеваний (табл.).
Таблица
Частота выявления изолированных и комбинированных врожденных пороков развития у участников исследования (n = 113)
На этапе пренатальной диагностики комбинация врожденного порока развития легочной ткани и других органов выявлена специалистами в 3 (2,7%) наблюдениях: у одного плода — типичные признаки экстралобарной БЛС и левосторонней ВДГ, у второго — округлое жидкостное объемное образование в области дна желудка и крупный секвестр легочной ткани в плевральной полости, у третьего — комбинация признаков КАМЛ и ВПС (атрезии трикуспидального клапана).
Трудности пренатальной диагностики сочетания БЛС и КАМЛ связаны со сходной внутриутробной картиной этих заболеваний, которая зачастую не позволяет дифференцировать их даже при изолированном поражении [3, 7], поэтому на данном этапе еще 6 плодам был установлен диагноз врожденного порока легкого.
В остальных наблюдениях комбинированных пороков основной диагноз ставили по результатам УЗИ на разных сроках гестации: у 2 плодов — аномалии развития легких и у 2 — левосторонняя ВДГ.
После рождения дети были госпитализированы для дальнейшего наблюдения и обследования в отделение хирургии, реанимации и интенсивной терапии новорожденных. Все дети родились доношенными, без признаков интранатальной асфиксии. В случаях пренатально установленного диагноза ВДГ на этапе родильного зала и транспортировки в блок интенсивной терапии пациентам была оказана реанимационная помощь в полном объеме.
Клиническая картина после рождения у младенцев с ВДГ была обусловлена дыхательной и сердечнососудистой недостаточностью, дети в тяжелом состоянии нуждались в интенсивной терапии в период подготовки к хирургической коррекции. Среди 10 новорожденных с основным диагнозом порока развития легочной ткани признаки дыхательной недостаточности разной степени тяжести и изменения аускультативной картины над очагом (ослабление дыхания, хрипы, крепитация) после рождения отмечены у 6, тогда как в остальных 4 наблюдениях клинических признаков поражения легочной ткани не было, крепитирующие хрипы носили транзиторный характер в первые сутки жизни ребенка, в последующем не выслушивались.
По результатам первичной обзорной рентгенографии органов грудной клетки у 3 пациентов с подозрением на ВДГ диагноз был подтвержден, в 4 наблюдениях признаки врожденного порока развития легкого имели вид участка уплотнения ткани, деформации легочного рисунка и смещения органов средостения в здоровую сторону, в остальных 6 случаях отклонения не выявлены. Полученные результаты соответствуют литературным данным о невысокой информативности обзорной рентгенографии при врожденных пороках развития легких [1, 4–6].
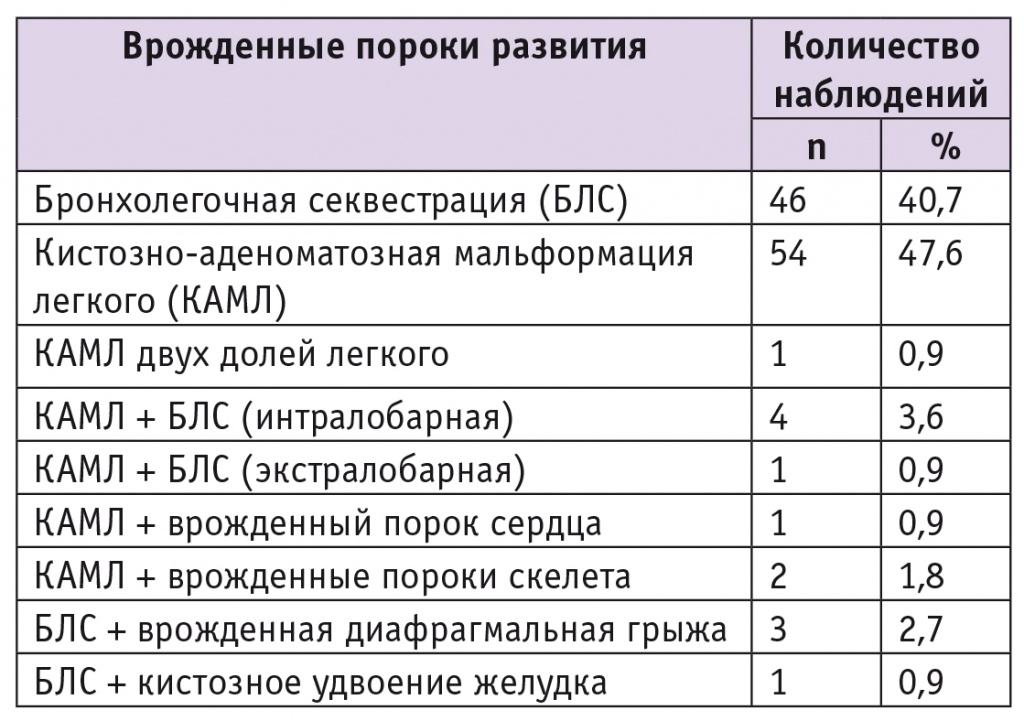
УЗИ плевральной полости позволило обнаружить признаки порока в большинстве случаев (11 из 13). У 2 детей с ВДГ наряду с петлями кишечника, селезенкой и желудком в плевральной полости найдено дополнительное объемное образование смешанной кистозносолидной структуры, с четкими неровными контурами и тонкой капсулой, с активным кровоснабжением (рис. 1А, Б).
Рис. 1. Врожденная диафрагмальная грыжа слева и экстралобарный секвестр легкого.
А ― объемное образование плевральной полости (ультразвуковое исследование: В-режим, межреберный доступ, продольное сканирование); Б ― активное кровоснабжение образования (цветное доплеровское картирование); В ― секвестр легочной ткани в плевральной полости, истинная грыжа левого купола диафрагмы (стрелка) (эндофото). Здесь и далее в статье фото авторов
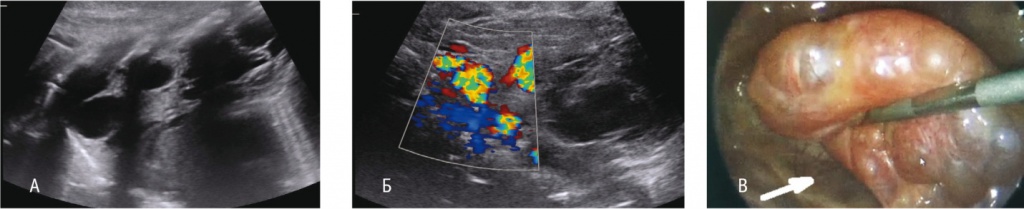
В одном случае подтверждены безвоздушный секвестр легкого больших размеров с аномальным сосудом из грудного отдела аорты в левой плевральной полости и поддиафрагмальная киста с толстой слоистой стенкой и жидкостным анэхогенным содержимым, типичными для дупликационных образований желудка (рис. 2А). У 8 детей выявлены различные изменения легочной ткани в виде деформации субплевральных участков, очагов уплотнения с кистозными включениями различной формы и размеров, содержащими жидкость и газ в разных пропорциях, среди них у 5 дополнительно обнаружили аномальное кровоснабжение патологического участка. У 2 пациентов (одного с ВДГ слева и одного с подозрением на КАМЛ) ультразвуковые признаки порока легкого отсутствовали.
Рис. 2. Экстралобарный секвестр легкого и дупликационная киста желудка.
А ― объемное безвоздушное образование плевральной полости (стрелка), анэхогенное образование поддиафрагмального пространства (двойная стрелка) (ультразвуковое исследование: В-режим, межреберный доступ, продольное сканирование); Б ― объемное безвоздушное образование плевральной полости (стрелка), анэхогенное образование поддиафрагмального пространства (двойная стрелка) (магнитно-резонансное сканирование: Т2-режим, сагиттальный срез); В ― кистозное образование поддиафрагмального пространства (эндофото)
Следует отметить, что, несмотря на значительную эффективность УЗИ в диагностике пороков легочной ткани, ни в одном случае не удалось установить сочетание секвестрации легкого и КАМЛ. Трудности ультразвуковой диагностики связаны со сходной картиной поражения легкого при этих пороках и экранированием зоны интереса воздушной тканью, препятствующей тщательному осмотру. Однако интралобарная БЛС была заподозрена в 5 наблюдениях после выявления аномального питающего секвестрацию сосуда из бассейна аорты.
Первичный осмотр при поступлении в отделение позволил определить пороки развития костей скелета у 2 новорожденных — костную полидактилию I пальца кисти у одного и двустороннюю деформацию плюсневых костей (metatarsus varus) у второго. После ультразвукового скрининга в обоих случаях подтверждена комбинация врожденных аномалий уже на этом диагностическом этапе.
Окончательный диагноз у 10 детей был установлен по результатам использования дополнительных методов обследования (МРТ и КТ). Исключение составили 3 пациента с ВДГ, тяжесть состояния которых не позволила осуществить транспортировку, однако дети проходили предоперационную подготовку к осуществлению хирургической коррекции основного заболевания, в таких случаях характер грыжи и наличие сопутствующих заболеваний определяют при интраоперационной ревизии органов грудной и брюшной полостей.
КТ была сделана 8, МРТ — 2 детям, в одном случае прибегли к обоим методам, одному ребенку потребовалось проведение повторного исследования. Всего 10 детям было выполнено 12 исследований: 10 КТ и 2 МРТ. На основании КТ диагноз комбинации интралобарной БЛС и КАМЛ установлен 4 пациентам, диагноз КАМЛ подтвержден в 4 случаях. МРТ у девочки с экстралобарной БЛС и поддиафрагмальной дупликационной кистой желудка позволила визуализировать оба образования (рис. 2Б).
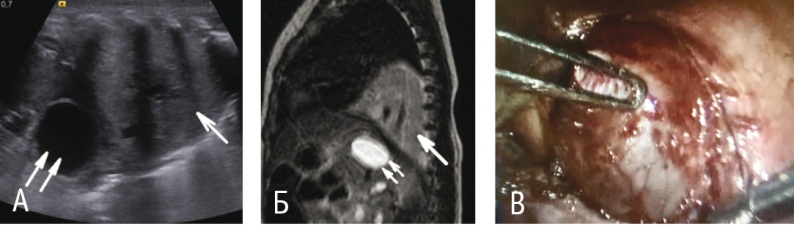
МРТ делали также ребенку с подозрением на экстралобарную БЛС по данным УЗИ, однако у секвестра не было четких границ с нижней долей легкого, он имел характеристики внутрилегочного, что заставило продолжить обследование. По результатам КТ дополнительно выявили сопутствующие мелкокистозные изменения ткани нижней доли левого легкого и подтвердили комбинацию БЛС и КАМЛ (рис. 3А, Б).
Рис. 3. Кистозно-аденоматозная мальформация и интралобарный секвестр легкого.
А ― участок плотной ткани в задних отделах нижней доли левого легкого с неровным нечетким контуром (стрелка) (магнитно-резонансное сканирование: Т2-режим, сагиттальный срез); Б ― ткань секвестра легкого безвоздушна (стрелка), ткань нижней доли левого легкого деформирована, повышенной воздушности (двойная стрелка) (компьютерная томограмма грудной клетки, аксиальный срез); В ― интралобарная секвестрация легкого, аномальный питающий сосуд из грудного отдела аорты (эндофото)
Повторная КТ потребовалась в одном наблюдении при поражении двух долей правого легкого (подробно описано ниже).
Анализ результатов обследования показал высокую информативность МРТисследования мягкотканных и жидкостных образований, коими являются кистозные образования различной локализации и секвестры легкого, в то время как поражения воздушной легочной ткани недоступны тщательному осмотру в магнитнорезонансных режимах, в этих случаях диагностическая ценность КТ не вызывает сомнений. Вместе с тем существуют ограничения к применению рентгеновских методов, в первую очередь речь идет о неблагоприятном влиянии лучевой нагрузки на развивающийся организм. Поэтому скрининговое УЗИ органов грудной полости становится важным диагностическим звеном в выборе дальнейшей тактики обследования пациента. При выявлении признаков экстралобарного расположения секвестра легочной ткани, особенно в комбинации с другими жидкостными или мягкотканными образованиями, для дальнейшей диагностики рекомендуется применять МРТ, при обнаружении связи очага с аэрированной легочной тканью — КТ. В редких случаях нужно выполнение обеих процедур по индивидуальным показаниям.
Показаниями к хирургическому вмешательству при подтверждении врожденного порока легочной ткани являются признаки дыхательной недостаточности. Операции произвели всем 13 детям с сочетанными пороками развития. Объем хирургической помощи определяли индивидуально на основании проведенного обследования, клинической картины заболевания и интраоперационной картины. Девочке с КАМЛ верхней и нижней долей правого легкого хирургическое лечение выполнено в два этапа торакотомным доступом. На первом этапе произведена верхняя лобэктомия после первичного КТ в связи с типичными изменениями ткани и клинической картиной синдрома внутригрудного напряжения и компрессии средней и нижней долей правого легкого. В периоде реконвалесценции на фоне прогрессирующей дыхательной недостаточности по результатам повторной КТ обнаружены характерные для КАМЛ кистозные элементы в ткани нижней доли правого легкого, выполнена нижняя лобэктомия.
В остальных наблюдениях проведено одноэтапное хирургическое лечение комбинации пороков. Пороки развития костей скелета в большинстве своем не подлежат хирургической коррекции в раннем детском возрасте, пациентам с КАМЛ производили лобэктомию порочной доли легкого. При сочетании КАМЛ и интралобарного секвестра легкого делали перевязку аномального сосуда и лобэктомию пораженной доли. В 2 наблюдениях этап перевязки аномального сосуда выполнен эндоскопическим доступом, а лобэктомия — традиционным торакотомным, в других 2 случаях все этапы осуществлены видеоторакоскопически (рис. 3В).
У мальчика с экстралобарным секвестром и КАМЛ нижней доли легкого секвестр был удален, вмешательство же на легком не выполняли в связи с небольшими размерами патологических очагов повышенной воздушности и отсутствием кистозных элементов в их составе, что исключало высокий риск развития осложнений и позволило продолжить консервативное наблюдение за ребенком.
Особого внимания заслуживает сочетание КАМЛ и ВПС. Атрезия трикуспидального клапана — редкий порок «синего» типа, при котором особенности гемодинамики единственного желудочка сердца обусловливают повышенную нагрузку на сосуды малого круга кровообращения. У пациента с атрезией трикуспидального клапана без стеноза легочной артерии наблюдали КАМЛ верхней доли левого легкого больших размеров, плотной, практически безвоздушной структуры, занимающую более 2/3 объема левой плевральной полости. В условиях нарастания сердечной недостаточности с помощью консервативной терапии ребенок был подготовлен к удалению безвоздушного участка легкого, усугублявшего недостаточность кровообращения. Выполнена верхняя лобэктомия торакоскопическим путем, которая позволила улучшить гемодинамику малого круга кровообращения и на фоне консервативной терапии подготовить ребенка к этапной кардиохирургической коррекции порока сердца.
Дупликационная киста желудка у пациента с экстралобарным секвестром легкого удалена одноэтапной операцией дополнительным разрезом диафрагмы и вылущиванием оболочек кисты из стенки желудка (рис. 2В).
Видеоторакоскопическая гофрирующая пластика диафрагмы при истинной диафрагмальной грыже была дополнена удалением секвестра легкого в двух наблюдениях (рис. 1В). У одного ребенка с ложной ВДГ секвестр легкого стал интраоперационной находкой, выполнена его резекция в рамках основной эндоскопической операции.
Всего у 13 младенцев произведены 14 операций с учетом этапного лечения, при этом исключительно эндоскопическим доступом — 10. Течение послеоперационного периода — гладкое во всех наблюдениях, по данным катамнеза, который к настоящему времени составляет от 2 месяцев до 8 лет, рост и развитие пациентов в отдаленные сроки не страдают. Морфологическое подтверждение диагноза получено во всех случаях.
Хирургическая коррекция комбинированных врожденных пороков развития легких требует индивидуального подхода к определению сроков и объема операции. Консервативное наблюдение осуществляется при небольших размерах очага без крупных кистозных полостей и риска развития осложнений. При выборе схемы хирургической помощи предпочтение следует отдавать одноэтапной коррекции, если таковая представляется возможной. В клинически сложных случаях необходимо принятие этапных решений на основании клинической картины и результатов обследования пациента.
ЗАКЛЮЧЕНИЕ
Врожденные пороки развития легочной ткани относятся к редким, в большинстве случаев изолированным заболеваниям. Их сочетания, а также комбинации с аномалиями развития других органов встречаются крайне редко, по нашим наблюдениям, у 11,7%. УЗИ плевральных полостей является ценным скрининговым диагностическим методом, на основании результатов которого можно дифференцированно подходить к выбору оптимального метода окончательной визуальной диагностики. Современные технические возможности обеспечивают точную диагностику с выявлением особенностей кровоснабжения патологического очага. Видеоторакоскопический доступ предпочтителен в хирургическом лечении сложных комбинированных пороков развития легких, поскольку в подавляющем большинстве случаев позволяет выполнить их одноэтапную эффективную коррекцию.








