На современном этапе мастопатию следует рассматривать как фоновое заболевание для развития рака молочных желез. Только ранняя диагностика нераковых болезней молочных желез на стадии диффузного гиперпластического процесса, патогенетическая терапия, а также наблюдение за такими пациентками позволяют реализовать профилактические меры в отношении рака молочной железы. Пока же страшной реальностью является тот факт, что рак молочных желез занимает первое место в структуре онкологической заболеваемости и смертности женщин России. Доброкачественные заболевания молочных желез выявляются у 25% женщин в возрасте до 30 лет и у 60% пациенток старше 40 лет. Наиболее часто наблюдается диффузная форма доброкачественной дисплазии молочных желез (ДДДМЖ), составляющая 60–80% от числа всех болезней молочных желез в женской популяции[1, 8, 10].
Проблемы подтверждения наличия или отсутствия ДДДМЖ, правильной интерпретации полученных клинико-анамнестических, лабораторных и эхоскопических данных, а также определения формы мастопатии у конкретной пациентки остаются актуальными и в настоящее время. Они ежедневно возникают у многих специалистов (гинекологов, онкологов, врачей ультразвуковой диагностики).
С 2007 г. выявление и лечение доброкачественных заболеваний молочных желез входят в обязанности специалиста акушера-гинеколога[5–7]. Однако при практической реализации этого возникают определенные затруднения.
Основой для выявления заболеваний молочных желез являются методы лучевой диагностики. Именно гинеколог должен выбрать дифференцированную тактику: ежегодное наблюдение, лечение диффузных форм мастопатии или направление к онкологу при выявлении узловых форм заболевания и/или рака молочных желез[11, 13]. Для выбора правильной тактики наиболее удобный и доступный диагностический метод — УЗИ. Однако на современном этапе существуют трудности, касающиеся интерпретации сонографических характеристик клинических форм диффузной мастопатии различными авторами[4, 9, 12]. В связи с этим назрела необходимость создания и использования в практической медицине алгоритмов с целью получения диагностических коэффициентов (ДК) согласно современным требованиям доказательной медицины[2].
Цель исследования: разработка математической модели ультразвуковой диагностики ДДДМЖ.
МАТЕРИАЛЫ И МЕТОДЫ
В рамках целевой межведомственной научно-практической программы «Здоровье женщины» — совместного проекта Сибирского государственного медицинского университета, НИИ фармакологии и регенеративной медицины им. Е. Д. Гольдберга (Томск), НИИ психического здоровья, г. Томск (руководитель программы — профессор Л. С. Сотникова), — в 2009–2012 гг. обследованы 269 женщин репродуктивного возраста. Средний возраст пациенток — 30,4 ± 0,3 года. Основную группу составили 223 женщины, имевшие в соответствии с клинико-рентгенологической классификацией Н. И. Рожковой (1993) диагноз ДДДМЖ. Заболевание молочных желез верифицировали при помощи УЗИ с использованием линейного датчика 14 МГц с применением цветового и энергетического доплеровского картирования в первую фазу менструального цикла (5–10-й день). пациенткам старше 35 лет дополнительно выполняли рентгенологическую маммографию.
Полученные эхографические показатели позволили разделить пациенток с ДДДМЖ на четыре клинические группы: в первую группу (n = 93) вошли женщины с ДДДМЖ с преобладанием железистого, во вторую (n = 69) — кистозного, в третью (n = 33) — фиброзного компонента; участницы четвертой группы (n = 28) имели смешанную форму ДДДМЖ. Контрольную группу составили 46 практически здоровых женщин без соматических и гинекологических заболеваний, сопоставимых с участницами основных групп по возрасту.
Статистический анализ данных осуществляли при помощи пакета программ Statistica 6.0 (StatSoft, США). Для обработки результатов обследования использовали анализ вариационных рядов методами описательной статистики с вычислением медианы (Ме) и верхнего и нижнего квартилей. Качественные признаки оценивали путем вычисления абсолютных и относительных частот. Анализ различий по количественным признакам выполняли методами множественного сравнения независимых групп (ANOVA Краскела — Уоллеса) и методами сравнения двух независимых групп (U-тест Манна — Уитни). Для изучения связей между признаками применяли корреляционный анализ Кенделла. Разницу между значениями считали статистически значимой при p < 0,05.
Для оценки индивидуальных особенностей пациенток был реализован алгоритм неоднородной последовательной процедуры распознавания (цит. по[3]).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Для решения задач диагностики с помощью неоднородной последовательной процедуры распознавания из участниц основных групп были сформированы обучающая (n = 135) и тестовая (n = 88) выборки. Для обучающей выборки в ходе исследования были получены ДК применительно к каждому из возможных состояний («больна», «здорова») с использованием выражения следующего вида (по четырем формам ДДДМЖ):
где
xij — значимые для диагностики заболевания независимые (имеющие слабую связь) признаки, характеризующие состояние организма женщины, i — индекс диапазона, j — индекс признака;
А1 — наличие заболевания в каждом конкретном случае;
А2 — отсутствие данного заболевания;
P — условная вероятность;
P(xij /А1) — вероятность события xij при условии наступления события А1;
P(xij/А2) — вероятность события xij при условии наступления события А2.
Из всех признаков xij была построена последовательность, в которой они располагались в порядке убывания информативности. Впоследствии признаки, имевшие низкую информативность, были исключены из построенной последовательности. Информативность признаков определяли с помощью информационной меры Кульбака.
Для каждой формы ДДДМЖ по ДК с учетом информативности признаков были получены решающие правила. Качество распознавания с использованием диагностических таблиц проверяли на тестовой выборке женщин.
Формула для принятия решения о наличии или отсутствии заболевания у женщин тестовой выборки имеет следующий вид:
ДКпор(А2) < ДК(x1) + ДК(x2) + ... + ДК(xn) < ДКпор(А1), (2)
где
α — ошибка первого рода (ошибка пропуска состояния А1);
β — ошибка второго рода (ошибочная диагностика состояния А1).
Примем допустимыми ошибку первого рода α = 0,05 и ошибку второго рода β = 0,1 при установленных нами значениях допустимых ошибок ДКпор(А1) = 10; ДКпор(А2) = –12,5.
Как только неравенство (2) нарушается, т. е. достигается один из порогов, процедуру прерывают и выносят одно из диагностических решений. При достижении ДКпор(А1) выносится решение о наличии состояния А1, при достижении ДКпор(А2) — состояния А2. Если не достигнут ни один из порогов, это значит, что имеющейся информации недостаточно для принятия решения.
Полученные с помощью неоднородной последовательной процедуры распознавания диагнозы для женщин тестовой группы сопоставляли с клиническими данными, затем определяли количество правильно и неправильно принятых решений. Анализ полученных результатов показал, что отношение рисков составляет 0,3–0,7 при 95%-м ДИ, а построенные диагностические таблицы позволяют получить дополнительную информацию для повышения качества диагностики и прогнозирования заболевания.
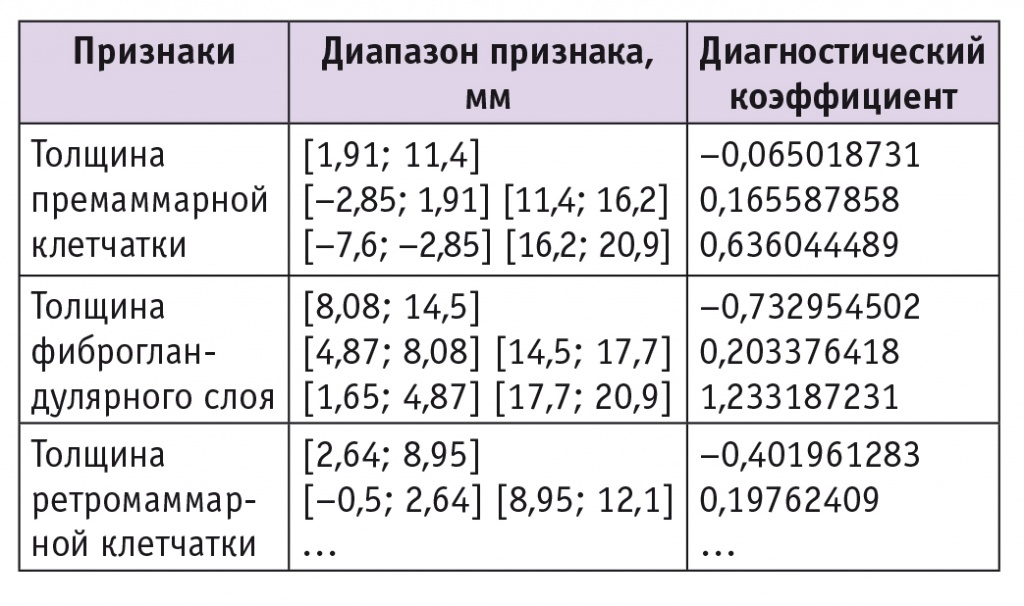
Эхоскопически при ДДДМЖ с преобладанием железистого компонента (первая группа) у пациенток отмечали увеличение толщины фиброгландулярного слоя до 19,2 ± 6,7 мм со средней или пониженной эхогенностью, уменьшение толщины премаммарной клетчатки (в среднем до 3,5 ± 5,4 мм) и ретромаммарного слоя (в среднем до 1,9 ± 2,4 мм). Дуктэктазия встретилась лишь у 7,5% пациенток первой группы. При проведении доплерографии нами выявлено увеличение количества сосудов и скорости кровотока. Средние значения скорости кровотока: Vmax = 0,16 (0,15–0,17) м/с, Vmin = 0,06 (0,05–0,07) м/с. Индекс резистентности составил 0,6 (0,5–0,7), пульсационный индекс — 1,13 (1,11–1,15).
На основании вышеприведенной формулы определения вероятности наличия у пациентки ДДДМЖ с использованием неоднородной последовательной процедуры распознавания были получены диапазоны значений и ДК признаков, которые характерны для ДДДМЖ с преобладанием железистого компонента (табл. 1). Полученные решающие правила в виде диагностических таблиц для диагностики ДДДМЖ с преобладанием железистого компонента обеспечивают качество распознавания 94%.
Таблица 1
Признаки, значимые для диагностики доброкачественной диффузной дисплазии молочных желез с преобладанием железистого компонента
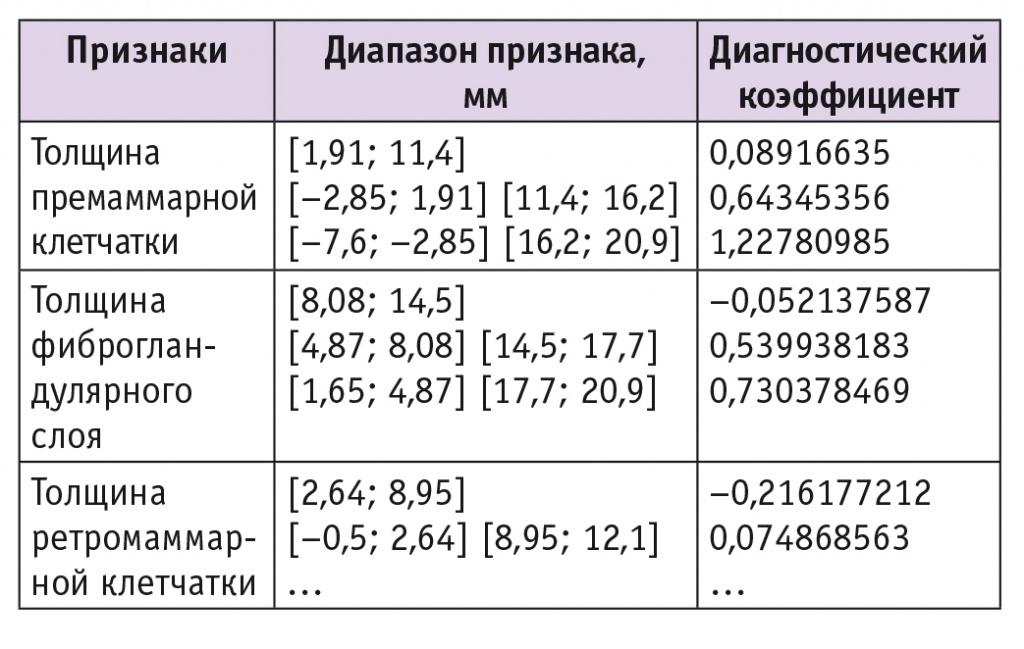
При ДДДМЖ с преобладанием кистозного компонента (вторая группа) у всех пациенток определяли кисты, средний размер которых составил 5 ± 3,4 мм. В большинстве случаев кисты были обнаружены в обеих железах (88,4%), у 11,6% женщин — в одной из желез. Толщина железистого слоя была увеличена у 76,8% пациенток и составила в среднем 12,3 ± 3,8 мм, что статистически значимо ниже, чем при железистом варианте ДДДМЖ (r = 0,73; р < 0,05). Во второй группе также был отмечен более выраженный перидуктальный фиброз, а у 33,3% пациенток выявлено расширение млечных протоков. Анализ измеренных доплерографически показателей кровотока при ДДДМЖ с преобладанием кистозного компонента не выявил статистически значимых отличий от участниц первой группы.
Нами были получены диапазоны значений и ДК признаков, характерных для ДДДМЖ с преобладанием кистозного компонента (табл. 2). Качество распознавания — 87%.
Таблица 2
Признаки, значимые для диагностики доброкачественной диффузной дисплазии молочных желез с преобладанием кистозного компонента
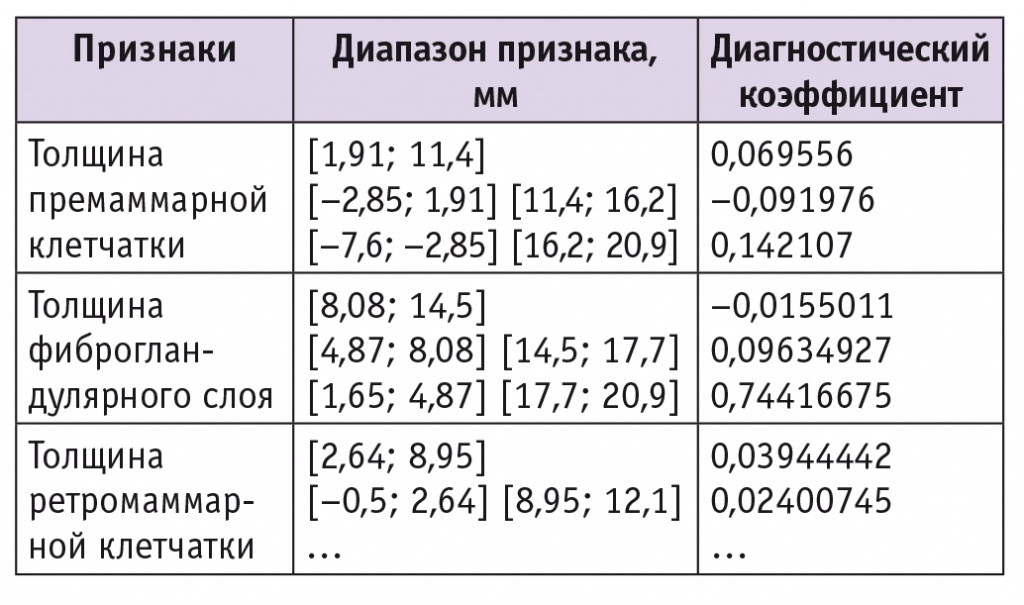
Характерными признаками ДДДМЖ с преобладанием фиброзного компонента (третья группа) оказались резкое повышение эхогенности железистой ткани, наличие перидуктального фиброза и фиброзирование связок Купера. При этом толщина фиброгландулярного слоя составила 12,4 ± 4,2 мм, что статистически значимо не отличалось от значений у женщин контрольной группы. Сравнительный анализ показал, что в третьей группе степень увеличения толщины железистой ткани была существенно меньше, чем в первой группе (r = 0,81; р < 0,05), а сам показатель статистически значимо не отличался от такового у пациенток второй группы (r = 0,47; р > 0,05). В третьей группе отмечено статистически значимое увеличение толщины пре- и ретромаммарной клечатки — до 8,4 ± 4,7 и 5,0 ± 4,2 мм соответственно. Дуктэктазия выявлена нами у 66,7% женщин — чаще, чем в первой и второй группах (r = 0,76; р < 0,05). Оценка показателей кровотока при ДДДМЖ с преобладанием фиброзного компонента не показала статистически значимых отличий от таковых при других вариантах ДДДМЖ.
Диапазоны значений и ДК признаков, характерных для ДДДМЖ с преобладанием фиброзного компонента, представлены в таблице 3. Примененный для диагностики алгоритм с использованием неоднородной последовательной процедуры распознавания обеспечивает качество распознавания 84%.
Таблица 3
Признаки, значимые для диагностики доброкачественной диффузной дисплазии молочных желез с преобладанием фиброзного компонента
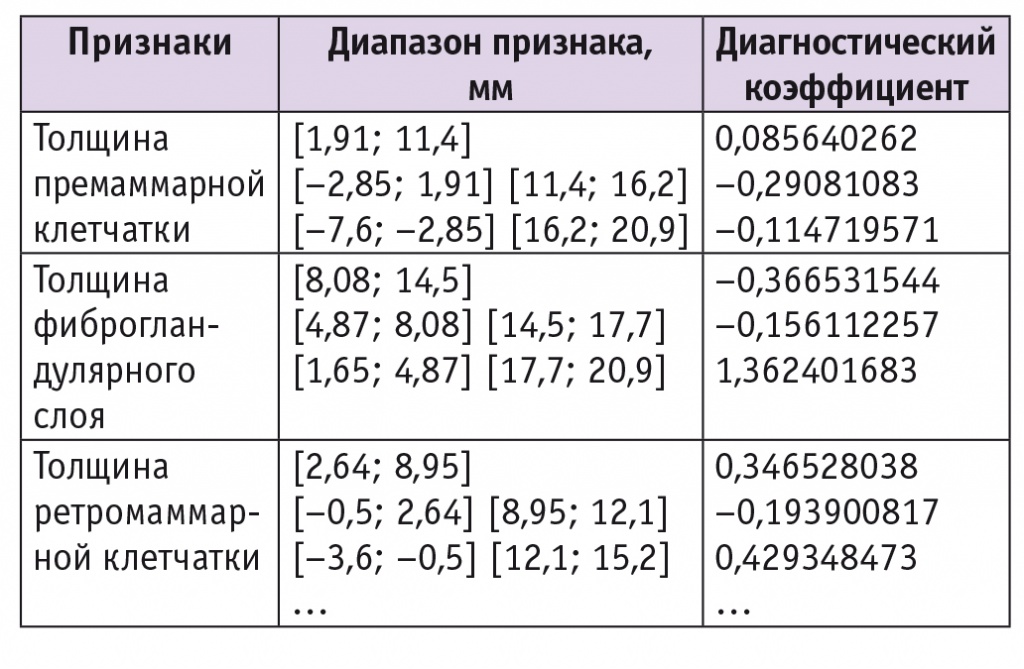
Признаками смешанной формы ДДДМЖ (четвертая группа), наряду с увеличением толщины фиброгландулярной ткани до 16,2 ± 6,4 мм, неоднородным повышением эхогенности железистого слоя, наличием перидуктального фиброза и фиброзированием связок Купера, послужили кисты различных размеров. В 78,6% наблюдений кисты были найдены в обеих железах. Дуктэктазия была обнаружена у 50,0% пациенток — чаще, чем в трех других группах исследования (r = 0,76; р < 0,05). Анализ показателей кровотока при данной форме не выявил статистически значимых отличий от других вариантов ДДДМЖ.
При определении вероятности возникновения смешанной формы ДДДМЖ с использованием неоднородной последовательной процедуры распознавания были получены диапазоны значений и ДК признаков, характерных для смешанной формы ДДДМЖ (табл. 4). Отношение рисков для данных значений составило 0,6 при 95%-м ДИ; качество распознавания — 78,6%.
Таблица 4
Признаки, значимые для диагностики смешанной формы доброкачественной диффузной дисплазии молочных желез
Разработанная математическая модель не только позволяет просто и объективно диагностировать форму ДДДМЖ в любом возрасте с применением метода УЗИ, но и дает возможность оценивать эффективность проводимых лечебных мероприятий с позиций доказательной медицины (патент № 2452389 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией» от 10.06.2012). При этом значимыми критериями оценки эффективности являются не только клинические симптомы, но и определенные объективные эхографические показатели (толщина премаммарной и ретромаммарной клетчатки и фиброгландулярного слоя).
ЗАКЛЮЧЕНИЕ
В результате исследования разработана математическая модель для ультразвуковой диагностики и объективной оценки эффективности терапии диффузной доброкачественной дисплазии молочных желез, позволяющая вывести на качественно новый уровень раннюю профилактику рака молочных желез. Использование принципов доказательной медицины дает возможность определить диагностический алгоритм и диагностические коэффициенты для каждой конкретной формы заболевания. Полученные решающие правила в виде диагностических таблиц обеспечивают качество распознавания 78,6–94% и позволяют получить адекватные научные и практические выводы, существенно ускоряющие и облегчающие работу медицинского персонала.








