Рак шейки матки (РШМ) является одной из распространенных злокачественных опухолей у женщин. В настоящее время это заболевание занимает 6е место в структуре онкологической патологии у женщин и 3е место среди опухолей репродуктивных органов. По данным ракового регистра, в Российской Федерации в 2015 г. отмечен прирост стандартизированных показателей заболеваемости РШМ на 21,9%.[1]. При этом в структуре заболеваемости ранние стадии рака (IA–IIA) составляют 58%[2].
Цель исследования: оценить эффективность флуоресцентного метода (ФМ) детекции сигнальных лимфатических узлов (СЛУ) c использованием индоцианин зеленого (indocianine green, ICG) у больных РШМ.
МАТЕРИАЛЫ И МЕТОДЫ
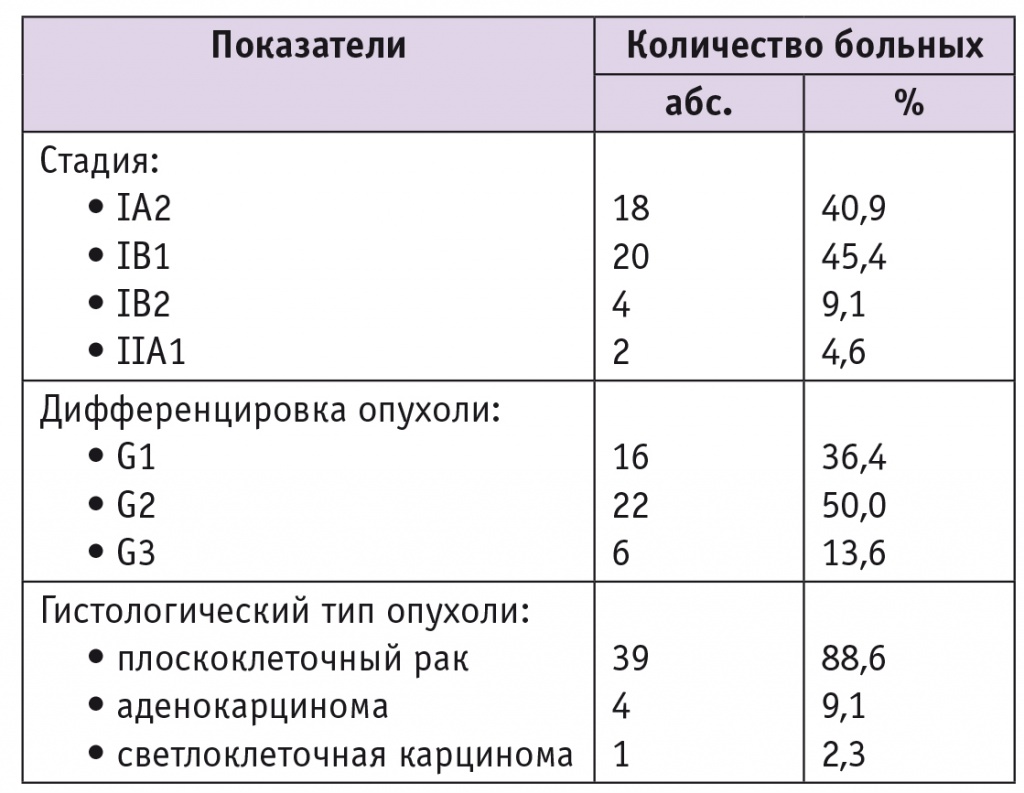
С марта 2015 по ноябрь 2017 г. проанализированы результаты обследования и лечения в хирургическом онкогинекологическом отделении Национального медицинского исследовательского центра онкологии им. Н. Н. Петрова 44 больных с морфологически верифицированным диагнозом РШМ с клинически установленными стадиями IA2, IB1–IIA1 по классификации International Federation of Gynecology and Obstetrics (FIGO) 2011 г. Клиникоморфологическая характеристика больных РШМ представлена в таблице. Возраст участниц исследования — 30–75 лет (в среднем — 44,9 года). Индекс массы тела — 20–40 (26,35) кг/м2. Размеры лимфоузлов ≤ 10 мм.
Таблица
Клиническая и морфологическая характеристика больных раком шейки матки (n = 44)
Эндовидеохирургические операции выполнены с применением видеокамеры высокого разрешения, инструментов стандартной длины, маточного манипулятора и видеокамеры с прямой оптикой. После ревизии брюшной полости СЛУ определены методом флуоресценции с использованием ICG и эндовидеохирургического комплекса с функцией ближнего инфракрасного свечения (NIR). ФМ с ICG заключается в эффекте флуоресценции в ближнем инфракрасном спектре при освещении 806 нм, передающемся с помощью специальной камеры в видеоизображения в видимом спектре света.
Тридцать семь пациенток были прооперированы в объеме лапароскопической нервосберегающей радикальной гистерэктомии (Piver III типа) с тазовой лимфаденэктомией, 6 — в объеме лапароскопической радикальной гистерэктомии с расширенной параметрэктомией, тазовой и парааортальной лимфаденэктомией до уровня почечных сосудов, одна больная — в объеме лапароскопической радикальной трахелэктомии с тазовой лимфаденэктомией. Все операции проведены с соблюдением правил абластики с эвакуацией удаленных СЛУ через специальный эндоскопический контейнер, который удалялся через 11 мм порт, установленный в области левого подреберья. Остальные лимфоузлы и препарат удаляли в специальных эндоскопических контейнерах через влагалище с лапароскопическим ушиванием культи.
У 13 женщин произведена транспозиция яичников.
Критериями исключения из исследования являлись:
- клинические стадии РШМ > IIA1;
- инвазия в параметрии по МРТ малого таза (IIB);
- выявленные при МРТ увеличенные забрюшинные лимфоузлы > 10 мм и их структурные изменения;
- наличие в анамнезе хирургического и/или лучевого лечения;
- противопоказания к хирургическому лечению.
Больные были обследованы в стандартном порядке по протоколу, одобренному локальным Этическим комитетом при НМИЦ онкологии им. Н. Н. Петрова. Все пациентки подписывали информированное согласие на участие в исследовании по детекции СЛУ ФМ.
Участницам проводили гинекологический осмотр, патоморфологическую верификацию биоптата опухоли шейки матки, УЗИ органов брюшной полости и малого таза, МРТ органов малого таза с внутривенным контрастированием, КТ органов брюшной полости и грудной клетки. По показаниям выполнялись фиброколоноскопия и цистоскопия.
Всем больным эндовидеохирургическая операция произведена под эндотрахеальным наркозом.
Техника операции. Первый троакар (10 мм) устанавливался параумбиликально, через него вводился лапароскоп. Далее слева и справа в гипогастральных областях устанавливались 5 мм троакары и один 5 мм троакар — в надлобковой области. После ревизии органов брюшной полости и малого таза проводилось коагулирование трубноматочных углов. Перед введением в полость матки атравматического маточного манипулятора ICG (25 мг препарата, разведенного в 10 мл воды для инъекции) веден в строму шейки матки на глубину 1 см на 3м и 9м часах условного циферблата по 5 мл в каждой точке. После этого лапароскопическим доступом с обеих сторон производилось рассечение брюшины с вскрытием параметриев для визуализации групп общих, наружных, внутренних и обтураторных лимфоузлов. Через 5–10 минут после введения препарата ICG видеокамера переключалась в инфракрасный режим (режим ICG) для определения топографии лимфоузлов (рис. 1).
Рис. 1. Выявленный сигнальный лимфатический узел (указан стрелкой) справа во внутренней группе лимфоузлов: А — в обычном и в инфракрасном режиме; Б — в обычном режиме. Фото авторов
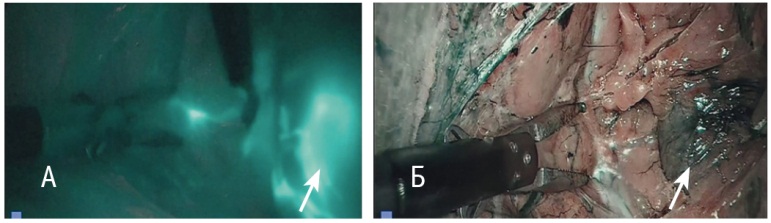
Сигнальными считались те узлы, которые первыми окрашивались после введения ICG. В большинстве случаев окрашивание происходило в течение 3–10 минут. Производилось удаление СЛУ с обеих сторон, далее они помещались в специальный эндоскопический контейнер, удалялись из брюшной полости через 11 мм порт, установленный в левом подреберье и в дальнейшем отправлялись на срочное интраоперационное гистологическое исследование. После получения результата срочного гистологического заключения СЛУ интраоперационно решался объем хирургического вмешательства. У 6 женщин объем параметрэктомии и лимфаденэктомии был увеличен до радикальной гистерэктомии с расширенной параметрэктомией, тазовой и парааортальной лимфаденэктомией до уровня почечных сосудов.
При отсутствии одностороннего или двустороннего окрашивания СЛУ производилась радикальная гистерэктомия с тазовой лимфаденэктомией.
РЕЗУЛЬТАТЫ
При использовании ФМ с ICG количество случаев выявления СЛУ составило 43 (97,7%), количество случаев двустороннего выявления СЛУ — 34 (77,3%). Только у одной (2,3%) больной СЛУ не был обнаружен.
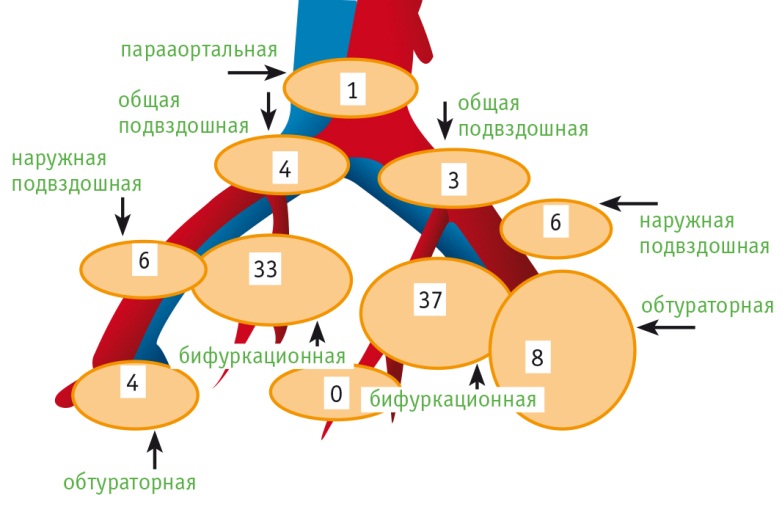
Суммарно у 44 больных найдены 102 СЛУ (справа — 50, слева — 51 и 1 СЛУ в парааортальной зоне) (медиана — 2,31).
В большинстве случаев (68,6%) СЛУ локализовались во внутренней группе лимфоузлов, ближе к бифуркации подвздошных сосудов. В обтураторной ямке обнаружены 4 СЛУ справа и 8 слева, во внутренней группе у бифуркации подвздошных сосудов — 33 справа и 37 слева, в области наружной подвздошной артерии — справа и слева по 6 СЛУ, в области общих подвздошных сосудов — 4 справа и 3 слева. В одном случае СЛУ находился в парааортальной зоне, а именно в аортокавальной группе. В одном случае при детекции ФМ с использованием ICG выявлены 5 СЛУ: 3 слева, 1 справа и 1 в парааортальной зоне (рис. 2).
Рис. 2. Топография и количество сигнальных лимфатических узлов, выявленных флуоресцентным методом
Если по результатам срочного патогистологического исследования данных за метастатическое поражение СЛУ не было, операцию выполняли в объеме радикальной нервосберегающей пангистерэктомии с тазовой лимфаденэктомией.
Метастатически пораженные СЛУ обнаружены только у 6 (13,6%) пациенток, в 2 случаях метастатическое поражение наблюдалось у женщин, получивших неоадъювантную химиотерапию в связи с клинической установленным РШМ стадии IB2. У остальных 4 пациенток метастатическое поражение отмечено при клинически установленной стадии IB1.
У одной (2,3%) участницы найден метастатически пораженный лимфатический узел, который не был выявлен ФМ и не являлся сигнальным.
Таким образом, из 44 больных у 7 (15,9%) были метастазы в тазовых лимфоузлах.
При обнаружении метастаза в СЛУ выполнялась лапароскопическая радикальная гистерэктомия с расширенной параметрэктомией, тазовой и парааортальной лимфаденэктомией до уровня почечных сосудов. У участниц с выявленными метастазами в тазовых лимфатических узлах в удаленных парааортальных лимфатических узлах метастазов не было.
Кроме того, одной молодой пациентке с РШМ IB1 стадии с отсутствием метастазов в СЛУ выполнена органосохраняющая операция — лапароскопическая радикальная трахелэктомия с тазовой лимфаденэктомией.
Необходимо отметить, что, по данным МРТ с внутривенным контрастированием, в 10 (22,7%) наблюдениях при размерах лимфоузлов 8–10 мм было высказано предположение об их метастатическом поражении, что имело патоморфологическое подтверждение только у 6 женщин.
У 22 (50,0%) больных биопсия опухоли выполнялась методом диатермоэлектроконизации (ДЭК) шейки матки для уточнения диагноза. Перенесенная ДЭК не препятствовала проникновению контраста через ткань шейки матки и детекции СЛУ у 21 (95,4%) из 22 женщин.
Четырем пациенткам было проведено по 3 курса неоадъювантной химиотерапии по схеме AP (доксорубицин и цисплатин) в дозоинтенсивном режиме при клинических стадиях T1b2. В первом случае был выявлен 1 СЛУ, у двух больных имела место двусторонняя детекция СЛУ, у одной больной СЛУ не найдены.
При введении препарата ICG аллергических реакций или побочных эффектов не было.
ОБСУЖДЕНИЕ
Основными прогностическими факторами при ранней стадии РШМ являются размеры опухоли, глубина стромальной инвазии, гистологический тип, ее дифференцировка, наличие лимфоваскулярной инвазии и метастазов в лимфатических узлах. Метастатическое поражение лимфатических узлов — наиболее неблагоприятный фактор прогноза у больных РШМ, увеличивающий частоту рецидивов и тем самым влияющий на выживаемость. В то же время установлено, что у пациенток с РШМ IA и IB стадий частота метастазирования в лимфатических узлах — 0–16% и 15–31% соответственно[3, 4].
Исследованиями M. Frumovitz и соавт. и J. Kodama и соавт. (2009, 2011) подтверждено, что при величине опухоли не более 2 см вовлеченность параметриев в процесс при стадиях IA2 и IB1 — 0–7,7% и 4–14%[5, 6].
Диагностика поражения лимфатических узлов при РШМ в основном базируется на данных, предоставляемых КТ и МРТ. В то же время данные КТ и/или МРТ обладают низкой специфичностью в связи с тем, что интерпретация состояния пораженных лимфоузлов основывается в основном на описании их размеров и структурных изменений, что часто приводит к ложноотрицательным или ложноположительным результатам. Это объясняется тем, что единственным достоверным критерием метастатического поражения лимфоузлов при КТ и МРТ является обнаружение увеличенных лимфоузлов более 0,8 см и/или изменение их структуры[7].
Стандартный метод лечения ранних форм РШМ — хирургический в объеме радикальной гистерэктомии с тазовой лимфаденэктомией[8].
Установлено, что вовлечение лимфатических узлов происходит приблизительно у 12–22% больных РШМ ранних стадий, и становится очевидным, что при начальных стадиях радикальность операций значительно превосходит необходимую[9, 10]. Более того, анализ данных многочисленных отечественных и зарубежных исследований показал высокую частоту осложнений у больных, перенесших лимфаденэктомию, как то: кровотечение, нейрососудистые травмы, инфекция, лимфостаз, лимфорея, лимфокисты[11].
В 1977 г. R. M. Cabanas впервые обосновал концепцию детекции СЛУ[12]. СЛУ представляет собой первый лимфоузел, к которому оттекает лимфа от злокачественной опухоли. Методика детекции позволяет найти первый лимфатический узел, дренирующий опухоль.
Биопсия СЛУ является диагностическим методом, используемым для целевого определения вовлеченности первого лимфатического узла в опухолевый процесс, что немаловажно для планирования дальнейшей тактики лечения.
У больных раком молочной железы, вульвы и меланомой биопсия СЛУ стала стандартной процедурой в диагностике и терапии[13–16].
В настоящее время растет интерес к определению СЛУ при РШМ и раке эндометрия как в диагностических целях, так и для планирования дальнейшего лечения.
Использование красителей в детекции СЛУ при РШМ сильно эволюционировало. После того как впервые были получены неудовлетворительные результаты с применением только красителя метиленовый синий (methylene blue), методика выявления СЛУ значительно улучшилась — стали применять комбинацию синего красителя с радиофармпрепаратами[17].
При РШМ использование радионуклидного метода для определения СЛУ заключается в предоперационной инъекции в строму шейки матки радиоактивного препарата с последующим проведением ОФЭКТ/КТ, а также интраоперационным применением γсканера. В большинстве случаев используется радиоколлоид Тс99, который способен быстро накапливаться в региональных лимфатических узлах и выводится из организма через несколько часов.
Обнаружение СЛУ радионуклидным методом дорого стоит, требует конкретного технического оборудования и междисциплинарного сотрудничества.
Методики с использованием красителей проще, быстрее, дешевле, и весь процесс окрашивания СЛУ выполняется интраоперационно. Существуют несколько типов красителей, из которых наиболее часто применяют изосульфан синий, метиленовый синий и индигокармин. В течение последнего десятилетия с большими перспективами используется флуоресцентный препарат ICG для лимфатического картирования. Вскоре после того, как краситель или флуоресцентный препарат вводится в шейку матки, лимфатические протоки окрашиваются, и через некоторое время визуализируются СЛУ.
По рекомендациям National Comprehensive Cancer Network (2017) и European Association of Nuclear Medicine (2014) по лимфосцинтиграфии и детекции СЛУ, процедура детекции и биопсии СЛУ имеет четко определенное значение при РШМ изза низкого числа ложноотрицательных результатов[18, 19].
ICG представляет собой препарат, который флуоресцирует в ближнем инфракрасном спектре, что наблюдают с помощью специальной флуоресцентной камеры. Доказано, что ICG способствует более частому обнаружению СЛУ, чем другие красители[20–23]. В онкогинекологии ICG используется при раке вульвы, эндометрия и РШМ[24–26].
Детекция СЛУ и его биопсия при РШМ дают возможность уже интраоперационно провести стадирование и уточнить объем выполняемого оперативного вмешательства.
Многочисленные зарубежные исследования, основанные на определении детекции СЛУ тем или иным методом, позволили стандартизировать лечение больных РШМ[27].
По данным зарубежных авторов, алгоритм детекции СЛУ и ведение больных РШМ отличаются от таковых у пациенток со злокачественными опухолями вульвы, тела матки и молочной железы тем, что при обнаружении метастаза в СЛУ радикальная операция считается бесперспективной и производится лишь этап стадирования (тазовая лимфаденэктомия) для оценки распространенности процесса. При обнаружении СЛУ в парааортальной зоне уровень лимфаденэктомии расширяется и производится парааортальная лимфаденэктомия. После стадирования при обнаружении метастатического поражения в СЛУ больные направляются на радикальный курс лучевой терапии с еженедельным введением цисплатина. В случае если метастатическое поражение в СЛУ не обнаруживается, осуществляется радикальное хирургическое вмешательство[27, 28].
В то же время, согласно данным других исследователей, при обнаружении метастатического поражения в СЛУ возможно выполнение более радикальной операции — радикальной гистерэктомии с тазовой и парааортальной лимфаденэктомией[29].
ЗАКЛЮЧЕНИЕ
Определение сигнальных лимфатических узлов (СЛУ) флуоресцентным методом (ФМ) с использованием препарата индоцианин зеленого (indocianine green, ICG) у больных раком шейки матки (РШМ) является эффективным методом диагностики. ФМ с применением препарата ICG для детекции СЛУ позволяет произвести их топическую диагностику, при раннем РШМ — интраоперационно рестадировать заболевание и изменить лечебную тактику.








