Злокачественные новообразования шейки матки представляют собой одну из актуальных проблем здравоохранения. Несмотря на визуальную локализацию, у 40–60% пациенток рак шейки матки выявляется в стадиях IB2–IIIB (International Federation of Gynecology and Obstetrics (FIGO), 2009) [1–3], обозначаемых как местнораспространенные формы заболевания.
За последние десятилетия наметилась неблагоприятная тенденция к омоложению контингента больных злокачественными новообразованиями этой локализации. Так, среди женщин 20–39 лет с 2000 г. на 17% увеличилась заболеваемость раком шейки матки, при этом местнораспространенные формы заболевания встречаются почти в 70% случаев. Летальность в течение первого года с момента установки диагноза составляет примерно 20%, что свидетельствует о поздней диагностике и не всегда хороших результатах лечения таких пациенток[4, 5].
При начальных стадиях рака шейки матки IA1–IB1 (FIGO, 2009) применяется, как правило, радикальное хирургическое вмешательство, пятилетняя выживаемость таких больных превышает 95%[4, 6, 7]. Пациентки с местнораспространенными формами заболевания получают в основном химиолучевую терапию[8, 9]. Технический прогресс и усовершенствование установок для лучевой терапии в настоящее время обеспечивают возможность подведения необходимых доз непосредственно к опухолевому очагу. Тем не менее при местнораспространенном раке шейки матки не всегда удается достигнуть устойчивого выздоровления, количество рецидивов достигает 54–91%. Так, при IIB стадии пятилетняя выживаемость составляет 63,1%, при IIIA — 44,5%, при IIIB — 31,5%. Повышение лучевой нагрузки на ткани приводит к увеличению частоты, тяжести лучевых осложнений и формированию метахронных злокачественных новообразований различных локализаций[10–12].
В связи с неудовлетворительными результатами лечения больных местнораспространенным раком шейки матки на протяжении нескольких десятилетий производится исследование эффективности противоопухолевых лекарственных препаратов при этом заболевании. Показано, что при проведении неоадъювантной химиотерапии в ряде случаев удается достигнуть значительного уменьшения в размерах первичной опухоли и параметральных инфильтратов, что позволяет выполнить радикальную операцию. Наибольшая эффективность при этом отмечена у тех пациенток, которым неоадъювантную химиотерапию проводили с использованием таксанов и производных платины. По данным ряда авторов, применение указанной схемы при местнораспространенном раке шейки матки улучшает отдаленные результаты лечения пациенток, что позволяет позиционировать ее как альтернативу традиционной химиолучевой терапии [13–16].
Определенный интерес представляют также работы по изучению рентгеноангиохирургической инфузии цитостатиков в артериальное русло новообразования в сочетании с эмболизацией питающих его сосудов. Подобные методы в настоящее время широко применяются при первичном и метастатическом раке печени, получены удовлетворительные непосредственные и отдаленные результаты. Авторы указывают, что преимуществами такого подхода являются малая инвазивность, высокая селективность воздействия, возможность введения препаратов непосредственно в артерии, кровоснабжающие опухоль, снижение системных побочных эффектов химиотерапии[17, 18].
При местнораспространенном раке шейки матки результаты применения комплексного лечения с включением неоадъювантной химиотерапии (как внутривенной, так и внутриартериальной инфузии цитостатиков) и радикального хирургического вмешательства описаны лишь отдельными авторами и в отечественной литературе представлены недостаточно полно.
Цель исследования: оценка результатов внутривенной и внутриартериальной химиотерапии и последующего радикального хирургического вмешательства у больных раком шейки матки стадии IIB.
МАТЕРИАЛЫ И МЕТОДЫ
Данная работа представляет собой пилотное исследование, в которое включены 55 больных раком шейки матки стадии IIB (FIGO, 2009), пролеченные в отделении инновационной онкологии и гинекологии ФГБУ «НМИЦ АГиП им. акад. В. И. Кулакова» Минздрава России с 2014 по 2017 г.
У всех пациенток клинический диагноз рака шейки матки был морфологически верифицирован, соответствовал плоскоклеточному ороговевающему и неороговевающему раку по Гистологической классификации опухолей женского полового тракта ВОЗ (1993).
Возраст больных варьировал от 28 до 65 лет, в среднем составляя 38,6 ± 7,5 года.
Алгоритм обследования пациенток включал в себя стандартные клиниколабораторные методы, а также МРТ и ультразвуковое сканирование органов малого таза с определением объема шейки матки.
Стадию рака шейки матки устанавливали согласно критериям FIGO и TNM на основании клинических данных, полученных при физикальном обследовании пациенток. После операции в зависимости от морфологических находок установленную по FIGO стадию не изменяли.
На первом этапе комплексного лечения все больные получали неоадъювантную химиотерапию. В зависимости от способа введения цитостатиков пациентки были разделены на две группы. Основную группу составили 15 женщин, которым проводили внутриартериальную инфузию химиопрепаратов и эмболизацию маточных артерий. В контрольную группу были включены 40 пациенток, которым химиотерапию выполняли с внутривенным введением препаратов.
Пациентки основной группы получили курс неоадъювантной химиотерапии по схеме: 1й день — внутривенная инфузия паклитаксела в дозе 175 мг/м2 и карбоплатина в дозе 0,5 AUC 6 на фоне стандартной премедикации и применения антиэметиков; 2й день — рентгеноэндохирургическая инфузия карбоплатина (в дозе 0,5 AUC 6) в артерии, кровоснабжающие опухоль.
Применяли следующую технику. После пункции правой бедренной артерии устанавливали катетер над бифуркацией брюшной аорты и выполняли серию тазовых артериограмм. После изучения анатомии сосудов осуществляли катетеризацию последовательно левой, а затем правой маточной артерии, в которые вводили болюсно карбоплатин в общей дозировке 0,5 AUC 6, после чего производили эмболизацию указанных сосудов. Непосредственно после завершения процедуры выполняли контрольную ангиографию.
Пациентки контрольной группы получали неоадъювантную химиотерапию по схеме: паклитаксел в дозе 175 мг/м2 в/в капельно на фоне стандартной схемы премедикации, карбоплатин AUC 6 в/в капельно на фоне применения антиэметиков.
Всем участницам с местнораспространенным раком шейки матки на 1м этапе комплексного лечения проводили неоадъювантную химиотерапию в следующем режиме: 1й день — таксаны (паклитаксел) в дозе 135 мг/м2 или доцетаксел в дозе 75 мг/м2 на фоне стандартной схемы премедикации; 2й день — цисплатин в дозе 75 мг/м2 или карбоплатин AUC 5 в/в капельно на фоне антиэметиков. Через 3 недели курс химиотерапии по аналогичной схеме повторяли.
Через 2 недели после введения противоопухолевых лекарственных препаратов оценивали эффективность неоадъювантной химиотерапии, используя клинические методы (осмотр, бимануальное исследование), МРТ и УЗИ. Степень ответа опухоли шейки матки на терапию цитостатиками определяли, учитывая изменение объема новообразования, который вычисляли с применением всех используемых методов визуализации. Полученный результат классифицировали в соответствии с системой критериев Response Evaluation Criteria in Solid Tumours (RECIST) 1.1[19]. Оценивали также токсические реакции и осложнения, возникшие в процессе лечения.
При достаточном уменьшении размеров опухоли и параметральных инфильтратов выполняли хирургическое вмешательство в объеме радикальной экстирпации матки Piver III (тип C2 по классификации Querleu — Morrow)[20, 21] с использованием лапароскопического доступа. После получения патоморфологического описания операционного материала выявляли группы риска по прогрессированию заболевания с применением критериев Российского общества клинической онкологии (RUSSCO)[22], при необходимости пациенток направляли на адъювантную химиолучевую терапию.
При сохранении параметральных инфильтратов, больших размеров опухоли шейки матки хирургическое вмешательство не выполняли, пациенткам проводили химиолучевую терапию по радикальной программе.
РЕЗУЛЬТАТЫ
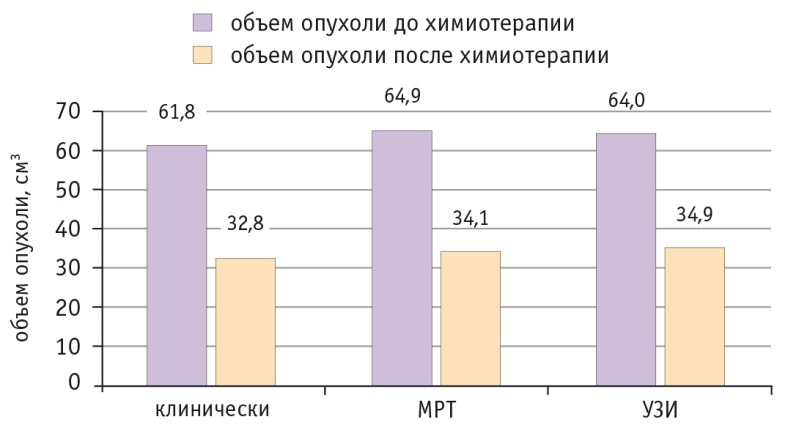
Мы не наблюдали значительные различия в показателях волюметрии опухоли шейки матки, полученных при осмотре и пальпации и при применении лучевых методов исследования (рис. 1, 2).
Рис. 1. Изменение объема опухоли у больных раком шейки матки стадии IIB, которым проводили неоадъювантную химиотерапию с использованием внутривенной инфузии
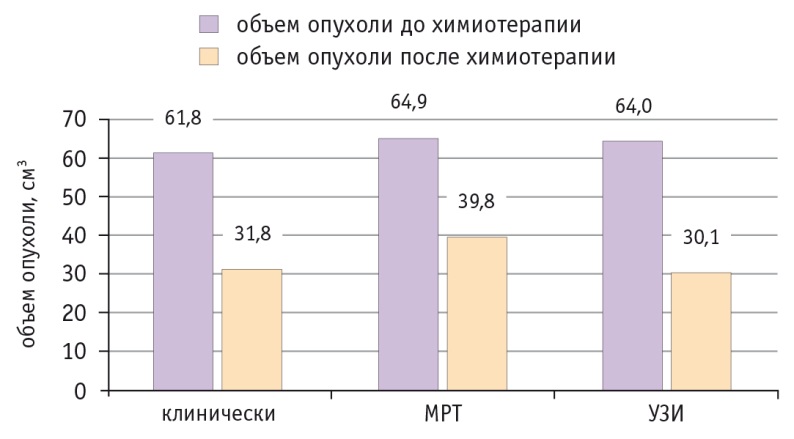
Рис. 2. Изменение объема опухоли у больных раком шейки матки стадии IIB, которым проводили неоадъювантную химиотерапию с использованием внутриартериального введения цитостатиков
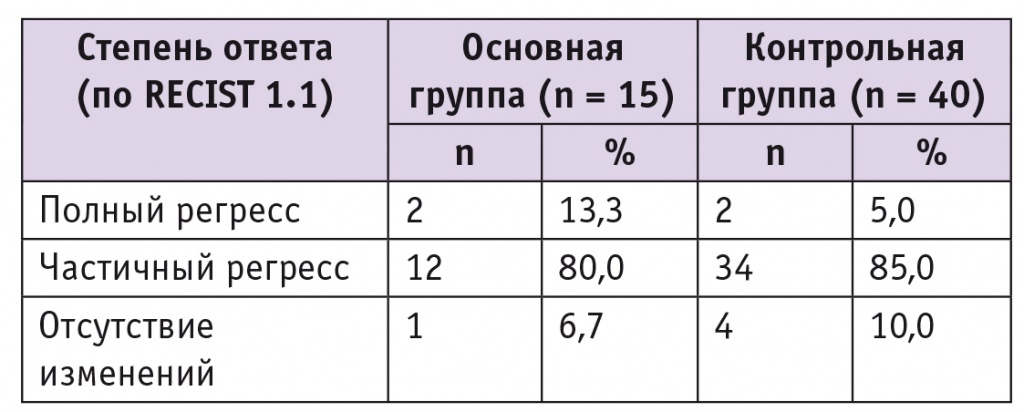
У пациенток обеих групп после неоадъювантной химиотерапии объем новообразования шейки матки уменьшался в среднем почти на 50%, что свидетельствует о достаточно высокой чувствительности опухоли к применяемым цитостатикам (рис. 3). Полный ответ (по RECIST 1.1) отмечен у 4 (7,3%) пациенток, частичный — у 46 (83,6%), отсутствие изменений — у 5 (9,1%). Прогрессирование заболевания на фоне неоадъювантной химиотерапии мы не наблюдали. Не выявлены статистически значимые различия в показателях эффективности неоадъювантной химиотерапии при различных способах введения цитостатиков.
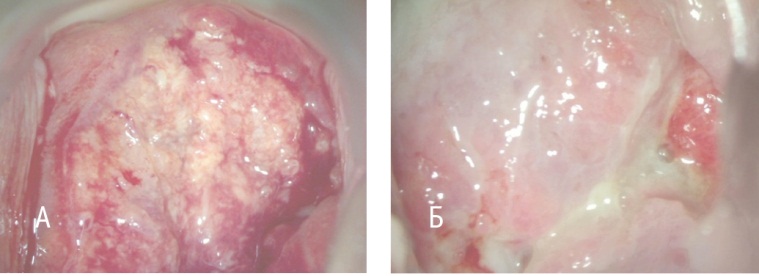
Рис. 3. Опухоль шейки матки: А — до химиотерапии, Б — частичный эффект: та же опухоль после химиотерапии. Фото авторов
Оценка эффективности противоопухолевых лекарственных препаратов в зависимости от способа введения представлена в таблице.
Таблица
Эффективность неоадъювантной химиотерапии
Для оценки степени тяжести токсических реакций применяли шкалу токсичности Common Toxicity Criteria (СТС), разработанную Национальным раковым институтом США[23].
Болевой синдром отмечали у пациенток основной группы в первые сутки после внутриартериального введения противоопухолевых лекарственных средств и эмболизации ветвей внутренней подвздошной артерии. Уровень болевых ощущений при этом не превышал I степени по шкале CTC, введение наркотических препаратов пациенткам не требовалось.
В контрольной группе тошнота зарегистрирована в 95,0% наблюдений, среди пациенток основной группы — в 66,7%. Во всех случаях по шкале токсичности CTC отмечали I–II степень тошноты. Рвота I степени была у 17 больных:у 2 участниц основной группы и 15 контрольной (13,3% и 37,5% соответственно).
Тромбоцитопения I степени установлена у 12,5% пациенток контрольной группы, уровень тромбоцитов ниже 90 × 109/л не наблюдали, проведение специфической терапии не требовалось. У пациенток основной группы тромбоцитопении не было.
Нейтропения I степени (не ниже 2,0 × 109/л) имела место у 13,3% участниц основной и у 17,5% пациенток контрольной группы. Уровень нейтрофилов восстанавливался без применения гемостимулирующей терапии у всех женщин.
Таким образом, исследование гастроинтестинальной, а также гематологической токсичности при проведении неоадъювантной химиотерапии показало хорошую переносимость лечения в обеих группах. Введение противоопухолевых препаратов было выполнено всем пациенткам до индивидуально запланированных доз. Отмечено несколько меньшее количество проявлений гастроинтестинальной и гематологической токсичности после внутриартериального введения химиопрепаратов, однако статистически значимые различия не получены.
При поступлении в стационар жалобы на боли внизу живота зафиксированы у 12 (21,8%) пациенток до начала специального лечения, после первого курса химиотерапии болевой синдром сохранялся у 8 (14,6%) больных, после двух курсов — у 6 (10,9%). Наркотические анальгетики не понадобились ни одной пациентке.
Радикальное хирургическое лечение удалось провести 51 (92,7%) больной: 38 (95,0%) из контрольной и 13 (86,7%) из основной группы. У 13,3% пациенток основной группы и у 5,0% контрольной отмечено недостаточное уменьшение размеров опухоли шейки матки и инфильтратов, радикальное хирургическое вмешательство не выполняли, проведена химиолучевая терапия.
Хирургическое вмешательство осуществляли на 14–18е сутки после неоадъювантной химиотерапии. У всех участниц использовали малоинвазивные видеоэндоскопические технологии в объеме расширенной экстирпации матки Piver III (тип C2). При гистологическом исследовании операционного материала у всех пациенток была обнаружена остаточная ткань новообразования шейки матки с признаками лечебного патоморфоза, по линии резекции параметриев и влагалища опухолевую ткань не выявляли (R0). Метастазы в регионарных лимфоузлах найдены у 46,6% больных основной группы и у 47,5% контрольной группы.
После хирургического лечения пациенток, относившихся к группам высокого и среднего риска прогрессирования заболевания, согласно рекомендациям RUSSCO, направляли для проведения адъювантной лучевой/химиолучевой терапии[22]. В группе больных, которым неоадъювантную химиотерапию проводили с применением внутривенной инфузии цитостатиков, адъювантное лечение потребовалось 57,5%, а среди пациенток, которым выполнили внутриартериальное введение препаратов, — 60,0%. В целом среди больных раком шейки матки стадии IIB, пролеченных с использованием неоадъювантной химиотерапии и радикального хирургического вмешательства, у 37,3% не было показаний к адъювантной лучевой/химиолучевой терапии.
Среднее время наблюдения за пациентками составило 29,7 месяца. В группе больных, которым цитостатики вводили внутриартериально, за это время отмечен один (6,7%) рецидив заболевания. Среди пациенток, которым неоадъювантную химиотерапию выполняли с применением внутривенной инфузии, рецидивы наблюдались у 3 (7,5%) женщин.
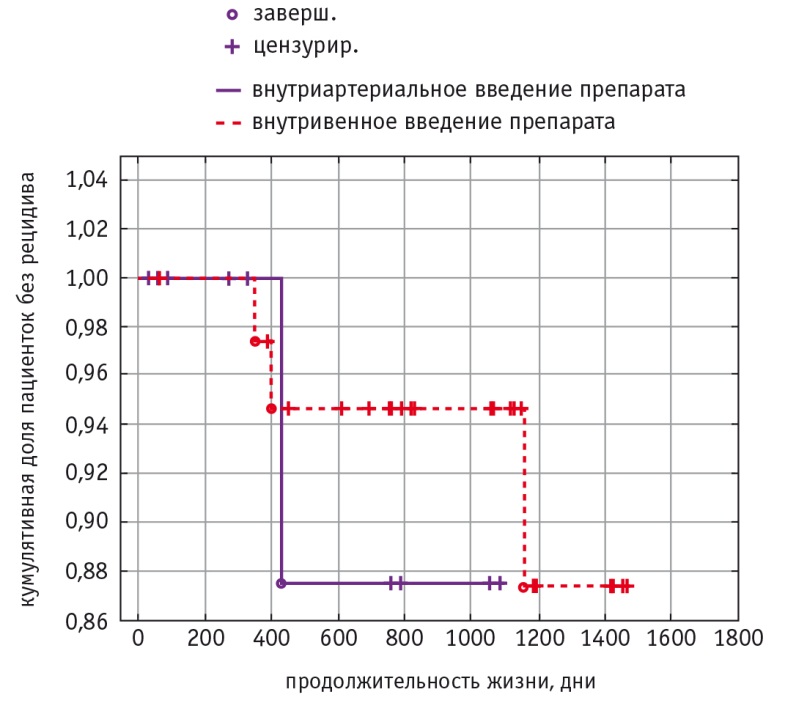
Расчет безрецидивной выживаемости пациенток, проведенный с помощью метода Каплана — Мейера, представлен на рисунке 4. Не выявлены различия данного показателя в группах больных раком шейки матки стадии IIB, которым радикальное хирургическое вмешательство выполняли после неоадъювантной химиотерапии с использованием внутриартериального и внутривенного введения цитостатиков. Показатель трехлетней безрецидивной выживаемости в обеих группах составлял около 87%.
Рис. 4. Безрецидивная выживаемость пациенток (метод Каплана — Мейера)
ОБСУЖДЕНИЕ
За последние годы проведено значительное количество исследований, показывающих улучшение отдаленных результатов у больных местнораспространенным раком шейки матки при включении в схему комплексного лечения неоадъювантной химиотерапии и радикального хирургического вмешательства[13, 15]. Активно разрабатываются и внедряются в практику рентгеноангиохирургические внутриартериальные методики инфузии цитостатиков в сочетании с эмболизацией сосудов опухоли при злокачественных новообразованиях различных локализаций[17, 18].
Основной идеей применения неоадъювантной химиотерапии при местнораспространенном раке шейки матки является уменьшение локорегионарного распространения опухолевого процесса, что проявляется в уменьшении размеров новообразования и параметральных инфильтратов, а также воздействии на лимфо и гематогенное метастазирование опухоли. Это в ряде случаев позволяет создать возможность для выполнения хирургического вмешательства с соблюдением принципов и правил онкологической радикальности. Необходимое условие — объективная оценка эффективности первого этапа лечения, для определения которой необходимо применять как традиционные клинические, так и современные лучевые методы обследования.
В нашем исследовании неоадъювантная химиотерапия проведена 55 больным раком шейки матки стадии IIB, всем пациенткам лекарственные препараты введены до индивидуально запланированных доз, отмечена удовлетворительная переносимость данного этапа лечения. Несмотря на меньшую степень выраженности побочных эффектов при внутриартериальном введении цитостатиков, статистически значимых различий между группами не было.
После проведения неоадъювантной химиотерапии у 92,7% участниц удалось достигнуть уменьшения размеров опухоли и параметральных инфильтратов, достаточного для выполнения радикального хирургического вмешательства. После введения цитостатиков с использованием внутривенной и внутриартериальной инфузии показатели непосредственной эффективности неоадъювантной химиотерапии значимо не различались. Тем не менее у больных, которым производили рентгеноангиохирургическое введение лекарственных препаратов, ответ опухоли на неоадъювантную химиотерапию отмечали в более короткие сроки, и он был несколько более выраженным. Вероятно, это обусловлено введением цитостатиков непосредственно в очаг поражения, а также ишемическими изменениями ткани новообразования вследствие эмболизации ветвей маточных артерий. В результате в данной группе больных оценка эффективности лечения оказалась возможной в ранний период после окончания химиотерапии, что позволило принять решение о выполнении радикального хирургического вмешательства на следующем этапе комплексного лечения.
Включение хирургического этапа в программу комплексной терапии дает ряд преимуществ. Так, у пациенток молодого возраста появляется возможность сохранения и транспозиции яичников. Снижение локорегионарного распространения опухолевого процесса, которое подтверждается при патоморфологическом исследовании операционного материала, в ряде случаев при местнораспространенном раке шейки матки позволяет отказаться от проведения адъювантной лучевой терапии. В нашем исследовании у 37,3% больных IIB стадией рака шейки матки при гистологическом исследовании операционного материала не были выявлены показания к проведению послеоперационного курса лучевой терапии.
Анализ кривых Каплана — Мейера показал, что трехлетняя безрецидивная выживаемость в обеих группах составляет около 87%. Это свидетельствует о достаточно высокой эффективности схемы лечения больных раком шейки матки стадии IIB, включающей в себя неоадъювантную химиотерапию, радикальное хирургическое вмешательство и, при наличии показаний, адъювантную химиолучевую терапию.
ЗАКЛЮЧЕНИЕ
Несмотря на большое количество литературных данных, в настоящее время не существует единого взгляда на выбор оптимальной схемы лечения больных раком шейки матки стадии IIB. С учетом результатов представленного исследования можно сделать вывод, что проведение химиотерапии при этом заболевании в большинстве случаев позволяет создать условия для выполнения радикального хирургического вмешательства.
Рентгеноэндоваскулярное внутриартериальное введение химиопрепаратов в сочетании с эмболизацией сосудов новообразования является эффективным способом проведения неоадъювантной химиотерапии, позволяющим получить результат в максимально короткие сроки при незначительном количестве побочных эффектов. Современные лучевые методы исследования (УЗИ, МРТ) могут предоставить объективную информацию об эффективности воздействия цитостатиков и должны применяться в процессе лечения пациенток для оценки регресса новообразования шейки матки.
Применение неоадъювантной химиотерапии с последующим радикальным хирургическим вмешательством при раке шейки матки стадии IIB является перспективным направлением научных исследований в онкогинекологии, предварительные результаты показывают значительное повышение как безрецидивной выживаемости больных, так и качества их жизни за счет отказа в ряде случаев от адъювантной лучевой терапии.








