ВВЕДЕНИЕ
Злокачественные новообразования молочных желез (ЗНО МЖ) стабильно занимают ведущие позиции в структуре причин заболеваемости и смертности от ЗНО у женщин[1]. Лечение рака МЖ (РМЖ) требует мультидисциплинарного подхода, который включает неоадъювантную химиотерапию (НАХТ), местное лечение (оперативное вмешательство и лучевую терапию) и адъювантную терапию[2]. НАХТ предполагает проведение системного лечения до операции[3]. Такая тактика все чаще используется у пациенток с РМЖ для получения потенциальных преимуществ, к которым относятся возможность достижения полного патоморфологического ответа (pathological complete response), оценка чувствительности к лекарственной терапии, возможность выполнения органосохраняющей операции[4–6].
У пациенток с агрессивными молекулярно-биологическими подтипами, к которым относят трижды негативный и HER2-положительный РМЖ, неоадъювантная терапия может стать наилучшей тактикой, независимо от возможности увеличить частоту органосохраняющих операций, что до сих пор было единственным доказанным преимуществом[7]. В настоящее время оценка результатов НАХТ позволяет выделить прогностические группы, которым была бы показана дальнейшая адъювантная терапия[8–10].
Цель исследования: оценить выраженность патоморфологического ответа по классификации Residual Cancer Burden (RCB) у пациенток c первично-операбельным и местнораспространенным РМЖ в зависимости от суррогатного молекулярно-биологического подтипа после НАХТ (химиотерапии ± анти-HER2-терапии).
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективное исследование включены 90 больных РМЖ (T0-3, N0-1, M0) с люминальным В HER2-отрицательным, люминальным В HER2-положительным, HER2-положительным нелюминальным, трижды негативным подтипами, которые находились на комплексном лечении в ГАУЗ ТО «МКМЦ «Медицинский город» (г. Тюмень) в период 2019–2021 гг. Возраст женщин, включенных в исследование, составил от 26 до 39 лет (медиана возраста — 36 лет).
Критерии включения: I–III стадия (T0-3, N0-1, M0) РМЖ, проведенная НАХТ. Критерий исключения: IV стадия РМЖ. Все пациентки подписали информированное добровольное согласие на участие в исследовании. Исследование было ретроспективным наблюдательным, все схемы лекарственного лечения соответствовали клиническим рекомендациям Минздрава России и не требовали одобрения локального этического комитета.
Перед началом неоадъювантной терапии проведен комплекс диагностических мероприятий. Диагноз ЗНО МЖ устанавливался на основании результатов инструментальных обследований: билатеральной маммографии, УЗИ МЖ и регионарных зон, сцинтиграфии костей скелета, рентгенографии органов грудной клетки, УЗИ органов брюшной полости и малого таза, биопсии опухоли с оценкой гистологического варианта и степени злокачественности, а также определения в опухолевой ткани рецепторов эстрогенов, прогестерона, Кi-67, HER2. При наличии подозрительных в отношении метастатического поражения регионарных лимфатических узлов, по данным инструментальных обследований, выполнялась цитологическая верификация.
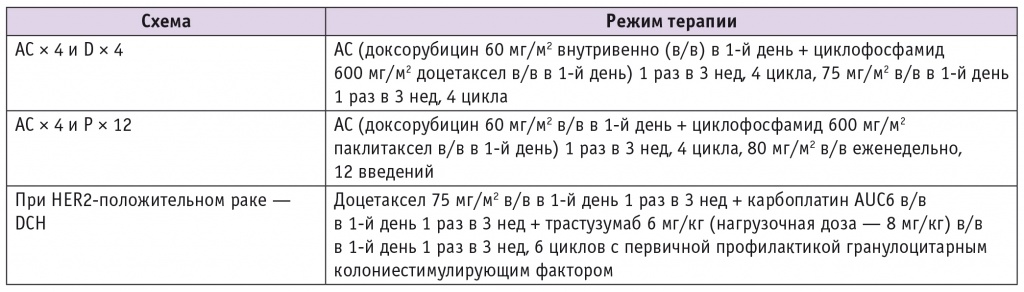
Неоадъювантная лекарственная терапия проводилась, согласно клиническим рекомендациям Минздрава России, и включала в себя схемы, представленные в таблице 1. После завершения НАХТ при отсутствии прогрессирования заболевания выполнялся следующий этап — хирургическое лечение.
Таблица 1
Режимы неоадювантной химиотерапии злокачественных новообразований молочных желез
Проведена оценка резидуальной опухоли по шкале RCB с использованием on-line калькулятора (www.mdanderson.org/breastcancer_RCB) после проведения неоадъювантной терапии у 85 пациенток.
Обработка статистических данных выполнялась с помощью программы SPSS Statistics, версия 26.0, методами описательной статистики. Статистически значимыми различия считались при р < 0,05.
РЕЗУЛЬТАТЫ
Клинико-морфологическая характеристика пациенток с ЗО МЖ представлена в таблице 2. Большинство из включенных в исследование женщин имели размер опухоли T2 (62,6%), у них диагностированы регионарные метастазы опухоли, у большинства женщин были стадии заболевания от IIA до IIIA.
Таблица 2
Общая характеристика пациенток с раком молочной железы (n = 90)
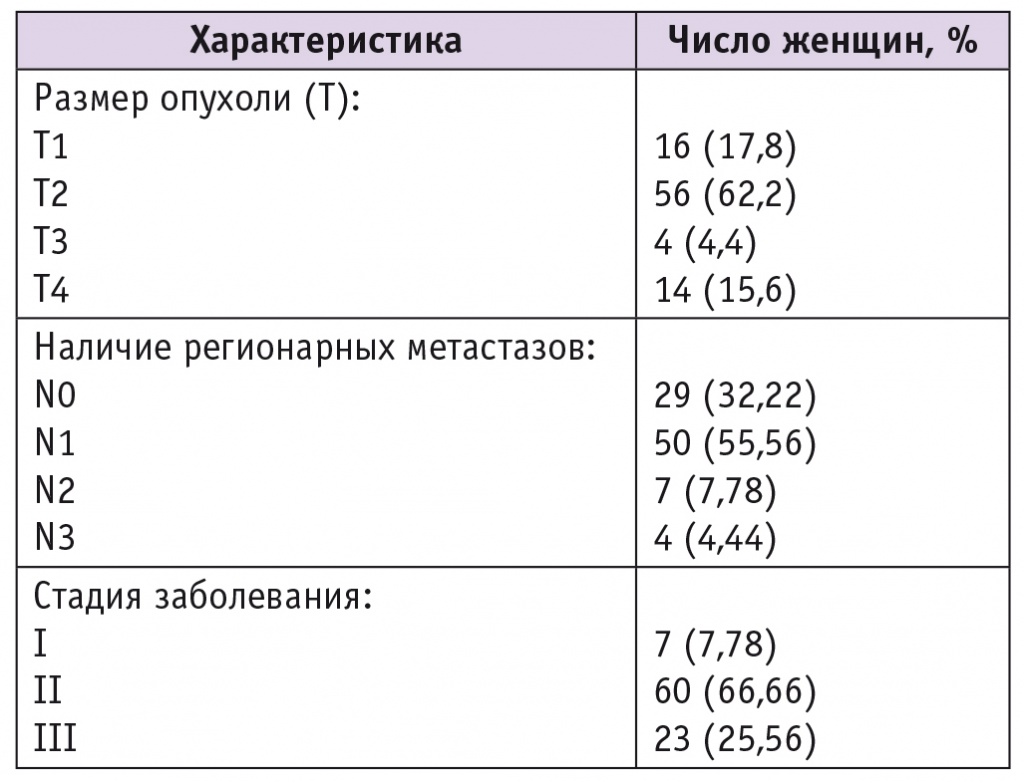
По гистологическому подтипу лидирующую позицию занимал инвазивный протоковый рак (86 (95,6%) случаев), инвазивный дольковый рак зафиксирован у 4 (4,4%) больных.
Пролиферативную активность опухоли оценивали с помощью индекса Ki-67: медиана составила 55%, Q1 = 35%, Q3 = 70%.
Низкий индекс Ki67 (< 30%) наблюдался всего у 16 (17,78%) женщин, у подавляющего большинства (n = 74; 82,22%) индекс Ki67 был высоким (≥ 30%).
Экспрессия рецепторов к эстрогенам > 0% зафиксирована у 44 (48,9%) участниц.
Распределение суррогатных биологических подтипов оказалось следующим: люминальный А — у 1 (1,1%), люминальный B HER2– — у 26 (28,9%), люминальный В HER2+ рак — у 17 (18,9%), HER2+ — у 13 (14,4%), трижды негативный рак — у 33 (36,7%) женщин. Преобладали люминальный В HER2-отрицательный и трижды негативный варианты.
Пациентки получали лекарственную терапию в неоадъювантном режиме в соответствии с клиническими рекомендациями Минздрава России, она включала таксан-антрациклиновые схемы и анти-HER2-терапию. При HER2-отрицательном статусе предпочтительнее схемы AC × 4 и D × 4 (n = 29; 32,22%) и AC × 4 и Р × 12 (n = 31; 34,45) по выбору врача.
У пациенток с HER2-положительным статусом схема выбора — DCН (n = 30; 33,33%).
Выполнялась послеоперационная оценка лечебного патоморфоза по RCB, при 0 и I степенях проведенная НАХТ считалась эффективной. Результаты представлены в таблице 3.
Таблица 3
Индекс Residual Cancer Burden (RCB) после неоадъювантной химиотерапии в зависимости от подтипа рака молочной железы (n = 85)
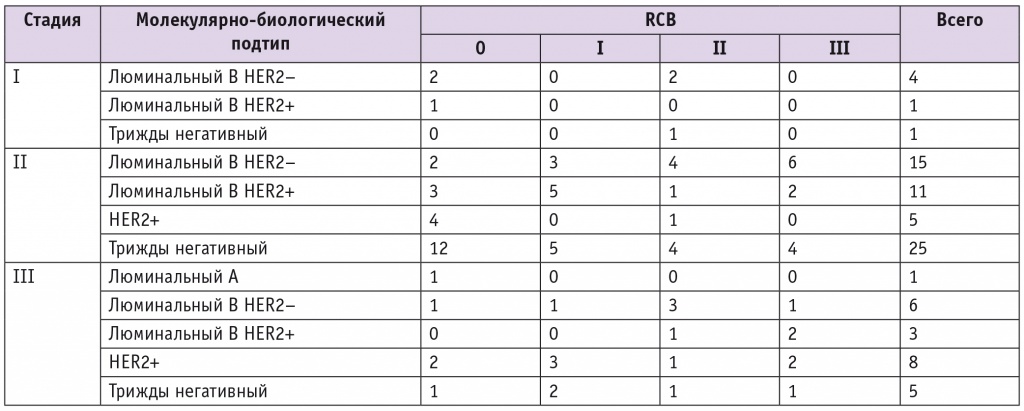
У пациенток с люминальным В HER2-негативным РМЖ в 20% случаев отмечен полный патоморфологический ответ, в 16% — RCB-I, в 36% — RCB-II, в 28% — RCB-III.
Среди женщин с люминальным В HER2-положительным РМЖ полный ответ достигнут у 26,67%, у 33,33% наблюдался RCB-I, у 13,33% — RCB-II, у 26,67% — RCB-III.
Среди пациенток с HER2-положительным РМЖ у 46,16% был RCB-0, у 23,08% — RCB-I, по 15,38% — RCB-II и RCB-III.
У участниц с трижды негативным РМЖ полный ответ достигнут в 41,94% случаев, в 22,58% отмечен RCB-I, в 19,35% — RCB-II, в 16,13% — RCB-III.
Частота полного патоморфологического ответа (RCB-0) после проведения НАХТ при более агрессивных подтипах РМЖ (трижды негативном и HER2-позитивном) значимо отличалась от таковой при HER2-негативном РМЖ (p < 0,0001). Наилучший ответ получен при люминальном В HER2-положительном, HER2-положительном и тройном трижды негативном раке.
По завершении НАХТ у 44 (48,9%) пациенток проведено радикальное оперативное вмешательство (мастэктомия ± реконструктивная операция), у 46 (51,1%) — органосохраняющее лечение. Результаты представлены в таблице 4.
Таблица 4
Оперативное лечение рака молочной железы (n = 90)

ОБСУЖДЕНИЕ
В 2019 году были опубликованы данные мультицентрового анализа, в котором приняли участие 5100 пациенток, получавших НАХТ в рамках 12 клинических исследований [10]. В работе дана оценка индекса RCB с отдаленными результатами при всех подтипах РМЖ. RCB оставался независимым прогностическим фактором в отношении безрецидивной выживаемости (полный патоморфоз vs резидуальная опухоль; HR = 2,50; 95% ДИ: 1,70–3,69; p < 0,001). В другом исследовании оценивалась значимость RCB с прогностической точки зрения. В нем 382 женщины с РМЖ (T1-3, N0-1) получали НАХТ таксан-антрациклиновыми схемами. Пятилетняя безрецидивная выживаемость пациенток с RCB-0 и RCB-I составила 92% (95% ДИ: 86–96%) и 94% (95% ДИ: 88–97%) соответственно, в то время как при RCB-II и III эти показатели были значимо (p < 0,05) ниже: 80% (95% ДИ: 59–82%) и 58% (95% ДИ: 45–81%).
Значение при RCB-III являлось фактором неблагоприятного прогноза независимо от статуса экспрессии рецепторов эстрогена и прогестерона, стадии, достигнутой после НАХТ (ypTN), проведенной адъювантной гормонотерапии. Таким образом, выживаемость больных с RCB-I, или near pCR (почти полным ответом), приближается к выживаемости пациенток с полной регрессией. С учетом этого женщины с RCB-I, вероятно, не нуждаются в дополнительном адъювантном лечении (за исключением гормонотерапии при положительной экспрессии рецепторов эстрогена). Иначе поступают при наличии резидуальной опухоли (RCB-II и RCB-III). Выживаемость в таких случаях ниже, чем при RCB-0 и RCB-I, поэтому применение адъювантной терапии у женщин с RCB-II и RCB-III может дать положительный результат.
ЗАКЛЮЧЕНИЕ
Унифицированная оценка остаточной опухоли после проведенной неоадъювантной химиотерапии позволяет четко выделить прогностические группы пациенток с различным ответом на лечение и планировать у них дополнительную лекарственную терапию.
Поступила: 09.02.2023
Принята к публикации: 20.03.2023








