Многочисленные исследования последних лет указывают на значительную распространенность бесплодия в браке, которая в России достигает 17,5%, при этом в 40–60% случаев оно обусловлено нарушениями репродуктивной функции женщины. В структуре женского бесплодия первое место занимает бесплодие трубного происхождения (код МКБ-10 — N97.1). Частота трубного бесплодия (ТБ) очень вариабельна: от 35% до 68%[1, 2, 10, 12].
Лечение данной формы бесплодия — непростая задача. Многоэтапная терапия, включающая коррекцию патологических изменений органов малого таза во время оперативной лапароскопии и гистероскопии, должна сопровождаться ранними и отсроченными восстановительными мероприятиями, планированием фертильных циклов при восстановлении проходимости маточных труб, что растягивается на годы. И только при отсутствии положительного эффекта от проведенного лечения и сохраняющейся непроходимости маточных труб рекомендуется применять методы ВРТ[2, 5, 6]. В подобной ситуации существует риск ятрогенных нарушений репродуктивной функции, в том числе снижения овариального резерва[1, 7].
Российской ассоциацией репродукции человека определено, что диагностические мероприятия для выявления ТБ не должны длиться более 3–6 месяцев. На остальные этапы лечения отводится не более 6 месяцев, и далее пациенткам следует проводить ЭКО и перенос эмбрионов (ПЭ) в полость матки[2, 4, 5, 14]. Результативность программ ВРТ лучше, когда эмбрионы высокого качества переносятся в высокорецептивный некомпрометированный эндометрий[3, 8, 9, 13, 18].
Анализ отчетов министерства здравоохранения Красноярского края за период 2009–2014 гг. позволил выявить тенденцию к уменьшению численности женского населения в регионе, в том числе количества женщин репродуктивного возраста. Остается высокой гинекологическая заболеваемость у женщин различных возрастных групп, что создает неблагоприятный популяционный фон для реализации репродуктивной функции. За 5 лет уровень гинекологической заболеваемости на 100 тыс. женского населения существенно возрос: показатель ВЗОМТ — на 6%, заболеваемость эндометриозом — на 7%, расстройствами менструальной функции — на 10%; на этом фоне частота встречаемости бесплодия увеличилась на 89%[11].
Учитывая значительный рост распространенности женского бесплодия, в качестве одного из резервов сохранения уровня рождаемости в Красноярском крае было определено увеличение объемов медицинской помощи при лечении бесплодия с использованием ВРТ. С 2013 г. оно осуществляется в рамках Территориальной программы государственных гарантий бесплатного оказания гражданам РФ медицинской помощи в Красноярском крае в двух негосударственных медицинских учреждениях г. Красноярска. В 2013 г. проводилось лечение только ТБ, в 2014 г. показания к ВРТ были расширены за счет включения ановуляторного (эндокринного) бесплодия.
Для успешной терапии женского бесплодия утверждены региональные регламентирующие нормативно-правовые документы. Созданы эффективные модели оказания медицинских услуг с использованием современных методов диагностики и лечения бесплодия на основе данных доказательной медицины[15–17, 19].
Цель исследования: изучить эффективность лечения ТБ с применением ВРТ по программе ЭКО/ИКСИ в рамках Территориальной программы государственных гарантий бесплатного оказания гражданам РФ медицинской помощи в Красноярском крае.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено в 2013–2014 гг. на клинических базах кафедры акушерства и гинекологии Института последипломного образования ГБОУ ВПО «Красноярский государственный медицинский университет им. проф. В. Ф. Войно-Ясенецкого» Минздрава России (зав. кафедрой — д. м. н., профессор А. Т. Егорова), Медицинского центра гинекологической эндокринологии и репродукции «Три сердца» (директор — С. А. Сыромятникова). В исследовании приняли участие 343 пациентки с ТБ в возрасте 24–45 лет, которые получили квоту на проведение лечения методом ЭКО/ИКСИ по заключению территориальной комиссии по отбору пациентов.
Критериями включения в исследование стали возраст от 24 до 45 лет, ТБ, ИМТ 18–35 кг/м2; уровень фолликулостимулирующего гормона (ФСГ) не выше 12 МЕ/л, антимюллерова гормона (АМГ) — не ниже 1 нг/мл; нормальные показатели эякулята.
Критериями исключения явились психические и тяжелые соматические заболевания, препятствующие вынашиванию беременности, рождению и воспитанию ребенка; гинекологические заболевания (сактосальпинкс, миома матки, эндометриоз, гиперпластические заболевания эндометрия), снижающие вероятность наступления беременности при использовании ВРТ.
Были сформированы две группы исследования: в 1-ю группу вошли 228 пациенток оптимального репродуктивного возраста (24–34 лет), во 2-ю группу — 115 женщин позднего репродуктивного возраста (35–45 лет).
У всех участниц было получено информированное согласие на лечение ТБ методом ЭКО и ПЭ.
У каждой пациентки проведен подробный анализ клинико-анамнестических данных, определена длительность бесплодия, оценены результаты гистологического исследования эндометрия. Состояние овариального резерва оценивали по уровням АМГ и ФСГ в сыворотке крови на 2–5-й день менструального цикла. Исследование выполняли радиоиммунологическим и иммуноферментным методами с использованием стандартных наборов реактивов фирмы Immunotech (Чехия) согласно приложенным к ним инструкциям. При показателях АМГ 1–2 нг/мл овариальный резерв считали низким, > 2–10 нг/мл — нормальным, > 10 нг/мл — высоким.
Пациенткам проведена программа ЭКО и ПЭ с индукцией суперовуляции и культивированием эмбрионов до стадии бластоцисты. При развитии синдрома гиперстимулированных яичников (СГЯ) и тонком эндометрии цикл ЭКО сегментировали и осуществляли криоконсервирование эмбрионов. В зависимости от овариального резерва у пациенток использовали один из трех протоколов индукции овуляции:
- длинный протокол с применением агониста ГнРГ трипторелина и рекомбинантного ФСГ (рФСГ) фоллитропина альфа;
- короткий протокол с применением агониста ГнРГ трипторелина и рФСГ фоллитропина альфа;
- короткий протокол с применением рФСГ фоллитропина альфа и антагониста ГнРГ цетрореликса.
Эффективность программ ЭКО определяли по проценту наступления беременности в расчете на число эмбриопереносов[9, 15–17, 19].
Средний возраст пациенток 1-й группы составил 31,1 ± 0,7 года, 2-й группы — 37,2 ± 0,4 года (р < 0,05). Длительность ТБ у 148 (64,9%) женщин 1-й группы была в пределах 1–3 лет, у 80 (35,1%) — 4–6 лет; средняя длительность бесплодия во всей группе составила 5,1 ± 0,2 года.
Во 2-й группе бесплодие длилось в течение 1–3 лет у 19 (16,5%) пациенток (р1, 2 < 0,05), 4–6 лет — у 43 (37,4%) (р1, 2 > 0,05), 7–9 лет — у 53 (46,1%) (р1, 2 < 0,001). Средняя длительность бесплодия к моменту исследования во 2-й группе достигла 7,5 ± 0,4 года (р1, 2 < 0,05).
В 1-й группе доля вторичного бесплодия составила 68,0%, первичного — 32,0% (р < 0,05), во 2-й группе — 73,9% и 26,1% соответственно (р < 0,05).
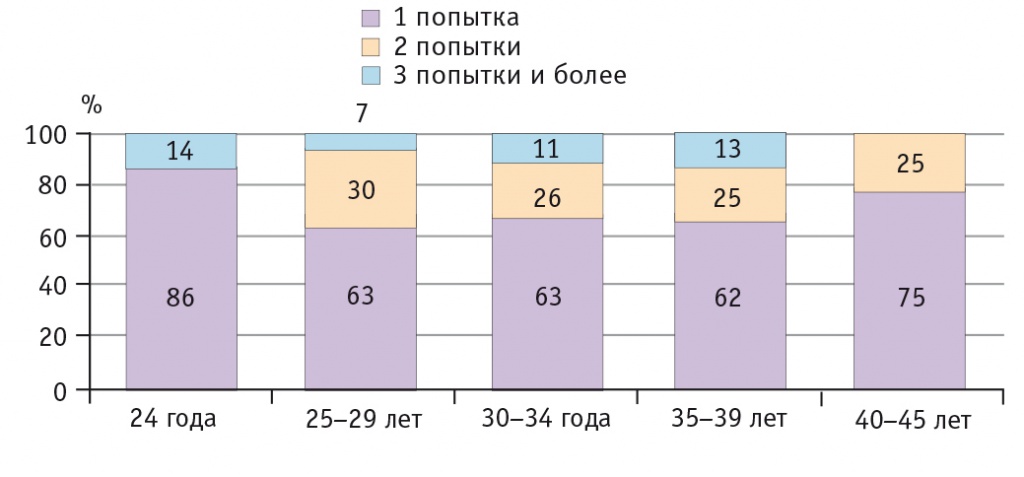
В 1-й группе длительность бесплодия 5 лет и менее наблюдалась у 155 (68,0%) пациенток, более 5 лет — у 73 (32,0%); во 2-й группе — у 62 (53,9%) и 53 (46,1%) пациенток соответственно. В 1-й группе в возрасте 24 лет были 7 (3,1%) женщин, у 1 (14,3%) из них в анамнезе отмечены 2 неудачные попытки ВРТ; 64 (28,1%) участницы находились в возрастном интервале 25–29 лет, подавляющее большинство пациенток — 157 (68,8%) — в возрасте 30–34 лет (р < 0,05). Во 2-й группе 105 (91,3%) женщин были в возрасте 35–39 лет и 10 (8,7%) — 40–45 лет (р < 0,05). При этом у пациенток обеих групп имели место указания на неудачные попытки ЭКО в анамнезе, число которых было выше в позднем репродуктивном возрасте (рис.).
Рис. Число попыток экстракорпорального оплодотворения в различных возрастных группах у пациенток с трубным бесплодием, %
Статистическую обработку полученных результатов проводили с помощью пакета стандартных программ Statistica for Windows 5.5. Для оценки статистической значимости различий количественных признаков с распределением, близким к нормальному (по критерию Колмогорова — Смирнова), применяли t-критерий Стьюдента, для ненормально распределенных величин — критерий U Манна — Уитни. Различия считали достоверными при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе гистологической оценки эндометрия хронический эндометрит (ХЭ) был верифицирован у каждой второй пациентки — 114 (50,0%) женщин — 1-й группы и у 69 (60,0%) участниц 2-й группы (р < 0,05). По условию проведения Территориальной программы ВРТ у всех женщин с ХЭ были выполнены мероприятия по прегравидарному оздоровлению, которые включали антибактериальную терапию при выявлении значимого инфекта, гормональную коррекцию при тонком эндометрии и физиотерапию при фибротических изменениях эндометрия.
Оценку овариального резерва и выбор протокола индукции суперовуляции осуществляли, исходя из содержания ФСГ и АМГ. Статистически значимых различий между пациентками 1-й и 2-й групп по уровню ФСГ получено не было: он составил 6,2 ± 0,2 мЕД/мл и 6,7 ± 0,3 мЕД/мл соответственно (р > 0,05). Пациентки 2-й группы имели достоверно более низкий уровень АМГ — 3,2 ± 0,5 нг/мл против 4,7 ± 0,5 нг/мл (р < 0,05), что было ожидаемо в связи с их возрастом.
Эффективность использованных протоколов индукции суперовуляции представлена в таблице.
Таблица
Эффективность использованных протоколов индукции суперовуляции у обследованных пациенток с трубным бесплодием
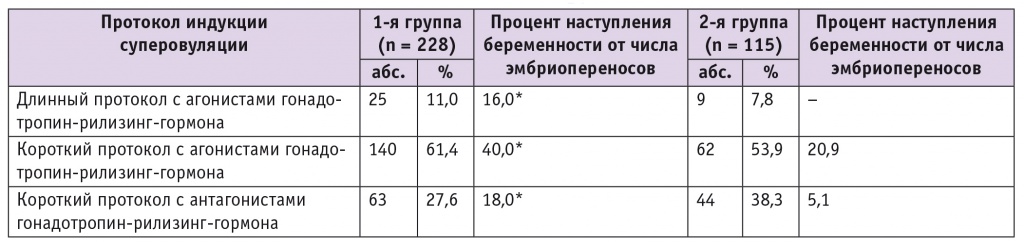
* Отличие от 2-й группы статистически значимо (p < 0,05).
В 1-й группе 140 (61,4%) и во 2-й группе 62 (53,9%) пациентки были простимулированы по короткому протоколу с агонистами ГнРГ, который показал более высокую эффективность по сравнению с длинным протоколом с агонистами ГнРГ и коротким с антагонистами ГнРГ (р < 0,05 для обоих показателей). Нами не получено статистически значимых различий в эффективности длинного протокола с агонистами ГнРГ и короткого протокола с антагонистами ГнРГ у пациенток 1-й группы (р > 0,05). Низкую эффективность продемонстрировало использование длинного протокола с агонистами ГнРГ у женщин позднего репродуктивного возраста (n = 9): у 6 (66,7%) пациенток индукция овуляции не была успешной при показателях АМГ менее 2 нг/мл, у них имелся бедный ответ яичников и отсутствовал должный рост фолликулов, цикл индукции был остановлен. У 3 (33,3%) женщин 2-й группы было получено по 4 ооцита, по 3 эмбриона высокого качества, но из-за тонкого эндометрия (5,6 ± 0,5 мм) пришлось отказаться от ПЭ и провести криоконсервирование эмбрионов.
В 1-й группе при проведении индукции суперовуляции среднее число полученных ооцитов составило 8,4 ± 0,8, СГЯ развился у 14 (6,1%) пациенток, у 2 (0,9%) был отмечен тонкий эндометрий к моменту ПЭ, остановку развития эмбрионов наблюдали у 9 (3,9%) участниц. У 7 (28,0%) из 25 пациенток, у которых использовали длинный протокол с агонистами ГнРГ, выявлена остановка развития эмбрионов, полученных из ооцитов, при СГЯ. Таким образом, сегментирование программ ВРТ и криоконсервация эмбрионов были использованы у 16 (7,0%) пациенток; ПЭ проведен 203 (89,0%) женщинам при средней толщине эндометрия 9,5 ± 0,7 мм, среди них доля наступления беременности составила 73,9% (n = 150). Беременность наступила у 4 пациенток 24 лет, у 46 в возрасте 25–29 лет и у 100 в возрасте 30–34 лет. Все они имели длительность бесплодия 5 лет и менее.
Во 2-й группе получен статистически значимо меньший ответ яичников, среднее число ооцитов — 5,4 ± 0,5 (р < 0,05). У 6 (5,2%) пациенток со сниженным овариальным резервом (показатель АМГ менее 2 нг/мл) ответ яичников на стимуляцию овуляции не был получен. На этапе проведения эмбриологического протокола остановка развития эмбриона имела место у 20 (17,4%) пациенток. Тонкий эндометрий к моменту ПЭ отметили у 8 (7,0%) женщин, у них сегментировали программу ВРТ и провели криоконсервацию эмбрионов. ПЭ был осуществлен 81 (70,4%) женщине при средней толщине эндометрия 9,3 ± 0,7 мм. Доля наступления беременности в расчете на число эмбриопереносов составила 25,9% (n = 21, из них 20 женщин в возрасте 35–39 лет и 1 женщина в возрасте 40–45 лет).
ЗАКЛЮЧЕНИЕ
Эффективность использования вспомогательных репродуктивных технологий (ВРТ) среди пациенток с трубным бесплодием (ТБ) оказалась высокой у женщин оптимального репродуктивного возраста при длительности бесплодия 5 лет и менее (73,9% от числа эмбриопереносов). У пациенток с ТБ в позднем репродуктивном возрасте эффективность программ ВРТ была почти в 3 раза ниже — 25,9% от числа эмбриопереносов.
Применение длинного протокола с агонистами гонадотропин-рилизинг-гормона (ГнРГ) нецелесообразно у пациенток позднего репродуктивного возраста со сниженным овариальным резервом (показатель антимюллерова гормона (АМГ) менее 2 нг/мл): из 9 женщин, у которых использовали данный протокол, у 66,7% было отмечено торможение роста ооцитов, а у 33,3% за счет антиэстрогенного эффекта агонистов ГнРГ, возникающего в период индукции, имел место тонкий эндометрий, при котором перенос эмбрионов в цикле приходится отменять.
Среди женщин оптимального репродуктивного возраста с нормальным овариальным резервом (показатель АМГ более 2 нг/мл) при длинном протоколе с агонистами ГнРГ у 28,0% (7 из 25) пациенток сегментирование цикла ВРТ было обусловлено синдромом гиперстимулированных яичников и остановкой развития эмбрионов.








