В повседневной медицинской практике все шире используют ВРТ. Но если первоначально отмечались стремительные успехи и повышалась эффективность применения методов ВРТ, то в последнее время коэффициент рождаемости достиг фазы плато[6]. Кроме того, растет осознание повышенного риска осложнений в перинатальном периоде у женщин, забеременевших с помощью ВРТ[3]. В настоящее время все большее внимание уделяется увеличению количества и улучшению качества ооцитов, эмбрионов, повышению частоты имплантации и успешных перинатальных исходов.
Одна из стратегий — применение гепарина у всех пациенток, воспользовавшихся ВРТ, сейчас он успешно используется у женщин с приобретенной тромбофилией[2, 16]. Гепарин может снижать риск тромбоза при искусственной стимуляции яичников, модулировать фундаментальные физиологические процессы, необходимые для миграции, адгезии и имплантации оплодотворенной яйцеклетки, дифференцировки и инвазии трофобласта, благодаря неантикоагулянтным эффектам[15].
Цель данного обзора: обобщение использования низкомолекулярных гепаринов на основе международных рекомендаций, описание возможных механизмов действия гепарина как средства, способствующего успешной имплантации.
ИЗМЕНЕНИЯ ГЕМОСТАЗА ПРИ ИСКУССТВЕННОЙ СТИМУЛЯЦИИ ЯИЧНИКОВ
В целях увеличения количества эмбрионов, доступных для переноса и заморозки, женщины получают массивную терапию экзогенными гонадотропинами, что повышает риск тромбоза[37]. Изменения гемостаза во время стимуляции яичников схожи с наблюдаемыми во время беременности и вызваны быстрым (более чем в 100 раз за 2 недели) ростом уровня эстрадиола[4, 10]. При этом увеличиваются концентрации эндогенных факторов свертывания (V фактора, фибриногена, фактора Виллебранда), снижаются уровни антитромбина, протеина S. Однако, несмотря на прокоагулянтные сдвиги, сокращение времени свертывания остается в пределах нормы и отсутствуют изменения фибринолиза[19].
В случае развития синдрома гиперстимуляции яичников изменения становятся более значимыми: наблюдаются более высокие уровни фибриногена, фактора Виллебранда, D-димеров, тромбин-антитромбиновых комплексов, снижение содержания прекалликреина, ингибитора тканевого (III) фактора[31].
Несмотря на сильно измененные показатели свертывания, тромбоэмболия при стимуляции яичников — довольно редкое явление (0,08–0,11%)[9]. При развитии синдрома гиперстимуляции яичников осложнения возникают чаще — примерно у одной из 128 женщин (20–40-кратное увеличение риска по сравнению с таковым при физиологическом наступлении беременности)[34].
Для профилактики тромбоэмболических осложнений применяют низкомолекулярные гепарины (НМГ)[5]. Однако в ряде ситуаций при наследственных тромбофилиях рекомендуемые профилактические и даже лечебные дозы могут быть неэффективными[24]. Резистентность к противосвертывающей терапии может быть объяснена локальной гиперактивацией коагуляции и высокими концентрациями эстрадиола, снижающего антитромботические свойства эпителия. Клиническое прогрессирование тромбоэмболий встречается в 10% случаев и требует незамедлительного восстановления адекватного гемостаза[17].
Как и при беременности, длительность лечения венозных тромбозов/тромбоэмболий с транзиторными факторами риска с целью профилактики рецидива составляет в среднем 6 месяцев, при множественных факторах риска антикоагулянтная терапия может продолжаться на протяжении всей жизни женщины. Профилактическое лечение должно проводиться в течение беременности и как минимум 6 недель после родов[18]. В отсутствие должных клинических исследований оправдан прагматический подход к предотвращению угрожающих жизни тромбоэмболических осложнений во время искусственной стимуляции яичников[35].
Существующие рекомендации по антикоагулянтной терапии при ВРТ, в том числе в случае развития синдрома гиперстимуляции яичников (модифицированные American College of Chest Physicians Evidence-Based Clinical Practice Guidelines (2012)[18]), представлены в таблицах 1–3.
Таблица 1
Рекомендации по антикоагулянтной терапии при использовании вспомогательных репродуктивных технологий, в том числе в случае развития синдрома гиперстимуляции яичников[18]
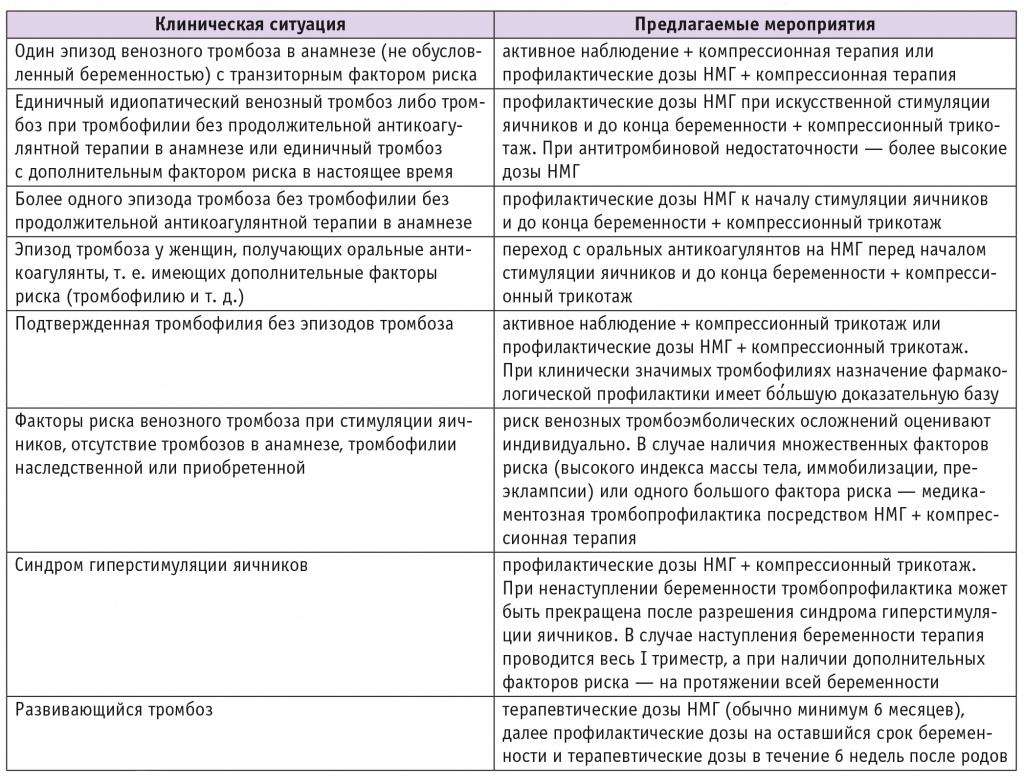
Примечание. НМГ — низкомолекулярный гепарин.
Таблица 2
Рекомендуемые дозировки нефракционированного гепарина[18]
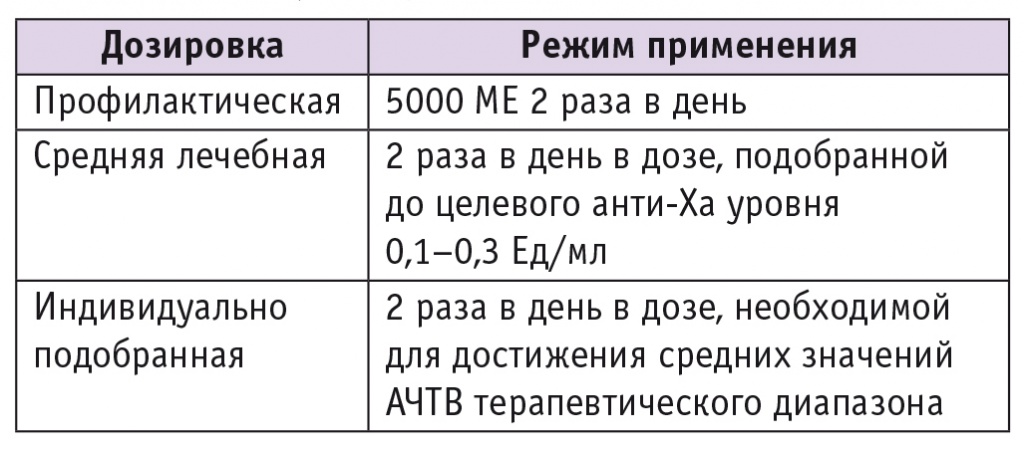
Примечания.
1. Гепарин вводится подкожно.
2. АЧТВ — активированное частичное тромбопластиновое время.
Таблица 3
Рекомендуемые дозировки низкомолекулярного гепарина[18]
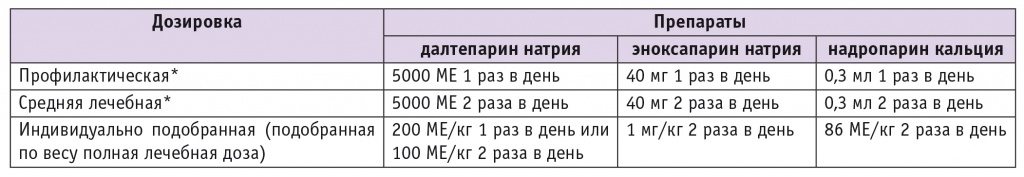
* При избыточном весе пациентки может потребоваться корректировка дозы.
Примечание. Низкомолекулярный гепарин вводится подкожно.
ГЕМОСТАЗ И НЕБЛАГОПРИЯТНЫЕ ПЕРИНАТАЛЬНЫЕ ИСХОДЫ
Эффективность антикоагулянтной терапии антифосфолипидного синдрома с привычным невынашиванием способствовала возобновлению интереса к использованию НМГ при тромбофилических осложнениях.
Немногочисленные исследования показывают увеличение рисков выкидыша, отслойки плаценты, задержки роста плода и преэклампсии в связи с наследственными тромбофилиями[1, 4].
Антифосфолипидный синдром — наиболее распространенный вариант приобретенной тромбофилии, он связан с частым прерыванием беременности и высоким риском повторного невынашивания[4, 25]. Роль антифосфолипидных антител в генезе бесплодия обсуждается в связи с неоднородной оценкой серопозитивности данных антител. Необходимо соглашение о том, какие антитела следует оценивать и какие титры считать позитивным результатом[23].
В некоторых исследованиях поставлена под сомнение роль антифосфолипидных антител при бесплодии, но авторы не изучали исходы у женщин с повторными выкидышами или последовательными потерями после ЭКО[7]. Аналогично приобретенной тромбофилии, у женщин, не достигших положительного результата после трех переносов эмбрионов, определяются повышенные уровни антифосфолипидных антител[29]. В связи с этим, по-видимому, следует проводить скрининг на тромбофилию при последовательных неудачах, так как антикоагулянтное лечение оказывает позитивное действие. Считают, что скрининг после одного ЭКО-опосредованного выкидыша не оправдан[7], однако положительные серологические результаты у женщин с двумя ранними ЭКО-опосредованными выкидышами выявляются с той же частотой, что у пациенток со спонтанным привычным невынашиванием (группа высокого риска рецидива — ~90%)[12]. Такие случаи поддаются терапии[12]. Следовательно, целесообразно проводить скрининг после двух ранних ЭКО-опосредованных выкидышей.
Женщинам с подтвержденным антифосфолипидным синдромом или повторными неудачами имплантации и положительными результатами теста на антифосфолипидные антитела рекомендуют назначать НМГ и АСК при стимуляции яичников и продолжать эту терапию в течение всей беременности[25]. Пациенткам с положительной реакцией на один тип антифосфолипидных антител при первой попытке ЭКО не показана антикоагулянтная терапия в связи с недостатком данных о влиянии антифосфолипидных антител на бесплодие, тогда как обнаружение нескольких типов антифосфолипидных антител, наоборот, требует применения НМГ и АСК в силу высокой корреляции с частотой венозных тромбозов и осложнений беременности[32].
Вместе с тем, на наш взгляд, описанная тактика ведения основана скорее на биологической «правдоподобности», чем на доказанных механизмах действия.
ЭФФЕКТЫ ГЕПАРИНА ВНЕ СИСТЕМЫ ГЕМОСТАЗА
Модуляция имплантации и развития трофобласта
Классически роль гепарина при использовании ВРТ при приобретенных и наследственных тромбофилиях рассматривается с точки зрения профилактики тромбозов. Но, возможно, эффекты гепарина значительно шире, учитывая его взаимодействия с большим спектром белков, которые влияют на физиологические процессы имплантации и развития трофобласта.
Известно, что риск осложнений и неблагоприятных перинатальных исходов при искусственном оплодотворении выше, чем при физиологически наступившей беременности. Нарушения имплантации и развития трофобласта коррелируют с риском преэклампсии, гестационного диабета, предлежания плаценты и необходимости оперативного родоразрешения[1]. Предпосылки к данным осложнениям появляются в I триместре при нарушении процессов имплантации и развития трофобласта[34]. Процесс имплантации до конца не изучен, тем не менее антикоагулянтную терапию предлагают в качестве профилактики у женщин с плацентарными осложнениями в анамнезе[20]. Учитывая высокие риски осложнений при использовании ВРТ, на практике часто применяют НМГ, также основываясь скорее на биологической «правдоподобности».
Селектины и гепарин
Инициация взаимодействия бластоцисты с эпителием эндометрия сходна с роллингом лейкоцитов. Считают, что селектины — молекулы клеточной адгезии — могут инициировать процесс имплантации[39].
Гепарин модулирует действие селектинов. Гепарины, содержащие полигликаны с бо’льшим молекулярным весом, такие как далтепарин, тинзапарин, блокируют связывание селектинов. Надропарин кальция, эноксапарин — гепарины с более легкими фрагментами — не влияют на функции селектинов[36], поэтому теоретически являются препаратами выбора. При этом надропарин кальция обладает лучшей локальной переносимостью по сравнению с эноксапарином[18, 36].
Кадгерины и гепарин
Кадгерины — группа гликопротеидов, обеспечивающих кальций-зависимую клеточную адгезию. Е-кадгерин экспрессируется многими тканями, включая эндометрий. Экспрессия Е-кадгерина влияет на миграцию и инвазию вневорсинчатого трофобласта[13].
Нефракционированный гепарин (НФГ) и НМГ вызывают снижение децидуальной экспрессии Е-кадгерина, что потенциально поддерживает дифференцировку внеклеточного трофобласта[30].
Инсулиноподобный фактор роста и гепарин
Инсулиноподобные факторы роста 1 и 2 (ИФР-1 и ИФР-2) также вовлечены в имплантацию и развитие плода[14].
НФГ и НМГ увеличивают содержание свободного ИФР-1 в дозозависимой манере, не влияя на общий ИФР-1 и ИФР-связывающий протеин[26]. In vitro ИФР-1 стимулирует миграцию клеток трофобласта, соответственно, локальное повышение уровня свободного ИФР-1 в сочетании со снижением содержания трансформирующего фактора роста (ТФР) под воздействием НМГ может способствовать успешной инвазии трофобласта[21]. Аналогично, увеличенная экспрессия ИФР-2 упрощает внедрение клеток внеклеточного цитотрофобласта в децидуальную оболочку и его васкуляризацию, как показано в эксперименте на мышах[28].
Цитокины и гепарин
Трансформирующий фактор роста. Различные цитокины вовлечены в регуляцию инвазии трофобласта. ТФР-β1–3 экспрессируются клетками как эндометрия, так и трофобласта и препятствуют пролиферации и инвазии трофобласта[22]. НМГ ингибирует экспрессию ТФР-β1 мезангиальными клетками, предотвращая усиленное связывание ядерных протеинов с регуляторным сайтом ТФР-β1-промоутера[40].
Интерлейкин 1 и гепарин. ТФР-β1-промоутер ИЛ-1 — провоспалительный цитокин, который также предположительно участвует в процессе имплантации[11]. Введение естественного ингибитора антагониста ИЛ-1-рецепторов предотвращает имплантацию бластоцисты у мышей, благодаря снижению уровней интегринов на эпителиальной поверхности в просвете спиральных сосудов[36]. Добавление ИЛ-1 к бластоцистам в культуре увеличивает эндометриальную экспрессию интегрина β3, что улучшает адгезию бластоцисты[33]. Влияние НФГ и НМГ на экспрессию ИЛ-1 трофобластом и бластоцистой не доказано, но сообщается о повышении экспрессии ИЛ-1 в лейкоцитах in vitro в ответ на введение гепаринов[8], что повышает вероятность аналогичных эффектов в эндометрии.
Матриксные металлопротеиназы (ММР) и гепарин. ММР — семейство из 22 эндопротеаз, способных разрушать компоненты внеклеточного матрикса и являющихся важными медиаторами клеточно-клеточных и клеточно-матриксных взаимодействий. В исследованиях in vitro удачная имплантация и плацентация обусловлены равновесием между экспрессией ММР трофобластом и их ингибированием естественными тканевыми ингибиторами металлопротеиназ[27].
Действие гепарина на ММР различно[38], но НМГ в терапевтических дозах индуцирует транскрипцию ММР-2 и ММР-9, необходимых для инвазии трофобласта, и экспрессию белков с сопутствующим снижением экспрессии тканевых ингибиторов металлопротеиназ[41]. Таким образом, НМГ способен улучшать инвазию трофобластных клеток, регулируя их деструктивные возможности.
ЗАКЛЮЧЕНИЕ
Представленные в обзоре данные свидетельствуют о том, что гепарин участвует в регуляции гемостатических реакций, связанных с миграцией, имплантацией оплодотворенной яйцеклетки, развитием эмбриона и, соответственно, с искусственным оплодотворением. Однако необходимо понимать, что имплантация — мультифакториальный процесс с вовлечением эндокринных, паракринных, аутокринных и юкстакринных механизмов, регулирующих межклеточные и клеточно-матриксные взаимодействия. Хотя изучение механизмов взаимодействия между развивающимся эмбрионом и эндометрием продолжается, сегодня известно, что гепарин потенциально может модулировать многие из них, включая успешную адгезию, пенетрацию развивающегося эмбриона. Более того, применение гепарина увеличивает частоту беременностей у женщин с повторными неудачными попытками экстракорпорального оплодотворения и тромбофилией.
Вместе с тем необходимо проведение дополнительных исследований, подтверждающих описанный выше потенциал гепарина (в том числе его низкомолекулярных фракций) как средства, способствующего успешной имплантации, для обоснованного внесения его применения в рекомендации для всех женщин, прибегающих к вспомогательным репродуктивным технологиям, с целью повышения частоты наступления беременности и благоприятных исходов и снижения частоты осложнений гестации.
В настоящее время использование гепарина в клинической практике должно быть основано на данных доказательной медицины, обобщенных в международных клинических рекомендациях[18].








