Распространенность бесплодия в мире составляет от 10% до 29% [7, 12]. В Российской Федерации за период с 1998 по 2012 г. темпы прироста рождаемости оказались ниже ожидаемого [2], при этом распространенность бесплодного брака в России достигает 15,0–17,4% и имеет тенденцию к росту [4, 5].
Лечение бесплодия методами ВРТ в России становится все более востребованным: с 2000 по 2013 г. количество циклов ЭКО увеличилось более чем десятикратно (с 6003 до 64 918 циклов) [6], однако относительное число неудач ЭКО не имеет тенденции к снижению. Существенный вклад в генез маточного фактора бесплодия вносит хронический эндометрит, частота которого при бесплодном браке в целом колеблется от 17,2% до 73,1% [1], составляя до 30,3% у пациенток с неудачами ЭКО в анамнезе [3, 11].
Эндометрий в течение менструального цикла подвергается циклическим изменениям: происходят его рост, десквамация и регенерация. Основная его роль заключается в поддержке имплантации эмбриона и успешной реализации репродуктивной функции. Бóльшую часть менструального цикла эндометрий невосприимчив к эмбриону, однако он приобретает особые рецептивные свойства в ограниченном пространственном и временнóм промежутке лютеиновой фазы цикла, известном как окно имплантации [9, 15]. Последнее характеризуется морфологической и гистологической трансформацией в эндометрии и ассоциируется с изменением активности различных функциональных систем трех участников этого процесса: макроорганизма женщины, эндометрия и эмбриона.
Знание комплекса патогенетических механизмов, контролирующих специфические изменения эндометрия в этот короткий промежуток времени, — ключ к пониманию не только процесса имплантации, но и причин неудач реализации репродуктивной функции при различных гинекологических заболеваниях (хроническом эндометрите, эндометриозе, миоме матки, гиперплазии эндометрия). В то время как в медицинском сообществе укрепляется сознание того, что первопричина большинства осложнений гестационного процесса (преждевременных родов, задержки роста плода, преэклампсии) — неполноценность процесса плацентации, нет единого мнения о ее основополагающих патогенетических механизмах на самых ранних этапах инвазии синцитиотрофобласта [1, 3].
Рецептивность эндометрия регулируется множеством факторов, в том числе эндометриальной перфузией. Недостаточная перфузия может быть существенным звеном в патогенезе бесплодия. Результаты исследования D. Sardana и соавт. (2014) продемонстрировали связь между снижением рецептивности эндометрия и ухудшением его васкуляризации в лютеиновой фазе цикла [10]. Неполноценность плацентации, несомненно, характеризуется неполноценной эндоваскулярной инвазией трофобласта и неполным ремоделированием спиральных артерий (СА), что отчасти лежит в основе неудач ЭКО, а также осложнений гестационного процесса [8].
Трехслойная структура и толщина свыше 7 мм — основные сонографические маркеры рецептивности эндометрия, однако опора на эти признаки часто приводит к ложноположительным результатам. Адекватное кровоснабжение эндометрия — необходимое условие для успешной имплантации. В норме перфузия на уровне СА обнаруживается в лютеиновой фазе цикла. Как известно, высокие значения пульсационного индекса в маточных артериях — предиктор неудач имплантации [13, 14]. Не вызывает сомнений, что васкуляризация эндометрия — признак, обладающий определенной прогностической ценностью в отношении успеха имплантации при переносе эмбриона (ПЭ). Поскольку бластоциста имплантируется в эндометрий, целесообразно косвенно оценивать его рецептивность по адекватности васкуляризации.
В последние годы именно в этой области сосредоточен интерес специалистов репродуктивной медицины. Поиск предикторов успеха имплантации с высокой прогностической ценностью, доступных выявлению неинвазивными методами, остается актуальным.
Цель исследования: обосновать целесообразность рутинного применения трансвагинальной ультразвуковой доплерографии (ТВУЗДГ) перед ПЭ для оценки вероятности успеха имплантации эмбриона при ЭКО.
МАТЕРИАЛЫ И МЕТОДЫ
В ретроспективное сравнительное исследование вошли женщины (n = 101), которым был выполнен 101 цикл ЭКО и ПЭ в клинике ВРТ «Дети из пробирки» (Москва) в период с 1 января 2014 г. по 30 ноября 2015 г. включительно. ПЭ проводили как в протоколе стимуляции овуляции (при низком риске развития синдрома гиперстимуляции яичников), так и в криопротоколе. Выполняли перенос двух эмбрионов.
Критерии включения: возраст моложе 41 года; хорошее качество эмбрионов; в исследование вошли женщины, состоявшие в бесплодном браке, с первичным и вторичным бесплодием, обусловленным различными факторами (хроническим эндометритом, трубным фактором, эндометриозом, синдромом поликистозных яичников), в том числе с бесплодием неясного генеза.
Критерии исключения: плохое качество эмбрионов; наличие внутриматочных синехий, субмукозного узла миомы матки, узлов миомы матки диаметром 4 см и более, гидросальпинкса, тяжелых экстрагенитальных заболеваний.
Участниц разделили на две группы в зависимости от исходного характера перфузии эндометрия: в первой группе (n = 38) кривые скоростей кровотока (КСК) были зарегистрированы на всех уровнях сосудистого русла матки; во второй группе (n = 63) КСК отсутствовали на уровне СА.
Трансвагинальное УЗИ выполняли на 2-й день спонтанного или индуцированного менструального цикла. Повторно толщину эндометрия (ТЭ) определяли через неделю после начала индукции пролиферации (на 9-й день менструального цикла). ТВУЗДГ проводили всем пациенткам в менструальном цикле, предшествовавшем ПЭ. В ходе слепого трансвагинального УЗИ и ТВУЗДГ (специалист не знал результатов клинического обследования) в середине лютеиновой фазы цикла (на 19–22-й день менструального цикла) оценивали показатели сосудистого русла матки на уровнях левой и правой маточных, аркуатных, радиальных, базальных артерий, СА.
Трансвагинальное УЗИ и ТВУЗДГ делали, используя сканер Esaote MyLab 70 (Esaote, Италия), кавитальный датчик 6–10 МГц. Последовательно получали изображения матки и яичников в сагиттальной и поперечной плоскостях в режимах серошкальной эхографии (2D), цветного доплеровского кодирования и импульсно-волнового доплера. В режиме импульсно-волнового доплера получали огибающую доплеровского спектра при частоте повторения импульсов 750 Гц, фильтр устанавливали на уровне 50 Гц, при оценке кровотока на уровне СА максимальная скорость потока составляла 6 см/с, а уголнезависимый показатель (индекс резистентности — RI) определяли в автоматическом режиме. При значениях RI ≤ 0,52 на уровне СА васкуляризацию эндометрия расценивали как адекватную.
На этапе прегравидарной подготовки все женщины получали препарат фолиевой кислоты (фолиевая кислота 400 мкг + цианокобаламин (Фолибер) по 1 табл./сут в течение 3 месяцев и до наступления беременности). Контролируемую индукцию суперовуляции проводили по протоколу: десенситизация гипоталамо-гипофизарно-яичниковой системы с применением аналогов ГнРГ (трипторелин по 0,1 мг/сут подкожно в течение 14 дней) и непосредственным переходом к использованию индукторов овуляции (фоллитропин альфа по 150 ME/сут внутримышечно по схеме), в качестве триггера овуляции назначали ХГЧ по 10 000 МЕ внутримышечно однократно. Мониторинг роста фолликулов производили путем фолликулометрии с помощью трансвагинального УЗИ и оценки концентрации эстрадиола в сыворотке крови микроиммунофлюоресцентным методом (нормативные значения для первой фазы менструального цикла ― 23–179 пг/мл); оценивали наличие овуляции и размеры желтого тела.
В циклах ЭКО, в которых выполняли криоПЭ, для индукции пролиферации эндометрия использовали препараты эстрадиола со 2-го дня менструального цикла (17β-этинилэстрадиол по 1,0 мг/сут трансдермально) при отсутствии кист в яичниках и ТЭ менее 5 мм. Для поддержки лютеиновой фазы цикла применяли препараты прогестерона (микронизированный прогестерон в дозе 200 мг/сут интравагинально).
Через 14 дней после ПЭ всем пациенткам определяли уровень β-ХГЧ в периферической крови. При уровне β-ХГЧ более 50 МЕ/л тест на наличие беременности считали положительным.
Математическую обработку полученных результатов производили с использованием методов описательной статистики на персональном компьютере с помощью программы Exсel 2007. Доверительный интервал (ДИ) указан как M ± m, где M — медиана, а m = 2σ (2 стандартных отклонения). Различия считали достоверными при р < 0,05.
РЕЗУЛЬТАТЫ
Группы были сопоставимы по возрасту и массе тела. Средний возраст составил 32,7 ± 4,9 года, средний ИМТ — 27,1 ± 2,9 кг/м2. В результате исследования выявлены статистически значимые различия исходной васкуляризации эндометрия в зависимости от возраста, длительности и причины бесплодия (табл. 1, 2).
Таблица 1
Зависимость наличия кривых скоростей кровотока на уровне спиральных артерий от возраста женщин и длительности бесплодия
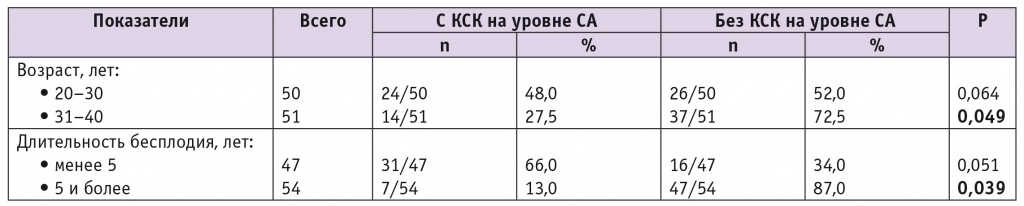
Примечание. В таблицах 1–3: КСК — кривые скоростей кровотока; СА — спиральные артерии.
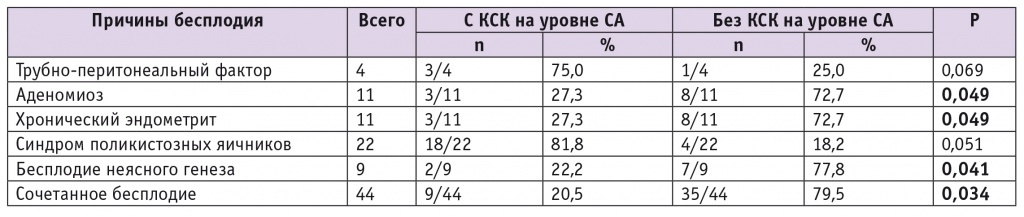
Таблица 2
Распределение причин бесплодия среди обследованных женщин
Среди женщин в возрасте 20–30 лет КСК на уровне СА определялись в 1,7 раза чаще, чем у участниц в возрасте от 31 года до 40 лет; в подгруппе от 31 года различия между долями женщин с наличием и отсутствием КСК на уровне СА были значимыми (р = 0,049) (см. табл. 1, рис. 1). При бесплодии длительностью менее 5 лет КСК на уровне СА регистрировали у 66,0% пациенток, а 5 лет и более — лишь у 13,0% (в 5,1 раза реже); в подгруппе с длительностью бесплодия от 5 лет выявлены достоверные различия между долями пациенток с наличием и отсутствием КСК на уровне СА (р = 0,039).
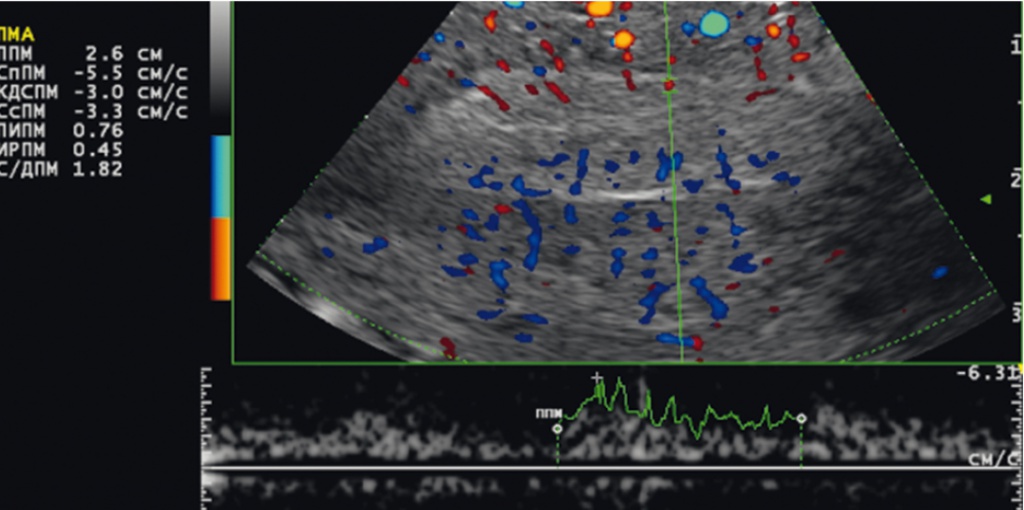
Рис. 1. Кривые скоростей кровотока на уровне спиральных артерий у пациентки 25 лет из первой группы (трубно-перитонеальный фактор). Фото Е. А. Девятовой
Установлено, что в сравнении с первой группой в группе с отсутствием КСК на уровне СА пациенток с сочетанным бесплодием было в 3,9 раза больше (79,5%; р = 0,034), с бесплодием неясного генеза — в 3,5 раза больше (77,8%; р = 0,041), с аденомиозом и хроническим эндометритом — в 2,7 раза больше (в обоих случаях 72,7%; р = 0,049) (см. табл. 2, рис. 2).
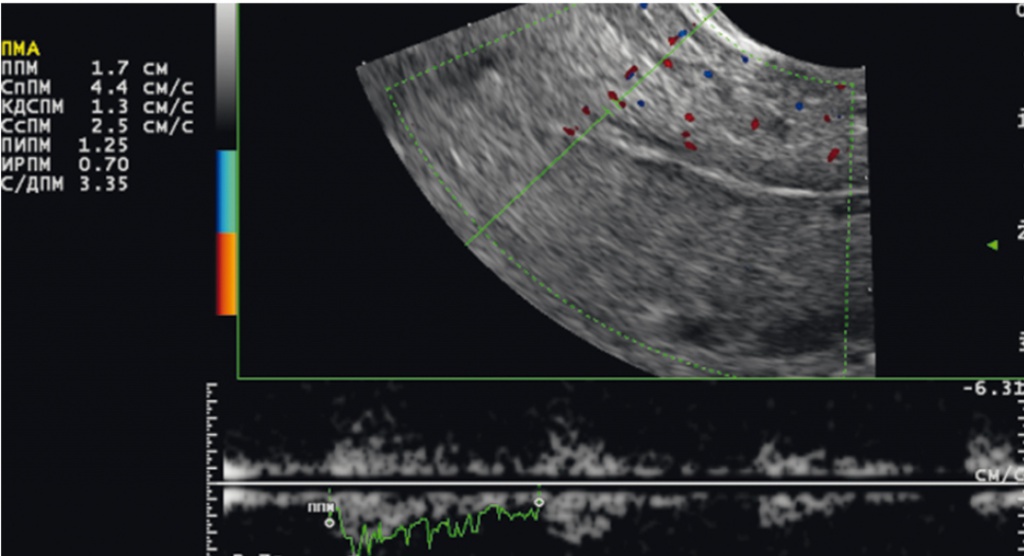
Рис. 2. Отсутствие кривых скоростей кровотока (КСК) на уровне спиральных артерий у пациентки 39 лет из второй группы (сочетанное бесплодие: аденомиоз II степени и хронический эндометрит). КСК определяются на уровне базальных артерий (индекс резистентности ― 0,70). Фото Е. А. Девятовой
Установлены внутригрупповые различия частоты наступления беременности (ЧНБ) на ПЭ в зависимости от ТЭ (табл. 3). Так, при ТЭ 8–11 мм ЧНБ на ПЭ в обеих группах была выше (р < 0,05), чем при значениях ТЭ менее 8 мм и более 11 мм, и составила в первой и второй группах 77,3% и 51,3% соответственно (р = 0,043). При ТЭ менее 8 мм ЧНБ на ПЭ была наименьшей (37,5% и 11,8% соответственно), и различия между группами при этом также были достоверными (р = 0,039). При значениях ТЭ более 11 мм данный показатель составил 50,0% в первой группе и 42,9% во второй. Суммарная ЧНБ на ПЭ была достоверно выше при исходной регистрации КСК на всех уровнях сосудистого русла матки, составив 63,1% в первой группе против 39,7% во второй (р = 0,045).
Таблица 3
Частота наступления беременности на перенос эмбриона в протоколах экстракорпорального оплодотворения
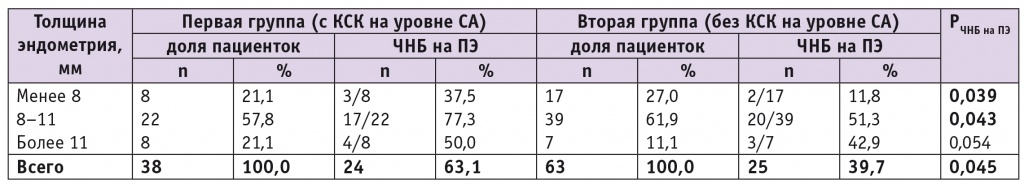
Примечание. ПЭ — перенос эмбриона; ЧНБ — частота наступления беременности.
ОБСУЖДЕНИЕ И ВЫВОДЫ
Исследователи подтверждают, что толщина и структура эндометрия, а также его адекватная васкуляризация — полезные прогностические признаки в отношении успеха ПЭ в циклах ЭКО [10, 13]. Данные о минимально допустимой ТЭ для успешного наступления беременности в литературе разнятся. Как правило, при ТЭ менее 7 мм беременность после ПЭ не наступает, однако в литературе имеются указания на случаи наступления беременности при ТЭ 6 мм и даже 4 мм [14]. Вместе с тем ТЭ свыше 14 мм ассоциирована с высоким риском потери беременности [13].
В нашем исследовании более высокая ЧНБ на ПЭ (63,1%) отмечена в группе с исходной регистрацией КСК на всех уровнях сосудистой сети матки. При ТЭ менее 6 мм беременность наступила лишь у одной женщины.
В литературе представлены разноречивые данные по оценке корреляции между васкуляризацией эндометрия и субэндометриального слоя и частотой имплантации эмбриона в спонтанном цикле и в цикле ЭКО [13, 14]. Несомненно, оценка васкуляризации эндометрия — полезное диагностическое исследование, обладающее клинической ценностью для определения вероятности имплантации в циклах ЭКО. В ряде работ показано, что измерение интраэндометриального кровотока играет первостепенную роль в косвенной оценке рецептивности эндометрия и его результаты могут определять прогноз имплантации, а оценка васкуляризации эндометрия перед ПЭ в циклах ЭКО — надежный способ прогнозирования успеха имплантации [1, 3, 13].
В исследовании выявлена взаимосвязь суммарной ЧНБ на ПЭ и исходной васкуляризации на уровне СА: 63,1% против 39,7% в группе, в которой КСК на уровне СА отсутствовали. В первой группе суммарная ЧНБ на ПЭ была в 1,6 раза выше, чем во второй (p = 0,045), что подтверждает значимость метода ТВУЗДГ для прогнозирования вероятного успеха ПЭ в циклах ЭКО. Очевидно, что данный метод оценки состояния эндометрия позволяет выделить группу риска неудач имплантации, провести целенаправленную прегравидарную подготовку при отсутствии адекватной перфузии эндометрия таким пациенткам и отказаться от переноса двух/трех эмбрионов, тем самым снизив риск многоплодия при лечении бесплодия методом ЭКО.
ЗАКЛЮЧЕНИЕ
Перед переносом эмбриона (ПЭ) в циклах ЭКО для определения вероятности успеха имплантации целесообразно проводить комплексную оценку толщины и васкуляризации эндометрия методом трансвагинальной ультразвуковой доплерографии (ТВУЗДГ). Такой диагностический подход, введенный в рутинную практику, позволит выделить группу высокого риска и провести этим пациенткам прегравидарную подготовку, направленную на снижение риска неудач имплантации, а в конечном счете уменьшить число неудач имплантации при ПЭ и повысить эффективность ЭКО.








