Последние десятилетия ознаменованы активным развитием ВРТ, широким внедрением новых методов в медицинскую практику. Тому есть несколько причин: частота встречаемости пар с бесплодием из года в год не меняется и даже имеет тенденцию к росту; с возникновением новых методов ВРТ появилась возможность помочь парам с ранее неизлечимыми формами бесплодия; изменилось репродуктивное поведение населения (возраст перворождающих зачастую превышает 35 лет) [1, 2].
Новые условия требуют создания новых подходов к разработке способов профилактики врожденных и наследственных нарушений у потомства пациентов, включенных в программу ВРТ, так как главная задача, решаемая с помощью вспомогательных технологий — рождение здорового ребенка.
Успех ВРТ зависит прежде всего от двух факторов: от правильно подобранного алгоритма стимуляции суперовуляции у конкретной женщины и от генотипа эмбриона. В отношении предотвращения рождения генетически больного ребенка передовым направлением в клинической практике становится преимплантационная генетическая диагностика (ПГД), важным преимуществом которой является полноценное исследование эмбриона до момента переноса его в организм матери. Профилактические мероприятия в рамках ВРТ при этом сводятся к селекции и переносу единственного здорового эмбриона в полость матки.
Исследование клеток неразвивающегося хориона, полученного в рамках программы ВРТ, показало, что анеуплоидия может быть представлена любой из 24 хромосом. Следовательно, для достижения главной цели ЭКО — рождения здорового потомства — необходимо до переноса эмбриона в полость матки исследовать у него максимально возможное количество хромосом.
За время развития методов преимплантационного генетического скрининга (ПГС) возможности исследователей выросли от изучения единичных хромосом (методом флуоресцентной гибридизации in situ — англ. fluorescence in situ hybridization) до работы с 24 хромосомами. Существующий на сегодняшний день метод микроматричной сравнительной геномной гибридизации (англ. array comparative genomic hybridization — aCGH) зарекомендовал себя как высокоэффективный способ оценки анеуплоидий в единичных клетках эмбриона и стал золотым стандартом. С введением в практику витрификации эмбрионов на стадии бластоцисты биопсию трофэктодермы начали проводить на 5-е сутки, что дало возможность получить от эмбриона большее количество клеток, а следовательно и ДНК. Казалось бы, результат должен был быть однозначным, но на практике оказалось совсем не так. Доказано, что на стадии доимплантационного развития у большой доли эмбрионов наблюдается мозаицизм [8, 16]. Точного ответа на вопрос, какая часть клона имеет анеуплоидию, а какая — нормальный хромосомный набор, не может дать ни один из существующих в настоящее время методов. Однако соотношение нормального и патологического клонов имеет большое значение для дальнейшего развития эмбриона. То, что перенос эмбрионов без генетической патологии в разы повышает уровни имплантации и вероятность вынашивания беременности, уже ни у кого не вызывает сомнений. Z. Yang и соавт. в своей работе рекомендуют селективно переносить как можно меньше эмбрионов с учетом возраста, анамнеза и проведенных ранее циклов и при этом предварительно проводить ПГС [19]. При переносе только одного эмбриона после ПГС беременность получена в 70,9% наблюдений [19].
До сих пор остается открытым вопрос о мозаицизме, незначительных делециях/дупликациях в кариотипе у эмбрионов. Даже метод аCGH не всегда позволяет точно определить, есть ли у конкретного эмбриона мозаицизм, делеции/дупликации. Данные высокопроизводительного секвенирования (англ. next generation sequencing — NGS) более четко указывают на наличие мозаицизма у преимплантационных эмбрионов, что дает возможность точнее выбрать здоровые эмбрионы для переноса.
Метод NGS принципиально отличается от других методов ПГС. Он основан на определении последовательности нуклеиновых кислот. Для получения результата вначале исследуемую ДНК модифицируют и создают коллекцию случайных фрагментов нужной структуры.
К основным этапам NGS можно отнести:
-
выделение ДНК, получение ее фрагментов определенной длины;
-
прикрепление адаптеров по краям фрагментов;
-
амплификацию каждого фрагмента ДНК;
-
определение нуклеотидной последовательности фрагментов ДНК;
-
биоинформатический анализ данных.
Эта технология в последнее время находит все более широкое применение в клиниках ВРТ за рубежом, вытесняя метод аCGH. Публикации ряда авторов доказывают ее преимущества перед другими. Так, Y. Tan и соавт. (2014), проведя исследования эмбрионов методами NGS и генотипирования однонуклеотидных полиморфизмов (англ. single nucleotide polymorphism — SNP), показали, что эти подходы обеспечивают сравнимую точность и эффективность у эуплоидных эмбрионов [17]. Однако при изучении анеуплоидных образцов в семи случаях результаты NGS и SNP не совпали, дополнительный анализ был проведен с использованием метода количественной флуоресцентной ПЦР (англ. quantitative fluorescence polymerase chain reaction — QF-PCR). При сравнительном анализе среди результатов SNP были выявлены два ложноположительных и четыре ложноотрицательных образца, которые по данным NGS были точно дифференцированы. Трисомия по Y-хромосоме также была выявлена с использованием метода NGS, но не SNP [17].
Бóльшую надежность метода NGS при ПГС продемонстрировали и другие авторы. Проведя сравнительный анализ данных, полученных при исследовании эмбрионов методами NGS и аCGH, F. Fiorentino и соавт. (2014) показали, что некоторые анеуплоидии хромосом, выявленные методом NGS и подтвержденные при проведении QF-PCR, не были обнаружены посредством аCGH [4].
S. Zozula и соавт. (2015) проанализировали методом NGS 53 образца ДНК эмбрионов, которые после ранее проведенного aCGH были признаны эуплоидными [20]. Повторный анализ выявил в них статистически значимый рост уровня мозаицизма (на 24,6%; р < 0,05), 17% эмбрионов в связи с высокой частотой этой патологии были реклассифицированы как анеуплоидные. Таким образом, NGS в сравнении с aCGH продемонстрировал бóльшие чувствительность и специфичность в отношении детекции мозаицизма.
Цель исследования: оценить эффективность метода NGS для выявления анеуплоидий эмбрионов, полученных в программах ВРТ.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнена в лаборатории молекулярной генетики Перинатального медицинского центра ЗАО «МД ПРОЕКТ 2000» (ГК «Мать и дитя») (заведующая лабораторией — д. б. н. Ж. И. Глинкина) с января по май 2016 г.
В исследование были включены супружеские пары с нормальным кариотипом. Материалом для изучения служили клетки трофэктодермы, полученные от эмбрионов в рамках программы ЭКО. Биопсию трофэктодермы проводили на 5-е сутки развития эмбрионов. Были исследованы 254 эмбриона, взятые от 97 пациенток; возраст женщин составлял от 22 до 48 лет, в среднем 37 лет (± 6,3 года). У 6 пациенток было проведено по два цикла стимуляции. Все эмбрионы получены оплодотворением методом ИКСИ.
Стимуляцию суперовуляции выполняли в соответствии со стандартными протоколами в зависимости от гормонального профиля и индивидуальных особенностей женщины.
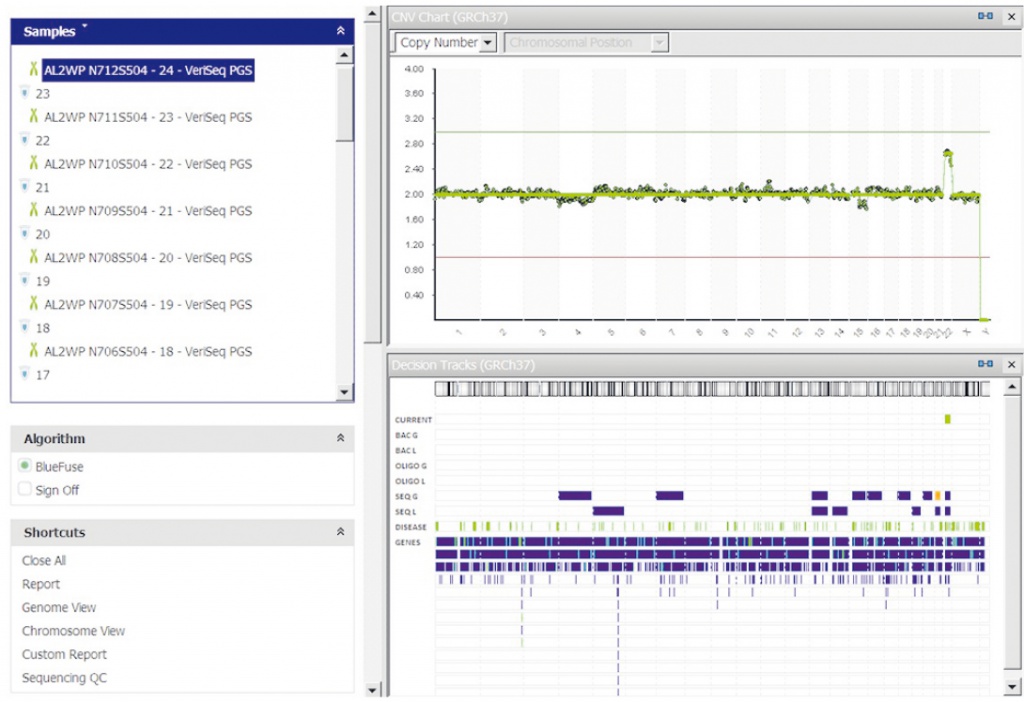
ПГС проводили согласно технологии фирмы Illumina (США) на приборе MiSeq. ДНК из клеток трофэктодермы выделяли методом полногеномной амплификации. Данные, полученные прибором, обрабатывали с помощью программного обеспечения BlueFluse Multi (Illumina) (рис. 1). Интерпретацию результатов секвенирования проводили в автоматическом режиме на основании оценки количества прочтений участков хромосом. Результат анализа для врача был представлен в виде графика, где по оси Х были расположены хромосомы, а по оси Y — количество анализируемых хромосом.
Рис. 1. Внешний вид результата анализа в программе BlueFluse Multi
РЕЗУЛЬТАТЫ
Полногеномная амплификация клеток трофэктодермы была проведена на клетках от эмбрионов согласно протоколу Illumina. Для анализа качества полученной ДНК и проверки на наличие контаминации применяли электрофорез, который показал отсутствие ДНК в присланных контролях и в пяти образцах, что составило 1,96%. Таким образом, в дальнейшее исследование были включены 249 образцов.
Анализ секвенирования в 162 образцах из 249 (65,1%) выявил генетическую патологию. Частота выявления патологических эмбрионов в разных возрастных группах представлена в таблице 1.
Таблица 1
Частота выявления патологических эмбрионов в зависимости от возраста женщин
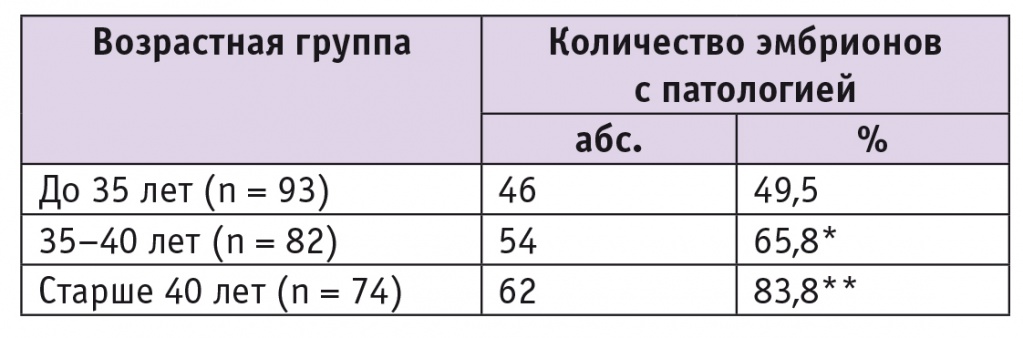
* P = 0,034 при сравнении с группой до 35 лет.
** P = 0,011 при сравнении с группой 35–40 лет.
Частота верификации эмбрионов с патологией у женщин 35–40 лет оказалась достоверно выше, чем у пациенток до 35 лет (р = 0,034), а в группе старше 40 лет она превышала показатель в группе 35–40 лет (р = 0,011).
Проведенный анализ показал, что анеуплоидия одной хромосомы имела место в 86 из 162 наблюдений (53,0%); двух — в 38 (23,5%); более двух хромосом — в 38 (23,5%), в том числе множественные анеуплоидии (более 5 хромосом) были выявлены у 10 из 38 эмбрионов (26,3%) (табл. 2).
Таблица 2
Зависимость патологических изменений в эмбрионе от возраста женщин
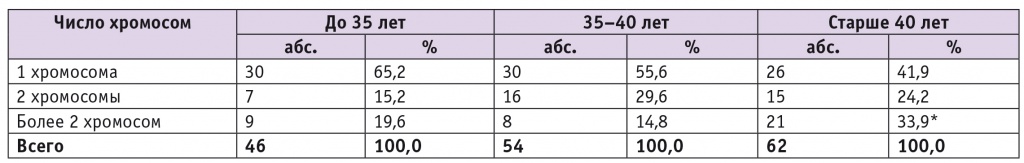
* P = 0,020 при сравнении с группами до 35 лет и 35–40 лет.
Нами не установлено различий по частоте патологических изменений, представленных одной или двумя хромосомами, в сравниваемых возрастных группах. Частота патологии более чем в двух хромосомах у женщин в возрасте до 35 лет и 35–40 лет также не различалась, однако была статистически значимо выше в группе пациенток старше 40 лет (р = 0,020).
Детальный анализ результатов показал, что частота встречаемости патологии (моносомия, трисомия, делеции, дупликации, мозаицизм) хромосом 15, 16, 21, 22 была выше по сравнению с другими хромосомами. В расчет не брали эмбрионы с множественными анеуплоидиями.
Всего у 152 эмбрионов с патологией было проанализировано 3648 хромосом. Количество эуплоидных хромосом составило 3384 (92,8%), анеуплоидных — 264 (7,2%).
В возрастной группе до 35 лет патология была выявлена в 62 из 3648 хромосом (1,7%); в группе 35–40 лет — в 82 из 3648 (2,2%). В группе старше 40 лет патология обнаружена в 120 из 3648 хромосом (3,3%). Структура генетических изменений в указанных группах представлена в таблице 3.
Таблица 3
Структура генетических изменений в разных возрастных группах (проанализировано 3648 хромосом у 152 эмбрионов)
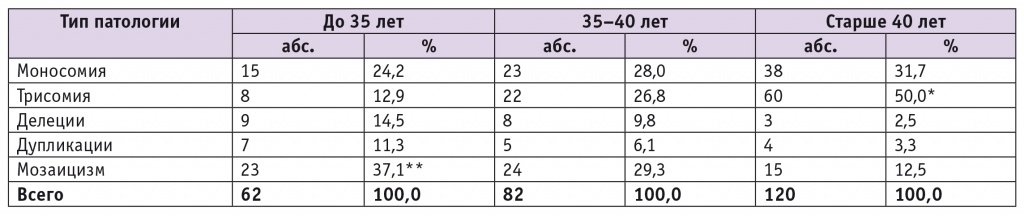
* P < 0,01 при сравнении с группами до 35 лет и 35–40 лет.
** P < 0,01 при сравнении с группами 35–40 лет и старше 40 лет.
Примечание. Из анализа были исключены 10 эмбрионов с множественными анеуплоидиями.
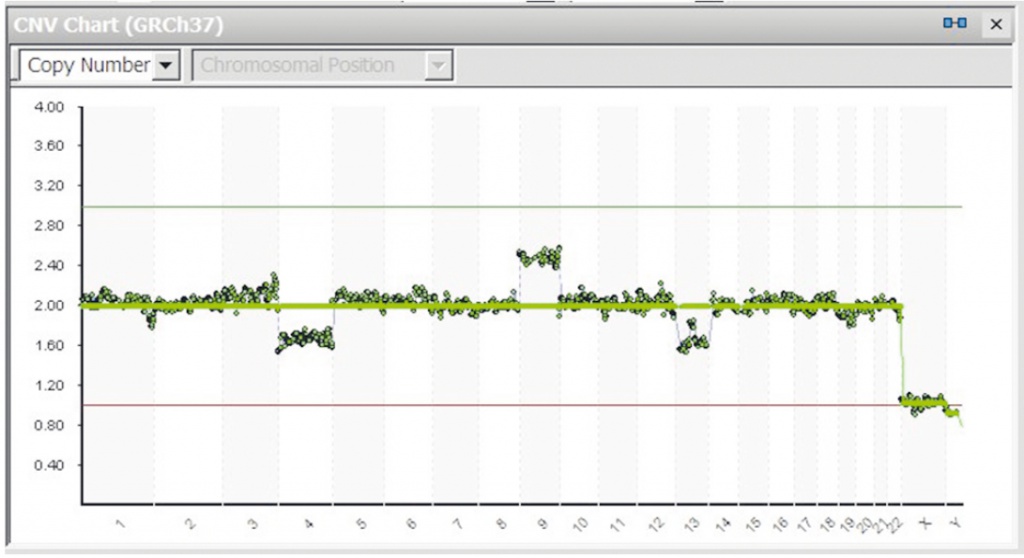
Изучение уровня мозаицизма (см. табл. 3, рис. 2) показало, что наиболее высоким он был в возрастной группе до 35 лет: 37,1% против 29,3% в группе 35–40 лет и 12,5% — старше 40 лет (в обоих случаях р < 0,01).
Рис. 2. Мозаицизм хромосом 4, 9 и 13 в клетках трофэктодермы эмбриона 5-го дня развития
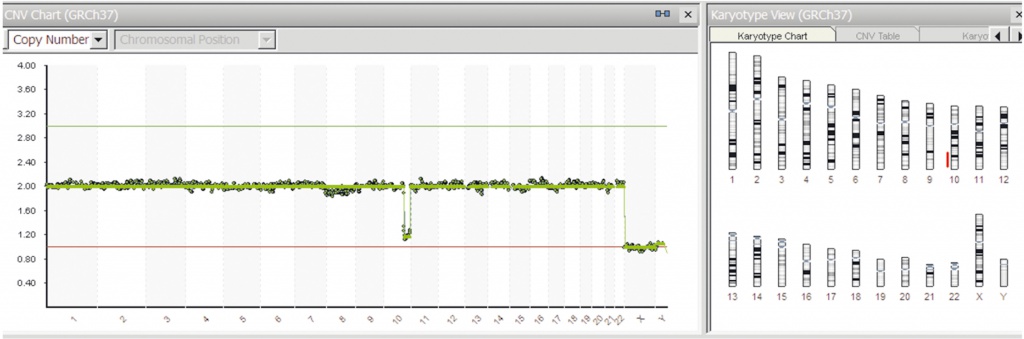
Особый интерес представляет изучение в клетках трофэктодермы делеций и дупликаций. Частота делеций/дупликаций (см. табл. 3, рис. 3) оказалась выше (р < 0,05) в возрастных группах до 35 лет (16 из 62 наблюдений; 25,8%) и 35–40 лет (13 из 82 наблюдений; 15,9%) по сравнению с группой старше 40 лет (7 из 120 наблюдений; 5,8%).
Рис. 3. Частичная делеция длинного плеча хромосомы 10 в клетках трофэктодермы эмбриона 5-го дня развития
ОБСУЖДЕНИЕ И ВЫВОДЫ
В последние годы в мире бурно развиваются молекулярно-генетические методы исследования, которые изменяют известные представления о возможных причинах возникновения патологических состояний человека. Доказано, что нарушения репродуктивной функции могут быть обусловлены как хромосомными изменениями, генными мутациями у самих родителей, так и возникновением в их половых клетках мутаций de novo. Этот факт указывает на необходимость проявлять настороженность при использовании методов ВРТ у таких супружеских пар.
За более чем 20 лет применения ПГС в мире накоплены многочисленные данные о частоте генетических нарушений в эмбрионах. Эти данные с каждым годом пополняются и уточняются с введением в практику новых методов исследования (табл. 4).
Таблица 4
Уровни анеуплоидии в эмбрионах по данным разных авторов
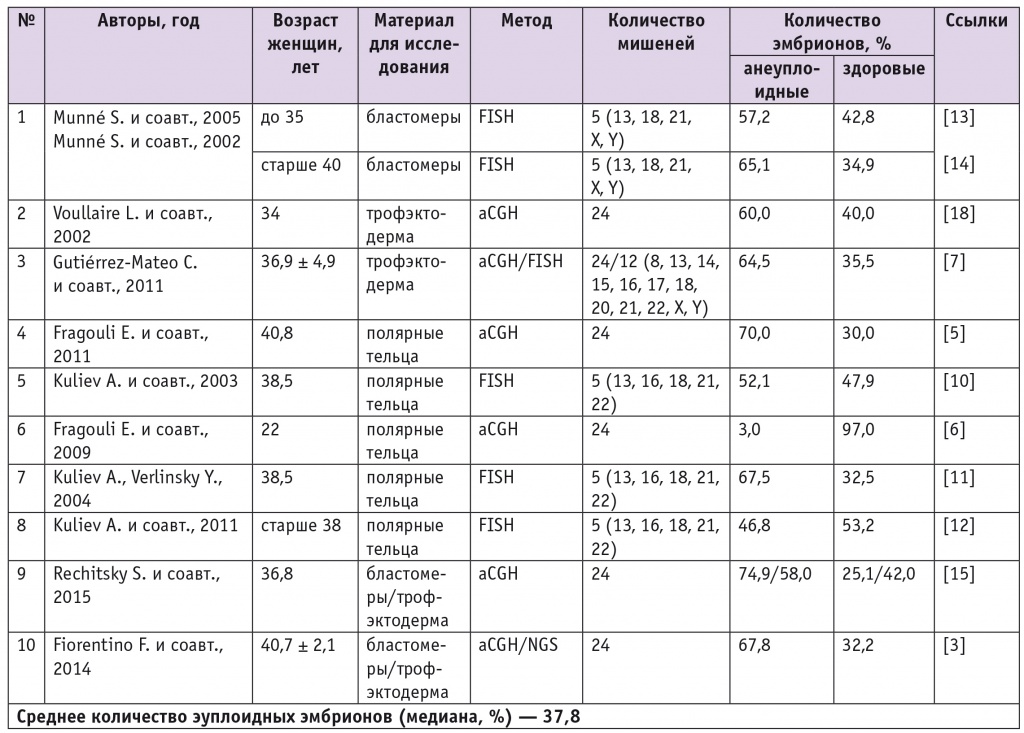
Примечание. aCGH — array comparative genomic hybridization (микроматричная сравнительная геномная гибридизация); FISH — fluorescence in situ hybridization (флуоресцентная гибридизация in situ); NGS — next generation sequencing (высокопроизводительное секвенирование).
Результаты исследований всех авторов указывают на высокую частоту анеуплоидий в преимплантационных эмбрионах, и этот показатель зависит от возраста женщин. Полученные нами данные не противоречат этим представлениям, после 40 лет процент анеуплоидных эмбрионов составляет 83,8%.
В ходе проведенного исследовании в группах до 35 лет, 35–40 лет и старше 40 лет выявлены различия в частоте и структуре генетической патологии. Мозаицизм и делеции/дупликации чаще встречались в возрасте до 40 лет (мозаицизм — у 37,1% и 29,3% в группах до 35 и 35–40 лет соответственно против 12,5% в группе старше 40 лет; делеции/дупликации — у 25,8% и 15,9% в группах до 35 и 35–40 лет соответственно против 5,8% в группе после 40 лет), а трисомии — чаще в группе женщин старше 40 лет (у 50,0% против 12,9% в группе до 35 лет и 26,8% в группе 35–40 лет). Безусловно, этот факт необходимо учитывать при планировании программ ВРТ у пациенток старше 40 лет. Женщины этого возраста должны проходить медико-генетическое консультирование, их необходимо информировать о высоком риске возникновения генетической патологии в эмбрионах (частота трисомий — 50,0%). Вместе с тем следует повышать информированность врачей всех специальностей о ВРТ [9] и возможностях метода NGS.
Как было показано выше, метод NGS позволяет четко диагностировать в эмбрионах мозаицизм, делеции и дупликации. Выявление такого рода патологии требует изменить подход к консультированию супружеских пар клиническим генетиком. Врач должен знать роль тех или иных обнаруженных вариаций в биологических процессах, свободно владеть базами данных, в которых собрана информация о значении генетических изменений. В настоящее время создано несколько баз данных, позволяющих проверить те или иные данные. Например, информация о клинически значимых вариациях генома человека представлена в базе OMIM (англ. Online Mendelian Inheritance in Man — онлайн-проект «Менделевское наследование у человека»). Одной из известных баз является dbSNP (англ. db Single nucleotide polymorphism — база данных по однонуклеотидному полиморфизму), где представлены SNP, делеции и т. д. Существуют даже базы, где собрана информация о вариантах нормы: НарМар (проект «Гаплоидный геном»), DGV (англ. Database of Genomic Variants — база данных геномных вариантов) и др.
Расположение вариации также может иметь значение. В частности, если вариация находится в кодирующей последовательности, она способна оказывать влияние на рамку считывания или привести к замене аминокислоты. Разработаны специальные программы, позволяющие на основании информации о месте расположения генетической особенности сделать вывод о ее биологической роли.
ЗАКЛЮЧЕНИЕ
Преимплантационная генетическая диагностика методом высокопроизводительного секвенирования является на сегодняшний день самым точным способом выявления генетической патологии у эмбрионов и может быть рекомендована к применению в рамках вспомогательных репродуктивных технологий как профилактическая мера в отношении невынашивания беременности и рождения больного ребенка.








