Согласно «Глобальной статистике рака» от 2020 г., у 1 из 70 женщин на планете диагностируют рак яичников (РЯ)[1]. Стандартизированный по возрасту показатель заболеваемости РЯ составляет 6,6 на 100 000 женщин, стандартизованный показатель смертности — 3,9 на 100 000 женщин[1]. Эпидемиология РЯ в России аналогична мировым показателям: для женщин в возрасте 30–59 лет стандартизированный по возрасту показатель заболеваемости РЯ составляет 6,2%, для женщин до 30 лет — 3,5%. Большинство (более 90%) злокачественных новообразований яичников относят к эпителиальным опухолям, которые включают серозные карциномы высокой и низкой степени злокачественности, эндометриальные, муцинозные и светлоклеточные карциномы[2].
Средний возраст выявления РЯ составляет 58–60 лет: 40% заболевших находятся в возрасте 30–60 лет, 3–17% — моложе 40 лет. Большинство женщин с ЭРЯ (60–75%) имеют запущенную стадию заболевания при первичном обращении в медицинское учреждение, а общая пятилетняя выживаемость этих пациенток не превышает 45%[1]. Существуют 2 основные теории происхождения большинства серозных опухолей яичников высокой степени злокачественности первичного рака брюшины. Одна из них рассматривает в качестве источника опухоли эпителий фаллопиевой трубы, другая — поверхностный эпителий яичника[3].
Стандартная циторедуктивная операция по лечению больных с РЯ включает экстирпацию матки с придатками, удаление большого сальника и видимых проявлений опухолевого процесса с тазовой и парааортальной лимфаденэктомией или без нее[4]. У женщин репродуктивного возраста с ранней стадией заболевания или заболеванием, ограниченным одним яичником, может быть выполнена органосохраняющая операция с удалением только пораженного яичника. Удаление интактного яичника рекомендуется сразу после реализации репродуктивной функции. Двусторонняя овариоэктомия у женщин репродуктивного возраста сопровождается быстрым развитием климактерических расстройств, включая вазомоторные симптомы, нарушение сна, когнитивные нарушения, сексуальную дисфункцию, вагинальные симптомы и снижение минеральной плотности костной ткани[4].
В исследовании, посвященном изучению здоровья медицинских сестер, проведенном в 2009 г., 29 380 женщин перенесли гистерэктомию по поводу доброкачественного заболевания, у 16 345 (55,6%) была выполнена гистерэктомия с двусторонней овариоэктомией, а 13 035 (44,4%) в том же году перенесли гистерэктомию с сохранением яичников. После 24 лет последующего наблюдения женщин, которые никогда не получали менопаузальную гормональную терапию (МГТ), было выявлено, что двусторонняя овариоэктомия была ассоциирована с повышенным риском смертности от всех причин (отношение рисков (ОР) = 1,12; 95% доверительный интервал (ДИ): 1,03–1,21), не/фатальной коронарной болезнью сердца (ОР = 1,17; 95% ДИ: 1,02–1,35), инсультом (ОР = 1,14; 95% ДИ: 0,98–1,33) и раком легкого (ОР = 1,26; 95% ДИ: 1,02–1,56)[5].
МГТ является эффективным методом коррекции климактерических расстройств и профилактики отдаленных последствий дефицита эстрогенов у женщин с хирургической менопаузой. Однако в связи с тем, что эстрогены регулируют клеточную пролиферацию слизистой оболочки посредством связывания с собственными рецепторами (ER) клетки, а именно с ERα (онкоген) и ERβ (ген-супрессор опухоли, который экспрессируется в 40–60% опухолевых клеток яичников), возникает вопрос о безопасности применения МГТ у пациенток с отягощенным онкологическим анамнезом.
Результаты метаанализа, проведенного в 2018 г., не продемонстрировали прогностического влияния уровней экспрессии ER на показатель выживаемости женщин, имеющих в анамнезе РЯ[6].
Антионкогены BRCA1 и BRCA2 кодируют аминокислотные последовательности ядерных белков, участвующих в регуляции репарации повреждений ДНК и делении клеток. Патогенные варианты в гене BRCA1/2 приводят к хромосомной нестабильности и злокачественной трансформации клеток молочной железы, яичников и других органов. Мутации генов BRCA1 ассоциированы с кумулятивным риском рака молочной железы (РМЖ) в течение жизни до 72% и риском РЯ до 44%. При патогенном варианте гена BRCA2 риск развития РМЖ и РЯ составляет 69 и 17% соответственно. Носители патогенных вариантов в генах BRCA имеют оценочный 80% пожизненный риск РМЖ и 40% пожизненный риск РЯ. Варианты мутаций определяют характер течения онкологического заболевания и терапевтические стратегии[7, 8].
В ряде наблюдательных исследований показано, что у пациенток без РЯ в анамнезе текущее и недавнее использование МГТ связано со статистически значимым, но небольшим увеличением риска РЯ, главным образом серозной и эндометриоидной карциномы. Причем этот риск сохранялся в течение 5 лет после отмены МГТ[9]. В исследовании Women's Health Initiative не отмечено значительного увеличения риска РЯ[10].
В метаанализе 52 эпидемиологических исследований абсолютный риск РЯ при длительном (> 5 лет) использовании МГТ женщинами старше 50 лет составил 1 случай на 10 000 женщин в год, что указывает на очень низкий риск. Метаанализ подтверждает ранее опубликованные результаты исследования Million Women Study[11].
МГТ ассоциирована с усилением ангиогенеза, который может стимулировать рост резидуальных опухолевых клеток у женщин, получающих противоопухолевую терапию по поводу РЯ, или индуцировать развитие таких гормонозависимых заболеваний, как РМЖ. Преимущества в отношении качества жизни для каждой пациентки необходимо сопоставлять с любыми теоретически возможными рисками. Тем не менее прогноз при ранней стадии РЯ благоприятный и отличается низкой частотой рецидивов (менее 10% женщин с рецидивом заболевания при РЯ I стадии), и более продолжительной общей выживаемостью. Риск последствий преждевременной/ранней менопаузы, включая остеопороз, сердечно-сосудистые заболевания, мочеполовые расстройства и деменцию, может перевешивать риски, связанные с применением МГТ. Рецидивы РЯ имеют неблагоприятный прогноз с высокой смертностью (> 90% для стадии IV) и пятилетней общей выживаемостью (менее 25–30%). Показатели качества жизни важны для пациентов как с ранней, так и с поздней стадией заболевания[12, 13].
МГТ является высокоэффективным средством коррекции симптомов менопаузы. Однако метаанализ когортных исследований и исследований случай–контроль продемонстрировал повышенный риск развития РЯ (особенно серозного и эндометриоидного вариантов) среди пользователей без диагностированного РЯ в анамнезе, получавших МГТ более 10 лет. Доказательства эффективности и безопасности МГТ у женщин, перенесших хирургическое лечение по поводу РЯ, ограничены. Три систематических обзора, посвященных изучению безопасности МГТ у больных РЯ после хирургически индуцированной менопаузы, как с онкологической точки зрения (рецидив и выживаемость), так и с точки зрения качества жизни, не продемонстрировали неблагоприятного влияния МГТ на выживаемость у пациенток с перенесенным РЯ. В одном исследовании больные РЯ серозного типа, получавшие МГТ, имели лучшую общую выживаемость[3].
При анализе имеющейся информации выявлено, что использование МГТ после диагностики РЯ не влияло на риск рецидива или выживаемость[14]. Хотя большинство исследований по своему дизайну являются наблюдательными, этот вывод также поддерживается двумя рандомизированными контролируемыми исследованиями (табл. 1). Несколько РКИ выявили улучшение показателя выживаемости у женщин с РЯ, получающих МГТ[15].
Таблица 1. Безопасность менопаузальной гормональной терапии (МГТ) у пациенток с отягощенным анамнезом по раку яичников (РЯ)
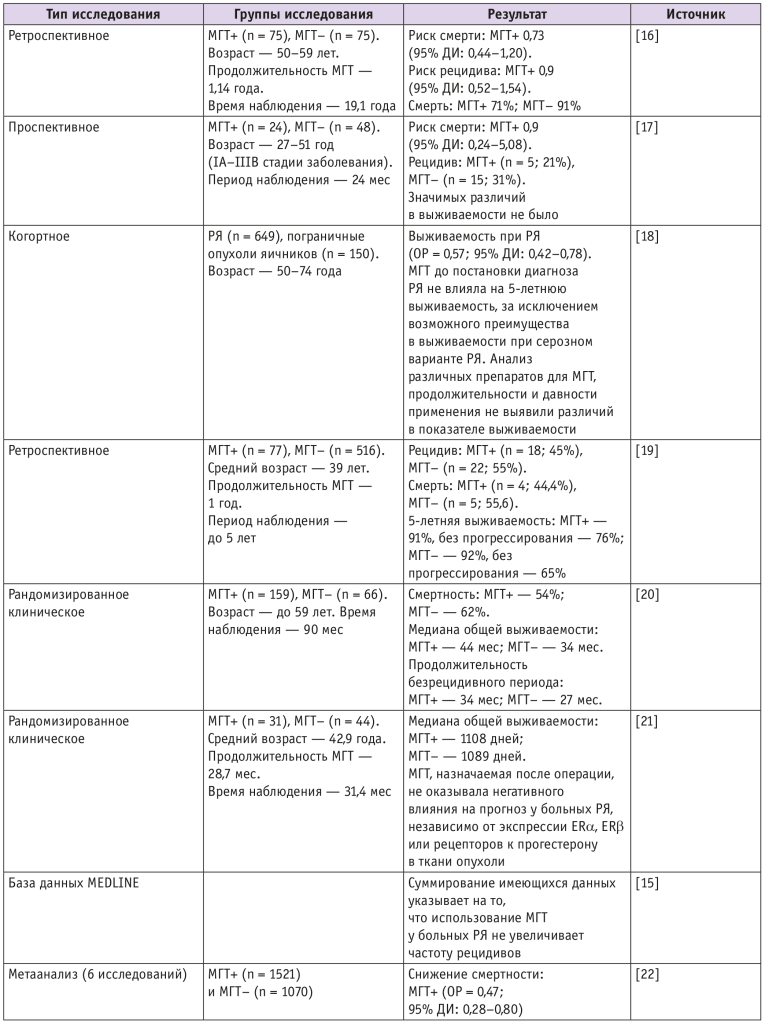
В рекомендациях Международного общества по менопаузе (2016) отмечено, что долгосрочная (> 5 лет) монотерапия эстрогенами может быть ассоциирована с увеличением атрибутивного риска РЯ в возрасте старше 50 лет (1 дополнительный случай на 1000 пользователей и 1 дополнительная смерть на 1700 пользователей). Комбинированная МГТ не сопровождается увеличением соответствующего риска[23].
Французские национальные рекомендации по ведению больных с редкими гистологическими вариантами РЯ и сохранению их фертильности были разработаны 35 экспертами различных специальностей на основе формального консенсуса. К группе редких эпителиальных опухолей яичников относят серозные, муцинозные, эндометриоидные и светлоклеточные аденокарциномы низкой степени злокачественности. Муцинозная и светлоклеточная аденокарцинома являются гормононезависимыми опухолями. Серозные низкой степени злокачественности и эндометриоидные аденокарциномы потенциально гормоночувствительные, что подтверждается исследованиями эффективности терапии антиэстрогенами данных гистологических вариантов новообразований яичников. В связи с этим эксперты отмечают возможность использования МГТ только при муцинозной и светлоклеточной аденокарциноме яичников. Таким образом, возможность назначения МГТ зависит от гормональной чувствительности опухоли и риска его рецидива. МГТ следует проводить только после окончания адъювантного лечения[24].
В целом рекомендуется соблюдать осторожность в случае потенциально чувствительных к гормональной терапии новообразований, таких как опухоли стромы полового тяжа, серозные низкой степени злокачественности и эндометриоидные аденокарциномы, а также серозные пограничные опухоли яичников.
В заявлении Европейского общества по менопаузе и андропаузе и Международного общества гинекологической онкологии о коррекции менопаузальных расстройств после гинекологического рака отмечено: МГТ не связана с риском рецидива и не снижает показатель общей/безрецидивной выживаемости у женщин с несерозными гистологическими вариантами и герминогенными опухолями яичников, хотя доказательства ограничены. В связи с фактом отсутствия четких подтверждений эффективности ингибиторов ароматазы МГТ можно считать приемлемой у пациенток с данными гистологическими вариантами опухолей яичников при низком риске рецидива. У женщин со II–IV стадиями серозного РЯ/брюшины низкой степени злокачественности, а также при прогрессировании заболевания применение МГТ не рекомендовано. Краткосрочное назначение МГТ пациенткам с носительством патологических вариантов генов BRCA1 и BRCA2 после риск-редуцирующей аднексэктомии считается безопасным[25].
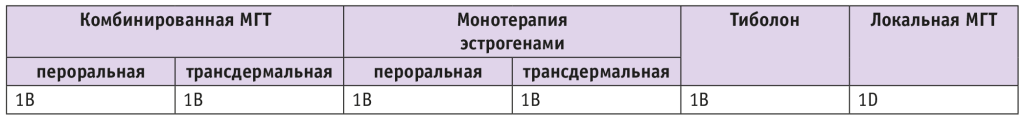
В 2022 г. консорциум научных сообществ по менопаузе разработал инструмент для определения критериев приемлемости назначения МГТ пациенткам с различным соматическим анамнезом и при различных клинических ситуациях Для ранжирования критериев приемлемости МГТ группа экспертов объединила результаты 14 обзоров и 32 метаанализов с учетом характера влияния МГТ на определенные исходы, в интересующих группах женщин, а также рейтингов достоверности полученных результатов Для унификации полученной информации определены следующие критерии приемлемости в соответствии с международной номенклатурой ВОЗ:
-
I категория: нет ограничений использования МГТ;
-
II категория: преимущества перевешивают риски;
-
III категория: риски перевешивают преимущества;
-
IV категория: МГТ не следует использовать.
Качество доказательств было классифицировано как высокое (A), среднее (B), низкое (C) или очень низкое (D).
В исследованиях не было установлено различий в зависимости от типа МГТ или пути введения эстрогена (табл. 2). В настоящее время нет достоверных данных, поддерживающих или исключающих использование МГТ при неэпителиальных опухолях яичников[26].
Таблица 2. Критерии приемлемости назначения менопаузальной гормональной терапии (МГТ) у пациенток, имеющих рак яичников в анамнезе[26]
Эксперты Североамериканского общества по менопаузе (2022) также подтверждают, что, согласно имеющейся информации, использование МГТ у пациенток с отягощенным анамнезом по РЯ не влияет на риск рецидива или выживаемость. Несмотря на имеющиеся результаты исследований, эксперты разработали ключевые положения рекомендаций:
-
у женщин с отягощенным анамнезом по РЯ польза от использования МГТ перевешивает риски, особенно при тяжелых вазомоторных симптомах и ранней менопаузе. Применение МГТ не рекомендовано женщинам с гормонозависимыми вариантами РЯ, включая гранулезоклеточные опухоли и серозную карциному низкой степени злокачественности (уровень доказательности II);
-
краткосрочное использование МГТ можно рассмотреть в ситуации установленного генетического риска (по мутациям BRCA1 и BRCA2) у пациенток младше 50 лет после риск-редуцирующей операции (билатеральной сальпинго-оофрэктомии) (уровень доказательности II)[14].
В руководящих рекомендациях Европейского общества медицинской онкологии и Европейского общества гинекологической онкологии в рамках миссии по улучшению качества медицинской помощи больным РЯ отмечено, что МГТ не противопоказана при тяжелых симптомах менопаузы, однако ее безопасность при низкой степени злокачественности серозных и эндометриоидных опухолях остается не до конца изученной[27]. Принимая во внимание отсутствие единой позиции ряда международных научных сообществ по безопасности применения МГТ при серозном РЯ низкой степени злокачественности, авторы данного обзора не рекомендуют применение МГТ в данной клинической ситуации[14, 27].
При верификации при установленном диагнозе РЯ молодые женщины с большей вероятностью будут испытывать симптомы индуцированной менопаузы вследствие двусторонней овариоэктомии. Эффект эстрогенной депривации заключается не только в формировании большого спектра климактерических расстройств и снижении качества жизни, но и в увеличении риска развития возраст-ассоциированных заболеваний (атеросклероз, остеопороз, ишемическая болезнь сердца, деменция и т. д.)[28].
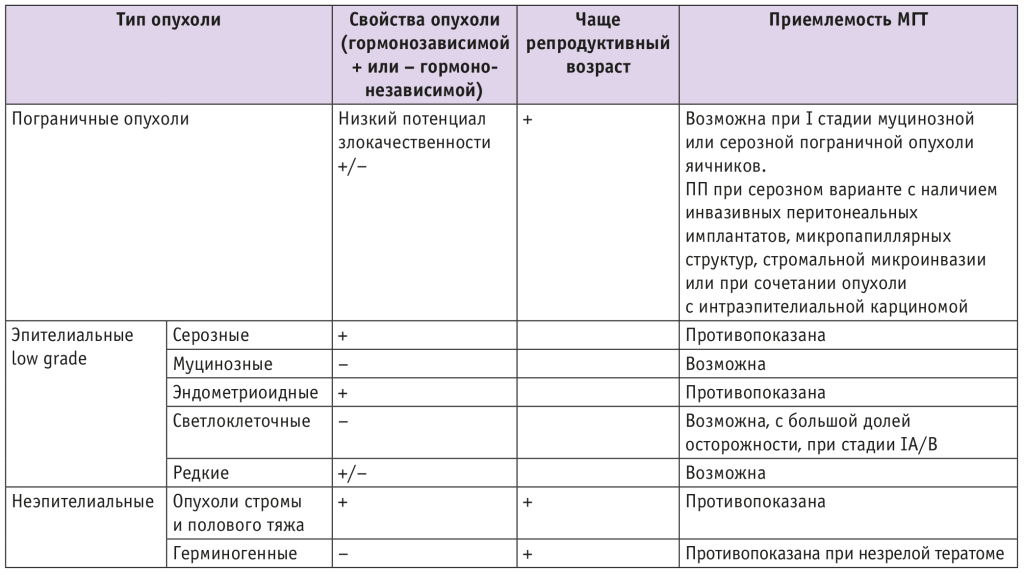
Решение вопроса о возможности назначения МГТ молодым женщинам должно проводиться в формате междисциплинарного консилиума с учетом гистологического типа опухоли, стадии заболевания и его прогноза. В табл. 3 представлена суммарная информация о клинических ситуациях, позволяющих в формате междисциплинарного консилиума решить вопрос о возможности назначения МГТ.
Таблица 3. Решение вопроса о возможности назначения менопаузальной гормональной терапии (МГТ) пациенткам, имеющим рак яичников в анамнезе (в формате междисциплинарного консилиума)
ЗАКЛЮЧЕНИЕ
При решении вопроса о коррекции последствий эстрогендефицитного состояния приоритет — у негормональных методов лечения. Однако пациентки репродуктивного возраста с индуцированной менопаузой после хирургического лечения РЯ требуют индивидуального и междисциплинарного подхода к реабилитации.
Поступила: 22.05.2023
Принята к публикации: 11.07.2023








