Начиная с 2006 г. во всем мире приоритетным направлением в профилактике рака шейки матки (РШМ) наряду с проведением скрининговых программ является вакцинация против ВПЧ. В то же время возможность вакцинации от папилломавирусной инфекции (ПВИ) для первичной профилактики инфицирования и развития РШМ представляет собой одно из главных достижений науки последних десятилетий, ведь определение природы онкологических заболеваний позволило создать только две профилактические вакцины, способные предотвратить онкологические заболевания, — вакцины, направленные против гепатита В и ПВИ.
По данным ВОЗ, ВПЧ является главным инициирующим фактором в генезе РШМ, а также злокачественных процессов вульвы, влагалища, перианальной и орофарингеальной области у мужчин и женщин, а также рака половых органов у мужского населения[1–4].
Статистика говорит о крайне высокой распространенности ВПЧассоциированного рака — ежегодно в мире фиксируют более 600 тыс. новых случаев этой патологии, приблизительно 90% из которых приходится на РШМ, из них более 300 тыс. случаев заканчиваются летальным исходом[5].
В РФ ежегодно регистрируют порядка 15–16 тыс. новых случаев РШМ и более 7 тыс. летальных исходов[6].
Немаловажными показателями, характеризующими запущенность РШМ и качество лечения, являются удельный вес больных с запущенным опухолевым процессом (III–IV стадии), а также летальность пациенток в течение года с момента установления диагноза, которые в РФ в 2015 г. оставались на достаточно высоком уровне: 34,6% и 15,2%, соответственно[7]. В структуре инвалидности 83% в онкогинекологии приходится на РШМ[8]. Заболеваемость РШМ, тенденция к омоложению больных с данной патологией, высокий процент запущенных случаев и, как следствие, рост инвалидности среди женщин трудоспособного возраста — это мировые проблемы, охватывающие наиболее активную, социально значимую часть женского населения[9]. Пик инфицирования ВПЧ у женщин приходится на 16–25 лет и снижается с возрастом, у мужчин, напротив, пик пораженности ПВИ приходится на чуть более старший возраст, чем у женщин, и остается постоянным или незначительно уменьшается по мере взросления[10].
Для первичной специфической профилактики заболеваний, связанных с ПВИ, в мире зарегистрированы три вакцины:
- двухвалентная (Церварикс (ГлаксоСмитКляйн Байолоджикалз С. А., Бельгия) для защиты от 16го и 18го типов вируса);
- четырехвалентная (Гардасил (Мерк Шарп и Доум Б. В., Нидерланды) для защиты от 16го, 18го, 6го и 11го типов вируса);
- девятивалентная (Гардасил 9 (Мерк Шарп и Доум Б. В., Нидерланды) для защиты от 16го, 18го, 6го, 11го, 31го, 33го, 45го, 52го и 58го типов).
В России сертифицированы две вакцины — двухвалентная Церварикс и четырехвалентная Гардасил. Вакцины были лицензированы на основании их клинической эффективности и безопасности у молодых взрослых женщин и молодых взрослых мужчин. Их эффективность была оценена с помощью множества конечных точек — ВПЧассоциированных заболеваний и хронической ПВИ.
Из 132 стран мира, где проводится вакцинация, в настоящее время 70 стран включили в свои национальные программы иммунизацию девочек, а в 14 странах — также и мальчиков[11].
Профилактическая вакцинация против РШМ рекомендована ведущими профессиональными ассоциациями/организациями мира:
- ВОЗ;
- Европейским центром контроля заболеваний (European Centre for Disease Prevention and Control);
- Международной федерацией гинекологии и акушерства (International Federation of Gynecology and Obstetrics);
- Американским онкологическим обществом (American Cancer Society);
- Обществом гинекологической онкологии (Society of Gynecologic Oncology);
- Европейским обществом специалистов в области онкогинекологии (European Society of Gynaecological Oncology);
- Национальным объединенным заключением Society of Obstetricians and Gynecologists of Canada — Society of Gynecologic Oncology of Canada — Society of Canadian Colposcopists;
- Американской коллегией акушеровгинекологов (American College of Obstetricians and Gynecologists) и др.
В России реализованы около 30 региональных программ по вакцинации девочекподростков против ВПЧ. В частности, Московская область стала одним из субъектов Российской Федерации, где с 2008 г. начал осуществляться пилотный проект по иммунизации девочек 12–13 лет против РШМ[12].
В настоящее время в мире (табл. 1) накоплен 10летний опыт вакцинопрофилактики ВПЧассоциированных заболеваний, который представлен в виде результатов многочисленных исследований.
Таблица 1
Программы вакцинации против вируса папилломы человека с заявленными данными об эффективности[14–21]
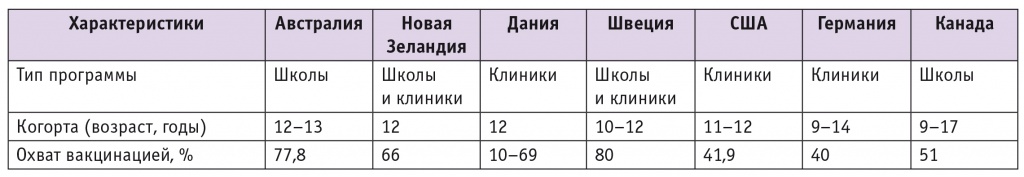
Для оценки влияния вакцины против ВПЧ используются клинические результаты:
- краткосрочные (месяцы): распространенность инфекции ВПЧ, частота возникновения аногенитальных бородавок
- среднесрочные (годы): частота возникновения предраковых или диспластических поражений шейки матки, наружных половых органов, влагалища или ануса;
- долгосрочные (десятилетия): частота возникновения РШМ, рака наружных половых органов, влагалища или ануса.
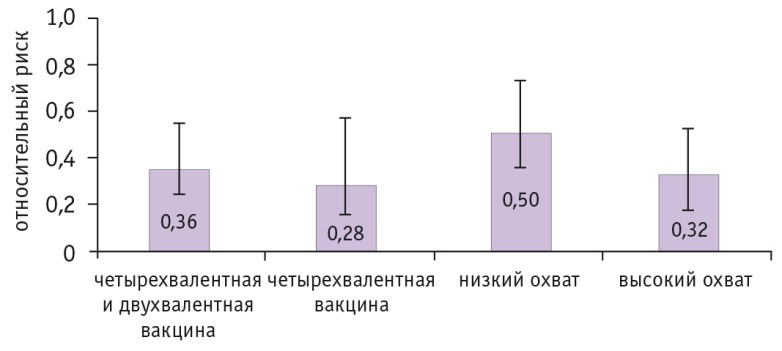
По результатам 20 исследований[13], в 9 странах мира наблюдалось значимое сокращение распространенности ВПЧ 16/18 (на 72%) после вакцинации четырехвалентной вакциной девочек 13–19 лет по сравнению с периодом до вакцинации против ВПЧ (рис. 1).
Рис. 1. Относительный риск инфицирования вирусом папилломы человека 16/18 в период после вакцинации у девочек в возрасте 13–19 лет[13]
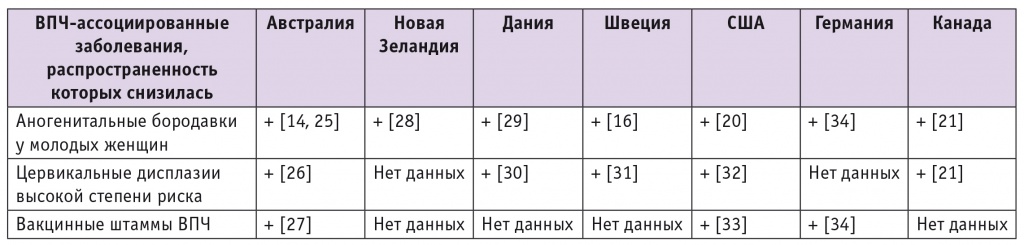
Данные о заболеваемости вакцинными штаммами вируса и ВПЧассоциированными болезнями, подтверждающие эффективность вакцинации, также представили разные
страны (табл. 2).
Таблица 2
Эффективность вакцинации против вируса папилломы человека (ВПЧ) в разных странах мира
По данным клинических исследований, эффективность четырехвалентной вакцины против ВПЧ у изначально неинфицированных женщин от 16 до 26 лет в отношении профилактики рака и диспластических состояний шейки матки, вульвы, влагалища, а также аногенитальных бородавок составила 98–100%. У женщин от 24 до 45 лет эффективность в отношении профилактики персистирующей инфекции, cervical intraepithelial neoplasia (CIN) любой степени или аногенитальных поражений, вызванных вакцинными штаммами, — 88,7%.
У юношей и мужчин четырехвалентная вакцина против ВПЧ предотвращала появление аногенитальных бородавок, а также наружные генитальные поражения, перинеальную, перианальную внутриэпителиальную неоплазию, внутриэпителиальную неоплазию пениса 1–3й степени, вызванные ВПЧ 6го, 11го, 16го и 18го типов в 90,6% случаев, анальную интраэпителиальную неоплазию 1–3й степени — в 77,5% случаев.
Несмотря на низкий охват вакцинацией в США (в 2010 г. только 32% девушек в возрасте 13–17 лет были привиты четырехвалентной вакциной против ПВИ), распространенность типов ВПЧ, входящих в состав вакцины, по данным анализа мазков из шейки матки и влагалища, у девушек 14–19 лет снизилась с 11,5% в 2003–2006 гг. (довакцинальная эпоха) до 5,1% в 2007–2010 гг. (вакцинальная эра) (р < 0,001). В настоящее время охват вакцинацией в США характеризует тенденция роста: так, по данным Centers for Disease Control and Prevention, в 2015 г. доля вакцинированных девочек составила 60%, мальчиков — 50%[22].
По результатам проведенного в Швеции популяционного когортного исследования с участием почти 2,21 млн девочек и женщин в возрасте 10–44 лет, проживающих в Швеции с 2006 по 2010 г., эффективность четырехвалентной вакцины против ВПЧ в отношении снижения частоты возникновения остроконечных кондилом составила 76% у тех, кто получил по 3 дозы вакцины до достижения 20 летнего возраста[23].
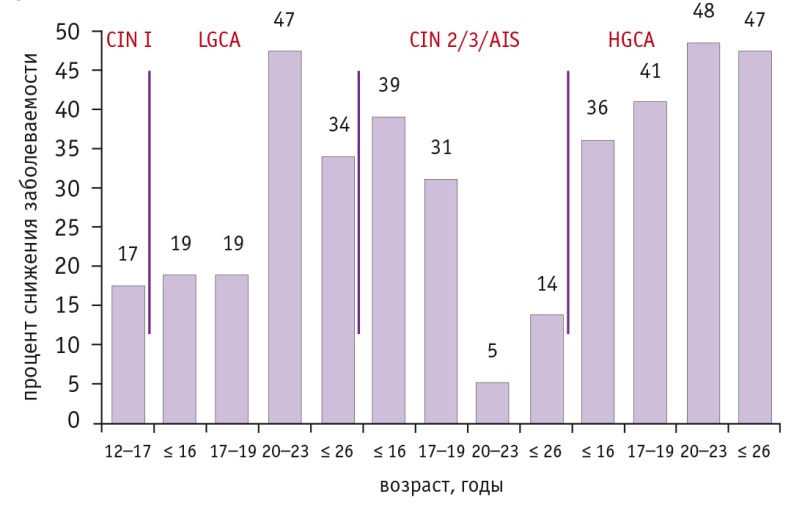
Показательны данные по уменьшению доли цервикальных неоплазий в результате вакцинации среди женщин разных возрастов в Австралии (рис. 2). Эффективность трех доз вакцины от ВПЧ против развития патологии шейки матки высокой степени риска составила 57% для 15–18летних и 53% для 19–22-летних, эффективность двух доз — 23% для 15–18-летних и 32% для 19–22летних.
Рис. 2. Уменьшение доли поражений шейки матки среди вакцинированных (как минимум 1 доза) в сравнении с невакцинированными в эру вакцинации женщин в Австралии[11]. Примечание: AIS (adenocarcinoma in situ) — аденокарцинома in situ, CIN (cervical intraepithelial neoplasia) — цервикальная интраэпителиальная неоплазия, HGCA (high-grade cervical abnormalities) — высокодифференцированные поражения шейки матки, LGCA (low-grade cervical abnormalities) — низкодифференцированные поражения шейки матки
Значимое снижение риска развития РШМ как результат вакцинации отмечено в Дании. Среди вакцинированных женщин (≥ 1 дозы) риск атипии или рака был сокращен до 60%, а риски CIN 2/3 и CIN 3 — до 80% по сравнению с непривитыми женщинами (рис. 3).
Рис. 3. Cнижение риска развития предрака и рака шейки матки после вакцинации против вируса папилломы человека в Дании (результаты цитологического исследования)[24]. Примечание: CIN (cervical intraepithelial neoplasia) — цервикальная интраэпителиальная неоплазия
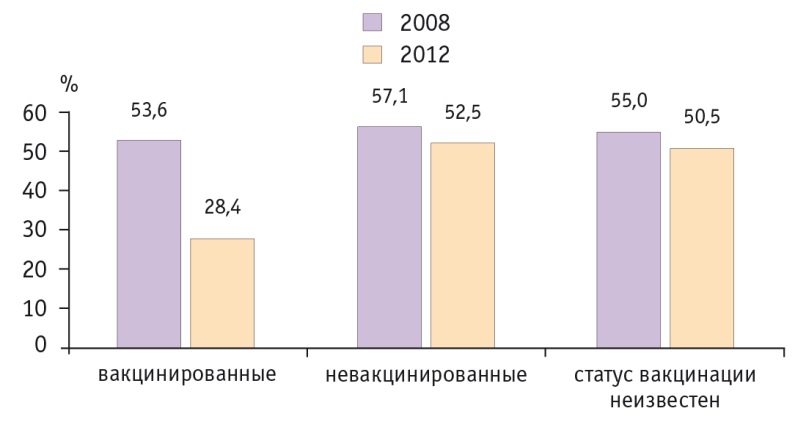
Вакцинация эффективна и в отношении CIN, ассоциированных с ВПЧ 16го и 18го типов, что отражено в результатах американского исследования (рис. 4). Распространенность ВПЧ 16/18ассоциированных CIN2+ сократилась с 53,6% в 2008 г. до 28,4% в 2012 г. среди женщин, которые получили хотя бы одну дозу четырехвалентной вакцины против ВПЧ.
Рис. 4. Распространенность ВПЧ 16 и 18-го типов, ассоциированных с cervical intraepithelial neoplasia 2+, среди женщин с учетом вакцинального статуса в динамике, США[36]
Данные об эффективности вакцинации от ВПЧ в отношении инвазивного ВПЧассоциированного рака были получены в недавно опубликованном исследовании, проведенном в Финляндии[35]. Согласно результатам исследования, в группе невакцинированных от ВПЧ женщин (n = 17838, возраст — 14–19 лет) зарегистрированы 10 случаев ВПЧассоциированного рака (РШМ — у 8, орофарингеальный рак — у одной, рак вульвы — еще у одной женщины) в сравнении с группой вакцинированных от ВПЧ (n = 9529, возраст — 14–17 лет), в которой не было ни одного наблюдения ВПЧассоциированного рака (общая эффективность вакцинации — 100%, 95%ный ДИ: 16–100).
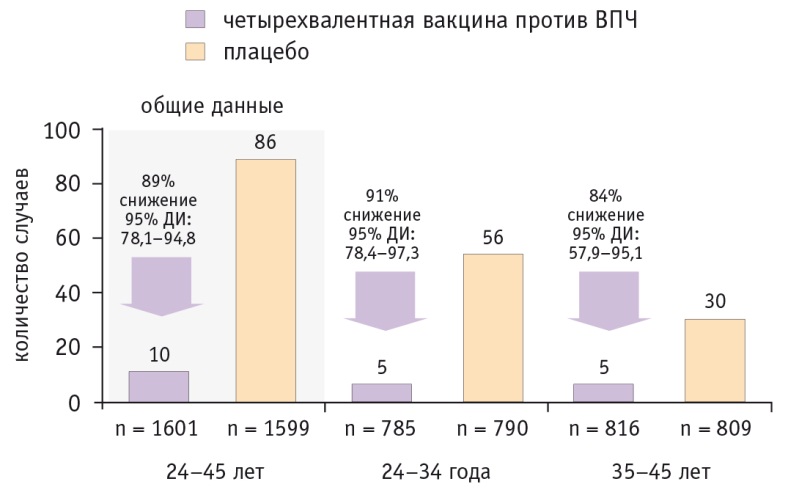
В последние годы появились публикации о вакцинации женщин при наличии персистирующей ВПЧинфекции (рис. 5). Вакцинация женщин (n = 3200) с известным предшествующим контактом с типами ВПЧ, входящими в состав вакцины (6го, 11го, 16го и 18го), но без активной или скрытой инфекции была эффективной на уровне 91% — создала защиту от повторного заражения типами ВПЧ, воздействию которых они подвергались ранее, а также защищала от прочих типов ВПЧ в составе вакцины[37–39].
Рис. 5. Эффективность вакцинации в отношении частоты регистрации вакцинно-ассоциированных типов ВПЧ-персистирующей инфекции, cervical intraepithelial neoplasia различной степени и аногенитальных бородавок
Ретроспективный анализ субпопуляции участниц проведенного исследования FUTURE I и II, подвергавшихся радикальной терапии для лечения заболеваний шейки матки либо с наличием диагностированных заболеваний вульвы или влагалища с последующим введением четырехвалентной вакцины против ВПЧ либо плацебо показал, что вакцинация значимо снизила частоту возникновения какихлибо связанных с ВПЧ заболеваний в последующем[38, 39]. Согласно данному исследованию, после хирургического лечения шейки матки (n = 587) частота какихлибо последующих связанных с ВПЧ заболеваний в группе пациенток, получавших вакцину, была на 46% ниже по сравнению с группой плацебо (включая снижение частоты возникновения интраэпителиальных поражений шейки матки 2й или более тяжелой степени на 65% и любых связанных с ВПЧ 6го, 11го, 16го или 18го типов заболеваний — на 79%).
Важно отметить, что результаты вакцинации пациенток (n = 360) четырехвалентной вакциной после проведения процедуры петлевой электроконизации шейки матки при гистологически подтвержденной CIN 2–3 при сравнении с результатами невакцинированных пациенток показали снижение доли пациенток с рецидивом (2,5% против 7,2%) в течение последующего наблюдения средней продолжительностью 3,5 года[40, 41].
Немаловажными являются данные о влиянии вакцины против ВПЧ на беременность. В 5 клинических исследованиях безопасности и эффективности четырехвалентной вакцины III фазы все наступившие беременности регистрировали, и женщины находились под наблюдением для оценки исходов беременности. В исследованиях участвовали женщины, у которых беременность наступила до (n = 2011), во время или после вакцинации. Эти исследования не выявили значительных различий между группами в частоте беременностей, закончившихся рождением живого ребенка, гибелью плода, самопроизвольным абортом или рождением ребенка с врожденными пороками. При введении вакцины беременным отмечена хорошая переносимость.
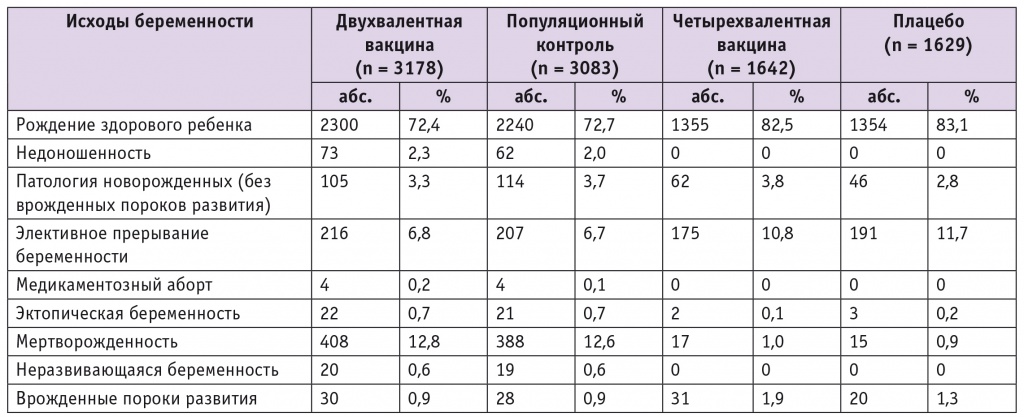
Особый интерес представляют женщины, которые забеременели во время курса вакцинопрофилактики. По существующим в настоящее время данным, более 2000 женщин забеременели во время вакцинации (табл. 3).
Таблица 3
Исходы беременностей у женщин, получивших двухвалентную и четырехвалентную вакцины[42, 43]
Для сбора более полной информации о нежелательных явлениях вакцины был открыт регистр беременности (США, Канада, Франция) для Гардасила, целями которого стали сбор и анализ данных об исходах беременности для более полной характеристики профиля безопасности вакцины у беременных. В течение 6 лет наблюдения при помощи регистра (n = 2082) выявлено следующее: 87% детей родились живыми, 97% из них были здоровыми; пораженность основными врожденными дефектами оценивалась как 2,5 случая на 100 живорожденных — это не больше установленного базового показателя (2,67 случаев на 100 живорожденных)[43]. В настоящее время в связи с доказанной безопасностью и отсутствием достоверных сведений о тератогенном действии вакцины регистр беременных закрыт.
Обзор суммированных данных постлицензионного эпиднадзора в отношении безопасности, проводимого в течение более 4 лет при плановом использовании двухвалентной вакцины, показал, что исходы беременности у женщин, непреднамеренно привитых во время беременности, были схожи с исходами у невакцинированных женщин[44].
В настоящее время имеется информация относительно безопасности и иммуногенности вакцин против ВПЧ у лиц с нарушениями иммунной системы, вызванными ВИЧ. По результатам проспективного открытого клинического исследования, целью которого было оценить безопасность и иммуногенность четырехвалентной вакцины у подростков и молодых пациентов с ВИЧинфекцией в сравнении с пациентами без ВИЧинфекции в возрасте 13–27 лет, продемонстрирована сходная иммуногенная эффективность в обеих группах, отсутствие отрицательного влияния на уровень CD4+ и вирусную нагрузку, а также безопасность и хорошая переносимость четырехвалентной вакцины[45].
M. J. Levin и соавт.[46] показали, что применение четырехвалентной вакцины безопасно, иммуногенно и не влияет на уровень CD4+ и вирусную нагрузку у ВИЧинфицированных детей и подростков в возрасте 7–12 лет. Среди целевой группы для вакцинации против ВПЧ может быть небольшое число ВИЧинфицированных лиц даже в регионах, где распространенность ВИЧ относительно невысока. Озабоченность относительно безопасности вакцинации или сниженной эффективности среди женщин, которые могут быть ВИЧинфицированными, не должна быть причиной отсрочки начала широкомасштабной вакцинации против ПВИ. Тестирование на ВИЧ не должно быть условием для проведения плановой вакцинации против ВПЧ[47].
Московская область стала одним из первых регионов РФ, где была принята Областная программа иммунизации против РШМ (2007–2010 гг., 2011–2016 гг.) «Вакцинопрофилактика онкологических заболеваний, вызываемых вирусом папилломы человека».
С самого начала реализация проекта осуществлялась в районах с высокой заболеваемостью РШМ, а ключевым триггером для понимания необходимости мероприятий стал рост заболеваемости РШМ в Московской области в период с 2002 по 2008 г., а также значимый экономический ущерб для региона от ВПЧассоциированных заболеваний, который достигал 1,5 млрд рублей в год.
На протяжении 10 лет вакцинацией поочередно охвачены 18 муниципальных районов МО, где привиты более 19 000 девочекподростков в возрасте 12–13 лет, а с 2015 г. в вакцинацию были включены и девушки более старшего возраста — 17 лет[48, 49].
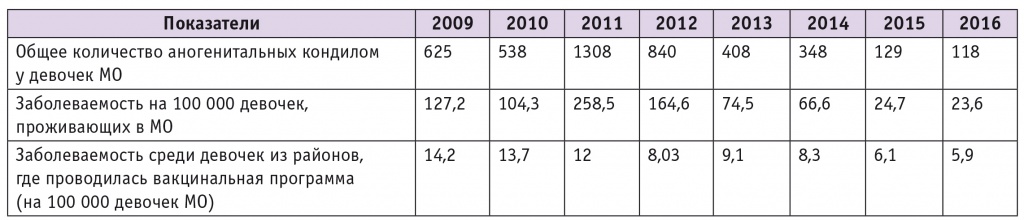
По результатам вакцинации в Московской области проведена оценка заболеваемости аногенитальными кондиломами среди девочек за последние 9 лет. На основании анализа статистических отчетов детских гинекологов Московской области в результате проведенной вакцинации отмечено снижение заболеваемости кондиломами в 2016 г. по сравнению с 2009 г. с 14,2 до 5,9 на 100 000 девочек (табл. 4).
Таблица 4
Динамика заболеваемости аногенитальными кондиломами у девочек Московской области по итогам вакцинации[49]
Важно отметить, что более высокая эффективность зарегистрирована в тех районах, где охват вакцинацией составлял 80% и более[49].
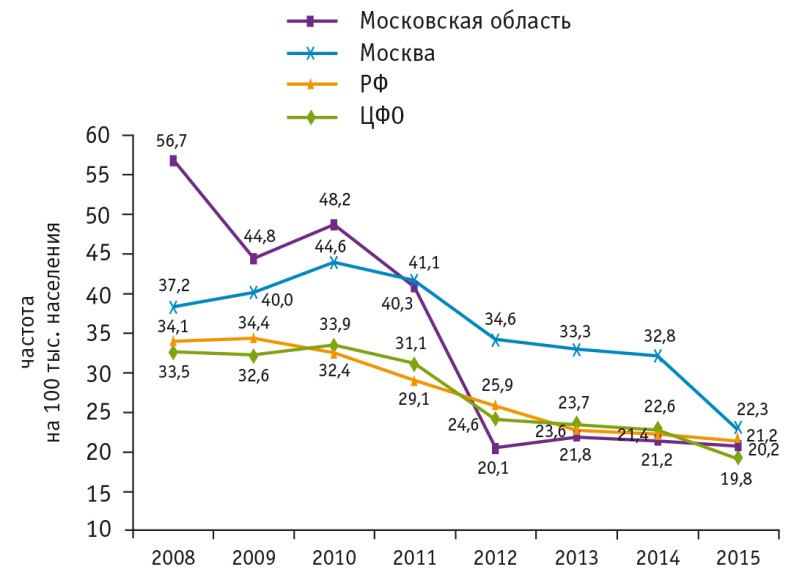
Снизилась также заболеваемость аногенитальными кондиломами среди населения МО в целом, что отражено на рисунке 6.
Рис. 6. Заболеваемость населения аногенитальными кондиломами в РФ, Центральном федеральном округе (ЦФО), Москве и Московской области в 2008–2015 гг. (на 100 тыс.), по данным Федеральной службы государственной статистики
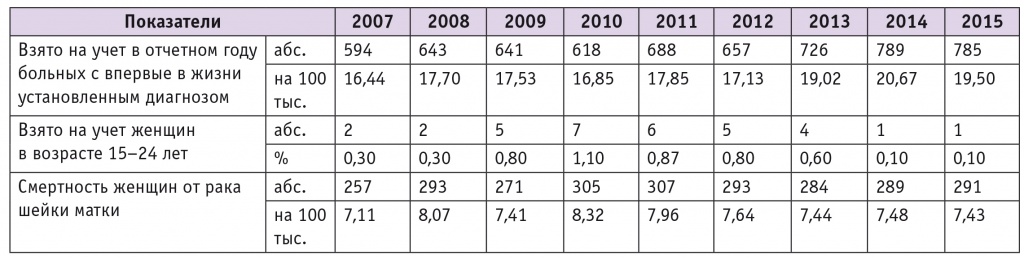
Самым значимым результатом программы вакцинации к 2015 г. стало заметное уменьшение заболеваемости у молодых женщин в возрасте 15–24 лет (табл. 5).
Таблица 5
Заболеваемость женщин раком шейки матки в Московской области в 2007–2015 гг. (данные статистического отдела ГБУЗ МО «Московский областной онкологический диспансер»)
ЗАКЛЮЧЕНИЕ
Согласно заключению ВОЗ, самая эффективная скрининговая программа не может повлиять на распространение папилломавирусной инфекции (ПВИ), которая остается основной причиной развития онкологической патологии, в то время как профилактика рака шейки матки (РШМ) и/или других заболеваний, вызываемых ВПЧ, является приоритетом общественного здравоохранения. При этом вакцинация не отменяет необходимость проведения цитологического скрининга и регулярных гинекологических осмотров для вторичной профилактики.
Анализ последних данных подтверждает целесообразность вакцинации не только у девочекподростков, но и у женщин репродуктивного возраста до 45 лет, у пациенток с наличием персистирующей ПВИ, после лечения предраковых заболеваний вульвы и шейки матки. Вакцинация против ВПЧ с успехом может быть использована и у ВИЧинфицированных подростков и женщин, и ее эффективность доказана в многочисленных исследованиях. Своевременная вакцинация против ВПЧ, включение вакцинации в календарь иммунизации, по мнению ВОЗ, не только позволят снизить объем финансовых потерь РФ, но и приведут к улучшению репродуктивного здоровья населения и демографической ситуации в стране[50].
Поэтому профилактическая вакцинация против ВПЧ, наряду с программами скрининга, является частью согласованной стратегии и тактики борьбы с РШМ и другими ВПЧассоциированными заболеваниями не только в РФ, но и в мире.








