Среди факторов риска сращения малых половых губ одни авторы основное значение отводят воспалительным заболеваниям вульвы и влагалища инфекционной природы [3–6], другие — аллергическим заболеваниям (атопическому дерматиту) [7–9], третьи — сочетанному воздействию факторов [10, 11].
Девочки, уже умеющие говорить, жалуются на боль в области промежности и внизу живота. Родителей беспокоит, что их ребенок сильно тужится при микции, стал раздражительным, плаксивым. У младенцев нередко повышается температура тела, нарушаются сон, аппетит, особенно в результате острой задержки мочи при полном закрытии половой щели. Вышеуказанное послужило причиной выбора в качестве цели исследования сравнительную оценку особенностей микробиоценоза и локального иммунитета слизистой оболочки влагалища у девочек в периоде раннего детства с рецидивом сращения малых половых губ, с острым вульвовагинитом, атопическим дерматитом и у здоровых сверстниц.
МАТЕРИАЛЫ И МЕТОДЫ
С октября 2009 г. по 2012 г. было проведено одномоментное когортное исследование по результатам клиниколабораторного обследования 217 девочек в возрасте от 1 месяца до 3 лет включительно.
В исследование включили 68 девочек с острым бактериальным вульвовагинитом, 60 — с рецидивом сращения малых половых губ, 27 — с атопическим дерматитом (основная группа)и 62 здоровых девочек без отклонений физического и полового развития (контрольная группа).
Критерием включения в основную группу стало наличие изолированного патологического состояния вульвы: 1) рецидива частичного или сплошного сращения малых половых губ; 2) клинически и лабораторно подтвержденного воспаления вульвы и влагалища инфекционного генеза (вульвовагинита); 3) клинически подтвержденного атопического дерматита. Критерии включения в группу контроля: 1) подтвержденное клинически и лабораторно соматическое и гинекологическое здоровье; 2) отсутствие сращений малых половых губ в анамнезе и на момент включения в исследование.
Сбор клиникоанамнестических данных и взятие биоматериала осуществляли в научнополиклиническом отделении и во втором гинекологическом отделении ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В. И. Кулакова» Минздрава России, а также в консультативнодиагностическом центре ФГАУ «Научный центр здоровья детей» Минздрава России.
Лабораторное исследование проводилось в лаборатории молекулярногенетических методов ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени академика В. И. Кулакова».
Биоматериал с внутренней поверхности основания малых половых губ и с боковой стенки влагалища за гименом получали путем деликатного соскоба эпителия с помощью одноразового универсального урогенитального зонда (ЗГУЦМ, Россия) с последующим переносом содержимого соскобов в пробирки с транспортной средой.
Для выделения ДНК микроорганизмов из полученного биоматериала использовали наборы «ПробаГС» («ДНКТехнология», Россия). Показателем адекватности получения биоматериала служило количество геномной ДНК эпителиальных клеток, попавших в пробу. Количество взятого материала оценивали в абсолютных числах, за минимальный пороговый уровень принимали значение 104 (log 4). Лабораторный контроль взятого материала после анализа его количества был валиден во всех случаях.
При количественной оценке биоценоза влагалища (набор «Фемофлор», «ДНКТехнология») учитывали общую бактериальную массу, массу Lactobacillus spp., Bifidobacterium и основных групп микроорганизмов, представляющих условнопатогенную микрофлору, с включением Streptococcus spp., Streptococcus pyogenes, Staphylococcus spp., Staphylococcus aureus, Gardnerella vaginalis, Enterobacterium, Enterococcus, Prevotella bivia/Porphyromonas, Sneathia spp./Leptotrihia spp./Fusobacterium spp., Megasphaera spp./Veilonella spp./Dialister spp., Lachnobacterium spp./Clostridium spp., Mobiluncus spp./Corynebacterium spp., Peptostreptococcus spp., Eubacterium, Atopobium vaginae, Mycoplasma hominis, Ureaplasma spp, Candida spp. Помимо стандартного набора групп микроорганизмов «Фемофлор16», образцы исследовали на наличие абсолютных патогенов: Chlamydia trachomatis, Neisseria gonorrhoeae, Trichomonas vaginalis. Амплификацию осуществляли путем ПЦР в режиме реального времени. Количество ДНК рассчитывали в логарифмах геномных эквивалентов микроорганизмов в конкретном образце (log/ГЭ/образец). Обработка результатов осуществлялась автоматически с помощью программного обеспечения к приборам.
Для уточнения состояния местного иммунитета в забранных образцах определяли содержание транскриптонов ИЛ1β, ФНОα, ИЛ6, ИЛ8, ИЛ10, ИЛ12α, ИЛ18, ИФНγ, ТФРβ, а также общий лейкоцитарный антиген CD45.
Во избежание деградации мРНК полученный биоматериал помещали в пробирки с раствором гуанидинтиоцианата (лизирующий раствор набора «ПробаНК», «ДНКТехнология»). В работе использовали коммерческие реактивы «ДНКТехнология». Производитель гарантировал отсутствие амплификации на матрице геномной ДНК цитокинов и референсных генов. Это позволило исключить дополнительный этап обработки нуклеиновых кислот ДНКазой.
Реакцию обратной транскрипции ставили в объеме 40 мкл (в реакцию брали 33 мкл образца). В качестве праймеров для обратной транскрипции применяли специфические олигонуклеотиды. Реакцию ставили в двух повторах для каждой точки. Нормировка проводилась по пяти референсным генам: HPRT1, TBP, B2M, GUSB, ABL. Использован метод сравнения индикаторных циклов (метод ∆Cq). Уровень отмеченной экспрессии нормировали относительно референсных генов и медианных значений в контрольной группе (метод ∆Cq). Медиану значений в контрольной группе принимали равной 1.
Этическая экспертиза. Запланированный дизайн исследования получил одобрение комиссии этического комитета ФГБУ «Научный центр акушерства, гинекологии и перинатологии имени акад. В. И. Кулакова» Минздрава России.
При проведении исследования родителям девочек или их законному представителю в доступной форме была разъяснена суть и обоснована необходимость запланированных манипуляций. Изучение анамнеза и обследование осуществляли с письменного согласия и в присутствии законного представителя ребенка в соответствии с действующим законодательством. При отказе от проведения диагностических процедур обследование немедленно прекращалось, и девочка исключалась из исследования.
Статистический анализ. Для выбора статистических методов первоначально определяли тип исходных данных (возраст, рост, и т. п.). Для количественных переменных в качестве меры центральной тенденции выбрана медиана, а в качестве интервальной оценки — верхний и нижний квартили (25й и 75й процентили). Для сравнения количественных признаков использовались непараметрический Uтест Манна — Уитни для несвязанных совокупностей при сравнении двух независимых выборок. При анализе качественных или полуколичественных признаков оценивали частоту встречаемости в процентах и распределение по стратам. Для оценки значимости различий в распределении соответствующих признаков между группами использовали критерий χ², а также точный критерий Фишера (F) для небольших выборок. Для оценки силы связи между предиктором и исходом вычисляли ОШ и ОР, которые приводились с 95%ным ДИ. Значения считали статистически значимыми при p ≤ 0,05, высоко значимыми — при p < 0,001.
РЕЗУЛЬТАТЫ
Медиана общей бактериальной массы образцов, полученных от здоровых девочек, составила 5,87 log/ГЭ/образец, в которой с учетом среднего процента обнаружения в каждом образце определялись следующие группы микроорганизмов: Eubacterium spp. — 82%, Pr. bivia/Porphyromоnas spp. — 76%, Megasphaera spp./Velionella spp./Dialister — 53%, Peptostreptococcus spp. — 41%, Snethia spp./Fusobacterium spp./Leptotrihia — 29%, Enterobacterium — 27%, Streptococcus spp. — 24%, Mobiluncus spp./Corynebacterium spp. — 18%, Enterococcus spp. — 16%, Staphylococcus spp. и G. vaginalis — 10%, Bifidobacterium и A. vaginae — 4%, Lactobacillus spp. — 2%.
Для уточнения количественных значений, характерных для здоровых девочек раннего возраста, с учетом данных об общей бактериальной массе за доминирующие условно приняли микроорганизмы, медианные значения которых были больше или равны 4 log/ГЭ/образец: Pr. bivia/Porphiromonas — 4,95; Eubacterium spp. — 4,91; Megasphaera spp./Velionella spp./Dialister — 4,56; Peptostreptococcus spp. — 4,32. Оставшиеся микроорганизмы были отнесены к минорным представителям: Streptococcus spp. — 3,90 log/ГЭ/образец; Mobiluncus spp./Corynebacterium spp. — 3,94 log/ГЭ/образец; Enterobacterium — 3,32 log/ГЭ/образец; Snethia spp./Fusobacterium spp./Leptotrihia — 3,24 log/ГЭ/образец; Lachnobacterium spp./Clostridium spp. — 2,94 log/ГЭ/образец; Staphylococcus spp. — 2,85 log/ГЭ/образец; G. vaginalis — 2,65 log/ГЭ/образец; Enterococcus spp. — 2,59 log/ГЭ/образец; Bifidobacterium — 2,44 log/ГЭ/образец; Candida spp. — 2,18 log/ГЭ/образец; A. vaginae — 1,85 log/ГЭ/образец; Lactobacillus spp. — 1,74 log/ГЭ/образец.
Современные данные микробиологических исследований указывают на зависимость видового представительства Lactobacillus от биохимических и физических свойств той среды, где они обитают, что может послужить ключом к патогенезу патологических процессов, развивающихся в области вульвы и влагалища. Поэтому нами был рассмотрен видовой состав Lactobacillus spp., обнаруженных у здоровых девочек раннего возраста. Поскольку абсолютное количество Lactobacillus spp. находилось на пределе чувствительности метода, для исключения неспецифических результатов при анализе учитывали только те виды, количество которых превышало 5% от общего количества выявленных групп Lactobacillus spp. Среди лактобацилл, обитающих на слизистой влагалища у девочек раннего возраста, преобладал вид L. iners, составляя 59,7% от всех выделенных видов лактобацилл с абсолютными значениями 1,80 log /ГЭ/образец.
Таким образом, в микроценозе слизистой оболочки влагалища у девочек периода раннего детства доминируют анаэробные микроорганизмы порядка Clostridiales: семейств Eubacteriaceae (Eubacterium spp.), Bacteroidaceae (Pr. bivia/Porphyromоnas spp.), Acidaminococcaceae (Megasphaera spp/Velionella spp./Dialister), Peptostreptococcaceae (Peptostreptococcus spp.).
Микробиоценоз 68 девочек с острым бактериальным вульвовагинитом характеризовался типичной для данного возраста общей бактериальной массой, медиана которой составила 5,7 log/ГЭ/образец. Групповой состав микроорганизмов в пристеночном слое эпителия влагалищной стенки у пациенток с острым бактериальным вульвовагинитом не отличался от такового у здоровых девочек. А медианы количественного значения выявленных групп выглядели следующим образом: Eubacterium — 5,0 (3,5–5,7), Peptostreptococcus spp. — 4,7 (3,5–5,3), группы Pr. bivia/Porphyromоnas spp. — 4,6 (3,9–5,3), Megasphaera spp./Velionella spp./Dialister и Enterobacterium — 4,4 (3,1–5,0), Streptococcus spp. и Snethia spp./Fusobacterium spp./Leptotrihia — 4,1 (3,7–4,8), Bifidobacterium — 3,9 (3,5–4,3) log/ГЭ/образец. ДНК Mobiluncus spp./Corynebacterium spp. и Staphylococcus spp., несмотря на наличие их у всех девочек, определялись в малом количестве — 3,5 (3,1–4,0) log/ГЭ/образец и 3,2 (3,2–3,4) log/ГЭ/образец соответственно. Еще меньшим оказалось содержание ДНК Lactobacillus spp. — 1,8 (1,3–2,1) log/ГЭ/образец. При этом ДНК Lactobacillus были обнаружены лишь в 6 из 130 образцов у девочек двух сравниваемых групп.
Важно отметить, что по количественному значению ДНК микроорганизмов, которые традиционно считаются основными возбудителями бактериального вульвовагинита, а именно Enterobacterium, Staphylococcus spp., Streptococcus spp., пациентки с этим заболеванием не отличались от здоровых сверстниц. При оценке насыщенности изученных образцов геномными эквивалентами всех обнаруженных микроорганизмов и грибов рода Candida оказалось, что они не могут быть признаны значимыми ассоциантами биотопа у девочек с острым бактериальным вульвовагинитом, так как концентрация их не превысила нижний порог чувствительности метода (≤ 3,0 log/ГЭ/образец).
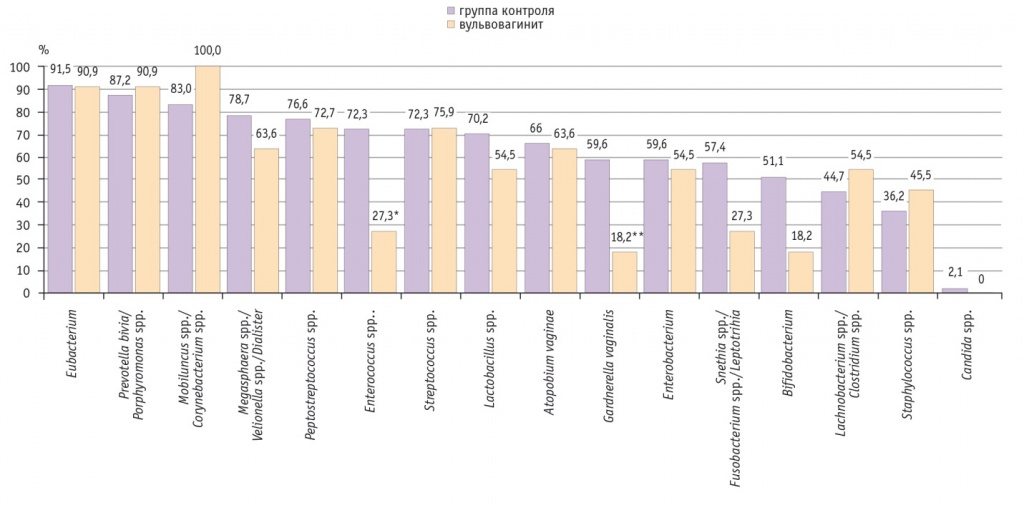
Неожиданной находкой стало в 2,6 раза более редкое выявление в структуре общей бактериальной массы девочек с острым вульвовагинитом микроорганизмов группы Enterococcus (27,3% против 72,3%; р = 0,014) и в 3,2 раза более редкое — G. vaginalis (18,2% против 59,6%; р = 0,033) по сравнению с участницами контрольной группы, количество ДНК G. vaginalis в этих образцах было небольшим — 2,8 (2,1–3,4) log/ГЭ/образец (рис. 1).
Рис. 1. Частота обнаружения различных групп микроорганизмов у девочек с острым вульвовагинитом и в группе контроля, %.
* Р = 0,014
** Р = 0,033
Корреляционный анализ взаимодействий выявленных групп микроорганизмов в структуре их общей биомассы в изученных образцах у пациенток с острым вульвовагинитом продемонстрировал сильную взаимозависимость количества G. vaginalis и Lactobacillus spp. Полученные данные позволили выдвинуть предположение о влиянии количественного равновесия этих микроорганизмов на состояние общего микробиоценоза и провести анализ величин соотношения Lactobacillus spp. и G. vaginalis (L/G) у девочек контрольной группы и с острым бактериальным вульвовагинитом. Для проверки данной гипотезы равновесным было принято количественное соотношение L/G у здоровых девочек, равное –0,5 log/ГЭ/образец. Полученные графические данные показали значимо большее соотношение L/G у девочек с острым бактериальным вульвовагинитом (p < 0,05). Для статистического подтверждения диагностической значимости величины этого соотношения был проведен ROCанализ. Полученный коэффициент площади под кривой, который составил 0,8–0,9, свидетельствовал о высокой информативности величины L/G в диагностике острого бактериального вагинита у девочек в периоде раннего детства.
У 27 пациенток, имеющих в прошлом и на момент обследования клинические проявления атопического дерматита в области промежности и наружных половых органов, медиана общей бактериальной массы составила 5,9 log/ГЭ/образец, не отличаясь от таковой у девочек контрольной группы. Спектр микроорганизмов оказался аналогичным и был представлен 16 группами бактерий, не являющихся облигатно патогенными. В преобладающем числе образцов, полученных у девочек с атопическим дерматитом, определены ДНК Eubacterium (92,6%), Megasphaera spp./Velionella spp./Dialister (92,6%), Mobiluncus spp./Corynebacterium spp. (85,2%), Pr. bivia/Porphyromоnas spp. (81,5%), Peptostreptococcus spp. (81,5%), Enterococcus spp. (81,5%) и Streptococcus spp. (77,8%). Наиболее редко выявляли ДНК Lactobacillus spp. (29,6%) и G. vaginalis (18,5%) (рис. 2).
Рис. 2. Частота обнаружения групп различных микроорганизмов у девочек с атопическим дерматитом и в группе контроля, %.
* Р = 0,001
** Р = 0,002
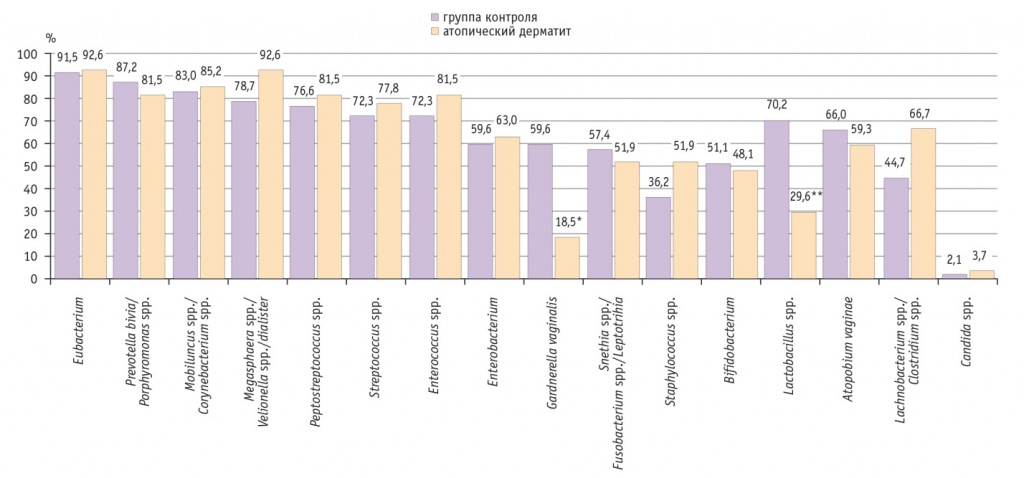
Сравнительный анализ с группой здоровых сверстниц показал, что ДНК G. vaginalis при атопическом дерматите обнаруживалась в общей бактериальной массе в 3,2 раза (р = 0,001), а Lactobacillus spp. — в 2,4 раза (р = 0,002) реже.
При уточнении количества ДНК выделенных групп микроорганизмов в образце, расположенных в градиентном ряду, статистически значимых отличий от группы контроля не найдено: Pr. bivia/Porphyromоnas spp. — 5,5 (5,1–6,1), Eubacterium — 5,1 (4,4–5,5), Megasphaera spp./Velionella spp./Dialister — 5,1 (4,4–5,4), Snethia spp./Fusobacterium spp./Leptotrihia — 4,9 (4,3–5,8), Enterobacterium — 4,7 (3,7–5,1), Peptostreptococcus spp. — 4,6 (4,2–5,4), Streptococcus spp. — 4,3 (3,9–4,5), Mobiluncus spp./Corynebacterium spp. — 4,1 (3,6–4,3), G. vaginalis — 3,7 (3,2–4,4), Staphylococcus spp. — 3,6 (3,2–4,3), Lachnobacterium spp./Clostridium spp. — 3,6 (3,3–3,8), Bifidobacterium — 3,4 (3,1–3,8), A. vaginae — 3,2 (2,3–4,0), Enterococcus spp. — 2,7 (2,2–3,2), Lactobacillus spp. — 2,3 (2,2–2,6) log/ГЭ/образец.
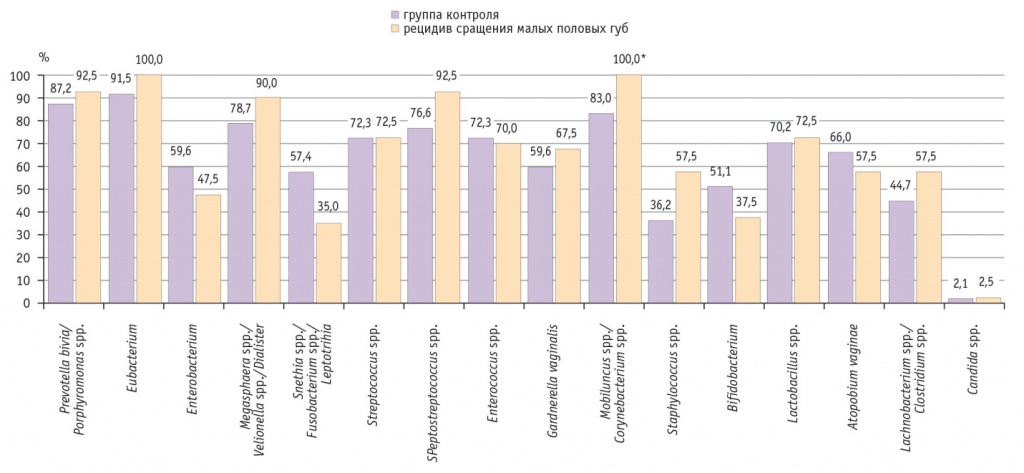
При анализе образцов, полученных от девочек, страдающих сращением малых половых губ, было выявлено, что медиана общей бактериальной массы характеризовалась значением 5,7 log/ГЭ/образец. Как и в других группах, в большинстве образцов обнаруживали анаэробные группы микроорганизмов. Однако по сравнению с участницами контрольной группы у пациенток с рецидивом сращения малых половых губ микроорганизмы группы Mobiluncus spp./Corynebacterium spp. выявляли примерно в 1,2 раза чаще (100% против 83%; p = 0,018) (рис. 3).
Рис. 3. Частота выявления групп различных микроорганизмов у девочек с рецидивом сращения малых половых губ и в группе контроля, %.
* Р = 0,018
Количественные значения выявленных групп не имели статистически значимых различий с таковыми у здоровых девочек и были следующими: Pr. bivia/Porphyromоnas spp. — 5,1 (4,5–5,6), Eubacterium — 4,8 (4,6–5,4), Enterobacterium — 4,5 (3,7–4,8), Megasphaera spp./Velionella spp./Dialister — 4,4 (4,0–5,1), Peptostreptococcus spp. — 4,4 (4,0–4,9), Streptococcus spp. — 4,3 (3,4–4,7), Snethia spp./Fusobacterium spp./Leptotrihia — 4,3 (3,3–5,0) log/ГЭ/образец. ДНК Mobiluncus spp./Corynebacterium spp. определялись в массе, равной 3,8 (3,4–4,5), Staphylococcus spp. — 3,6 (3,2–4,0), Lachnobacterium spp./Clostridium spp. — 3,4 (3,2–3,9), Enterococcus spp. — 3,0 (2,5–4,1), G. vaginalis — 3,0 (2,7–3,2), Bifidobacterium — 3,0 (2,8–3,3), A. vaginae — 2,2 (1,9–2,7), Lactobacillus spp. — 2,0 (1,7–2,2) log/ГЭ/образец. ДНК грибов рода Candida была обнаружена в пограничной с нормой концентрации, но лишь у одной из обследованных девочек.
Следует указать, что ни в одном из изученных 217 образцов не выявили ДНК Str. pyogenes, St. aureus, M. genitalium, Ureaplasma spp.(Ureaplasma parvum, Ureaplasma urealyticum), Ch. trachomatis.
С учетом полученных данных представило интерес изучение состояния локального иммунитета слизистой оболочки влагалища. В доступной литературе не удалось обнаружить данных об особенностях локального иммунитета, исследованного с учетом спектра и уровней экспрессии генов цитокинов на слизистой оболочке влагалища у девочек периода раннего детства. Современные методики идентификации позволили нам получить уровни экспрессии определенных генов цитокинов и рассчитать их медиану и квартильные интервалы в обследованных группах. За нормативные приняли показатели девочек контрольной группы. Уровни экспрессии цитокинов были нормированы относительно референсных генов, что позволило принять полученные уровни экспрессии у здоровых девочек за единицу и провести сравнение их медианных значений и квартильных интервалов в клинических группах с использованием статистических методов оценки. Более подробно описаны лишь те, которые оказались значимо изменены.
По сравнению с нормой при остром бактериальном вульвовагините уровень экспрессии маркера лейкоцитарной реакции CD45 оказался увеличенным в 1,7 раза (р = 0,01). Как известно, этот цитокин, являясь общим лейкоцитарным антигеном, экспрессируется популяцией Т, В и Nkклеток, моноцитами/макрофагами. Напротив, уровень экспрессии ИЛ18, продуцируемого макрофагами и способствующего индукции выработки ИФНγ, оказался в 1,9 раза меньшим, чем у здоровых участниц исследования (р = 0,04). Других значимых отклонений от группы контроля с учетом критерия Манна — Уитни не было.
В группе девочек с атопическим дерматитом выявлено более низкое, чем в контрольной группе, содержание большинства мРНК генов цитокинов. Однако значимо меньшими были лишь уровни ИЛ8 (p = 0,03), ИЛ10 (р = 0,02) и CD45 (р = 0,05). Подобная ситуация вполне объяснима, так как ИЛ8, вырабатываемый тучными клетками, эндотелием, моноцитами, лимфоцитами, воздействуя на нейтрофилы, базофилы, Тклетки, кератиноциты, вызывает хемотаксис, ангиогенез, освобождение супероксида. ИЛ10, продуцируемый Тклетками, подавляет синтез цитокинов, воспалительный и иммунный ответ, в том числе Тклеточную пролиферацию.
У девочек с рецидивом сращения малых половых губ отмечались низкие уровни экспрессии абсолютно всех изученных цитокинов. В 1,4 раза меньше нормы была экспрессия ИЛ18 (р = 0,04), в 1,2 раза — ИЛ10 (р = 0,008), в 2,7 раза — ИЛ1β (p = 0,003). ИЛ1β секретируется макрофагами, большими гранулярными лимфоцитами и Вклетками. Он индуцирует экспрессию молекул адгезии на клетках эндотелия, что способствует миграции лейкоцитов. Участвуя в локальном и системном воспалении и являясь частью врожденного иммунитета, ИЛ1β представляет собой один из мощнейших регуляторов активности лейкоцитов.
Показатель ИЛ12α при сращении малых половых губ был меньше в 1,9 раза, чем у здоровых девочек (р = 0,003). Этот цитокин продуцируется макрофагами, дендритными клетками. Представляя собой сильный стимулятор продукции ИФНγ Т и Nkклеток, ИЛ12α регулирует Th1 дифференцировку.
У девочек с рецидивом сращения малых половых губ по сравнению с контрольной группой была в 1,9 раза меньше экспрессия ТФРβ (р = 0,0001). Продуцентами этого белка служат множество клеток, включая стромальные, эпителиальные клетки, макрофаги, регуляторные Тлимфоциты, многие разновидности опухолевых клеток. Он секретируется в неактивной форме, и для его активации требуется протеолитическое расщепление молекулы, чтобы она приобрела способность взаимодействовать с высокоаффинными рецепторами. Одной из функций ТФРβ является снижение выработки воспалительных цитокинов, способствующее заживлению ран, подавлению роста рубцовой ткани.
Кроме того, у пациенток с рецидивом сращения малых половых губ была в 1,5 раза меньше, чем в группе контроля, экспрессия ФНОα (р = 0,01), выработка которого осуществляется макрофагами, тучными клетками и лимфоцитами. Этот цитокин действует как активатор макрофагов, гранулоцитов, цитотоксических клеток, активирует адгезию лейкоцитов к клеткам эндотелия, индуцирует белок острой фазы, стимулирует ангиогенез, повышает выработку молекул главного комплекса гистосовместимости 1го класса.
ЗАКЛЮЧЕНИЕ
Суммируя полученные данные, можно заключить, что наличие рецидивирующего сращения малых половых губ у девочек раннего возраста не связано с острым воспалительным процессом инфекционной этиологии. Групповое представительство микроорганизмов на слизистой оболочке влагалища у девочек раннего возраста характеризуется динамичным изменением качественного состава различных их групп. Возможно, баланс микробиологического сообщества влагалища у таких девочек сохраняется за счет присутствия определенных групп микроорганизмов при их минимальных количественных значениях. При этом немаловажную регулирующую роль играют Gardnerella vaginalis с определенными минимальными количественными показателями.
Использование ПЦР в режиме реального времени позволяет оценить состояние микроценоза слизистой влагалища у девочек дошкольного возраста, оно обязательно должно включать расширенный спектр микроорганизмов, в том числе типирование Lactobacillus spp., отдельное определение G. vaginalis, Enterococcus и учет как общей группы Staphilococcus spp. и Streptococcus spp., так и их патогенных видов. Оценивать количественные значения полученных групп микроорганизмов следует, обращая особое внимание на наличие и количество Lactobacillus spp. и G. vaginalis. При повышении их соотношения более –0,5 log/ГЭ/образец и появлении клинической симптоматики устанавливают диагноз вагинита.
У девочек дошкольного возраста с целью прогнозирования различных патологических процессов целесообразно проводить анализ локальной экспрессии мРНК генов цитокинов ИЛ18, CD45, ТФРβ, ФНОα. При снижении уровней экспрессии мРНК генов ТФРβ и ФНОα у девочек в возрасте до 3 лет учитывают возможный риск рецидива сращения малых половых губ. В свою очередь, при росте уровней экспрессии мРНК генов CD45 и снижении такового ИЛ18 по сравнению с референсными значениями устанавливают диагноз вульвовагинита.








