Рак яичников (РЯ) не является исключением и представляет собой тот злокачественный процесс, в отношении которого не достигнут должный уровень ни по одному из обозначенных пунктов. Это обусловлено отсутствием общепринятой концепции, позволяющей полноценно описать механизмы канцерогенеза при РЯ. В результате для него отмечается самый высокий показатель смертности среди онкогинекологической патологии [1–3].
В последние годы наши знания о патогенезе и инициации неопролиферативных процессов значительно приумножились, и в обиход врачей-онкологов вошли такие понятия, как персонифицрованная медицина, таргетная терапия, опухолевая стволовая клетка (ОСК), эпигенетические модификации и многие другие. Тем не менее, несмотря на мощный прогресс молекулярной биологии в понимании многих аспектов канцерогенеза, РЯ продолжает оставаться заболеванием, при котором практические приемы лечения существенно отстают от научных достижений.
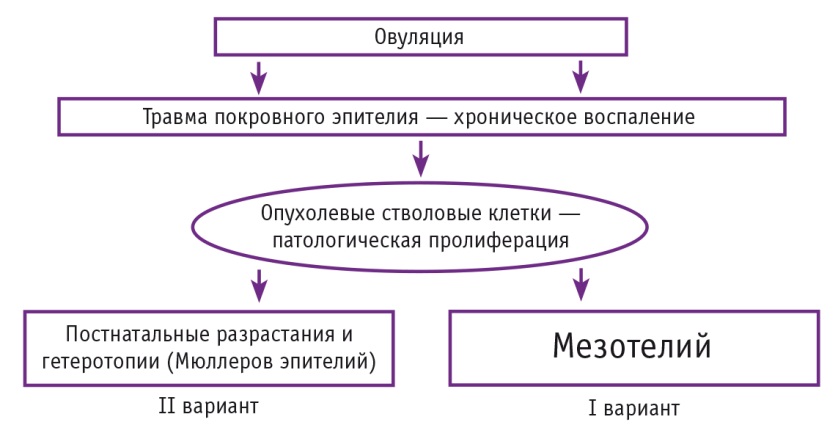
Патогенетический сценарий РЯ имеет ряд важных моментов, которые следует четко обозначить. Основным фактором развития хронического воспаления и пролиферации является травма поверхностного эпителия яичника, обусловленная овуляцией. Ключевой момент, переводящий хронический пролиферативно-воспалительный процесс в новое качественное русло, сопряжен с включением в пролиферативный импульс мутагенной стволовой клетки [4].
При этом возможны два варианта его дальнейшего развития. Если покровный эпителий представлен мезотелиальным компонентом, то формируется единый пролиферативный сигнал, обеспечивающий обширное опухолевое поле на самых ранних этапах канцерогенеза, — формируется I вариант РЯ. Если же покровный эпителий сформирован производными Мюллерова эпителия, то изначально имеет место относительно локализованный опухолевый процесс в зоне яичников, постепенно распространяющийся на всю поверхность малого таза и далее по брюшной полости, — II вариант РЯ (рис. 1).
Рис. 1. Патогенетические варианты рака яичников
Колоссальный массив накопленной на сегодня информации позволяет однозначно утверждать, что процесс развития первичного РЯ и особенно его рецидивных и метастатических форм идеально описывается моделью канцерогенеза, основанной на концепции ОСК. Активированные овариальные ОСК, содержащиеся в опухолевых очагах, а также в асците у больных РЯ, имеют все характерные свойства ОСК: соответствующий молекулярно-генетический портрет, способность к самообновлению и дифференцировке, повышенную туморогенную, метастаз-образующую активность и устойчивость к химиотерапии [5–9]. Современная методическая и инструментальная база позволяет не только детально изучить и охарактеризовать содержащиеся в асците при РЯ клеточные популяции и растворимые провоспалительные факторы, но и воспроизвести модельные эксперименты, адекватно описывающие в условиях in vitro и in vivo все этапы опосредованной асцитом опухолевой прогрессии: от образования туморогенных опухолевых сфероидов из ОСК в условиях провоспалительного микроокружения до последующей их интраперитонеальной диссеминации и формирования вторичных опухолевых очагов.
С большой степенью вероятности можно утверждать, что в организме больной РЯ имеет место следующая последовательность событий [10–12]. На момент установления диагноза в перитонеальной жидкости (безасцитные формы РЯ) или в асците (асцитные формы РЯ) имеется некоторое количество овариальных ОСК, преимущественно в виде опухолевых сфероидов (рис. 2). После проведенного начального лечения (эвакуации асцита) основная часть овариальных ОСК естественным образом удаляется, однако оставшаяся часть, пополняемая за счет ОСК, диссеминированных из первичного опухолевого очага или перепрограммированных из нестволовых опухолевых клеток, сохраняет жизнеспособность. Далее эти ОСК в ходе цикловой неоадъювантной и/или лечебной полихимиотерапии стандартными противоопухолевыми препаратами неизбежно приобретают химиорезистентность, а также повышенную туморогенную и метастатическую активность, проходя процесс эпителиально-мезенхимального перехода (ЕМТ).
Рис. 2. Онкосфероиды [13]
При этом в начале курса химиотерапии ОСК асцита относительно неагрессивны, имеют низкую скорость пролиферации и проявляют чувствительность к стандартным противоопухолевым препаратам. Однако с каждым курсом химиотерапии содержащиеся в асците ОСК становятся все более агрессивными.
Следующий за этим период ремиссии, кажущийся врачу и пациентке спокойным и благополучным, на самом деле является более или менее непродолжительным временны́м промежутком, в течение которого происходит стремительное увеличение количества (пролиферация) высокотуморогенных метастаз-образующих овариальных ОСК, ставших таковыми в результате химиотерапевтического лечения. При этом рост числа агрессивных опухолевых клеток в брюшной полости стимулирует постоянное накопление перитонеальной жидкости, что, в свою очередь, способствует все более обширной диссеминации.
В итоге количество и туморогенность овариальных ОСК в растущем объеме асцита достигают драматических значений. Активированные сфероиды, перемещающиеся с током перитонеальной жидкости, контактируют с клетками мезотелиального слоя, выстилающего органы брюшной полости, после чего следует дезагрегация сфероидов на отдельные клетки и инициируется процесс ЕМТ, следствием которого становится колонизация мезотелия и образование вторичных опухолевых очагов — рецидивов и/или метастазов.
В некоторых случаях такие рецидивные опухоли могут сохранять чувствительность к препаратам стандартной химиотерапии, используемым при лечении РЯ. Однако в конце концов при формировании последующих опухолевых рецидивов содержание ОСК с каждым курсом химиотерапии возрастает, развивается абсолютная опухолевая химиорезистентность с неизбежным летальным исходом.
Полученные к настоящему времени данные позволяют уверенно говорить о том, что овариальные ОСК на разных этапах обратимого перехода от дормантности к максимальной туморогенной и метастатической активности имеют разный молекулярно-генетический портрет, вариабельность которого дополнительно усиливается вследствие разнообразия гисто-/фенотипов и клинических вариантов РЯ у разных пациенток [14].
Таким образом, проблема эффективной терапии РЯ сопряжена с решением ряда ключевых задач. В первую очередь, необходимо наряду со стандартной противоопухолевой терапией, элиминирующей основной массив опухолевой клеточной популяции, мощно ингибировать функциональную активность овариальных ОСК. Немаловажно предусмотреть блокаду основной провоспалительной ниши — асцита, в зоне которого опухоль развивается и приобретает множественное качественное разнообразие, обеспечивающее дальнейшую прогрессию — метастазирование. Только при использовании препаратов, подавляющих воспаление и активность ОСК, в процессе комбинированного лечения, а также в виде монотерапии после окончания лечения у врача-онколога появляется возможность как максимум исключить рецидив злокачественной опухоли, а как минимум, если такой рецидив все-таки возникает, не дать развиться опухолевой резистентности (т. е. сохранить чувствительность опухоли к стандартной химиотерапии).
В течение последних нескольких лет были опубликованы сотни работ, в которых для ряда новых соединений, а также для некоторых ранее известных лекарственных препаратов, применяемых для лечения заболеваний неопухолевого генеза, была продемонстрирована ингибирующая активность в отношении овариальных ОСК [15, 16]. Cреди известных противоопухолевых соединений растительного происхождения особого внимания заслуживают пищевой индол — индол-3-карбинол (I3C), его метаболит-3,3’-дииндолилметан (DIM) и флавоноид эпигаллокатехин-3-галлат (EGCG). К настоящему моменту всесторонне изучена и подробно описана мультитаргетная противоопухолевая активность I3C, DIM и EGCG в отношении опухолей различного происхождения [17–19], в том числе и РЯ [20–25], а также обнаружена способность DIM [26, 27] и EGCG [28–31] селективно ингибировать активность ОСК. Избирательное ингибирующее действие DIM и EGCG на ОСК обусловлено способностью данных веществ специфически блокировать ключевые молекулярные мишени самих ОСК, а также растворимые факторы ниши, являющиеся компонентами сигнальных каскадов, ответственных за жизнеспособность и туморогенные свойства ОСК, в том числе их химиорезистентность и метастатическую активность.
Цель нашего исследования: повышение эффективности стандартной комбинированной терапии больных РЯ путем включения в схему основного лечения мультитаргетных препаратов, содержащих I3C и сочетание I3C с EGCG.
МАТЕРИАЛЫ И МЕТОДЫ
В соответствии с заявленной целью в исследование были включены 284 пациентки, проходившие обследование и лечение в ФГБУ РНЦРР Минздрава России по поводу распространенного (III стадии) серозного РЯ, сопровождающегося асцитом и/или плевритом.
Возраст больных РЯ варьировал от 39 до 76 лет и в среднем составил 55,2 ± 1,5 года. Мы располагали всеми необходимыми клиническими, лабораторными данными и информацией о продолжительности жизни этих пациенток.
У всех женщин использовали общепринятый вариант комбинированного лечения впервые установленного РЯ, включающий стандартную химиотерапию 1-й линии по схемам ТР, ТС, DC и хирургическое вмешательство, подразумевающее экстирпацию матки с придатками вместе с субтотальной резекцией большого сальника и максимальным удалением диссеминированных опухолевых очагов.
Участниц исследования разделили на пять групп. У пациенток в группе 1 (n = 46) стандартное комбинированное лечение сопровождалось пероральным приемом I3C в суточной дозе 400 мг (по 200 мг 2 раза в сутки в виде препарата Индинол Форто) за 7–14 дней каждый день до начала неоадъювантной химиотерапии (НАХТ) и продолжалось вплоть до завершения наблюдения.
В группе 2 (n = 76) схема лечения была аналогичной, но с той разницей, что пациентки дополнительно к пероральному приему I3C 400 мг в сутки получали EGCG в дозе 280 мг в сутки (по 140 мг 2 раза в день) в виде препарата Промисан.
В группе 3 (n = 42) после традиционного лечения, включавшего НАХТ, женщинам проводили пролонгированную полихимиотерапию (ПХТ): отсроченные курсы по схемам ТР, ТС, DC через каждые 8 недель в течение 3 лет. За 7–14 дней до начала НАХТ и далее на протяжении всего периода лечения и наблюдения пациентки группы 3 также перорально получали I3C 400 мг в сутки и EGCG в дозе 280 мг в сутки в виде препарата Промисан.
В качестве контрольных были приняты две группы больных асцитной формой серозного РЯ III стадии, в схему лечения которых не входили препараты I3C, EGCG и/или пролонгированная ПХТ.
Пациентки из группы сравнения 1 (n = 40) проходили лечение по стандартной методике: хирургическое вмешательство и 6 курсов адъювантной химиотерапии (АХТ) по схемам ТР, ТС, DC. Данная группа была введена в исследование ввиду активных диспутов относительно увеличения общей и безрецидивной выживаемости при отказе от НАХТ.
Пациентки из группы сравнения 2 (n = 80), помимо хирургического лечения, получали химиотерапию по схемам ТР, TС, DC и в адъювантном (6 курсов), и в неоадъювантном (2–3 курса) режимах.
После завершения первичного лечения мониторинг состояния участниц осуществляли каждый месяц в течение первого года наблюдения (0–12 месяцев); в период со второго по третий год наблюдения — не реже чем один раз в 3–4 месяца (12–36 месяцев); далее каждые 6 месяцев в 4-й и 5-й годы (37–60 месяцев), при условии, что не было прогрессирования основного заболевания или других причин, требующих более частого контроля и дообследования.
Прогрессирование заболевания диагностировали с использованием различных методов лучевой визуализации (УЗИ, КТ, МРТ, ПЭТ, ПЭТ/КТ) и клинико-лабораторных исследований (определения уровня онкомаркера СА-125), основываясь на критериях Response Evaluation Criteria in Solid Tumors (RECIST) версии 1.1, Gynecologic Cancer InterGroup, и датировали числом, месяцем и годом обследования, впервые его выявившего.
Временной промежуток от момента начала лечения до прогрессирования или смерти по любой причине, включая токсические осложнения, был обозначен как безрецидивная выживаемость.
Последующая терапия РЯ осуществлялась согласно общепринятым схемам в зависимости от локализации рецидивов, времени до прогрессирования и индивидуальных характеристик пациенток, с применением химиотерапевтического (преимущественно), хирургического или лучевого методов по отдельности или в сочетании.
Продолжительность жизни рассчитывали от дня постановки диагноза до даты последнего наблюдения/смерти. Срок наблюдения за участницами исследования составил 5 лет (60 месяцев) или меньше в случае летального исхода. Для женщин с ограниченными сроками наблюдения проводилось определение дожития стандартным статистическим методом (по Каплану — Мейеру). Различия считали статистически значимыми при р < 0,05.
РЕЗУЛЬТАТЫ
Достижение максимально возможной продолжительности жизни наибольшим числом пациенток и поддержание должного ее качества независимо от исследуемой группы были приоритетом в нашей работе.
Эффективность терапии больных РЯ регулярно оценивали, полученные данные резюмировали как непосредственно по завершении каждого этапа первичного лечения, так и через отдаленные периоды: после пролонгированной химиотерапии, по истечении установленного срока наблюдения (60 месяцев).
Эффективность НАХТ обосновывали динамикой уровня СА-125 — согласно критерию Rustin и ответом опухоли в соответствии с критериями RECIST.
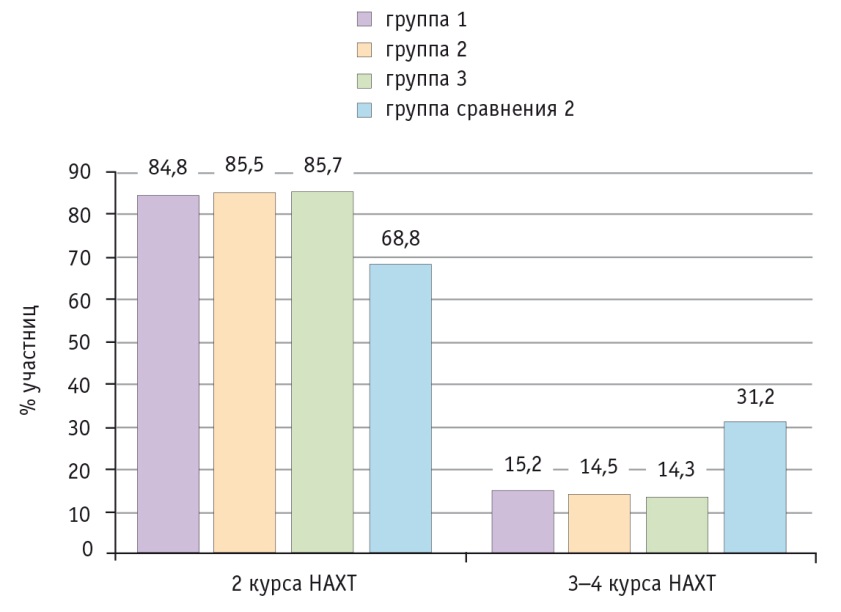
Уменьшение уровня СА-125 после 2 курсов ПХТ на 25% и после 3 курсов на 50% говорит о высокой эффективности НАХТ, оно наблюдалось у участниц всех групп. Тем не менее в группах 1–3 (среди принимавших I3С) положительную динамику регистрировали чаще, она была более выражена и достигалась меньшим числом курсов НАХТ, чем в группе сравнения 2 (рис. 3).
Рис. 3. Число курсов неоадъювантной химиотерапии (НАХТ), необходимое для достижения оптимальных результатов, в исследуемых группах
Динамика снижения уровня онкомаркера СА-125 после 2 курсов НАХТ в группах 1–3 оказалась приблизительно одинаковой: 91,3%, 90,5% и 90,0% соответственно. Это выше среднего показателя в группе сравнения 2 (79,9%; при сравнении с группами 1–3 p < 0,05).
Средние показатели СА-125 после 2 курсов НАХТ в группах 1–3: 50,5 ± 17,4 Ед/мл, 53,3 ± 21,3 Ед/мл и 58,3 ± 31,4 Ед/мл соответственно, в группе сравнения 2 — 108,4 ± 27,4 Ед/мл.
Таким образом, количество пациенток, которым потребовалось проведение 3-го или 4-го курса НАХТ для достижения оптимального результата и ассоциированного с ним уровня СА-125, оказалось ниже в группах 1–3: 15,2%, 14,5%, 14,3% соответственно, против 31,2% в группе сравнения 2 (при сравнении с группами 1–3 р < 0,05). Снижение числа курсов НАХТ способствовало уменьшению проявления цитотоксических реакций.
По окончании этапа НАХТ средний уровень СА-125 достиг или был ниже порогового значения в группе 1 (31,5 ± 26,1 Ед/мл), незначительно превышал норму и находился в области так называемой «серой шкалы» в группах 2 и 3 (37,7 ± 14,3 Ед/мл и 42,3 ± 22,1 Ед/мл соответственно), в группе сравнения 2 данный показатель составил 68,7 ± 35,4 Ед/мл. В группе сравнения 1 уровень СА-125 оставался по-прежнему высоким (589,6± 24,3 Ед/мл), НАХТ не проводилась.
Клиническими проявлениями маркерной (диагностированной в лабораторных условиях) эффективности НАХТ стали исчезновение асцита, уменьшение опухолевых очагов в размерах, их меньшая диссеминация, что позволило на следующем этапе выполнить операцию в наиболее полном объеме и снизить риск послеоперационных осложнений.
Согласно шкале RECISТ и данным, полученным обозначенными методами лучевой диагностики, после НАХТ у большинства участниц всех групп наблюдалась стабилизация течения заболевания (уменьшение суммы наибольших диаметров каждого очага на 20–30%): в группах 1–3 — у 69,6%, 68,4% и 69,0% соответственно, в группе сравнения 2 — у 90,0% женщин (при сравнении с группами 1–3 р = 0,09) (рис. 4).
Рис. 4. Оценка эффективности проведенной неоадъювантной химиотерапии в исследуемых группах по шкале Response Evaluation Criteria in Solid Tumors (версия 1.1)
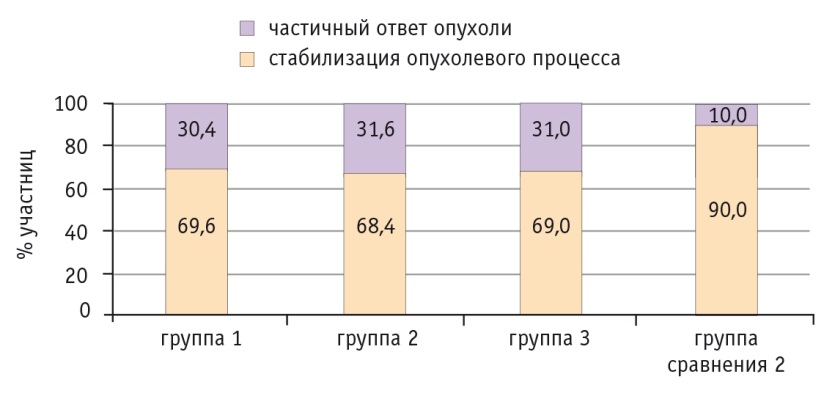
У ряда больных РЯ регистрировали частичный ответ опухоли: среди принимавших препараты I3C (группы 1–3) уменьшение суммы наибольших диаметров каждого очага более чем на 30% отмечали чаще — в 30,4%, 31,6% и 31,0% наблюдений соответственно; в группе сравнения 2 данный показатель не превышал и 10% (при сравнении с группами 1–3 р = 0,11).
Логичным следствием проведенной НАХТ в группах 1–3 стала техническая возможность выполнения циторедуктивной операции в наиболее оптимальном стандартном объеме. Учитывая значимую прогностическую роль размера остаточной опухоли, зачастую предопределяющую безрецидивную и общую продолжительность жизни, мы провели анализ объема операции во всех группах.
Оптимальную циторедукцию с размером остаточной опухоли менее 1 см удалось выполнить в группе сравнения 1 — 52,5%, в группе сравнения 2 — 63,8%, в группах 1–3 — 15,2%, 11,8% и 19,0% пациенток соответственно (при сравнении с группами контроля 1 и 2 р < 0,05). Выполнить полную макроскопическую резекцию (когда размеры остаточной опухоли не визуализируются) было возможно у 84,8%, 85,5% и 81,0% участниц, принимавших препараты I3C (группы 1–3), у женщин группы сравнения 1 данная возможность была минимальной — 12,5%, а в группе сравнения 2 составила около 25% (при сравнении с группами 1–3 р = 0,078 для группы контроля 1, p = 0,071 для группы контроля 2).
Количество женщин с размером остаточной опухоли 1 см или более оказалось наибольшим в группе сравнения 1 (35,0%), намного меньше в группе сравнения 2 (11,3%), такие пациентки отсутствовали в группах 1–3, среди принимавших препараты I3C (при сравнении с группами контроля 1 и 2 р = 0,062 и р = 0,0053 соответственно).
Все хирургические вмешательства выполнялись оперирующей бригадой отделения онкогинекологии ФГБУ РНЦРР, что позволило снизить зависимость полученных результатов от техники и специфики работы хирурга.
Лучшие результаты лечения после хирургического этапа отождествлялись с проведением НАХТ в сочетании с заблаговременным приемом препаратов I3C (Индинол Форто, Промисан), операция носила условно радикальный характер, что в полной мере укладывалось в рамки представленной концепции патогенеза РЯ.
Завершающим этапом первичной комбинированной терапии РЯ стало проведение 5–6 курсов АХТ по схемам 1-й линии таксан- и платиносодержащими препаратами (TP, TC, DC).
Число курсов зависело от индивидуальных клинико-лабораторных характеристик пациентки (размера остаточной опухоли, уровня онкомаркера СА-125, общего состояния и лабораторно-диагностических тестов); медиана в группах 1–3 составила 5 курсов, в группах сравнения 1 и 2 — 6 курсов.
Эффективность терапии оценивали по критериям шкалы RECIST через 21 день после окончания последнего курса АХТ.
Высокую результативность проведенного лечения отмечали во всех группах: объективный эффект, подразумевающий полный и частичный ответ опухоли, регистрировали у 98,7% женщин в группе 2, у 100% в группах 1 и 3, у 95,0% в группе сравнения 1 и у 90,0% в группе сравнения 2.
Несмотря на кажущееся сходство полученных данных, во всех группах имела место выраженная дифференцировка в зависимости от полного или частичного ответа опухоли.
В группах 1–3 исчезновение всех опухолевых очагов наблюдалось у 93,5%, 94,7% и 95,2% участниц соответственно, в то время как в группе сравнения 2 этот показатель составил 73,8%, а в группе сравнения 1 не превышал 62,5%.
Кроме того, у некоторых пациенток отмечали прогрессирование заболевания на фоне проводимой платиносодержащей АХТ: у 10,0% (максимальное количество) в группе сравнения 2, у 5,0% в группе сравнения 1, у 1,3% в группе 2 (всего у одной пациентки), в группах 1 и 3 платинорефрактерность не развивалась.
После завершения комбинированной терапии больных с впервые выявленным РЯ, помимо оценки ответа опухоли по шкале RECIST, немаловажное значение имело определение концентрации онкомаркера СА-125. Его показатель в большей мере служил прогностическим фактором, точкой отсчета для последующей регистрации отрицательной динамики течения заболевания.
Средний уровень СА-125 во всех группах после завершения комбинированной терапии был ниже общепринятого порогового значения: в группе 1 — 12,8 ± 15,2 Ед/мл, в группе 2 — 10,4 ± 11,4 Ед/мл, в группе 3 — 12,7 ± 18,7 Ед/мл, в группе сравнения 1 — 31,1 ± 16,3 Ед/мл, в группе сравнения 2 — 32,4 ± 14,1 Ед/мл.
Индивидуальные показатели широко варьировали: от 10 до 20 Ед/мл в группе 1, от 8 до 42 Ед/мл в группе 2, от 8 до 35 Ед/мл в группе 3, от 20 до 54 Ед/мл в группе сравнения 1 и от 20 до 55 Ед/мл в группе сравнения 2.
Резюмируя опыт лечения РЯ в исследуемых группах, отметим, что применение препаратов I3C заблаговременно до начала НАХТ способствует повышению ее эффективности, потенцируя мощный противовоспалительный эффект, выражающийся, помимо прочего, в исчезновении выпотной жидкости в брюшной и/или плевральной полостях, в нормализации уровня онкомаркера СА-125, данные препараты также организуют диссеминированный процесс, тем самым обеспечивая возможность выполнения операции в условно радикальном/полном объеме.
Длительная поддерживающая терапия больных РЯ по завершении стандартного комбинированного лечения препаратами I3C в группах 1 и 2 и их сочетание с пролонгированной ПХТ в группе 3 были призваны обеспечить продолжительный латентный период с учетом обозначенных в работе этиопатогенетических факторов течения заболевания.
Применение пролонгированной ПХТ в группе 3 в течение 3 лет каждые 8 недель способствовало гибели нового пула опухолевых клеток, вышедших из состояния дормантности и завершивших к этому моменту свой пролиферативный цикл.
В процессе наблюдения за пациентками в течение 60 месяцев (5 лет) во всех группах регистрировали случаи прогрессирования основного заболевания. Из 284 больных РЯ, включенных в исследование, отрицательную динамику, расцененную как рецидив, выявили у 248 (87,3%).
Подробный анализ полученных данных продемонстрировал, что большинство пациенток без прогрессирования РЯ, помимо стандартной терапии, получали препараты I3C (8 (17,4%) из группы 1), I3C в сочетании с EGCG (15 (19,7%) из группы 2) и их комбинацию с пролонгированной ПХТ (9 (21,4%) из группы 3). В группах сравнения 1 и 2 число женщин без прогрессирования оказалось минимальным — 2 (5,0%) и 2 (2,5%) соответственно.
У участниц, принимавших препараты I3C, безрецидивный период был более продолжительным. В группе 1 медиана безрецидивной выживаемости составила 39,5 месяца (95%-ный ДИ: 28,0–49,0), в группе 2 — 42,5 месяца (95%-ный ДИ: 38,0–49,0), в группе 3 — 48,5 месяца (95%-ный ДИ: 39,0–53,0), в группе сравнения 1 — 24,5 месяца (95%-ный ДИ: 14,0–34,0), в группе сравнения 2 — 22,0 месяца (95%-ный ДИ: 15,0–26,0) (рис. 5).
Рис. 5. Безрецидивная выживаемость в исследуемых группах
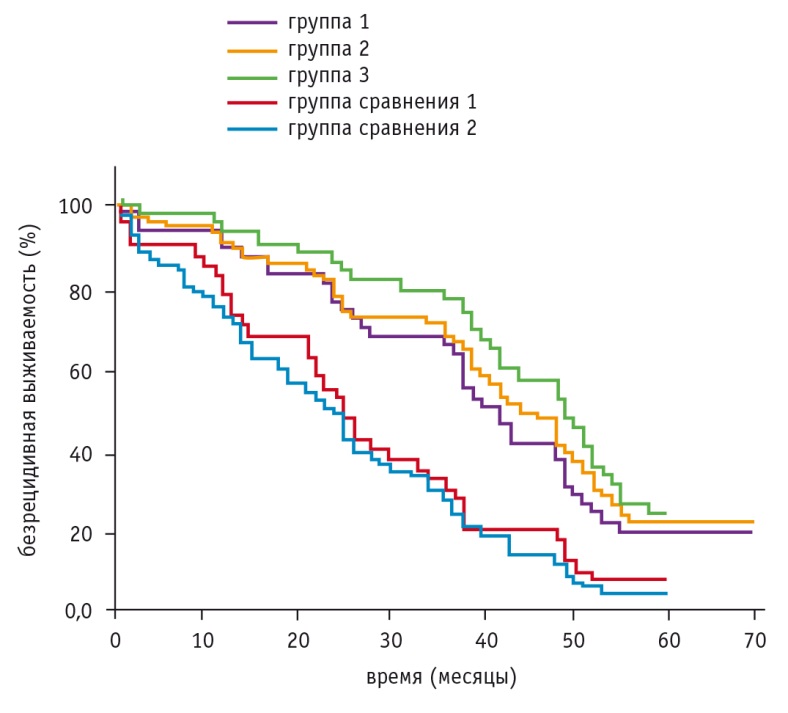
Кроме того, в группах пациенток, получавших препараты I3C, выявленные рецидивы РЯ гораздо реже сопровождались наличием выпотной жидкости (асцитом/плевритом), а спектр их локализации был преимущественно ограничен анатомическим пространством малого таза.
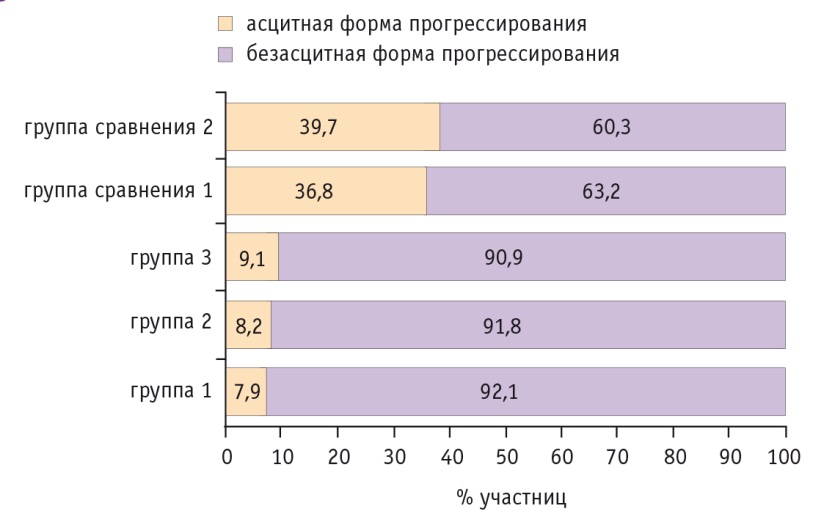
Безасцитный вариант прогрессирования РЯ преобладал во всех группах: в 92,1%, 91,8% и 90,9% наблюдений в группах 1–3 соответственно, в 63,2% и 60,3% наблюдений в группах сравнения 1 и 2 соответственно.
В группах 1–3 количество женщин с асцитными формами РЯ, составлявшее до лечения 100%, сократилось при прогрессировании до 7,9%, 8,2% и 9,1% соответственно. В группах сравнения 1 и 2 их частота также снизилась, но не столь значительно: со 100% до 36,8% и 39,7% соответственно. Такой характер прогрессирования обусловливал дальнейшее более благоприятное, менее агрессивное течение заболевания (рис. 6).
Рис. 6. Анализ соотношения асцитных и безасцитных форм рака яичников в исследуемых группах в случае дальнейшего прогрессирования заболевания
В группах 1–3 проблема рецидивирования РЯ была связана в большей степени с последующим развитием заболевания в прикультевой зоне (культя влагалища, брюшина прикультевой зоны, поражение лимфатических узлов — тазовых и парааортальных, париетальной брюшины таза). В группах сравнения 1 и 2, помимо метастазов в полости малого таза, достаточно часто выявляли отдаленные метастазы в паренхиме печени, мезотелиальном покрове диафрагмы, надключичных, поддиафрагмальных, паховых лимфатических узлах, головном мозге и т. п. Среди участниц групп 1–3, принимавших препараты I3C, такие случаи были единичными.
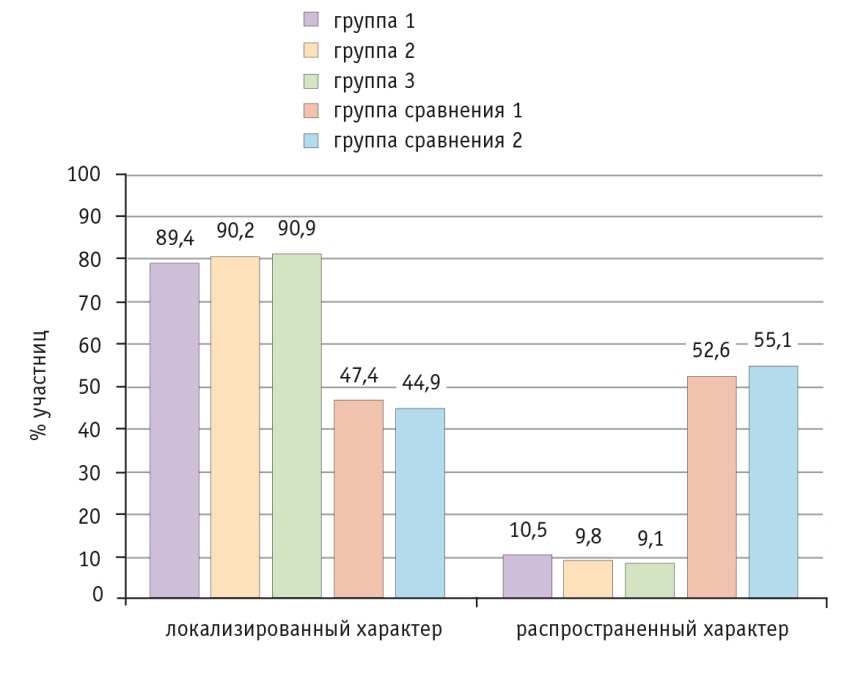
Обобщая полученные данные, мы условно разделили характер прогрессирования РЯ на локализованные и распространенные варианты. К локализованным формам были отнесены случаи дальнейшего метастазирования в регионарные лимфоузлы, продолженного роста опухоли в малом тазу и отсутствие асцита; к распространенным формам — все остальные.
Результаты позволили оценить динамику уменьшения доли распространенных форм прогрессирования РЯ: в группах 1–3 локализованный характер рецидивов отмечали у 89,4%, 90,2% и 90,9% соответственно. В группах сравнения 1 и 2, наоборот, локализованные формы прогрессирования РЯ встречались реже, чем диссеминированные, всего в 47,4% и 44,9% наблюдений соответственно (рис. 7).
Рис. 7. Характер дальнейшего прогрессирования рака яичников в исследуемых группах
Больные РЯ с локализованными формами прогрессирования при условии длительного безрецидивного периода (более 6 месяцев), полного объема предыдущей операции (без макроскопически определяемой опухоли) и удовлетворительного общего состояния рассматривались как кандидаты на проведение повторных циторедуктивных вмешательств.
Наличие длительного интервала без прогрессирования также позволяло в последующем применять более эффективные схемы химиотерапии на основе таксан- и платиносодержащих препаратов.
Пациенткам с РЯ с бесплатиновым интервалом менее 6 месяцев (в том числе женщинам с платинорефрактерным раком) проводили монохимиотерапию (2-й линии) одним из следующих химиопрепаратов: доксорубицином, этопозидом, винорельбином, топотеканом; их эффективность в таких клинических ситуациях не превышает, по данным ряда авторов, 10–30%.
Количество женщин с прогрессированием РЯ и возможностью продолжить химиотерапию таксан- и платиносодержащими препаратами по схемам 1-й линии в группах 1–3 составило соответственно 97,4%, 98,3% и 97%. В группе сравнения 2 таких пациенток оказалось 78,2% (минимальное число), в группе сравнения 1 — 84,2%.
Случаи платинорезистентного и платинорефрактерного РЯ среди больных, принимавших препараты I3C, были единичными — 1,6%, 2,6% и 3,0% в группах 1–3 соответственно. Имело значение и то, что пролонгированная ПХТ на фоне приема индинол-содержащего препарата (группа 3) не оказывала статистически значимого влияния на увеличение доли платинорезистентных форм. В группах сравнения 1 и 2 данный показатель достигал 15,8% и 21,8%, что соотносится с результатами многочисленных отечественных и зарубежных исследований. Некоторым больным, учитывая сложившуюся совокупность описанных выше факторов, решено было провести повторные циторедуктивные операции.
Возможность выполнения повторных циторедукций после завершения стандартной комбинированной терапии среди пациенток с РЯ из групп 1–3 была выше, чем в группах сравнения: преобладали полные первичные макроскопические резекции, повторный рост опухолевых очагов отмечался преимущественно в прикультевой зоне, носил безасцитный характер и регистрировался через более длительные временны́е промежутки, превышающие полгода.
В группе 1 повторную циторедуктивную операцию по поводу прогрессирования РЯ выполнили 9 из 38 (23,7%), в группе 2 — 15 из 61 (24,6%), в группе 3 — 10 из 33 (30,3%) участниц, в группах сравнения 1 и 2 эти показатели составили 2 из 38 (5,3%) и 5 из 78 (6,4%) женщин с прогрессированием соответственно.
Число больных, достигших 5-летнего рубежа продолжительности жизни, после поздней верификации РЯ оказалось не столь велико, как хотелось бы: из 284 женщин, включенных в исследование, только 153 (53,9%) смогли завершить участие в научной работе.
Большинство перешагнувших порог 5-летнего наблюдения принимали дополнительно к стандартной терапии препараты I3C: в группах 1–3 — 30 (65,2%), 48 (63,2%) и 30 (71,4%) женщин соответственно, в группах сравнения 1 и 2 — 16 (40,0%) и 29 (36,3%).
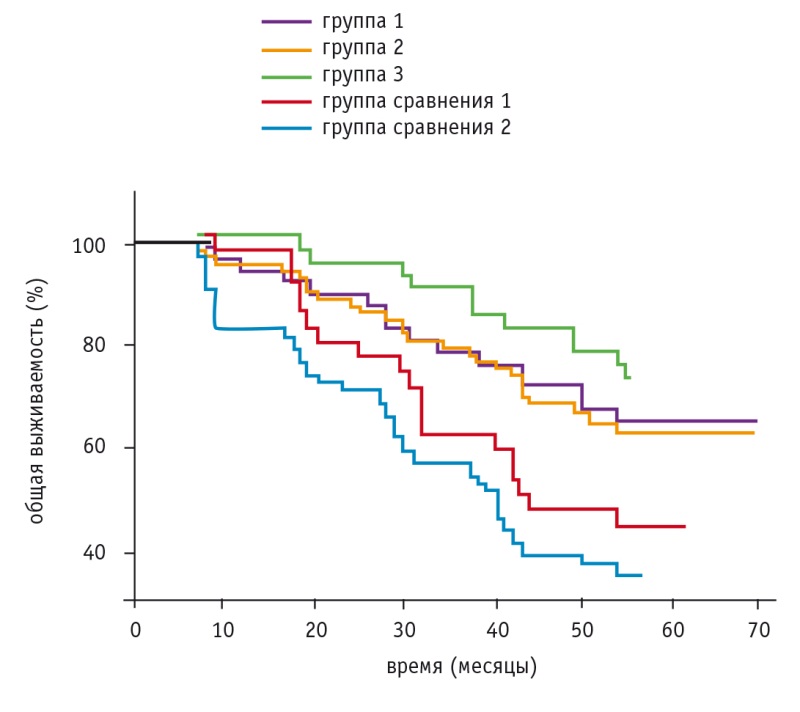
Медиана 5-летней выживаемости была равна 60 месяцам в группах 1–3 (для группы 1 95%-ный ДИ: 58,0–60,0 месяцев; для групп 2 и 3 95%-ный ДИ: 58–60,0 месяцев). В группе сравнения 1 медиана 5-летней выживаемости составила 46 (95%-ный ДИ: 28–60) месяцев, а в группе сравнения 2 — 44 (95%-ный ДИ: 33,0–58,0) месяца (рис. 8).
Рис. 8. Выживаемость больных раком яичников
Логичным завершением исследовательской работы стала оценка общего состояния больных РЯ по шкале Eastern Cooperative Oncology Group (ECOG) и качества жизни с использованием анкеты The European Organization for Research and Treatment of Cancer QLQ-C30 (EORTC-QLQ-C30) версии 3.0.
По истечении установленного срока исследования 60 месяцев (5 лет) среди пациенток, принимавших препараты I3C, удалось оценить лучшими баллами не только общее состояние и двигательную активность по шкале ECOG, но и получить более благоприятную субъективную оценку по большинству параметров вопросника о качестве жизни EORTC-QLQ-C30.
Токсичность проводимого химиотерапевтического лечения рутинно оценивали в соответствии со стандартной шкалой токсичности Common Terminology Criteria for Adverse Event v 3.0.
У всех больных РЯ были зарегистрированы некоторые негативные симптомы или их сочетания, характерные для применения цитотоксических препаратов. Тем не менее они купировались самостоятельно или назначением соответствующей терапии, не требовали редукции вводимых доз или отмены препаратов, включая I3C, а частота их проявления не имела статистически значимых различий между группами после завершения комбинированной терапии.
ОБСУЖДЕНИЕ
Представленное исследование является пилотным, однако на этом этапе можно высказать ряд соображений, формирующих начальное понимание достигнутого эффекта в лечении серозного РЯ III стадии. Опыт лечения РЯ огромен. На протяжении всей его истории не удалось сколь-нибудь существенно улучшить эффективность 5-летнего излечения. Причины этих неудач, прежде всего, были следствием отсутствия ясного понимания патогенеза болезни и его ключевых моментов. Отношение к серозному РЯ было таким же, как к обычному солидному опухолевому процессу, без понимания, что изначально процесс носит системный характер, а наличие асцита является важной его характеристикой, отражающей мощный воспалительный компонент. Другая немаловажная составляющая патогенеза заключается в том, что РЯ — это рак, в большей степени представленный опухолевыми стволовыми клетками. Данный фактор в корне меняет результат химиотерапии на протяжении всего периода лечения, делая ее малоэффективной или временно эффективной.
Именно учитывая эту патогенетическую конфигурацию заболевания, мы подошли к формированию основных принципов терапии:
- серозный РЯ III стадии является системным заболеванием;
- адекватная терапия его должна изначально быть системной;
- лекарственная терапия, кроме канцероцидного действия на соматические опухолевые клетки, должна иметь влияние на ОСК, блокируя механизмы формирования резистентных клонов, усиливая апоптоз;
- лекарственная терапия должна оказывать и мощный противовоспалительный эффект.
ЗАКЛЮЧЕНИЕ
Прием препаратов индол-3-карбинола (I3C) (Индинола Форто, Промисана) дополнительно к стандартной комбинированной терапии рака яичников (РЯ) способствовал повышению ее эффективности путем формирования условий для достижения полного или частичного ответа опухоли при химиотерапии 1-й линии таксан- и платиносодержащими препаратами, для выполнения полных и оптимальных циторедуктивных операций, для достижения более длительной безрецидивной и общей продолжительности жизни. Использование I3C также приводило к изменению характера рецидивирования на более локализованные его варианты, обеспечивая снижение числа асцитных форм и дальнейший рост опухолевых очагов преимущественно в прикультевой зоне. Все это обеспечило достижение лучших характеристик как общего состояния больных РЯ, так и качества их жизни.
Вышесказанное позволяет рекомендовать препараты I3C для длительной сопутствующей и поддерживающей терапии пациенток с РЯ сразу после верификации диагноза и в пролонгированном режиме, после завершения стандартного комбинированного лечения.








