Рак яичников (РЯ) был и остается актуальной проблемой современной онкогинекологии. Это по-прежнему обусловлено отсутствием эффективных методов ранней диагностики (чаще всего заболевание диагностируют на III–IV стадиях опухолевого процесса) [7], низкими показателями пятилетней выживаемости (от 30% до 50%) [8], высокой частотой рецидивов [7]. Кроме того, отсутствуют скрининговые методы выявления РЯ, которые продемонстрировали бы свою эффективность в крупных клинических исследованиях.
По данным статистики РФ, в 2014 г. РЯ был найден у 13 634 женщин, в 2015 г. — у 14 049, он занимал восьмое место (4,4%) в структуре общей онкологической заболеваемости и третье среди гинекологических опухолей (после рака тела и шейки матки) [7, 9]. За последние 10 лет прирост заболеваемости РЯ в РФ составил 11,9% [8]. Средний возраст женщин с РЯ в РФ в 2015 г. — 63,9 года [7], то есть пик заболеваемости приходится на период постменопаузы.
Важным аргументом в пользу необходимости ранней диагностики РЯ является и то, что выживание женщин после хирургического и последующего химиотерапевтического лечения гораздо выше и прогноз лучше, если оно проводится в специализированных центрах специалистами гинекологами-онкологами [10].
Все перечисленное выше диктует необходимость тщательного анализа сложившегося опыта диагностики, лечения и дальнейшего ведения пациенток с ООЯ, принятия решений, актуальных для повседневной клинической практики [11].
Цель исследования: изучить распространенность и морфологическую структуру ООЯ у женщин в постменопаузе и оценить прогностическую ценность измерения уровней СА-125, НЕ-4, а также Risk Malignancy Index (RMI) и Risk of Malignancy Algorithm (ROMA) в дифференциальной диагностике доброкачественных и злокачественных новообразований яичников на этапе предоперационного обследования.
Дизайн: комбинированное ретроспективное и проспективное исследование.
МАТЕРИАЛЫ И МЕТОДЫ
На первом этапе нами был проведен ретроспективный анализ 2177 протоколов аутопсий женщин, умерших в клиниках ФГБОУ ВО СибГМУ различного профиля в период с 1976 по 2016 г. Сто (4,6%) протоколов содержали описание макро- и/или микроскопического исследования патологически измененных яичников, из них 49 (2,2%) — протоколы секций пациенток, находившихся в постменопаузальном периоде (старше 55 лет). На основании данных протоколов была изучена морфологическая структура ООЯ у женщин в постменопаузе.
На втором этапе проведено проспективное исследование, в котором приняли участие 36 пациенток в постменопаузальном периоде, поступившие с целью хирургического лечения объемных образований в области маточных придатков в гинекологическую клинику ФГБОУ ВО СибГМУ в период с 2014 по 2017 г. Протокол исследования был одобрен Этическим комитетом ФГБОУ ВО СибГМУ Минздрава России (регистрационный номер 4336 от 30.11.2015 г.), все участницы исследования подписали информированное согласие.
Все пациентки были обследованы согласно стандарту при ООЯ, в соответствии с Приказом Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология» (за исключением использования вспомогательных репродуктивных технологий)». Помимо этого, у пациенток был определен уровень онкомаркера НЕ-4 в сыворотке крови методом хемилюминисцентного иммуноанализа (Architect, Abbott). На основании менопаузального статуса, результатов УЗИ органов малого таза и уровня онкомаркера СА-125 в сыворотке крови был рассчитан индекс малигнизации RMI. Значение индекса более 200 указывает на злокачественный характер ООЯ [12].
Расчет ROMA проводили с помощью калькулятора ROMA to Calculate Risk of Epithelial Ovarian Cancer (http://romatools.he4test.com/calculator_row_en.html) на основании менопаузального статуса и содержания онкомаркеров СА-125 и НЕ-4 в сыворотке крови. У женщин в постменопаузе значения ROMA, равные или более 27,7%, указывают на высокий риск, а значения ROMA менее 27,7% говорят о низком риске РЯ [13, 14].
После хирургического лечения в гинекологической клинике ФГБОУ ВО СибГМУ и получения результатов гистологического исследования операционного материала производили статистическую обработку данных с помощью компьютерной программы SPSS Version 20.
Для описания количественных данных, подчиняющихся нормальному закону распределения, использовали среднее значение + среднеквадратичное отклонение. Для количественных данных, не подчиняющихся нормальному закону распределения, рассчитывали медианы и квартили. Проверку на нормальность распределения признаков осуществляли с помощью критерия Колмогорова — Смирнова. Сравнение выборок проводили с применением непараметрических тестов: U-критерия Манна — Уитни и χ2. Для выявления зависимостей между количественными и качественными признаками использвали мультиноминальную логистическую регрессию. Различия считали статистически значимыми при p < 0,05.
Чувствительность метода (sensitivity (SE), доля позитивных результатов теста в группе больных РЯ) рассчитывали по формуле:
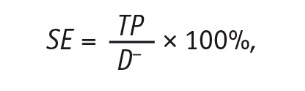
где TP — истинно положительные результаты исследования, D– — количество всех пациенток с РЯ.
Специфичность метода (specificity (SP), доля негативных результатов теста в группе пациенток с ДОЯ) определяли по формуле:
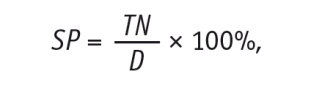
где TN — количество истинно отрицательных результатов исследования, D — количество пациенток с ДОЯ.
Помимо этого, был проведен ROC-анализ с расчетом площади под ROC-кривой (area under ROC curve, AUC) — количественной интерпретации вышеописанного статистического анализа (чем выше показатель AUC, тем более информативен метод исследования).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
По результатам анализа протоколов аутопсий, распространенность ООЯ у женщин в постменопаузе составила 2,2%, что соответствует данным литературы [1]. Средний возраст больных на момент смерти — 70 ± 9 лет. Смерть 44,9% женщин наступила вследствие сердечно-сосудистых заболеваний: инфаркта миокарда у 28,6%, инсульта головного мозга у 16,3%; 28,6% умерли из-за злокачественных новообразований различных локализаций (яичники, желудок, кишечник, легкие). Полученные нами результаты согласуются с официальными данными Росстата [15] о коэффициентах смертности по основным классам причин смерти (лидирующее положение занимают болезни системы кровообращения, на втором месте — новообразования). У 24,5% пациенток смерть наступила по причине воспалительных заболеваний органов и тканей и их осложнений (панкреатита, пиелонефрита, дивертикулита, дерматомиозита, флегмоны мягких тканей), у 2,0% — туберкулеза брюшины.
У 41 (83,7%) из 49 умерших постменопаузального возраста ООЯ не были указаны в заключительном клиническом диагнозе, то есть стали «находкой» при проведении патолого-анатомического исследования. Размеры ООЯ, впервые выявленных на аутопсии, варьировали от 3 мм до 160 мм.
По результатам гистологического исследования, у 83,7% умерших женщин постменопаузального возраста были выявлены доброкачественные ООЯ (ДОЯ), у 16,3% — злокачественные (ЗОЯ), то есть у каждой шестой пациентки в постменопаузе новообразование яичника являлось злокачественным.
Среди ДОЯ наиболее часто (24,5%) встречались эпителиальные опухоли: серозная цистаденома — у 20,5% пациенток, серозная аденофиброма — у 2,0%, эндометриоидная киста — у 2,0%. Немного реже находили простые (неклассифицируемые) кисты яичников (у 18,4% женщин) и инклюзионные кисты (у 8,2%). Опухоли стромы полового тяжа в варианте фибромы выявили у 4,1% умерших. Герминогенные опухоли были представлены зрелой тератомой у 2,0% пациенток. У 8,2% женщин обнаружили фолликулярные кисты яичников, у 4,1% — параовариальные, у 2,0% — кисту желтого тела. Помимо этого, при аутопсии у 8,2% умерших был найден стромальный гипертекоз яичников, у 2,0% — поликистоз и еще у 2,0% — апоплексия яичников.
Злокачественные опухоли яичников представлены следующими гистологическими вариантами: серозная цистаденокарцинома — 4,1%, муцинозная цистаденокарцинома — 6,1%, эмбриональный РЯ — 2,0%, недифференцированный РЯ — 4,1%.
РЯ был указан в заключительном клиническом диагнозе у 4 из 8 больных (50,0%), в заключительном патолого-анатомическом (как основной) — у 7 из 8 (87,5%).
По нашим данным, размеры ДОЯ варьировали от 3 мм до 160 мм, ЗОЯ — от 30 мм до 200 мм. Размеры ЗОЯ достоверно превышали размеры ДОЯ (р = 0,001), однако не могли являться дифференциальным критерием. У 37,5% умерших с РЯ диаметр выявленных опухолей составил от 30 мм до 40 мм.
Возраст пациенток гинекологической клиники СибГМУ, принявших участие в проспективном исследовании, варьировал от 42 до 79 лет, медианное среднее составило 57,5 (54–61) года. Длительность постменопаузы — от 1 года до 30 лет, в среднем — 9 ± 7 лет. С момента выявления новообразований в яичниках до хирургического лечения у пациенток прошло от 1 месяца до 10 лет, медианное среднее — 8 (3–24) мес.
По данным УЗИ органов малого таза на предоперационном этапе, размеры ООЯ варьировали от 4 мм до 300 мм, медианное среднее составило 31,5 (14–89) мм.
Во время предоперационного обследования у одной пациентки обнаружили повышение всех четырех исследуемых параметров (СА-125, НЕ-4, RMI, ROMA), у 3 пациенток — повышение уровня СА-125, а также RMI и ROMA, что позволило предположить у этих женщин наличие ЗОЯ.
Согласно результатам гистологического исследования операционного материала, у 88,9% участниц выявлены ДОЯ и у 11,1% — ЗОЯ. То есть у каждой девятой пациентки в постменопаузе ООЯ оказывалось злокачественным.
Данные о превалировании ДОЯ над ЗОЯ у пациенток в постменопаузе, полученные в проспективном исследовании, согласуются с результатами анализа протокола аутопсий, проведенного на первом этапе, а также с данными литературы [2, 16].
ДОЯ имели размеры от 4 мм до 200 мм, ЗОЯ — от 88 мм до 300 мм. Размеры ЗОЯ, как и при анализе протоколов аутопсий, достоверно превышали размеры ДОЯ (р = 0,006), но не могли являться надежным дифференциальным критерием. У 28,1% пациенток с ДОЯ размеры последних превышали 5 см, у 15,6% объемные образования имели диаметр более 10 см, при этом оставались доброкачественными.
Более половины (55,6%) доброкачественных новообразований яичников были представлены эпителиальными опухолями: серозные цистаденомы выявлены у 38,9% пациенток, муцинозные — у 8,3%, серозные аденофибромы — у 5,6%, эндометриоидная киста — у 2,8%. У одной (2,8%) пациентки была найдена зрелая тератома. У 8,3% участниц диагностирован стромальный гипертекоз, у 5,6% — фиброматоз, у 2,8% — стромальная гиперплазия яичников. У 13,8% пациенток обнаружили простые и мелкие инклюзионные кисты яичников.
Все ЗОЯ были представлены эпителиальными опухолями: идентифицированы 2 серозные карциномы, 1 муцинозная и 1 светлоклеточная карцинома.
При ДОЯ уровни онкомаркера СА-125 в группе исследования варьировали от 1,78 Ед/мл до 31,0 Ед/мл, при ЗОЯ — от 31,0 Ед/мл до 524 Ед/мл (р = 0,001) (дискриминационный уровень СА-125 равен 35 Ед/мл). В случаях положительных результатов при РЯ концентрация СА-125 была повышена минимум в 4 раза.
Уровень опухолевого маркера НЕ-4 в сыворотке крови при ДОЯ у женщин в постменопаузе находился в пределах от 30,9 пмоль/л до 100,4 пмоль/л (при норме до 140 пмоль/л); при ЗОЯ — от 37,3 пмоль/л до 235,9 пмоль/л (р = 0,082).
Для RMI были характерны значения от 7,12 до 164,4 при ДОЯ и от 124,0 до 2098,8 при ЗОЯ (р = 0,002) (дискриминационный уровень равен 200).
Показатели ROMA при ДОЯ у женщин пв остменопаузальном периоде находились в пределах от 2,5% до 22,8%; при ЗОЯ — от 14,0% до 80,2% (р = 0,001). Референсные значения ROMA в постменопаузе — менее 27,7%.
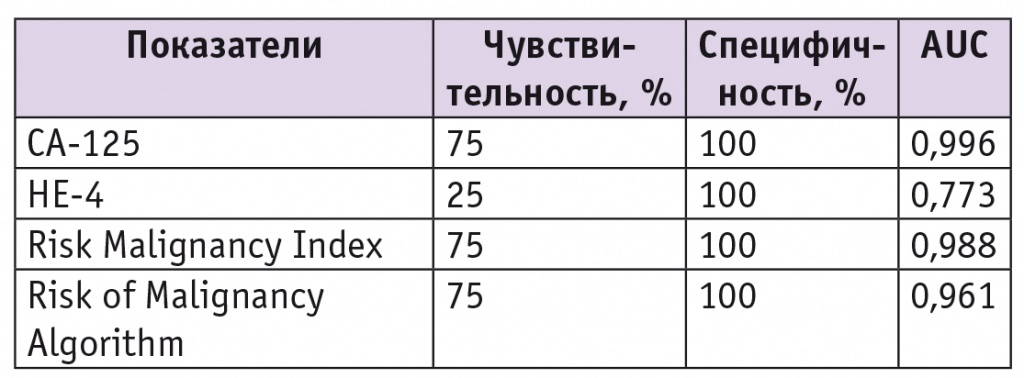
Содержание онкомеркера СА-125, показатели RMI и ROMA превышали дикриминационные у 3 из 4 женщин с РЯ. Уровень НЕ-4 превышал границы нормы у одной пациентки с РЯ. У участниц с ДОЯ вышеназванные диагностические показатели не выходили за границы нормы. На основании вышеизложенного можно сделать выводы о чувствительности и специфичности СА-125, НЕ-4, RMI и ROMA в проведенном исследовании (табл.).
Таблица
Чувствительность, специфичность и площадь под ROC-кривой (AUC) определения уровней СА-125, НЕ-4, измерения Risk Malignancy Index и Risk of Malignancy Algorithm у пациенток в постменопаузе
Значение СА-125 (как и трех других исследуемых параметров — НЕ-4, RMI, ROMA) оставалось в пределах нормы у пациентки со светлоклеточной карциномой яичника размером 216 × 159 мм, что согласуется с данными A. Barbati и соавт., указывающих на сравнительно редкое повышение уровня СА-125 в крови при данном гистологическом типе опухоли [17, 18].
Опухолевый маркер НЕ-4 показал ложноотрицательный результат у 3 пациенток: у участницы исследования с муцинозной карциномой яичника (60 лет, размеры опухоли — 300 мм, РЯ был вторичным — при гистологическом исследовании выявлены фокусы микроинвазии в пограничные опухоли), у женщины с серозной карциномой яичника (51 год, опухоль диаметром 125 мм), а также у пациентки со светлоклеточной карциномой (67 лет, размеры опухоли — 216 × 159 мм). Полученные результаты совпадают с данными литературы, в которых указано, что в эндометриоидных и светлоклеточных аденокарциномах обнаруживается более низкая и непостоянная экспрессия НЕ-4, а в образцах РЯ муцинозного гистологического типа экспрессия НЕ-4 может отсутствовать [19–21].
В отдельных исследованиях были получены схожие данные, свидетельствующие о некотором превосходстве чувствительности СА-125 над таковой НЕ-4. Так, Y. Park и соавт. [22], сравнивая диагностическую значимость онкомаркеров СА-125 и НЕ-4 в дифференциальной диагностике новообразований яичников, показали, что при специфичности 95% чувствительность НЕ-4 составила 44,8%, в то время как для СА-125 данный показатель — 55,2%.
Значения RMI и ROMA были ложноотрицательным у пациентки со светлоклеточной карциномой яичника в связи с низкой чувствительностью онкомаркеров СА-125 и НЕ-4, являющихся основой для расчета данных показателей, при данном типе опухоли [17–22].
Взаимосвязь между значениями диагностических тестов (СА-125, НЕ-4, RMI и ROMA) и гистологическими вариантами опухолей яичников не найдена (p > 0,05).
ЗАКЛЮЧЕНИЕ
Несмотря на то что диагностические методы в проведенном исследовании показали достаточно высокую чувствительность — СА-125, Risk Malignancy Index (RMI) и Risk of Malignancy Algorithm (ROMA), а также специфичность (СА-125, НЕ-4, RMI и ROMA), хирургический подход должен быть предпочтительным при ведении пациенток постменопаузального периода с объемными образованиями яичников (ООЯ).
Наиболее ценным показателем для дифференциальной диагностики доброкачественных и злокачественных новообразований яичников у женщин в постменопаузе на предоперационном этапе оказался уровень опухолевого маркера СА-125 (метод характеризовался наибольшим значением площади под ROC-кривой (AUC) — 0,996), наименее ценным — содержание НЕ-4 (АUC — 0,773).
Размер ООЯ, определенный при УЗИ или ином визуализационном исследовании, не должен являться критерием дифференциальной диагностики между доброкачественными и злокачественными ООЯ.








