В диагностике миомы большое значение имеет гистероскопия. Она позволяет оценить состояние эндометрия и при выявлении подозрительных участков произвести прицельную биопсию, провести дифференциальный диагноз с внутренним эндометриозом, определить степень деформации полости матки при центрипетальном росте интерстициальной миомы, визуально оценить локализацию и величину субмукозной миомы, ширину ее основания и глубину залегания интрамурального компонента [1, 4].
В определении показаний к оперативному лечению у пациенток с миомой матки важную роль играют лучевые методы диагностики. Так, современная трехмерная эхография позволяет провести послойный анализ, многоплановую реконструкцию, а также ретроспективную оценку полученных данных [3, 5]. Кроме того, доплерография при УЗИ помогает получить информацию о кровообращении в узле и прогнозировать динамику его роста. При пролиферирующей миоме по данным цветного доплеровского картирования определяется выраженный внутриопухолевый кровоток с локализацией сосудов по периферии (в капсуле) узла и с умеренным числом цветовых сигналов в центре узла [5].
Основным методом лечения больных миомой матки остается хирургический. Согласно современной концепции, раннее хирургическое органосохраняющее лечение является патогенетически обоснованным, так как удаление опухоли препятствует развитию миогенной гиперплазии и локальной гиперэстрогении, а значит, прогрессированию заболевания [6, 7]. Вместе с тем излишний консерватизм при ведении молодых женщин с миомой приводит к опасности потери органа в ближайшие 3–10 лет после выявления миомы матки при минимальном шансе реализации детородной функции [2–4].
На сегодняшний день вопрос о роли миомы матки в генезе бесплодия остается открытым. Считается, что гормональная нагрузка в программах ЭКО и переноса эмбриона (ПЭ) способствует росту миомы, что, в свою очередь, является противопоказанием для использования данных методов лечения бесплодия. В связи с этим удаление миоматозных узлов, согласно мнению большинства современных авторов, — необходимый этап подготовки пациенток к включению в программы ЭКО и ПЭ [1, 7].
Активно обсуждаются в литературе использование различного шовного материала, пути снижения интраоперационной кровопотери и обеспечения условий для формирования полноценного рубца на матке [8, 9].
Лапароскопическая миомэктомия остается «золотым стандартом» органосохраняющего лечения миомы матки [10]. Малая травматичность, четкость визуализации тканей, более короткие сроки госпитализации, меньший риск развития послеоперационного спаечного процесса позволяют широко применять лапароскопический доступ у женщин репродуктивного возраста. Однако неизбежное использование коагуляции вызывает термическое повреждение миометрия, которое может стать причиной появления свищей, расхождения швов на матке, а также избыточного образования послеоперационных спаек [6, 10].
Лапаротомический доступ обладает преимуществом при наличии множественных миоматозных узлов, узлов, расположенных в зонах сосудистых пучков [10]. Однако актуальными остаются вопросы выбора места и направления разреза на матке. По мере приближения ко дну матки разрезы должны приобретать дугообразную форму с выпуклостью в сторону дна матки (Давыдов С. Н., 1970). Кроме того, лапаротомный доступ позволяет произвести пальпацию стенок матки для диагностики мелких миоматозных узлов, не выявленных на догоспитальном этапе с помощью УЗИ.
Лапаротомический и лапароскопический доступы имеют ограниченное применение при шеечном и/или шеечноперешеечном расположении узлов. Такие локализации узлов — показание для выбора влагалищного доступа, достоинствами которого являются меньшие сроки реабилитации по сравнению с лапаротомией, меньший по интенсивности послеоперационный болевой синдром, косметический эффект, отсутствие необходимости использования дорогостоящего лапароскопического оборудования, минимальная вероятность развития внутрибрюшных сращений и проч. [10, 11].
Трансгистероскопический доступ в настоящее время считают оптимальным для удаления субмукозных миоматозных узлов, что важно для женщин фертильного возраста. Изолированную трансцервикальную миомэктомию целесообразно производить при величине подслизистых узлов 0го и 1го типов не более 5 см [10, 12]. Удаление субмукозных миоматозных узлов более 5 см сопровождается бóльшими техническими трудностями, приводящими к росту частоты осложнений.
Большинство авторов высказываются в пользу назначения в послеоперационном периоде после миомэктомии препаратов агонистов ГнРГ. Лечебный эффект агонистов ГнРГ реализуется посредством воздействия не только на эндокринную, но также и на аутокринную/паракринную систему. Доказано влияние агонистов ГнРГ на факторы роста, пролиферативный потенциал, апоптоз и ангиогенез, в результате чего снижается риск рецидива миомы матки [4, 6].
Основная цель проводимых операций — восстановление фертильности. Данные о наступлении беременности после миомэктомии сильно рознятся у разных авторов — 5–69% [1, 10, 11]. Учитывая вышесказанное, ряд экспертов, в том числе члены Американского общества акушеровгинекологов, рекомендуют проводить эту операцию женщинам с бесплодием или привычным невынашиванием беременности после исключения других причин снижения фертильности независимо от размеров узла. В России, согласно Приказу Минздрава России № 107н от 30.08.2012 г. «О порядке использования вспомогательных репродуктивных технологий, противопоказания и ограничения к их применению», выявленные субсерозные и интерстициальные миоматозные узлы, по расположению и размерам (более 4 см) способные оказать негативное влияние на течение беременности, необходимо удалять [7].
Выбор оптимального хирургического доступа при миомэктомии важен также для формирования впоследствии состоятельного рубца на матке. Согласно исследованиям, разрывы матки по рубцу после предшествующей миомэктомии происходят в 0,62–9,0% случаев и часто становятся причиной антенатальной и интранатальной гибели плода и жизнеугрожающего для беременной кровотечения [13].
Исследования психологического статуса пациенток с миомой матки показали в большинстве случаев существенное снижение качества жизни, социальной и физической активности, высокий уровень тревожности. В связи с этим многие авторы рекомендуют применять анкетирование с помощью как неспецифических, так и специализированных опросников для оценки психоэмоционального статуса и качества жизни пациенток. Целесообразно также оценивать динамику данных показателей после оперативного вмешательства в период реабилитации. Высокий уровень тревожности требует включения в комплекс лечебнореабилитационных мероприятий консультации смежных специалистов (невролога, психиатра) [1, 2, 6, 14].
Кроме того, для определения преимуществ и недостатков различных хирургических методик миомэктомии важна субъективная оценка интенсивности болевого синдрома в послеоперационном периоде. Общепризнанной для такой оценки является ВАШ, которая проста в применении и универсальна [15].
Цель исследования: оценка эффективности и безопасности различных хирургических техник миомэктомии, а также особенностей ведения послеоперационного периода для восстановления фертильности у пациенток с миомой матки.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование были включены 97 женщин репродуктивного возраста с миомой матки, обратившиеся в поликлинику Базовой акушерскогинекологической клиники Кубанского государственного медицинского университета Минздрава России (г. Краснодар) в 2012–2013 гг.
Анализировали жалобы пациенток, уточняли наличие репродуктивных планов. Для оценки качества жизни и динамики его показателей в ходе лечения применяли анкетирование при помощи неспецифического опросника Short Form 36 Health Status Survey (SF36) в переводе сотрудников Института клиникофармакологических исследований (СанктПетербург) [16]. Пункты данного опросника сгруппированы в восемь шкал: физическое функционирование, ролевая деятельность, телесная боль, общее здоровье, жизнеспособность, социальное функционирование, эмоциональное состояние и психическое здоровье. Каждый показатель может иметь значение от 0 до 100 баллов, при этом 100 баллов означают полное здоровье по соответствующей шкале. В совокупности шкалы опросника формируют два показателя — душевное и физическое благополучие.
Уровень ситуативной и личностной тревожности исследовали при помощи шкалы тревоги Спилберга — Ханина [14]. Количество баллов менее 30 по данной шкале означает низкий уровень тревожности, 30–45 баллов — средний уровень, а значение более 45 баллов указывает на высокий уровень тревожности.
Анкетирование проводили перед операцией и через 1 и 6 месяцев после нее.
Всем пациенткам с бесплодием были проведены гистероскопия с эхогистеросальпингоскопией и исследование показателей гормонограммы (ЛГ, ФСГ, пролактин, прогестерон, эстрадиол, антимюллеров гормон). Были также проанализированы результаты спермограмм и МАRтеста супругов, что дало возможность исключить из исследования женщин с трубноперитонеальным, эндокринным генезом бесплодия, а также мужским фактором.
УЗИ позволило произвести неинвазивную детальную оценку размеров миоматозных узлов, локализации, особенностей васкуляризации с определением в них качественных и количественных показателей кровотока. 3Dмоделирование полости матки дало возможность оценить размеры и форму ее деформации.
При подозрении на субмукозное расположение миоматозного узла, патологию эндометрия выполняли гистероскопию.
В ходе миомэктомии использовали лапароскопический, лапаротомный, влагалищный доступы или гистерорезектоскопию.
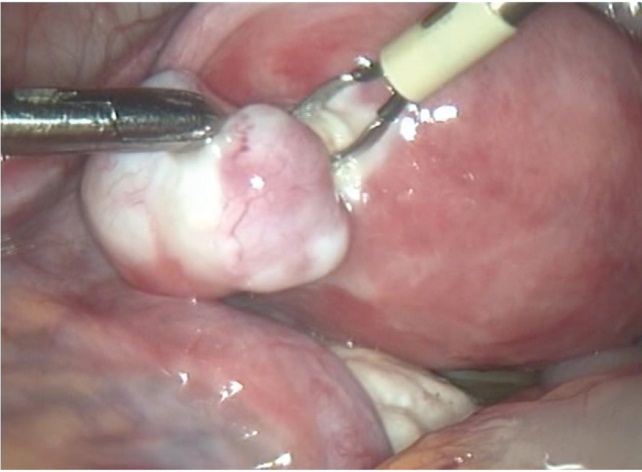
Лапароскопическую миомэктомию проводили при единичных и множественных субсерозных узлах (рис. 1), при единичных интерстициальных узлах с локализацией в дне матки. От лапароскопического доступа отказывались при низких или шеечноперешеечных расположениях узлов по задней или передней стенке матки, при интерстициальных узлах с центрипетальным ростом, деформирующих полость матки, а также при наличии выраженной спаечной болезни брюшной полости и малого таза.
Рис. 1. Лапароскопическое удаление субсерозного узла 0-го типа (фото Т. Г. Мелконьянц, 2013)
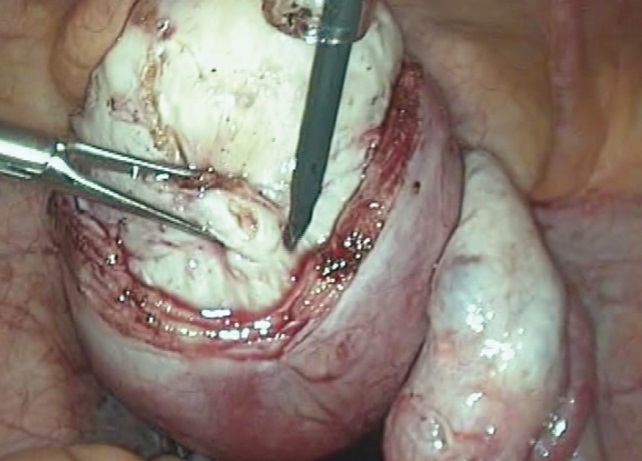
Лапароскопическая миомэктомия включала четыре технических этапа, согласно общепринятой методике (рис. 2).
Рис. 2. Выделение узла при лапароскопической миомэктомии (фото Э. В. Баширова, 2013)
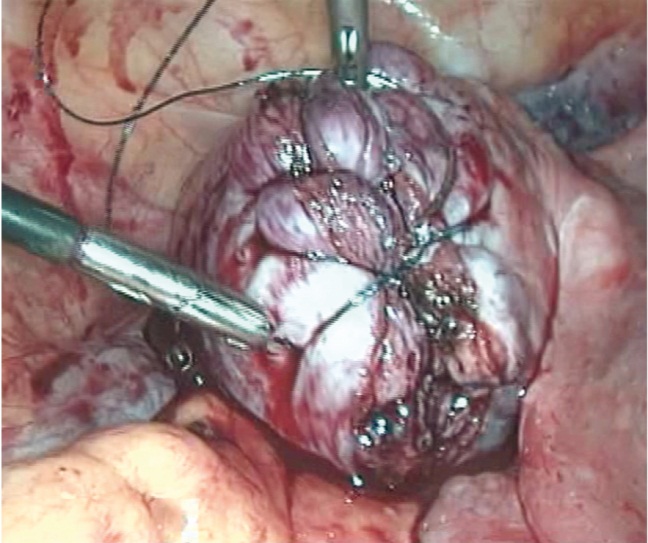
Для максимально эффективного восстановления целостности стенки матки нами использовался новый шовный материал — самофиксирующаяся нить с насечками, которые ориентированы в одном направлении, что позволяет нити свободно скользить по ходу шва, не смещаясь в обратную сторону (рис. 3).
Рис. 3. Разрез на матке, ушитый самофиксирующейся монофиламентной нитью (фото Э. В. Баширова, 2013)
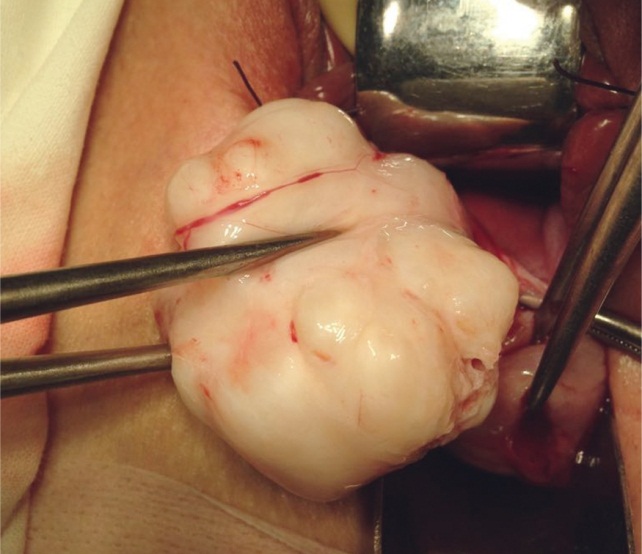
Влагалищный доступ применяли при низкорасположенных узлах как по передней, так и по задней стенке, при шеечной и шеечноперешеечной локализации узлов (рис. 4).
Рис. 4. Узел миомы, удаленный влагалищным доступом (фото О. В. Тарабановой, 2013)
После энуклеации узла рану на матке ушивали путем наложения мышечномышечных и серозномышечных швов.
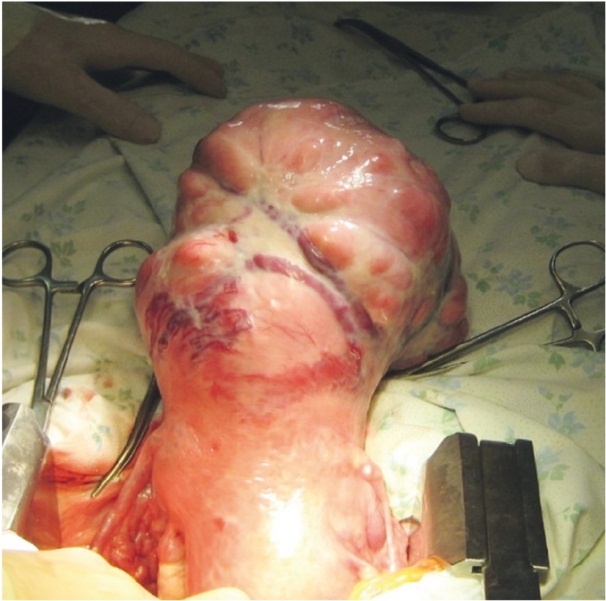
Лапаротомию выполняли у пациенток с множественными миоматозными узлами, узлами больших размеров, при интерстициальных узлах с центрипетальным ростом, интралигаментарных узлах (рис. 5).
Рис. 5. Гигантский узел миомы, обнаруженный при лапаротомии (фото О. В. Тарабановой, 2012)
При выборе направления разрезов на матке обращали внимание на их локализацию, количество, глубину расположения, архитектонику миометрия и сосудов. Учитывая преимущественно поперечное направление мышечных волокон во всех слоях миометрия и аналогичное направление относительно крупных артериальных сосудов второго порядка, охватывающих наиболее мощный сосудистый слой миометрия, при энуклеации миоматозных узлов отдавали предпочтение поперечным разрезам на матке. Ложе узлов ушивали двумя рядами рассасывающихся швов.
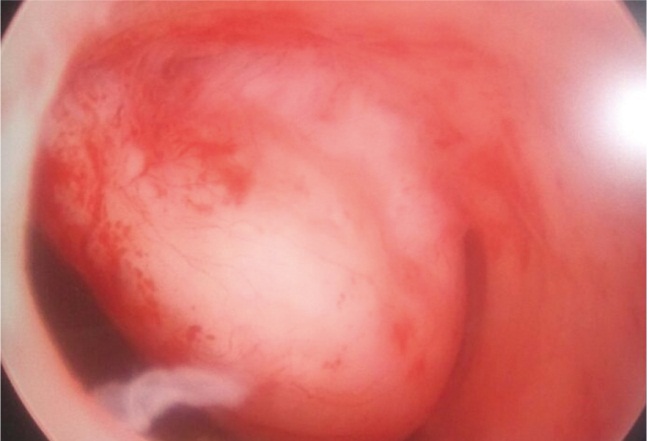
Гистерорезектоскопию выполняли у пациенток с субмукозными узлами 0го и 1го типа размерами менее 5 см (рис. 6) после предоперационной подготовки препаратами агонистов ГнРГ. Применяли петлевые электроды.
Рис. 6. Субмукозный узел 0-го типа (фото А. Н. Титовой, 2013)
Всем пациенткам после миомэктомии была назначена гормонотерапия препаратами агонистов ГнРГ в течение 6 месяцев. Овариальный резерв до и после миомэктомии оценивали путем исследования уровня антимюллерова гормона.
В послеоперационном периоде субъективную оценку боли проводили по ВАШ, результаты учитывали при определении вида и длительности назначения обезболивающих препаратов [5, 16].
Отдаленные результаты после проведенных миомэктомий нами установлены при телефонном опросе. Цель опроса — выявить женщин, у которых беременность наступила спонтанно, уточнить, сколько из них вошли в программу ЭКО и ПЭ, сколько беременностей завершилось родами живым плодом, сколько — самопроизвольным прерыванием или непрогрессирующей беременностью.
Статистическую обработку массива данных проводили с помощью пакета прикладных программ Statistica 6.0. При оценке достоверности различий между группами значимыми их считали при p < 0,05, для оценки информативности различий между сравниваемыми показателями применяли непараметрический метод (Uкритерий Манна — Уитни для малых выборок).
РЕЗУЛЬТАТЫ
Участницы исследования были распределены по возрасту следующим образом: 25 лет и моложе — 4 (4,1%), 26–35 лет — 33 (34,0%), 36–45 лет — 60 (61,9%). Средний возраст пациенток составил 36 ± 1,5 года.
Поводами для обращения 75 (77,3%) женщин стали нарушения менструального цикла или их сочетания: меноррагии встречались у 64 (85,3%), дисменорея — у 57 (76,0%), полименорея — у 38 (50,7%). У 52 (53,6%) участниц наблюдалась хроническая анемия.
Нарушение репродуктивной функции отмечено у 32 (33,0%) пациенток с миомой матки. При этом 12 (37,5%) из них страдали первичным бесплодием, у 17 (53,1%) в анамнезе были от 1 до 5 самопроизвольных выкидышей, у 3 (9,4%) — от 1 до 3 неразвивающихся беременностей.
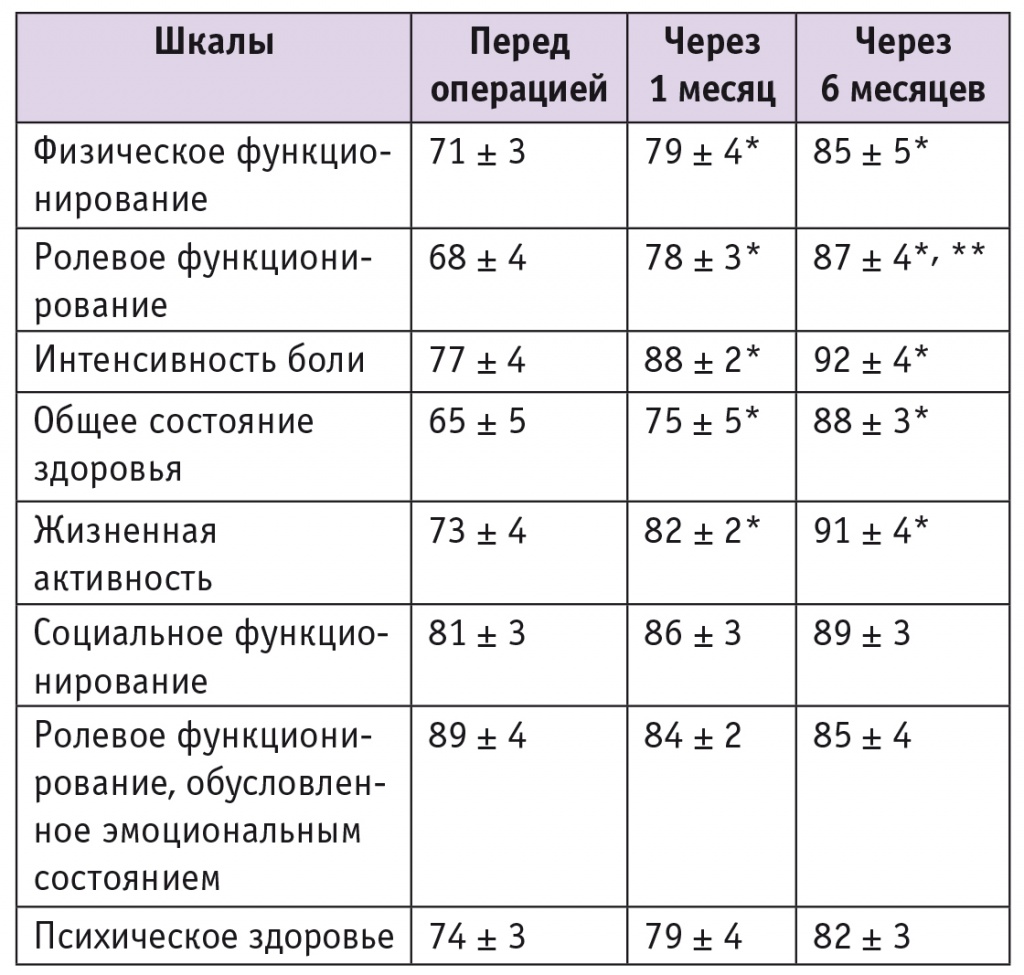
Средние значения показателей качества жизни пациенток, определенные при первичном обращении и после оперативного вмешательства, приведены в таблице 1.
Таблица 1
Качество жизни пациенток с миомой матки до и после операции, определенное по опроснику Short Form 36 Health Status Survey, баллы
* Отличие от исходного показателя статистически значимо (p < 0,05).
** Отличие от показателя через месяц после операции статистически значимо (p < 0,05).
При анкетировании с применением шкалы Спилберга — Ханина у большинства участниц был выявлен повышенный уровень тревожности. Так, только у 40 (41,2%) пациенток он определялся как низкий (21 ± 3 балла), у 51 (52,6%) — как средний (38 ± 2 балла), а у 6 (6,2%) — как высокий (56 ± 2 балла). Средний балл всех обследованных женщин — 36 ± 3. Пациентки с высоким уровнем тревожности были направлены на консультацию к психотерапевту для исключения невротических состояний.
По данным УЗИ были обнаружены увеличение толщины эндометрия — у 68,0% пациенток, уменьшение толщины эндометрия — у 14,4%, смещение Мэха как признак деформации полости матки — у 22,7%. При этом простая миома была выявлена у 52,6%, пролиферирующая — у 23,7% участниц. У 23,7% пациенток в матке одновременно имелись узлы простой и пролиферирующей миомы.
При гистероскопии найденная внутриматочная патология распределилась следующим: пролиферативный эндометрий — 54,7%, гиперпластические процессы эндометрия — 37,1%, синехии полости матки — 8,2% наблюдений. Аденомиоз был диагностирован у 33,0%, деформация полости матки миоматозными узлами — у 22,7% женщин.
В дальнейшем у участниц исследования были определены показания к хирургическому органосохраняющему лечению: подслизистая миома матки — у 8,2%, шеечная и шеечноперешеечная локализация узла — у 9,3%, большие размеры матки (12 и более недель беременности) — у 57,7%, маточные кровотечения, сопровождающиеся хронической анемией — у 12,4%, синдром тазовых и/или абдоминальных болей — у 50,5%, сдавление органов малого таза (мочеточника, мочевого пузыря, прямой кишки) — у 4,1%, привычное невынашивание беременности — у 28,9%.
Лапароскопическая миомэктомия проведена у 43,3% пациенток. Длительность операции — от 45 до 90 мин, в среднем — 65 ± 4 мин. Диаметр миоматозных узлов варьировал от 50 до 110 мм (средний размер — 63 ± 8 мм). Общая кровопотеря — от 100 до 400 мл, в среднем — 183 ± 23 мл. Интенсивность послеоперационного болевого синдрома по ВАШ — от 4 до 6 баллов, для обезболивания потребовалось назначение НПВП. Среднее число койкодней в стационаре — 5,1.
Влагалищную миомэктомию произвели 35,1% пациенток. Оперативным доступом для влагалищной миомэктомии у 76,5% из них стала передняя кольпотомия, у 14,7% — задняя кольпотомия, у остальных 8,8% — сочетание передней и задней кольпотомии. Диаметры миоматозных узлов варьировали от 30 до 120 мм (средний размер — 69 ± 8 мм). Время операции составило от 45 до 70 мин (в среднем — 56,9 ± 0,9 мин) и зависело от количества, размеров и расположения миоматозных узлов. Объем кровопотери — от 50 до 150 мл, в среднем — 89 ± 4 мл. Интенсивность послеоперационного болевого синдрома, оцененного по ВАШ, — от 3 до 6 баллов, поэтому потребовалось применение НПВП. Среднее количество койкодней в стационаре — 4,8.
Лапаротомическая миомэктомия была проведена у 13,4% больных. Диаметр миоматозных узлов колебался от 50 до 120 мм (средний размер — 85 ± 11 мм), количество — от 4 до 12. Длительность операции составила от 60 до 190 мин (среднее время — 119 ± 23 мин). Общая кровопотеря — от 200 до 500 мл, в среднем — 262 ± 4 мл. В 23,1% случаев интраоперационно при пальпации стенок матки были обнаружены мелкие миоматозные узлы, которые не были выявлены при УЗИ на предоперационном этапе.
В послеоперационном периоде интенсивность болевого синдрома 12 (92,3%) пациенток оценили от 9 до 10 баллов по ВАШ, что потребовало назначения наркотических анальгетиков в течение двух суток послеоперационного периода. У 3 (25,0%) из них поздний послеоперационный период осложнился спаечным процессом брюшной полости и болевым синдромом, несмотря на то что всем пациенткам интраоперационно и в послеоперационном периоде проводился комплекс противоспаечных мероприятий (интраоперационное использование противоспаечных барьеров, в послеоперационном периоде — курс противовоспалительной терапии в условиях стационара дневного пребывания). Среднее число койкодней в стационаре — 7,2.
Гистерорезектоскопию произвели 8,2% женщин с миоматозными узлами 0го и 1го типов. Диаметр подслизистых узлов миомы, удаленных при гистерорезектоскопии, варьировал от 5 до 40 мм (средний размер — 18 ± 8 мм). Длительность трансцервикальной миомэктомии составила от 15 до 45 мин (в среднем — 29 ± 7 мин). В послеоперационном периоде интенсивность болевого синдрома по ВАШ оценена от 1 до 3 баллов, обезболивающие препараты не назначали. Среднее количество койкодней в стационаре — 2,4. Через 3 месяца на контрольной гистероскопии у 1 (12,5%) пациентки после проведенной гистерорезектоскопии выявлены синехии полости матки, что потребовало рассечения синехий и внутриматочного введения противоспаечных барьеров. По результатам биопсии эндометрия у 37,5% участниц диагностирован эндометрий, лишенный пролиферативной активности.
Оценка овариального резерва у женщин после миомэктомии и последующей терапии препаратами агонистов ГнРГ не выявила достоверных различий в уровне антимюллерова гормона — 3,14 ± 0,25 нг/мл по сравнению с 3,44 ± 0,27 нг/мл до операции (p > 0,05).
Беременность в течение первых двух лет после отмены агонистов ГнРГ планировали 90 (92,8%) из 97 женщин. У 52 (57,8%) беременность наступила спонтанно. У 45 (50,0%) пациенток в доношенном сроке состоялись роды живым плодом, у 3 (3,3%) была зарегистрирована непрогрессирующая беременность, у 4 (4,5%) женщин беременность закончилась самопроизвольным прерыванием на сроках до 12 недель.
В программу ЭКО и ПЭ вошли 38 (42,2%) пациенток (произведено от 1 до 4 попыток). Клиническая беременность наступила у 16 (17,7%), родами живым плодом завершились 10 (11,1%) беременностей. В 3 (3,3%) наблюдениях была зарегистрирована непрогрессирующая маточная беременность и еще в 3 (3,3%) беременность самопроизвольно прервалась на малом сроке.
Анализ качества жизни наших пациенток по опроснику SF36 показал, что после операции средние показатели улучшились. Наиболее выраженные изменения были отмечены по показателям интенсивности боли, жизненной активности, ролевого функционирования, общего состояния здоровья (см. табл. 1).
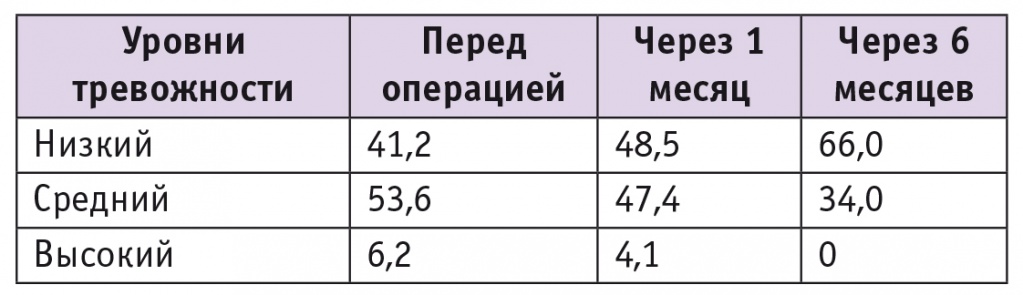
Средний балл по шкале тревожности через 1 месяц после операции составил 31 ± 2, а через 6 месяцев достоверно снизился до 20 ± 2 (p < 0,05). Из 52 пациенток, у которых перед операцией уровень тревожности был определен как средний, у 19 через 6 месяцев после операции он уменьшился до низкого. Подробная динамика уровня тревожности отражена в таблице 2.
Таблица 2
Уровни тревожности пациенток до и после операции, определенные по шкале Спилберга ― Ханина, %
Таких осложнений, как разрыв матки по рубцу во время беременности, у наших больных не было.
ОБСУЖДЕНИЕ
Большинство обследованных пациенток с миомой матки принадлежали к возрастной группе 35–45 лет. Однако встречаемость миомы в молодом возрасте (менее 25 лет), возможно, гораздо выше. Представленные невысокие цифры заболеваемости миомой матки у молодых женщин можно объяснить низкой обращаемостью к врачу в этом возрасте.
Результаты опубликованного в 2015 г. масштабного популяционного исследования среди жительниц США показали прямую корреляционную взаимосвязь между наличием клинически выраженных доброкачественных опухолей матки и качеством жизни по результатам анкетирования [17]. Согласно результатам нашего исследования, у большинства пациенток с миомой матки имеет место снижение качества жизни. Мы считаем, что это связано в первую очередь с психологическим напряжением, обусловленным нереализованным материнством. Прочие жалобы связаны с дисменореей, нерегулярностью менструального цикла, невозможностью выполнять повседневные действия изза физического недомогания или эмоционального напряжения, а также страхом перед болью, обильным менструальным кровотечением.
Множество фундаментальных трудов посвящены органосохраняющим хирургическим вмешательствам на матке (Радзинский В. Е., 2014; Стрижаков А. Н., Давыдов А. И., 2011; Вихляева Е. М., 2004). Так, известно, что лапаротомическую миомэктомию возможно провести независимо от клинической ситуации, доступ позволяет анатомично сопоставить раневые поверхности, что служит залогом хорошей состоятельности рубца и уменьшает риск разрыва матки при последующей беременности. В нашем исследовании при лапаротомическом доступе в 23,1% случаев были обнаружены узлы, ранее не визуализируемые при УЗИ. Однако неизбежная травматичность разреза на передней брюшной стенке обусловливает выраженный болевой синдром в послеоперационном периоде, что требует в назначения наркотических анальгетиков. Кроме того, нередки осложнения позднего послеоперационного периода — спаечная болезнь органов брюшной полости, малого таза и, как следствие, риск трубноперитонеального бесплодия. Данные факты ограничивают применение лапаротомического доступа и расширяют показания для применения малоинвазивных методов.
Преимущества метода лапароскопической миомэктомии — малоинвазивность, косметический эффект, что особенно важно для молодых пациенток, клинически незначимый болевой синдром, не требующий использования наркотических анальгетиков. По мнению ряда авторов, лапароскопическая миомэктомия не позволяет создать условия для полноценного сопоставления краев разреза, что важно для формирования состоятельного рубца [8, 10]. Данный факт неоднократно оспаривался в литературе, особенно после внедрения в практику новых шовных материалов и совершенствования эндоскопического оборудования [1, 13]. Анализируя мнения современных авторов, а также собственный опыт, мы пришли к выводу, что лапароскопический доступ при всех своих достоинствах не оправдан при множественных узлах, при интерстициальных узлах больших размеров с центрипетальным ростом. Кроме того, лапароскопический доступ требует дорогостоящего оборудования. На наш взгляд, существенным ограничивающим фактором для лапароскопической миомэктомии является наличие у хирурга навыков эндоскопического наложения швов.
Влагалищная миомэктомия имеет ряд очевидных достоинств, подтвержденных исследованиями R. Rolli и соавт. (2012), В. Е. Радзинского и соавт. (2010), — малоинвазивность, возможность использования метода у пациенток со спаечным процессом и проведения миомэктомии (при шеечных и низко расположенных шеечноперешеечных узлах) экстраперитонеально. Нет этапа морцелляции, что снижает риск распространения опухоли, если она окажется злокачественной. Наш опыт показывает, что после энуклеации узла есть условия для послойного ушивания с наложением мышечномышечных и серозномышечных швов. Кроме того, кровопотеря при влагалищном доступе ниже, чем при лапаротомическом и лапароскопическом, длительность операции меньше.
Преимуществами гистерорезектоскопии стали менее выраженный болевой синдром в раннем послеоперационном периоде и более короткие сроки госпитализации, что согласуется с результатами других исследований [9, 12].
Напрашивается вывод, что выбор хирургической тактики при миомэктомии должен определятся размером и количеством узлов, ожидаемым объемом кровопотери, а также уровнем владения хирургом тем или иным хирургическим доступом. Прогноз восстановления фертильности при миоме матки тем благоприятнее, чем раньше выполнено хирургическое вмешательство.
ЗАКЛЮЧЕНИЕ
Лечебная стратегия, которую выбирает клиницист индивидуально для каждой пациентки, зависит от ее возраста, локализации, количества и морфологического типа миоматозных узлов.
При выборе хирургического доступа необходимо оценить техническую выполнимость, безопасность и клиническую эффективность каждого из методов.
В послеоперационном периоде независимо от доступа целесообразно назначение агонистов ГнРГ с целью предупреждения рецидива миомы. На сегодняшний день нет единых рекомендаций по применению конкретного метода лечения для профилактики рецидива миомы матки.
Ни один из существующих вариантов терапии не является этиопатогенетическим. Пациентки с миомой матки должны находиться под диспансерным наблюдением согласно существующим нормативным документам.
Критериями эффективности лечения остаются купирование клинических симптомов заболевания, отсутствие рецидивов, восстановление детородной функции у пациенток репродуктивного возраста. Кроме того, качество жизни женщин после миомэктомии достоверно повышается. Однако терапия пациенток с миомой матки отличается сложностью достижения стойкого лечебного эффекта, что требует поиска новых способов лечения, в том числе оптимального сочетания малоинвазивной хирургии и медикаментозной терапии.








