Миома матки является одним из самых распространенных гормонозависимых гинекологических заболеваний, которому подвержены от 10% до 30% женщин репродуктивного возраста, в основном старше 30 лет [1, 2, 4, 5]. Если говорить о роли миомы матки в патогенезе женского бесплодия, то она более чем значительна — частота сочетания миомы матки и бесплодия составляет 30–51% [1, 6, 7]. По данным различных авторов, миома матки как единственная потенциальная причина бесплодия регистрируется у 1–20% женщин [4, 7].
Миома матки и аденомиоз характеризуются многофакторной этиологией и полигенным характером наследования. Несмотря на то что первопричиной возникновения миомы принято считать хромосомные и генные мутации, исследователи сходятся во мнении, что важную роль в развитии как миомы матки, так и генитального эндометриоза, играют гормональные факторы, процессы ангиогенеза и нарушения цитогенетики. Так, в 44% наблюдений причиной бесплодия служит сочетание миомы и наружного генитального эндометриоза, а у 36% пациенток — миомы и трубноперитонеального фактора. Каждой десятой женщине с миомой матки рекомендуют лечение с помощью вспомогательных методов репродукции. Различные гормональные нарушения выявляют у значительной доли больных миомой, что требует патогенетически обоснованной терапии [5, 8–10].
По данным литературы, в структуре гинекологических заболеваний только в 15–21% наблюдений миома матки встречается изолированно. Обращает на себя внимание высокая частота сочетания миомы матки с воспалительными заболеваниями придатков матки (65–80%), гиперпластическими процессами эндометрия, в структуре которых доля полипов — 22–35%, гиперплазии эндометрия — 38–45% [1, 8, 11]. Данный факт требует включения в комплекс послеоперационной реабилитации, помимо гормональной терапии, мероприятий, направленных на ликвидацию как самих патологических процессов, так и факторов риска их рецидива, профилактику спаечного процесса и оптимизацию структурнофункциональной состоятельности эндометрия.
Современные подходы к терапии миомы матки имеют целью сохранение органа и, как следствие, желаемой фертильности. Все более широкое распространение малоинвазивных органосохраняющих операций на матке (лапароскопии, влагалищной миомэктомии, гистерорезектоскопии) позволяет уменьшить операционную травму, снизить риск послеоперационных осложнений и выносить желанную беременность. Однако спорными остаются вопросы реабилитационной противорецидивной тактики, особенно гормональной терапии, в послеоперационном периоде [1, 7, 12].
Принято считать, что гиперэстрогения является одним из ключевых звеньев патогенеза миомы матки, поэтому назначение гормонотерапии, направленной на ее коррекцию в послеоперационном периоде, патогенетически обосновано. Среди наиболее эффективных и часто применяемых препаратов многие авторы выделяют агонисты ГнРГ (лейпрорелин, трипторелин, бусерелин и др.) [1, 5, 13]. Существует множество исследований, подтверждающих эффективность применения диеногеста в дозе 2 мг/сут в непрерывном режиме [1, 10].
Использование в послеоперационном периоде физиотерапевтических процедур целесообразно в связи с благоприятным влиянием на процессы репарации и обмена веществ в оперированных тканях. Воздействия, применяемые в физиотерапии, имеют целью мобилизацию собственных адаптационных процессов, а также улучшают трофику тканей за счет интенсификации обменных процессов и усиления крово и лимфообращения [8, 11, 12].
Цель исследования: оценить эффективность комплексной реабилитации и улучшить исходы лечения после миомэктомии у пациенток, страдающих бесплодием.
Материалы и методы
Проведено ретроспективное исследование, охватившее 80 женщин репродуктивного возраста, поступивших в отделение оперативной гинекологии Базовой акушерскогинекологической клиники Кубанского государственного медицинского университета в 2014 г. для выполнения лечебнодиагностической лапароскопии. У всех пациенток было получено информированное добровольное согласие на участие в проводимом исследовании.
Критерии включения: женское бесплодие; наличие миомы матки субсерозной и субсерозноинтерстициальной локализации, впервые выявленной или рецидивирующей после органосохраняющих вмешательств; фертильный супруг.
Критерии исключения: хронические экстрагенитальные заболевания в стадии декомпенсации, острые и хронические инфекционновоспалительные заболевания в стадии обострения, злокачественные новообразования.
Возраст обследованных пациенток — от 27 до 39 лет, в среднем — 34,9 ± 4,8 года. Средний возраст участниц с первичным бесплодием был на 4,2 года меньше, чем с вторичным (32,4 ± 3,3 года против 36,6 ± 3,7 года).
В зависимости от условий проведения комплексной послеоперационной реабилитации пациентки были стратифицированы на две группы: I группа — 40 женщин, проходивших курсы послеоперационной реабилитации в условиях стационара дневного пребывания, включавшие медикаментозное и физиотерапевтическое лечение, с последующим направлением на санаторнокурортное лечение; II группа — 40 пациенток, прошедших послеоперационную реабилитацию амбулаторно в виде одного курса противовоспалительной терапии.
Соотношение первичного и вторичного бесплодия в I и II группах существенно не отличалось и составило 70,0% к 30,0% и 65,0% к 35,0% соответственно. Длительность бесплодия, по данным анамнеза, варьировала от 2 до 20 лет.
Предоперационное комплексное клиниколабораторное обследование пациенток включало в себя УЗИ с цветовым доплеровским картированием и доплерометрией, осуществляемое при помощи сканеров экспертного класса, а также жидкостную гистероскопию с раздельным диагностическим выскабливанием матки. По результатам гистологического исследования соскобов судили о состоянии эндометрия и косвенно — о гормональном фоне.
Всем пациенткам была выполнена миомэктомия лапароскопическим доступом с использованием эндоскопической стойки с набором инструментов фирмы Karl Storz (Германия). Интраоперационно перед миомэктомией проводили коррекцию выявленной сопутствующей гинекологической патологии, проверку проходимости маточных труб, мобилизацию и восстановление нормальной анатомии органов малого таза. Этапы миомэктомии были традиционны: вылущивание миоматозного узла, обеспечение гемостаза, ушивание послеоперационного дефекта [4, 14].
Комплексная реабилитация предусматривала курс лечения, включавший гормонотерапию, противовоспалительное, иммуномодулирующее, физиотерапевтическое, санаторнокурортное лечение [3, 15].
Гормонотерапию назначали по показаниям с учетом сопутствующих дисгормональных заболеваний и заинтересованности в последующей реализации репродуктивной функции. Применяли препараты агонистов ГнРГ или диеногест.
На амбулаторнополиклиническом этапе проводили эндоэкологическую реабилитацию, включавшую следующие мероприятия:
- назначение лекарственных препаратов: Вобэнзима (5 т 3 р/д за 40 мин до еды), гимекромона (2 т З р/д за 10 мин до еды), Аскорутина (2 т 3 р/д), НаринеФорте (1 ст. л. 3 р/д), Эссенциале (2 капс. 3 р/д или 1 капс. 5 р/д), полиметилсилоксана полигидрата в форме пасты (1 ст. л. 2 р/д через 1,5 ч после еды), Галавита или Тимогена 1,0 в/м через день № 10, чередуя с алоэ 2,0 в/м № 10), Генферона (1 млн ЕД в прямую кишку № 20);
- озонотерапию, состоящую из внутривенного капельного введения озонированного физиологического раствора в объеме 200 мл с концентрацией озона 1,2–1,4 мг/л в количестве от 3 до 6 процедур;
- крайне высокочастотную терапию (КВЧтерапию) на область проекции матки и ее придатков, 30 минут на сеанс, на курс 10 процедур, в сочетании с интерференционными токами и магнитотерапией, противовоспалительный эффект которых дополняет медикаментозную терапию; воздействие локализовали в надлобковой, паховой и поясничнокрестцовой областях.
- процедуры климатотерапии в щадящетренирующем режиме (аэро и гелиотерапия), морские купания (на базе здравниц Черноморского побережья Кавказа);
- дифференцированную в зависимости от гормонального фона и особенностей сопутствующей патологии бальнеотерапию (сероводородную или йодобромную) в виде общих ванн и влагалищных орошений;
- индивидуально подобранные в зависимости от особенностей экстрагенитального статуса режимы приема лечебных минеральных вод;
- аппаратную физиотерапию, среди методов которой предпочтение отдавали современным (КВЧ и лазеротерапии, сочетанному физиотерапевтическому воздействию).
- на курорте «Горячий ключ»: йодобромные минеральные воды (скважина № 103/2);
- курорт Ейск: высокоминерализованные хлориднонатриевые йодобромные воды;
- курорт Хадыженск и санатории Апшеронского района: минеральные воды средней и малой минерализации, гидрокарбонатнохлоридные натриевые, слабощелочные, йодные, борные.
Результаты
Частота сочетания миомы матки с эндометриозом тазовой брюшины в исследуемых группах достоверно не отличалась и составила 67,5% и 70,0% соответственно (табл. 1). У этих пациенток чаще диагностировали поражение эндометриозом тазовой брюшины и яичников, что сопровождалось более выраженным спаечным процессом в брюшной полости, характерным для такой локализации процесса. В 41,2% наблюдений наружные формы эндометриоза сочетались с клиническими и эндоскопическими признаками эндометриоза матки.
Таблица 1
Частота встречаемости у пациенток с миомой матки других гинекологических заболеваний
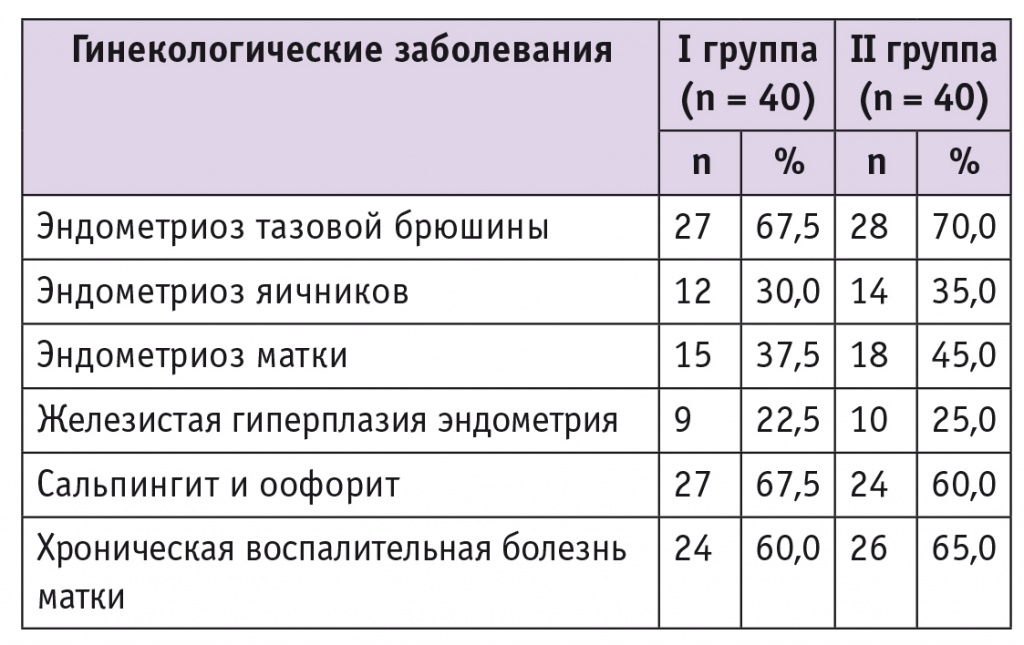
У большинства пациенток обеих групп в анамнезе отмечали хронические ВЗОМТ различной локализации. Достоверные различия по этому показателю между группами не выявлены.
Проведенное в рамках предоперационной подготовки УЗИ с цветным доплеровским картированием позволило своевременно диагностировать миоматозные узлы с хорошо выраженной васкуляризацией, локализованные в дне матки, а также обнаружить признаки сопутствующего аденомиоза. Этим пациенткам (42,5% в I группе и 35,0% во II группе) интраоперационно непосредственно перед миомэктомией производили окклюзию восходящих ветвей маточных артерий, что позволило сократить приток крови к телу матки, уменьшить объем кровопотери и облегчить энуклеацию узлов.
Количество диагностированных и удаленных миоматозных узлов варьировало от 1 до 8 (3,1 ± 1,2), диаметр наибольшего узла в наблюдении составил 9,0 см, наименьшего — 0,6 см. Средний размер опухоли — 5,6 ± 0,9 см. Множественная миома обнаружена у 55,0% женщин I группы и у 45,0% пациенток II группы (p > 0,05).
При гистологическом исследовании миоматозных узлов, удаленных у пациенток с бесплодием, обнаружены опухоли преимущественно с типичным вариантом строения с хорошо выраженной или гиалинизированной стромой. Клеточный тип лейомиомы диагностирован в 7,5% наблюдений в I группе и в 5,0% во II группе (p > 0,05).
Гормонотерапию агонистами ГнРГ проводили у 70,0% пациенток I группы и 62,5% II группы. Диеногест в дозе 2 мг/сут в непрерывном режиме в течение 8–12 месяцев получали 22,5% женщин I группы и 27,5% II группы. Остальные пациентки отказались от гормонотерапии.
Срок наблюдения самостоятельного восстановления фертильности после хирургического лечения составил 2 года. К планированию беременности участниц допускали спустя 6–12 месяцев после миомэктомии, критериями допуска служило отсутствие эхографических маркеров частичной или полной неполноценности рубца [11, 16].
Данные о репродуктивных исходах лечения пациенток представлены в таблице 2. В течение первого года после окончания реабилитации беременность спонтанно наступила у 42,5% участниц I группы и 27,5% II группы (p < 0,05). Срочные роды живым плодом произошли у 37,5% пациенток I группы и у 22,5% пациенток II группы (p < 0,05). В I группе в одном (2,5%) наблюдении беременность закончилась самопроизвольным прерыванием в сроке 7 недель; еще у одной (2,5%) пациентки диагностировали трубную беременность, по поводу которой была произведена лапароскопическая тубэктомия, выявлен рецидив наружного генитального эндометриоза. Две (5,0%) женщины из II группы также были экстренно прооперированы по поводу трубной беременности, во время лапароскопии обнаружили спаечный процесс II стадии с тенденцией к формированию гидросальпинксов.
Таблица 2
Исходы лечения пациенток с миомой матки в сочетании с бесплодием
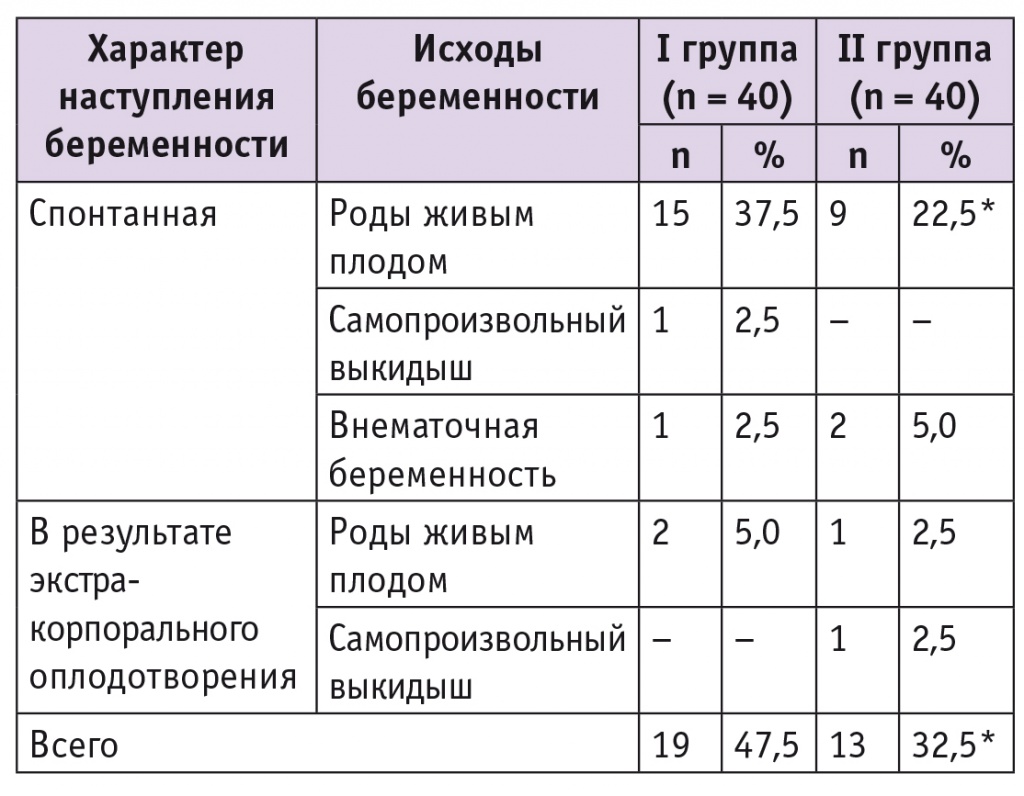
* P < 0,05.
В программу ЭКО сразу после окончания реабилитации были направлены 12,5% пациенток I группы и 10% II группы (p > 0,05). Клиническая беременность наступила у 2 (5,0%) участниц I группы: одна беременность завершилась родами в доношенном сроке, вторая — преждевременными родами двойней в сроке 34 недели. Во II группе беременность наступила также у 2 женщин. В одном случае она завершилась родами доношенным живым плодом, в другом — самопроизвольным прерыванием беременности в малом сроке.
Таким образом, среди пациенток I группы, прошедших курс реабилитации в условиях стационара дневного пребывания в сочетании с санаторнокурортным лечением, частота наступления беременности оказалась в 1,5 раза выше, чем во II группе, где реабилитационные мероприятия были ограничены амбулаторным этапом (p < 0,05).
Разрывов матки по рубцу во время беременности у обследованных пациенток не было.
Обсуждение
Период реабилитации после миомэктомии не менее важен, чем сама операция, поскольку правильное течение процессов репарации обеспечивает надежность формирующегося рубца. Напротив, негативное воздействие медикосоциальных факторов (несоблюдение рекомендованного режима, отказ от амбулаторного восстановительного лечения) отрицательно сказывается на процессах заживления и приводит к несостоятельности рубца на матке, что повышает риск репродуктивных потерь. Так, у 2 пациенток II группы диагностирован спаечный процесс II степени с тенденцией к формированию гидросальпинксов; их опрос выявил полное или частичное несоблюдение рекомендаций по проведению комплексной восстановительной терапии в амбулаторных условиях.
Физиотерапевтические процедуры, применяемые в послеоперационном периоде, должны быть интенсивными, а при необходимости курсы лечения следует повторять. При этом в комплексной восстановительной терапии важно использовать как преформированные, так и естественные физические факторы.
Частота наступления беременности у пациенток после миомэктомии и комплексной реабилитации оказалась достаточно высокой и соответствовала данным современной литературы, причем наибольшая частота благоприятных исходов приходилась на контингент женщин до 35 лет, что совпадает с результатами отечественных исследований [1]. Этот факт говорит о важности своевременного выявления и раннего лечения женщин с миомой матки, имеющих репродуктивные планы.
В некоторых случаях было решено отказаться от ожидания спонтанного наступления беременности в связи с такими причинами, как длительность бесплодия более 10 лет, снижение овариального резерва и др. Так, 12,5% пациенток из I группы и 10,0% из II группы по окончании восстановительного периода были направлены в отделение ВРТ для осуществления ЭКО.
Несмотря на высокую эффективность реконструктивнопластических операций при доброкачественных опухолях матки, они не устраняют причину заболевания, и, соответственно, не гарантируют отсутствие рецидивов в будущем. Кроме того, оценивая пути повышения эффективности хирургического лечения бесплодия, ассоциированного с миомой матки, можно заключить, что прогресс будет определяться не столько совершенствованием собственно хирургической техники удаления узлов и последующего восстановления дефекта миометрия, сколько успехами предоперационной подготовки и индивидуализированной реабилитационной терапии с учетом сопутствующих заболеваний, направленной на профилактику рецидива и восстановление детородной функции.
Заключение
Важными принципами послеоперационной реабилитации являются своевременность, комплексность, патогенетическая обоснованность и персонифицированный подход к подбору реабилитационных мероприятий.
Проведение комплексной реабилитации у пациенток после миомэктомии позволяет добиться лучших результатов в отношении восстановления фертильности. Низкая комплаентность к терапии в послеоперационном периоде — фактор, ухудшающий прогноз и исходы проведенного лечения.








