 |
Тапильская Наталья Игоревна Профессор кафедры акушерства и гинекологии, профессор кафедры онкологии ФГБОУ ВО «Санкт-Петербургский государственный педиатрический медицинский университет» Минздрава России, д. м. н., профессор |
 |
Хамошина Марина Борисовна Профессор кафедры акушерства и гинекологии с курсом перинатологии медицинского факультета Медицинского института ФГАОУ ВО «Российский университет дружбы народов», доктор медицинских наук, профессор |
 |
Шестакова Ирина Геннадьевна К. м. н., доцент кафедры акушерства, гинекологии и репродуктивной медицины факультета повышения квалификации медицинских работников Медицинского института ФГАОУ ВО «Российский университет дружбы народов» |
На сегодняшний день менопаузальная гормональная терапия (МГТ) является частью общей стратегии сохранения здоровья женщины в зрелом возрасте. В рекомендациях Международного общества по менопаузе обозначены показания для назначения МГТ [6]:
-
вазомоторные симптомы с изменением настроения, нарушением сна;
-
симптомы урогенитальной атрофии, сексуальная дисфункция;
-
профилактика и лечение остеопороза;
-
низкое качество жизни, связанное с климактерием (артралгии, мышечные боли, ухудшение памяти);
-
преждевременная и ранняя менопауза;
-
овариоэктомия.
Особого внимания в контексте персонифицированного подхода к выбору препарата на амбулаторном приеме заслуживают женщины, предъявляющие жалобы на нарушение сексуальной функции, пациентки с диагнозами ранней менопаузы и преждевременной недостаточности яичников. Безусловно, у таких пациенток сексуальная дисфункция ухудшает качество жизни [2].
Минимальная эффективная доза эстрогенного компонента препаратов МГТ как при преждевременной недостаточности функции яичников, так и в период менопаузального перехода, составляет 2 мг эстрадиола [13].
Применение эстроген-прогестаген-содержащих препаратов, назначаемых в окно терапевтических возможностей, позволяет провести профилактику сердечно-сосудистых заболеваний, остеопороза, болезни Альцгеймера [2]. В рекомендациях Международного общества по менопаузе отдельно обсуждаются сексуальные дисфункции, в частности гипоактивное расстройство сексуального влечения, как один из распространенных симптомов менопаузального перехода [3].
Основные принципы Международного общества по менопаузе, касающиеся МГТ:
-
МГТ остается наиболее эффективным методом лечения вазомоторных симптомов и урогенитальной атрофии;
-
рассмотрение возможности МГТ должно быть частью общей стратегии поддержания здоровья женщин в пери- и постменопаузе;
-
другие жалобы, связанные с менопаузой, например боли в суставах и мышцах, перепады настроения, нарушения сна и сексуальная дисфункция, могут уменьшиться на фоне МГТ;
-
назначение индивидуально подобранной МГТ (в том числе препаратов андрогенов, если это необходимо) может улучшить как сексуальность, так и общее качество жизни, однако препараты, содержащие андрогены, не зарегистрированы для лечения симптомов менопаузального перехода [3];
-
МГТ должна быть индивидуализирована и адаптирована в зависимости от симптомов и необходимости профилактики, анамнеза, результатов исследований, предпочтений женщины;
-
риски и преимущества МГТ для женщин в периоде менопаузального перехода отличаются от таковых для более пожилых пациенток.
В ряду гестагенов, зарегистрированных на территории Российской Федерации, левоноргестрел имеет высокую гестагенную активность и 100%-ную биодоступность. Более того, он демонстрирует положительное влияние на метаболический профиль [13]. По данным трех рандоминизированных плацебо-контролируемых исследований, добавление левоноргестрела к монотерапии эстрогенами у женщин в постменопаузе достоверно приводит к улучшению липидного профиля и не оказывает значительного влияния на параметры коагулограммы и активность фибринолиза [23].
Недавние революционные исследования, опубликованные в авторитетных международных изданиях, продемонстрировали, что нейрогенез в гиппокампе происходит всю жизнь [1]. Другими словами, в гипокампе на протяжении всей жизни вновь синтезируются нейроны, ответственные за память, обучение, концентрацию внимания [19]. Однако механизмы, стимулирующие это чрезвычайно важное для организма явление, до конца не ясны [4]. Синтезирующиеся в организме эстрогены и прогестерон обладают выраженным антиамнестическим, анксиолитическим, противосудорожным, антидепрессивным действием [12] (рис.).
Рис. Нейропротективные эффекты эстрогенов и гестагенов

К сожалению, одной из неблагоприятных особенностей менопаузального перехода является снижение интенсивности стероидогенеза [11].
Эстрогены, полученные извне в условиях формирующегося эстрогенного дефицита, обладают цитопротективным эффектом в отношении холинергических нейронов, которые, в свою очередь, отвечают за память, эмоции и познавательную деятельность [3, 7]. МГТ может оказывать позитивное влияние на когнитивную функцию женщин с хирургической менопаузой, если ее начали сразу после овариоэктомии, но в случае начала и применения ее у женщин старше среднего возраста, она не снижает риск деменции. МГТ же, начатая в среднем возрасте, снижает риск болезни Альцгеймера и деменции. Она может облегчить симптоматику или повысить вероятность ремиссии при депрессии в период менопаузального перехода.
Показано, что левоноргестрел (на культуре нейронов цереброкортикальной культуры 17-дневных эмбрионов крыс Спрег-Доули) усиливает экспрессию эстрогеновых рецепторов и нейротропного фактора, тем самым снижая интенсивность апоптоза и увеличивая выживаемость нейронов (табл. 1) [12].
Таблица 1
Влияние прогестагенов на экспрессию рецепторов стероидных гормонов и нейропротективное действие на культуре клеток [12]
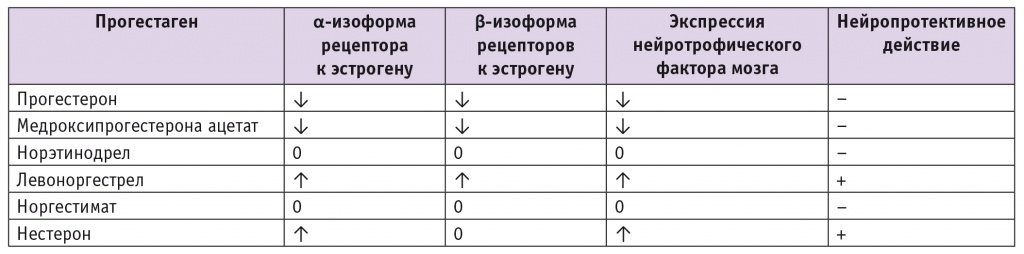
В ряде исследований сообщается, что дефицит эстрогенов в перименопаузе приводит к ухудшению когнитивных функций ЦНС, что является преморбидным фоном для формирования тревожно-депрессивных расстройств [18]. По данным метаанализа, терапия эстрогенами в перименопаузе обладает дополнительным антидепрессантным эффектом [20].
Тревожно-депрессивное расстройство ассоциировано со снижением либидо, классифицируемым как гипоактивное расстройство сексуальной функции, оно становится одним из ведущих симптомов у пациенток с дефицитом половых гормонов и проявляется в период менопаузального перехода.
Несмотря на известную взаимосвязь между дефицитом андрогенов и снижением либидо у женщин, по данным анкетирования на 16-м Конгрессе Европейского общества сексуальной медицины (Стамбул, 2014) только 43% и 53% врачей назначают андрогены для повышения либидо женщинам в пери- и постменопаузе соответственно [14]. Основные проявления синдрома дефицита андрогенов у женщин — сексуальная дисфункция, уменьшение физической активности, астения, усиление стрессовой реакции, ухудшение комму-никативности [5, 8].
Левоноргестрел, обладая остаточной андрогенной активностью, является прогестагеном выбора при климактерическом синдроме с выраженной астенодепрессивной симптоматикой [13]. Характерные жалобы: плохое настроение, усталость, вялость, подавленность, снижение работоспособности и когнитивных функций [5]. При диалоге с врачом обнаруживаются [8, 14]:
-
рост уровня депрессии по шкале Бека;
-
расстройство сексуальной функции (снижение либидо);
-
вялый тургор кожи, уменьшение мышечного тонуса, низкая толерантность к физическим нагрузкам;
-
высокая частота остеопении [8].
Крайне важным остается вопрос безопасности назначаемой МГТ. Необходимо понимать, что не все гестагены одинаково влияниют на систему гемостаза [22]. На 14-м Конгрессе 2-й Глобальной конференции Европейского общества по контрацепции и репродуктивному здоровью (Базель, Швейцария, 4–7 мая 2016 г.) были представлены данные о риске возникновения венозных тромбоэмболий, ассоциированных с различными типами гестагенов, входящих в состав КОК с одинаковым эстрогенным компонентом. При стратификации рисков выяснилось, что левоноргестрел как представитель высокоандрогенных прогестинов занимает первое место, демонстрируя наименьший риск тромбоэмболических осложнений (тромбозов как артериального, так и венозного происхождения) [24].
Препарат Климонорм®, содержащий левоноргестрел и эстрадиола валерат [13], рекомендуется в период менопаузального перехода, а также при:
-
преждевременной менопаузе;
-
состояниях, связанных с искусственно вызванной менопаузой;
-
синдроме после искусственной менопаузы (N95.3 по МКБ-10);
-
гипогонадизме.
Кроме того, существует особый контингент пациенток, которым показаны моноэстрогены как средства МГТ. Так, например, ежегодно в США выполняется более 617 тыс. гистерэктомий, из которых около 428 тыс. не связаны с онкологическими заболеваниями репродуктивной системы. Из них в 43% случаев выполняется двусторонняя сальпинговариоэктомия, и в результате у таких женщин развивается синдром после искусственной менопаузы [9, 16].
Международное общество по менопаузе декларирует тот факт, что использование моноэстрогенов в качестве МГТ связано со снижением риска инвазивного рака молочной железы (РМЖ). Эксперты считают, что необходимо принципиально различать риск РМЖ при монотерапии эстрогенами и при использовании комбинаций эстрогенов и прогестина. В 2015 г. были определены новые факторы риска РМЖ: раннее менархе, поздняя первая беременность, закончившаяся родами, количество родственников первой линии родства, заболевших РМЖ, РМЖ в анамнезе, атипическая гиперплазия ткани молочной железы по данным биопсии, расовая принадлежность [10].
Итак, почему терапия моноэстрогенами не повышает риск РМЖ, а наоборот, способствует его уменьшению до уровня ниже популяционного? Возможное объяснение подсказывают современные представления о стволовых раковых клетках и пренишах, т. е. РМЖ является самостоятельным заболеванием: это означает, что не существует предраковых болезней молочной железы и все ее доброкачественные заболевания (фибромы, кисты и др.) не малигнизируются [17]. С точки зрения стохастической теории возникновения рака, появление РМЖ объясняется в основном мутациями de novo, а клиническая и генетическая гетерогенность обусловлена дополнительными мутациями в генах, ассоциированных с опухолевым ростом и опухолевой прогрессией [10]. С точки зрения клональной теории возникновения рака, стволовые клетки рака молочной железы — в основном негативные по экспрессии рецепторов к эстрогенам и прогестагенам, однако существует популяция стероид-чувствительных стволовых клеток (СЧСК), богатых этими рецепторами и участвующих в формировании опухолевой микросреды (прениши). В репродуктивный период СЧСК сенсибилизированы к высоким уровням эстрогенов и прогестерона, но в постменопаузе на фоне резкого дефицита эстрогенов начинают активировать фермент ароматазу в пределах «ростовых» протоковых зон, поддерживая высокие локальные уровни эстрогенов. При этом заместительная терапия моноэстрогенами по принципу обратной связи подавляет активность ароматазы [17].
Более того, согласно новой клинической классификации, очевиден факт гетерогенности злокачественного новообразования молочной железы: не каждая клиническая форма РМЖ гормонозависима, природа опухоли ассоциирована с совершенно иными механизмами [10].
В эпидемиологическом сравнительном исследовании по типу «случай — контроль» среди женщин-носительниц мутаций в генах, ассоциированных с наследственным РМЖ (BRCA1 или BRCA2), имеющих сохраненную матку (n = 1110), МГТ только эстрогенами ассоциировалась со снижением риска рака эндометрия в несколько раз, в то же время МГТ только гестагенами — с повышением данного риска в 4–6 раз (табл. 2) [21].
Таблица 2
Факторы риска развития рака эндометрия [21]
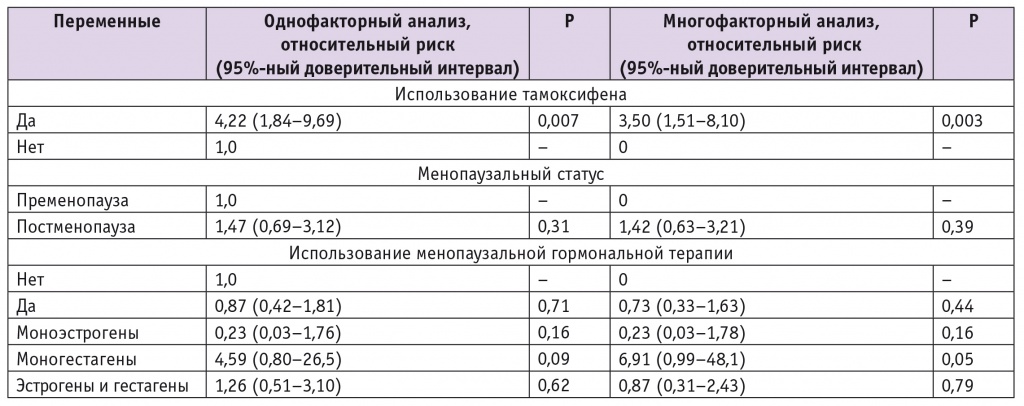
По результатам анализа канцерорегистра Великобритании с 1988 по 2011 г. установлено, что назначение МГТ связано со значительно меньшим риском возникновения рака печени (ОР = 0,58; 95%-ный ДИ: 0,37–0,90), особенно среди получающих МГТ моноэстрогенами (ОР = 0,44; 95%-ный ДИ: = 0,22–0,88) [15].
Безусловно, у эстрогенов существуют и иные терапевтические ниши. Так, препарат Прогинова, содержащий 2 мг эстрадиола валерата, показан при лечении врожденного и приобретенного гипогонадизма.
Назначение малых доз эстрогенов в послеоперационном периоде при лечении синдрома Ашермана улучшает процессы репарации базального и функционального слоев эндометрия.
Назначение Прогиновы пациенткам с тонким эндометрием в дозе 15–18 мг в день с 5-дневным введением прогестерона 1 раз в 120 дней (общий период лечения составил 240 дней) позволило у 87 пациенток из 101 достичь М-эха толщиной > 8 мм. Это дало возможность осуществить перенос эмбрионов в криопротоколе в следующем менструальном цикле. Применение эстрогенов в программах ВРТ нашло отражение в научно-практических рекомендациях 2015 г. Рациональной тактикой отмены эстрогенов во время наступившей беременности является постепенное снижение дозы не ранее 8–12 недель гестации.
Еще одна терапевтическая ниша Прогиновы — назначение ее после тотальной или субтотальной гистерэктомии с обеими придатками. Препарат становится средством выбора для купирования климактерических симптомов у пациенток:
-
с наследственным анамнезом РМЖ (монотерапия эстрогенами снижает риск РМЖ);
-
с сахарным диабетом 2 типа (монотерапия эстрогенами снижает риск первичного рака печени);
-
с болезнью Альцгеймера в семейном анамнезе (нейропротективный эффект эстрогенов в период менопаузального перехода и в возрасте ранней постменопаузы).
У пациенток с интактной маткой Прогинова показана в комплексной терапии климактерических симптомов при использовании внутриматочной левоноргестрелсодержащей рилизинг-системы в период перименопаузы.
ЗАКЛЮЧЕНИЕ
Персонифицированный подход к назначению менопаузальной гормональной терапии (МГТ) базируется на выборе лекарственного средства, содержащего гестагенный компонент с изученными дополнительными свойствами, а именно влиянием того или иного типа гестагена на когнитивные функции и возможностью коррекции сексуальной дисфункции. Более того, подбор МГТ в период менопаузального перехода осуществляется с учетом соматического статуса пациентки и существующих рисков тромбоэмболических осложнений. Безусловно, привлекает метаболическая нейтральность гестагена, входящего в состав препарата Климонорм. Одним из последних аргументов, определяющим выбор, является тот факт, что препарат занимает выгодные позиции по соотношению стоимости и эффективности.







