В последние годы в структуре показаний к операции кесарева сечения рубец на матке занимает лидирующие позиции. Практически у каждой четвертой пациентки именно рубец на матке является непосредственной причиной повторного абдоминального родоразрешения [1–5]. Выбор тактики ведения беременности, оптимальных сроков и методов родоразрешения у таких пациенток представляет значительные трудности и в каждом конкретном случае должен осуществляться индивидуально. При этом значительный рост частоты кесарева сечения и за рубежом, и в нашей стране уже перестал быть только медицинской проблемой [6–10].
Достижения в оперативной технике и современный шовный материал повысили репарационные возможности рубца и предопределили оптимизацию акушерской тактики у женщин с рубцом на матке после кесарева сечения и выбор в пользу самопроизвольного родоразрешения. При этом самый действенный путь снижения частоты кесарева сечения — не только его первичная профилактика, но и ведение родов через естественные родовые пути при наличии рубца на матке [11, 12].
Рубец на матке представляет собой плотное образование, состоящее из гиалинизированной, богатой коллагеновыми волокнами соединительной ткани, возникающее в результате регенерации при нарушении ее целостности. Заживление рассеченной стенки матки может происходить путем как реституции (полноценная регенерация), так и субституции (неполноценная регенерация). При полноценной регенерации заживление раны происходит благодаря гладкомышечным клеткам, при субституции — пучкам грубой волокнистой соединительной ткани, нередко гиалинизированной, при таком типе заживления с наибольшей вероятностью возможен разрыв матки во время следующей беременности [3, 12, 13].
Степень полноценности сформированного рубца является одной из основополагающих проблем следующей беременности и успешного ее завершения. В настоящее время оценка состояния рубца на матке после кесарева сечения остается важной задачей в акушерстве [1, 3]. Гистологические исследования иссеченных рубцов, проведенные на базе Новосибирского городского перинатального центра, показали, что при экстренном родоразрешении характерны массивные кровоизлияния в миометрии [4, 12]. В тканях матки и рубцах была отмечена выраженная диффузная и очаговая лейкоцитарная инфильтрация со склерозом сосудистой стенки (рис. 1–3). При плановой операции в рубцах отсутствовали кровоизлияния, а лейкоцитарная инфильтрация была умеренной (рис. 4).
Рис. 1. Кровоизлияния в миометрии после экстренного родоразрешения. Окраска гематоксилин-эозином, 60-кратное увеличение. Здесь и далее в статье фото авторов
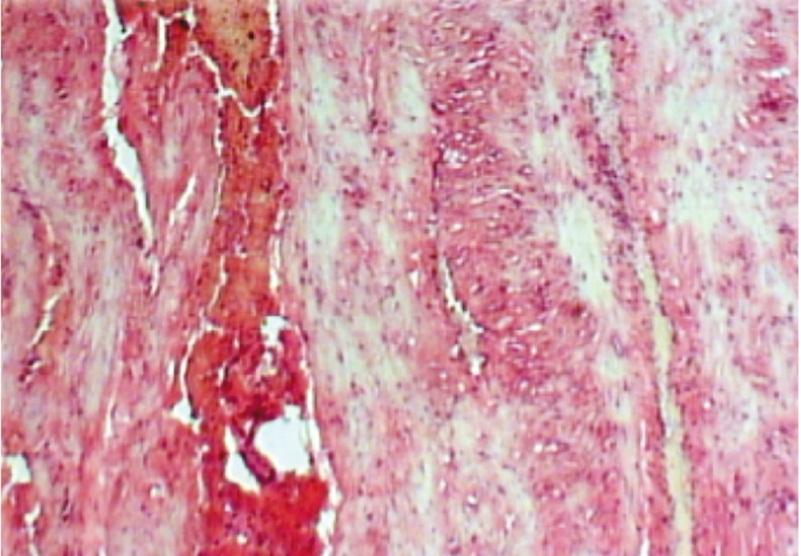
Рис. 2. Лейкоцитарные инфильтраты в миометрии после экстренного родоразрешения. Окраска гематоксилин-эозином, 60-кратное увеличение
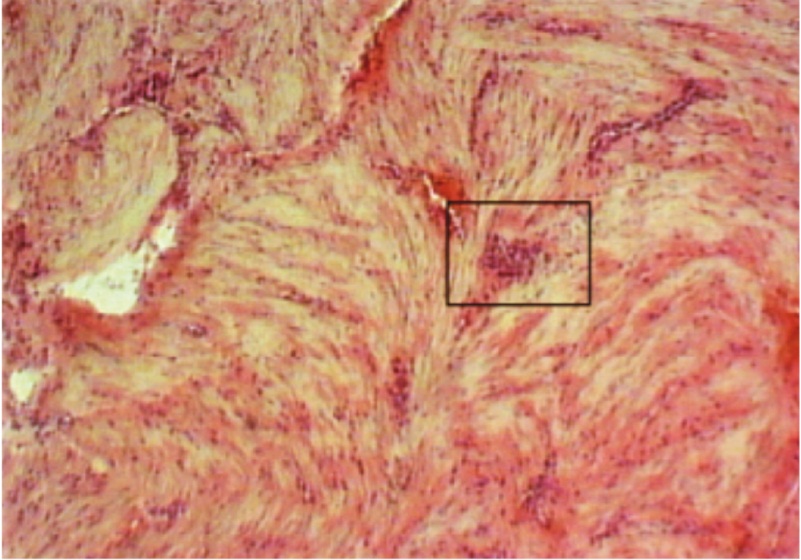
Рис. 3. Склероз стенок кровеносных сосудов в рубце матки при экстренном кесаревом сечении. Окраска гематоксилин-эозином, 60-кратное увеличение
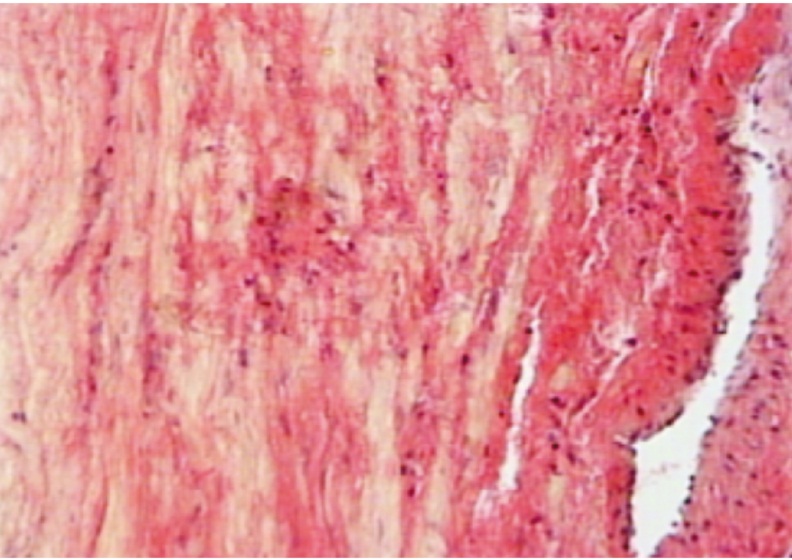
Рис. 4. Рубец на матке во время плановой операции. Отсутствие кровоизлияний и умеренная лейкоцитарная инфильтрация. Окраска гематоксилин-эозином, 60-кратное увеличение
Только на основании морфологического исследования рубца, подтверждающего отсутствие кровоизлияний и лейкоцитарной инфильтрации, делают заключение о возможности ведения родов через естественные родовые пути после предшествующего кесарева сечения, выполненного в плановом порядке. При этом проведенные исследования показали принципиальную возможность ведения самопроизвольных родов у пациенток с рубцом на матке вне зависимости от шовного материала, однако у 40% беременных после предыдущего оперативного родоразрешения формировался неполноценный рубец изза использования ненадлежащего шовного материала [4, 12].
Цель исследования: изучить изменения тканей матки и рубца на ней у крыс и установить вероятность самопроизвольных родов после лигирования маточных рогов с последующим введением в эти участки мультипотентных мезенхимальных стромальных клеток (ММСК), чтобы доказать принципиальную возможность улучшения репарации рубца и снижения частоты кесарева сечения у пациенток с оперированной маткой.
МАТЕРИАЛЫ И МЕТОДЫ
С 2009 г. на базе вивария лаборатории стволовой клетки ФГБУН ИХБФМ СО РАН проводится серия экспериментальных работ с лабораторными крысами, в ходе которых изучены изменения рубца на матке у лабораторных животных после наложения лигатур на маточные рога (моделирование гидрометры) и применения ММСК с трансфицированным геном GFP.
В качестве модели были использованы самки крыс инбредной линии Wag весом 180–200 г в возрасте 6 месяцев. Все манипуляции с животными осуществляли под общим ингаляционным эфирным наркозом в условиях чистой операционной с соблюдением правил проведения работ с использованием экспериментальных животных (Приказ Министерства высшего и среднего специального образования СССР № 742 от 13 ноября 1984 г.) [14–16].
В асептических условиях проводили нижнесрединную лапаротомию. Маточные рога выводили в рану и тщательно обкладывали стерильными салфетками. Под конец каждого рога вблизи тела матки подводили кетгутовую лигатуру и перевязывали оба рога в указанном отделе. Брюшную полость ушивали наглухо послойно [13, 16, 17].
Контролем выступали крысы с перевязанными маточными рогами после инъекций соответствующего объема культуральной среды без использования ММСК и интактные животные.
Сразу по истечении 3 недель к самкам крыс после удаления лигатур с рогов матки с последующим применением ММСК (n = 26) или без него (n = 46) подсаживали самцов. Регистрировали дату родов и количество новорожденных крысят. В связи с тем, что беременность у этого вида животных длится 22 дня [2, 9, 12], наблюдение вели в течение 10 недель после подсаживания самцов (3 срока наступления и завершения беременности).
ММСК выделяли, вымывая костный мозг из эпифизов бедренных костей у крыссамцов линии Wag. Полученную суспензию клеток помещали в пластиковые флаконы (Nunk, Дания), через 48 часов после эксплантации костного мозга неприкрепившиеся клетки сливали. Прикрепившиеся клетки культивировали в среде αМЕМ с добавлением 10% эмбриональной телячьей сыворотки (Biolot, Россия) при 37 °С в СО2-инкубаторе с 5% СО2 в условиях насыщенной влажности. Смену среды производили каждые три дня. При субкультивировании монослойную культуру рассевали в плотности 1000–5000 клеток/см2 (в зависимости от ростовых свойств используемой эмбриональной сыворотки), использовали стандартные растворы Версена и трипсина [17–19]. И первый, и второй пассаж ММСК трансфицировали ДНК плазмиды pЕGFPN1 (Clontech Laboratories Inc., США), содержащей ген зеленого флюоресцентного белка GFP [20].
Через 4 часа после трансфекции данные клетки разводили нетрансфицированными клетками в соотношении 1 : 2,5 соответственно, и по 100 мкл смеси, содержащей 106 клеток в 1 мл, при релапаротомии и после удаления нелизированных остатков шовного материала вводили в область сформированного рубца через 2 месяца после перевязки обоих маточных рогов [21].
Фрагменты маточного рога с рубцом, удаленные через 4 суток, 1, 2 и 3 недели после введения ММСК, фиксировали в 4%ном растворе параформальдегида на фосфатном буфере (рН = 7,4) не менее 24 часов, обезвоживали в градиенте этанола возрастающей концентрации, просветляли в ксилоле и заключали в гистопласт. Неокрашенные срезы толщиной 5–7 мкм изучали на световом микроскопе Axioimager M1 при увеличении до 1500 раз в режиме люминесценции с фильтром Alexa 488.
Статистическую обработку результатов проводили на прикладной статистической программе MS Excel 7.0 (Microsoft, США). Достоверность различий определяли на основании критерия Стьюдента.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Через 4 суток после удаления лигатуры с перевязанных рогов матки и введения ММСК в рубце миометрия, тканях вокруг и в миометрии в ходе микроскопии были найдены единичные небольшие сосуды, полностью построенные из светящихся клеток. Несколько реже клетки со свечением формировали только часть сосудистой стенки (рис. 5).
Рис. 5. Спустя 4 суток после введения мезенхимальных стромальных клеток с трансфицированным геном GFP в рубце рога матки присутствуют кольцевые структуры, напоминающие сосуды. Их стенки состоят из крупных клеток, где на фоне ярко светящейся цитоплазмы заметно более темное ядро. Флюоресцирующие клеточные элементы расположены не только внутри сосуда, но и снаружи. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
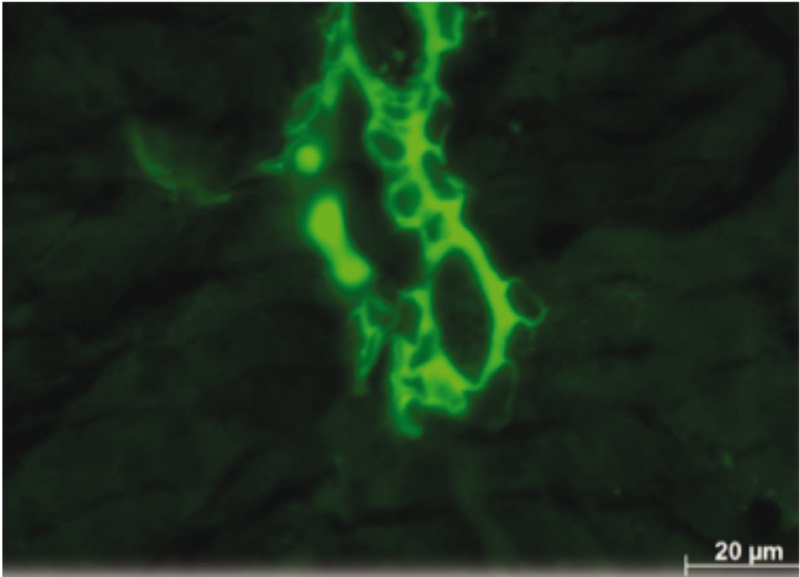
Таким образом, уже к 4м суткам после инъекции в рубце миометрия ММСК собираются в группы и формируют кольцевые структуры, сходные с молодыми сосудами: тонкие однослойные стенки и очень широкий, практически круглый просвет. Скорее всего, такие сосуды образуются в тканях de novo и только потом включаются в микроциркуляторное русло.
Спустя неделю после введения ММСК в рубце и тканях рядом с ним присутствовало множество мелких кровеносных сосудов, все оболочки которых были построены из светящихся клеток. В группе кровеносных сосудов светятся хорошо очерченные эндотелиальная выстилка и наружная оболочка. В просвете сосудов расположены эритроциты, то есть сосуды были функциональны (рис. 6).
Рис. 6. Через неделю после применения мезенхимальных стромальных клеток с трансфицированным геном GFP в рубце матки расположено множество мелких кровеносных сосудов, все оболочки которых построены из светящихся клеток. В этих клетках на фоне ярко флюоресцирующей цитоплазмы видно более темное ядро. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
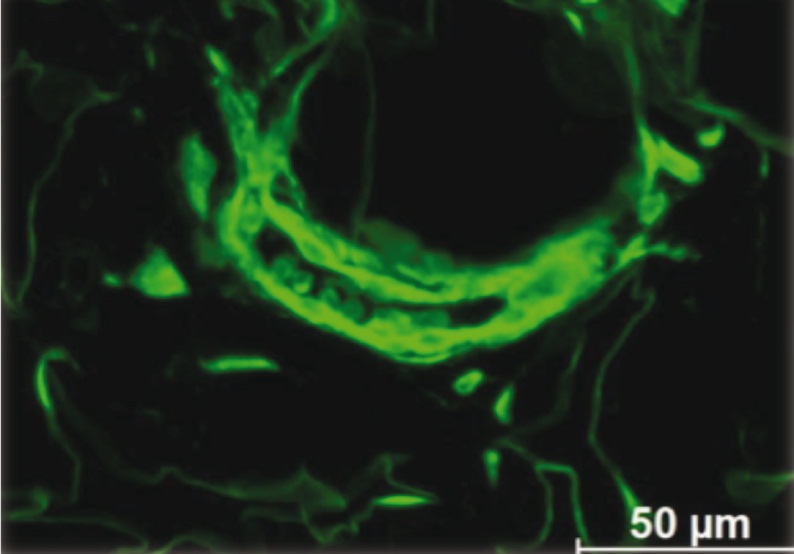
Через 2 недели после использования ММСК было обнаружено множество сосудов различного диаметра с флюоресцирующими клеточными элементами и структурами в сосудистой стенке. Из светящихся клеток были построены целиком сосудистые стенки или их отдельные элементы. Большинство сосудов содержали разный объем форменных элементов крови, что свидетельствует об их полноценности и активном функционировании (рис. 7).
Рис. 7. В рубце маточного рога на 2-й неделе после использования мезенхимальных стромальных клеток с трансфицированным геном GFP содержатся крупные сосуды артериального типа. Они имеют ярко флюоресцирующие эндотелиальную и адвентициальную оболочки. Большинство сосудов содержат форменные элементы крови с аутофлюоресценцией. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
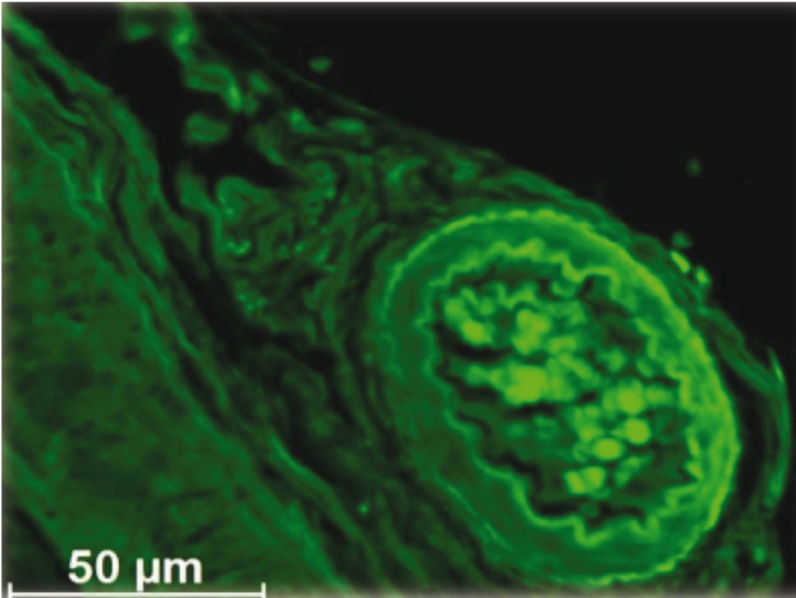
Максимальное количество сосудов со светящимися стенками сформировалось к 3й неделе после введения ММСК. Такие сосуды присутствовали в рубце, окружающей клетчатке и в тканях матки. Однако интенсивность флюоресценции заметно уменьшилась, что свидетельствует о снижении интенсивности свечения и эндотелия, и адвентиция (рис. 8).
Рис. 8. На 3-й неделе после инъекции мезенхимальных стромальных клеток с трансфицированным геном GFP в рубце рога матки отмечено свечение всех оболочек склерозированных сосудов. Их стенка ― негомогенная; на фоне яркого свечения внутренней и наружной оболочек флюоресцируют, но менее интенсивно, остальные структуры. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
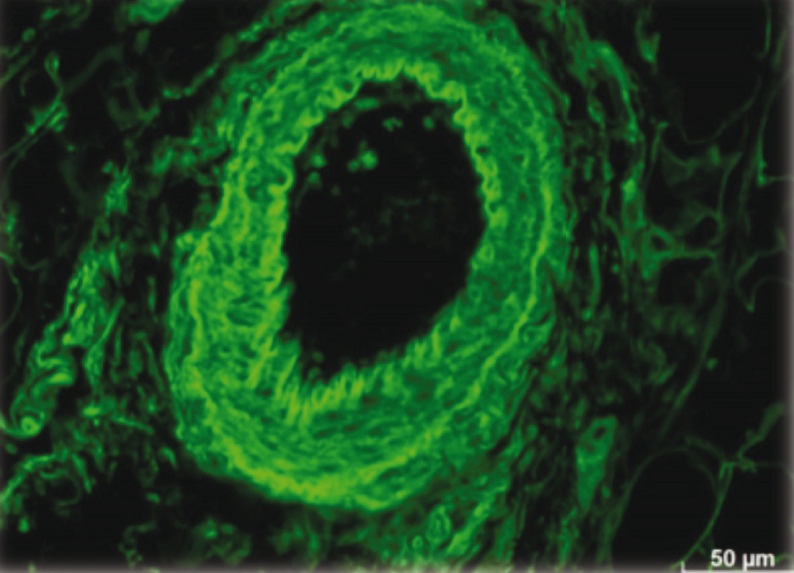
В то же время сосуды, которые сначала были построены полностью или частично из введенных ММСК, а затем из собственных клеток организма, остаются в тканях матки.
Таким образом, улучшается кровоснабжение атрофичных и склерозированных тканей рубца и создается возможность для его реорганизации. В литературе уже было отмечено, что в результате улучшения микроциркуляции в рубце может произойти омоложение коллагеновых и эластиновых волокон с появлением более тонких структур и упорядочиванием их расположения [14, 18].
На основании этого сделан вывод, что стволовые клетки, введенные в рубец на матке, формируют кровеносные сосуды за счет их дифференцировки в клетки сосудистых оболочек. Экспрессия гена GFP не только в эндотелии сосудов, но и в их адвентиции указывает на дифференцирование введенных ММСК как в эндотелиальном, так и в перицитарном направлениях. Было сделано заключение, что после введения в рубец ММСК они формируют кровеносные сосуды за счет дифференцировки в эндотелиоциты и перициты [17, 22].
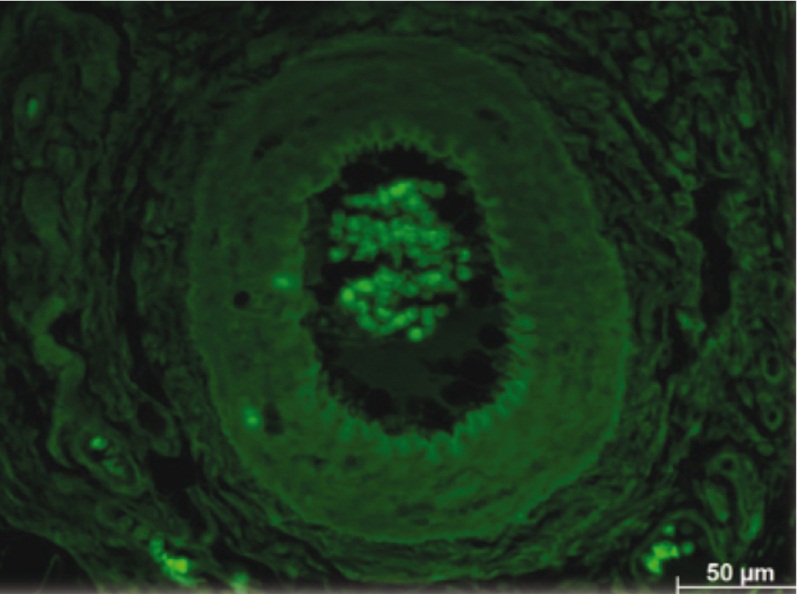
Что касается группы контроля и интактных животных, то были получены следующие результаты. В контроле на всех сроках эксперимента (у животных с гидрометрой без применения ММСК) и у интактных крыс в тканях матки и рубца было отмечено свечение только эритроцитов в многочисленных сосудах (рис. 9, 10).
Рис. 9. Рубец маточного рога контрольного животного спустя 2 недели после удаления лигатуры. Специфически светящиеся объекты в стенке сосудов отсутствуют, флюоресцируют только эритроциты. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
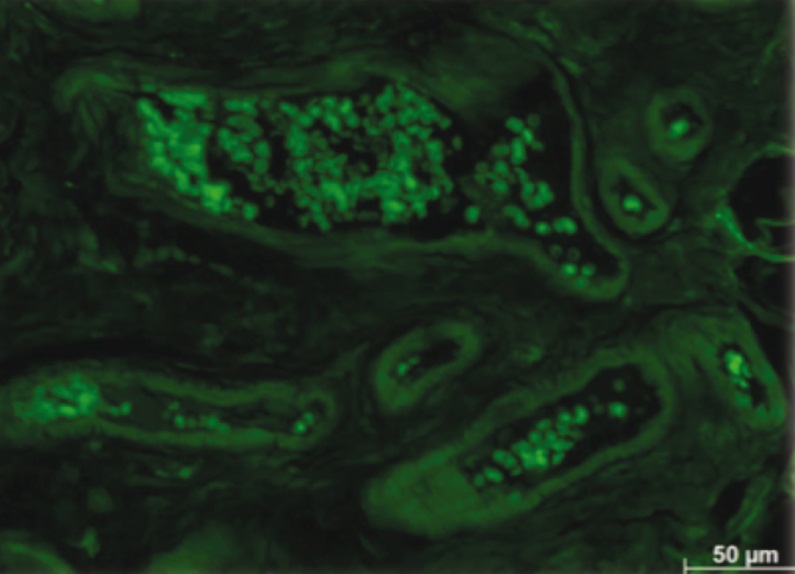
Рис. 10. У интактной крысы в роге матки флюоресцирующих объектов, кроме эритроцитов, нет. Неокрашенный срез в отраженном ультрафиолетовом свете с фильтром Alexa 488
После инъекций ММСК родили 8 из 26 (30,8%) животных, в контрольной группе без применения клеточных технологий — 7 из 46 (15,2%).
Животные после применения ММСК начали рожать на 7 дней раньше крыс, у которых клеточные технологии не использовали. С учетом длительности эстрального цикла у крыс в 4 дня [23] можно заключить, что у этих животных беременность наступает (восстанавливается проходимость маточных рогов) после введения ММСК на 7 дней, или 2 эстральных цикла, раньше, чем у таких же крыс без введения клеток.
Количество крысят после применения ММСК составило в среднем 3,13 ± 2,23, максимально 7 новорожденных, тогда как без использования клеточных технологий средняя численность потомства была равна 1,92 ± 1,12, а максимальное число крысят — 4. Возможно, что в результате использования ММСК и более быстрой регенерации структуры маточных рогов более эффективно восстанавливается проходимость обоих рогов.
В группе с применением ММСК за время наблюдения в течение 10 недель с момента подсаживания самцов погибли 2 из 26 (7,69%) крыс, в группе контроля — 6 из 46 (13,04%), но различие оказалось недостоверным.
Меньшая летальность животных после введения ММСК является хорошим результатом и указывает как на более быстрое восстановление просвета рога матки, так и на бóльшую прочность оставшихся рубцовых тканей, способных выдержать полноценную родовую деятельность.
ЗАКЛЮЧЕНИЕ
После инъекции в рубец матки лабораторных крыс мультипотентных мезенхимальных стромальных клеток (ММСК) с трансфицированным геном GFP в нем возрастает число сосудов, образованных de novo с участием введенных клеток. Из светящихся ММСК были построены целиком сосудистые стенки или их отдельные элементы. Такие сосуды присутствовали в рубце, окружающей клетчатке и в тканях матки. Таким образом, экспериментальное применение клеточных технологий продемонстрировало улучшение репарации рубца.








