ВВЕДЕНИЕ
Эпителиальный рак яичника (РЯ) является гетерогенным заболеванием. На сегодняшний день известно, что РЯ — это общий термин для ряда заболеваний, различающихся между собой по морфологическим и молекулярным характеристикам. Гистологические и молекулярные подтипы РЯ по-разному отвечают на химиотерпию.
При лечении онкологических заболеваний главная задача — точная направленность воздействия. Поэтому очень важным представляется дифференцированный подход к химиотерапии различных подтипов РЯ.
В современных клинических рекомендациях все большее значение придается персонализированным решениям в лечении и профилактике социально значимых заболеваний, что основано на использовании высоких технологий и становится одним из основных векторов развития биомедицины. Изучение биологических и молекулярных особенностей опухоли позволит выбрать правильную программу лечения для каждого больного.
Представляем вниманию читателей клиническое наблюдение пациентки, получавшей терапию в онкогинекологическом отделении ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России в рамках научно-исследовательской работы в 2017 г. и продолжающей диспансерное наблюдение в поликлиническом отделении института. Клинический случай демонстрирует необходимость оценки индекса перитонеального канцероматоза (peritoneal cancer index, РСI), а также использования новой молекулярно-генетической диагностики с целью формирования эффективной программы комбинированного лечения распространенного РЯ.
КЛИНИЧЕСКОЕ НАБЛЮДЕНИЕ
Больная М., 52 лет, обратилась в январе 2017 г. с жалобами на слабость, боль в эпигастральной области, снижение массы на 5 кг за последние 3 месяца. При обследовании был установлен диагноз РЯ IVВ стадии (FIGO) сТ3сN1М1lym (правый паховый лимфатический узел). У пациентки семейный онкологический анамнез не отягощен. При молекулярно-генетическом тестировании выявлена герминальная мутация в гене BRCA1 5382insC.
На МРТ малого таза (рис. 1) визуализировались множественные сливающиеся внеорганные узлы вдоль тазовой брюшины, петель тонкой кишки, вдоль сигмовидной кишки (с признаками поверхностной инвазии), слепой кишки, диаметром от 3 до 35 мм.
Рис. 1. А — магнитно-резонансная томограмма органов малого таза до проведения неоадъювантной химиотерапии. Индекс перитонеального канцероматоза — 15. Инфильтрация прямокишечного маточного пространства, канцероматоз брюшины малого таза. В — магнитно-резонансная томограмма органов малого таза после проведения неоадъювантной химиотерапии. Индекс перитонеального канцероматоза — 4. Здесь и далее в статье иллюстрации авторов
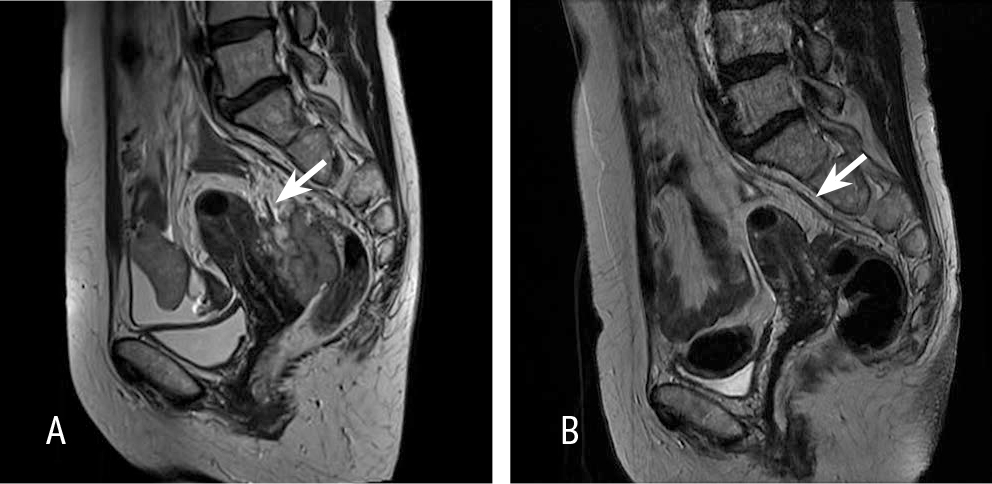
Правый яичник на этом фоне отчетливо не дифференцировался. Левый яичник размером 22 × 24 мм, неоднородной структуры с бугристыми контурами, спаян с телом матки и брюшиной боковой стенки таза.
В полости малого таза умеренное количество свободной жидкости. Вдоль левых наружных подвздошных сосудов визуализировался увеличенный структурно измененный лимфатический узел размером 9 × 9 мм; аналогичный по структуре лимфатический узел размером 14 × 11 мм был в правой паховой области.
По данным КТ грудной клетки и брюшной полости, определялись мелкие очаги в легких — слишком малы для интерпретации, требуют динамического наблюдения.
В брюшной полости множественные уплотненные брыжеечные лимфоузлы, узловатые образования по брюшине, в том числе между передней кривизной желудка, селезеночным изгибом толстой кишки и селезенкой, за восходящим отделом толстой кишки, за передней брюшной стенкой, размером до 35 × 16 мм, частично сливающиеся между собой. В правом фланке брюшной полости — вдоль стенки восходящего отдела ободочной кишки, слепой кишки (не отделяясь от стенок этих отделов кишечника; нельзя исключить их инвазию) — переходящее в малый таз (прилегают к мочевому пузырю) образование размером до 130 × 60 × 30 мм.
Узел между желудком и левой ножкой диафрагмы, аортой — до 18 × 10 мм. Кпереди у малой кривизны желудка — множественные узелки до 11 мм. Парааортально и паракавально — лимфатические узлы до 11 × 7,5 мм (рис. 1А). Уровень онкомаркера СА-125 составил 1508 Ед.
Для определения тактики лечения пациентки, патоморфологической верификации заболевания с учетом степени распространенности опухоли выполнены диагностическая лапароскопия, биопсия левого яичника и опухолевого (метастатического) узла брюшины малого таза для морфологической верификации диагноза. При патоморфологическом исследовании удаленного препарата установлен гистологический тип опухоли: high-grade серозная карцинома яичника. PCI составил 15, что является предиктором для неоптимальной циторедуктивной операции[1, 2].
В связи с носительством герминальной мутации в гене BRCA1 с согласия больной ее включили в исследование (внутренний протокол отделения онкогинекологии ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, протокол этического комитета № 354 от 10.04.2017 г.) и провели три курса неоадъювантной химиотерапии (НАХТ) по схеме МАР: цисплатин 100 мг/м2 в 1-й день, митомицин 10 мг/м2 в 1-й день, доксорубицин 30 мг/м2 в 1-й и 8-й дни 28-дневного цикла (премедикация не выполнялась).
На фоне терапии достигнут частичный регресс опухоли, так, по данным КТ органов грудной клетки, органов брюшной полости и МРТ органов малого таза (рис. 1В), отмечались выраженное уменьшение размеров и регресс большинства ранее выявленных метастазов по брюшине.
При исследовании сохранялось утолщение мезоколона справа до 4 мм в поперечном измерении (ранее — до 6 мм). Асцит не определялся. В полости малого таза — регресс узлов вдоль тазовой брюшины, петель тонкой кишки, вдоль сигмовидной кишки; правый яичник отчетливо не дифференцировался, левый яичник — 18 × 19 мм, неоднородной структуры с бугристыми контурами. Матка размером 86 × 41 мм, стенки влагалища не изменены, тазовые сегменты мочеточников не расширены, в полости малого таза свободная жидкость не выявлена. Тазовые лимфатические узлы не увеличены, лимфатический узел в правой паховой области до 5 мм в диаметре.
В феврале 2018 г. пациентке выполнены диагностическая лапароскопия, конверсия в лапаротомию, интервальная циторедуктивная операция в оптимальном объеме — лапаротомия, комбинированная экстирпация матки с придатками с двусторонней тазовой, паховой, парааортальной лимфаденэктомией, передней резекцией прямой кишки, оментэктомией, перитонеумэктомией, гипертермической интраперитонеальной химиоперфузией препаратом цисплатин. Интраоперационно, при ревизии органов брюшной полости и малого таза, PCI составил 4.
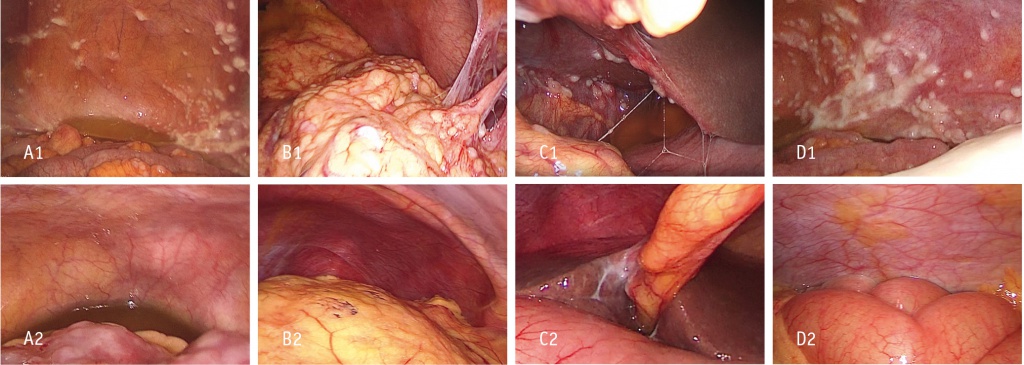
При гистологическом исследовании послеоперационного препарата выявлены резидуальный серозный РЯ с выраженными признаками лечебного патоморфоза (в яичнике Bohm 2, в большом сальнике Bohm 3), метастазы в тазовой брюшине с выраженными признаками лечебного патоморфоза. Жизнеспособная опухолевая ткань — не более 5%. Большой сальник с очаговыми скоплениями светлых макрофагов, очаговым фиброзом с лимфоидной инфильтрацией (рис. 2).
Рис. 2. Результаты диагностической лапароскопии: 1 — до лечения, 2 — после лечения. А — малый таз, пузырно-вагинальное пространство; В — большой сальник, левый купол диафрагмы; С — висцеральная поверхность печени, круглая связка печени; D — левый фланк брюшной полости
Известно, что в ходе химиотерапии функциональный статус гена BRCA1/2 в опухоли может меняться[3]. Современная концепция лекарственной терапии РЯ предполагает, что при ответе опухоли на неоадъювантный режим химиотерапии адъювантную химиотерапию продолжают по той же схеме. Однако если в опухоли у носительниц мутаций в генах BRCA1/2 происходит восстановление функции гена в ходе проведения НАХТ, то резидуальные опухолевые клетки могут утратить чувствительность к ген-специфическим препаратам: цисплатину, митомицину С[3].
У пациентки М. проведенное молекулярно-генетическое исследование биоптатов опухоли до начала НАХТ показало герминальную мутации в гене BRCA1 5382insC с утратой аллеля второго гена (феномен потери гетерозиготности, loss of heterozygosity, LOH) и мутацию p53 R231Х. Но после НАХТ и интервальной циторедуктивной операции в опухоли обнаружены клоны с восстановленной функцией гена BRCA1, феномен потери гетерозиготности отсутствовал (рис. 3).
Рис. 3. Механизм развития платинорезистентности в период проведения неоадъювантной химиотерапии у больных раком яичников. Автор рисунка — Городнова Т.В.
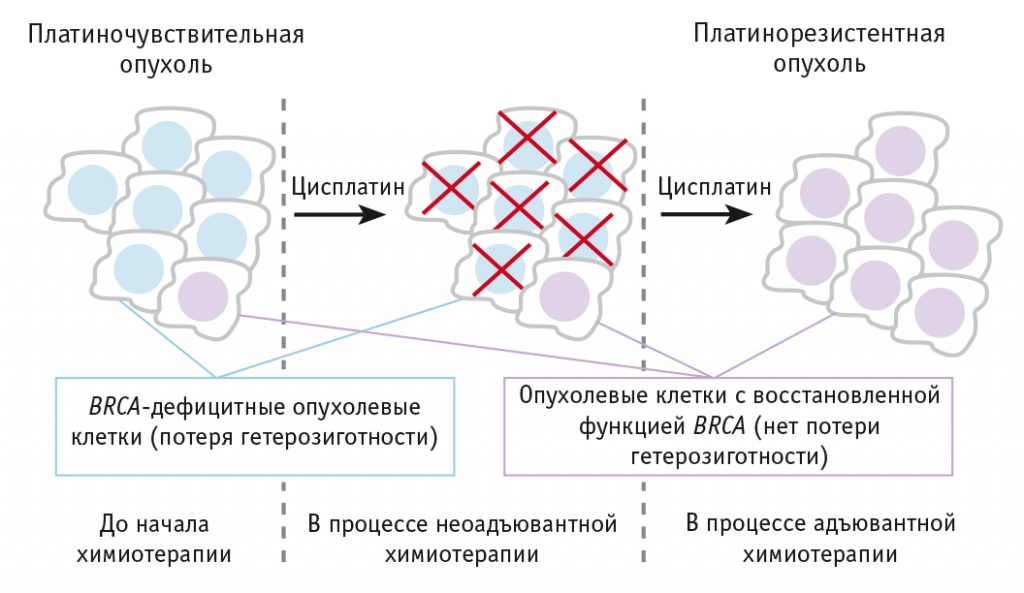
Эти данные свидетельствуют, что на фоне проведения НАХТ произошли гибель клеток с герминальной мутацией в гене BRCA1 и наличием феномена потери гетерозиготности и накопление клеток с герминальной мутацией в гене BRCA1 и отсутствием феномена потери гетерозиготности, что указывает на резистентность резидуальных опухолевых клеток без феномена потери гетерозиготности к проводимой ранее химиотерапии.
В связи с эти принято решение о смене схемы химиотерапии в послеоперационном периоде и отказе от заведомо неэффективного платинового компонента. Междисциплинарным консилиумом учреждения принято решение о проведении в послеоперационном периоде трех курсов бесплатиновой химиотерапии по схеме АТ: паклитаксел 150 мг/м2 в 1-й день и доксорубицин 50 мг/м2 в 1-й день 21-дневного цикла на фоне корригирующей терапии (дексаметазон 8 мг в/в, ондансетрон 8 мг в/в, фосапрепитант 150 мг в/в) с премедикацией препаратом дексаметазона по 10 мг в / м или внутрь за 12 и 6 часов до начала терапии паклитакселом. Терапию пациентка перенесла удовлетворительно.
Лечение было завершено в октябре 2017 г. В ходе динамического наблюдения за пациенткой до апреля 2022 г. данные о рецидиве заболевания не получены. Показатель безрецидивной выживаемости составляет 55,6 месяцев, общей выживаемости — 57,7 месяцев.
ОБСУЖДЕНИЕ
В 2018 г. опубликованы первые результаты исследования, включающего испытание схемы «митомицин С + цисплатин» в неоадъювантном режиме у больных BRCA1-ассоциированным РЯ[4]. В это исследование включены 12 пациенток, проходивших лечение по схеме МР (цисплатин и митомицин), и 22 женщины, получавшие терапию по схеме TCbP (паклитаксел и карбоплатин).
Объективный клинический ответ зарегистрирован у всех 12 пациенток в группе МР; всем выполнена полная циторедуктивная операция. В 2 (16,7%) из 12 послеоперационных образцов ткани яичника и большого сальника остаточные опухолевые клетки не обнаружены (полный патоморфологический регресс)[4].
В нашем исследовании мы включили в протокол лечения препарат доксорубицин, т. к. ожидали, что добавление доксорубицина к этой комбинации может увеличить скорость элиминации всех опухолевых клеток, обнаруживаемых в тканях, удаленных на этапе хирургического лечения.
Общепринятые представления о патогенезе наследственных раков подразумевают, что развитию опухоли всегда предшествует утрата (инактивация) оставшегося (нормального) аллеля вовлеченного гена (развитие феномена потери гетерозиготности, LOH). Однако в ходе химиотерапии функциональный статус гена BRCA1/2 в опухоли может меняться (функция гена BRCA может восстанавливаться)[3].
Оценка LOH-статуса образца опухоли до начала лекарственного лечения и после него позволяет зафиксировать приобретенную химиорезистентность опухоли в ходе терапии. Отсутствие феномена потери гетерозиготности в ткани опухоли свидетельствует о развитии платинорезистентности и может служить основанием для смены схемы лекарственной терапии в процессе комбинированного лечения.
Проведение молекулярно-генетического теста для определения потери гетерозиготности и уровня экспресcии гена BRCA позволяет мониторировать функциональные изменения статуса генов BRCA в опухолевой ткани пациенток в ходе лечения. LOH-тест описывает экспериментальный феномен, подразумевающий утрату одного из аллель-специфических сигналов в геноме опухоли при анализе полиморфного локуса гена BRCA[3].
Длительное время LOH рассматривалась как безусловное свидетельство делеции определенного участка ДНК, т. е. потеря гетерозиготности являлась синонимом инактивации супрессорного гена[5]. Действительно, потеря гетерозиготности, т. е. существенное изменение соотношения интенсивности сигналов, соответствующих материнскому и отцовскому аллелям полиморфного локуса, может вызываться не только утерей определенной генетической последовательности, но и ее амплификацией[3, 5].
Таким образом, впервые рассматривается феномен быстрой селекции BRCA1-профицитных клонов, который может быть одним из механизмов приобретенной резистентности к платине.
По-видимому, критическим является количество циклов неоадъювантной терапии: нами показано, что достаточно трех циклов для элиминации чувствительных клеток. Более продолжительная терапия той же схемой способна привести к более эффективной селекции наиболее устойчивых опухолевых клонов, что служит основой для возникновения планитонечувствительного рецидива у больных распространенным РЯ.
ЗАКЛЮЧЕНИЕ
Клинический случай демонстрирует развитие платинорезистентности BRCA1-ассоциированного рака яичника (РЯ) у пациентки после неоадъювантной химиотерапии. Данное наблюдение имеет большое клиническое значение, т. к., согласно концепции лекарственной терапии РЯ, при ответе опухоли на неоадъювантную химиотерапию адъювантную химиотерапию продолжают по той же схеме. Однако развитие платинорезистентности BRCA-ассоциированного РЯ можно выявить путем молекулярно-генетического исследования образцов опухоли после интервальной циторедуктивной операции на основании восстановления функции гена BRCA (отсутствие феномена потери гетерозиготности).
Описанное клиническое наблюдение может служить основанием для планирования рандомизированного проспективного исследования по изучению платинорезистентности и коррекции схемы адъювантной терапии, что позволит индивидуализировать программу лечения больных РЯ.
Поступила: 03.06.2022
Принята к публикации: 09.09.2022








