Профилактика и ранняя диагностика онкологических процессов наиболее эффективно снижают показатели заболеваемости и смертности от злокачественных опухолей, особое место среди которых занимает рак шейки матки (РШМ). Именно для этой локализации рака имеются реальные возможности вакцинопрофилактики, существует многолетняя история скрининга. Однако на практике эффективную профилактику и скрининг РМШ широкомасштабно внедрить не удалось. Анализ причин этого необходим для планирования будущих мероприятий в рамках решения стоящих перед отечественным здравоохранением задач по снижению смертности от онкологических заболеваний.
Статистические данные 2017 г. свидетельствуют, что РШМ занимает 5-е место в структуре онкологической заболеваемости у женщин и 10-е место в структуре смертности[1]. Стандартизованные показатели составили соответственно 15,76% и 5,18%[1]. Сравнительные данные за 1970 г. — заболеваемость 14,2% и смертность 4,9%[2]. Но тогда РШМ занимал 3-е место в структуре онкологической заболеваемости у женщин, а среди четырех основных локализаций рака репродуктивных органов (молочная железа, шейка матки, эндометрий и яичники) его доля достигала 45,1%, в то время как, по данным 2017 г., доля РШМ составила лишь 15% (рис. 1)[2].
Рис. 1. Удельный вес больных раком репродуктивных органов в РФ в 1970 г. и в 2017 г., %
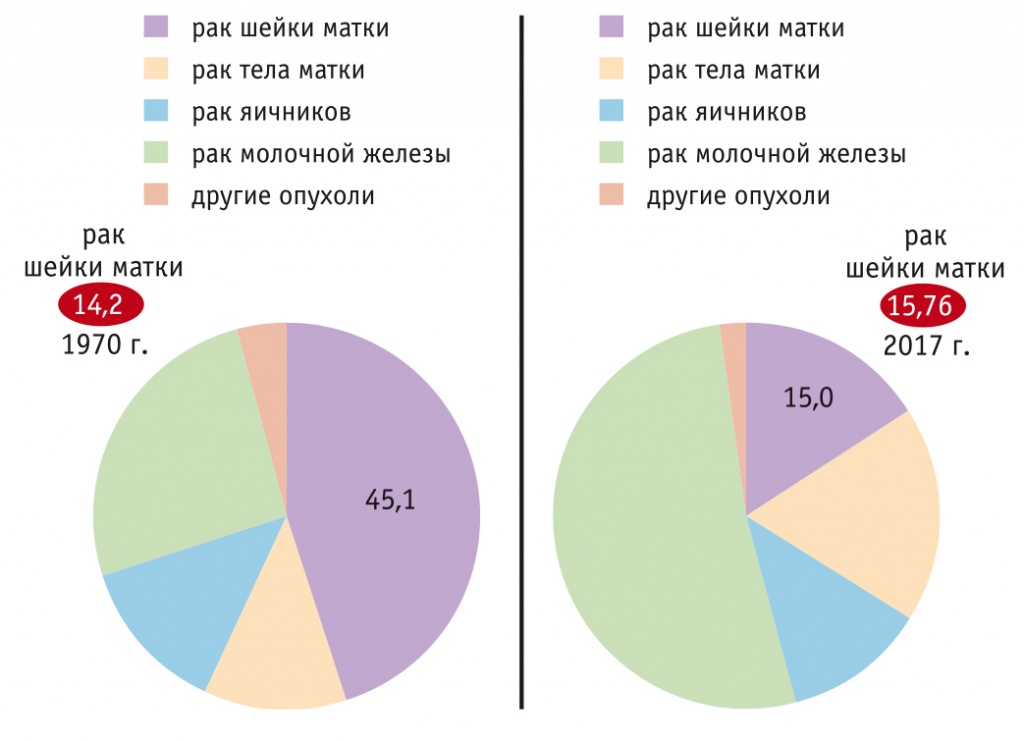
Таким образом, несмотря на некоторое увеличение показателей заболеваемости и смертности за прошедшие более чем 40 лет, уровень заболеваемости РШМ в структуре онкологических патологий существенно уменьшился, и это могло бы стать основой для переоценки стратегии и тактики в отношении профилактики и скрининга.
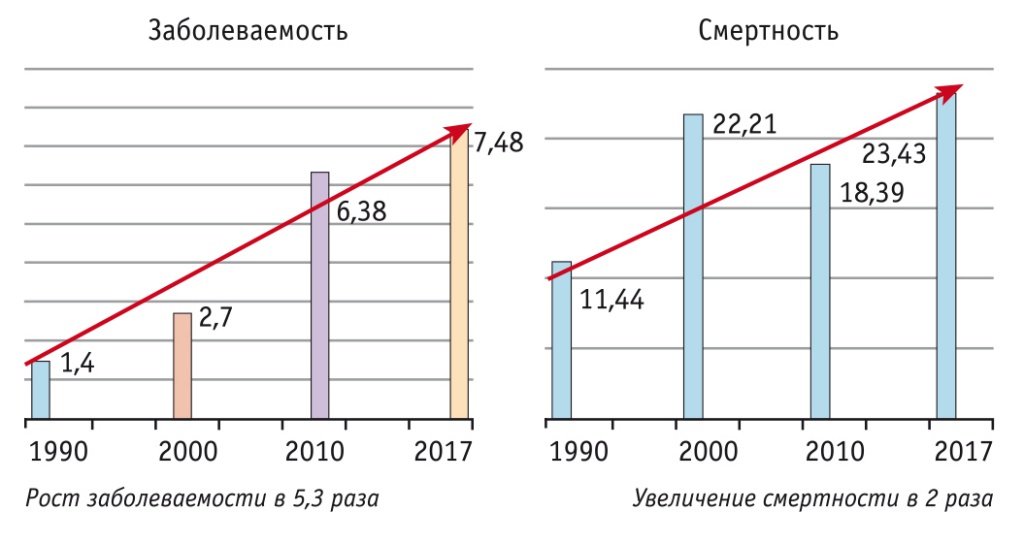
Однако за последние годы наблюдается тенденция к существенному росту доли женщин репродуктивного возраста, страдающих РШМ. В 2017 г. удельный вес РШМ среди злокачественных опухолей репродуктивных органов четырех основных локализаций у женщин до 40 лет составил 62,2% (рис. 2)[1]. В этой возрастной группе возросла не только заболеваемость, но и смертность. Результатом стали существенные репродуктивные потери, складывающиеся из числа погибших пациенток и пациенток после лечения. Особенно удручающая картина наблюдается в возрастной группе 15–29 лет. Именно в раннем репродуктивном возрасте заболеваемость увеличилась в 5,3 раза по сравнению с 1990 г., а смертность возросла в 2 раза (рис. 3)[2]. И это при том, что технологии современной терапии РШМ (хирургической, лекарственной, лучевой) качественно отличаются от методов 80–90-х годов прошлого столетия.
Рис. 2. Удельный вес больных раком репродуктивных органов в возрасте до 40 лет в РФ в 2017 г., %
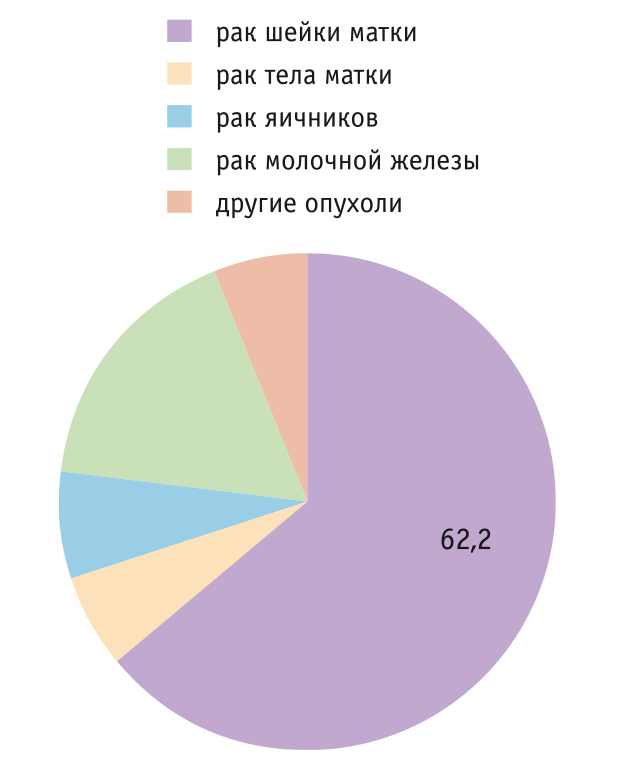
Рис. 3. Динамика заболеваемости и смертности от рака шейки матки в возрастной группе 15–29 лет в РФ в 1990–2017 гг. (на 100 000 женщин)
Следует остановиться на особенностях развития РШМ у девушек раннего репродуктивного возраста. Прежде всего, необходимо отметить, что конец 80-х и 90-е годы стали периодом мощных социально-культурных потрясений; за это время изменились многие нравственно-этические параметры нашего социума.
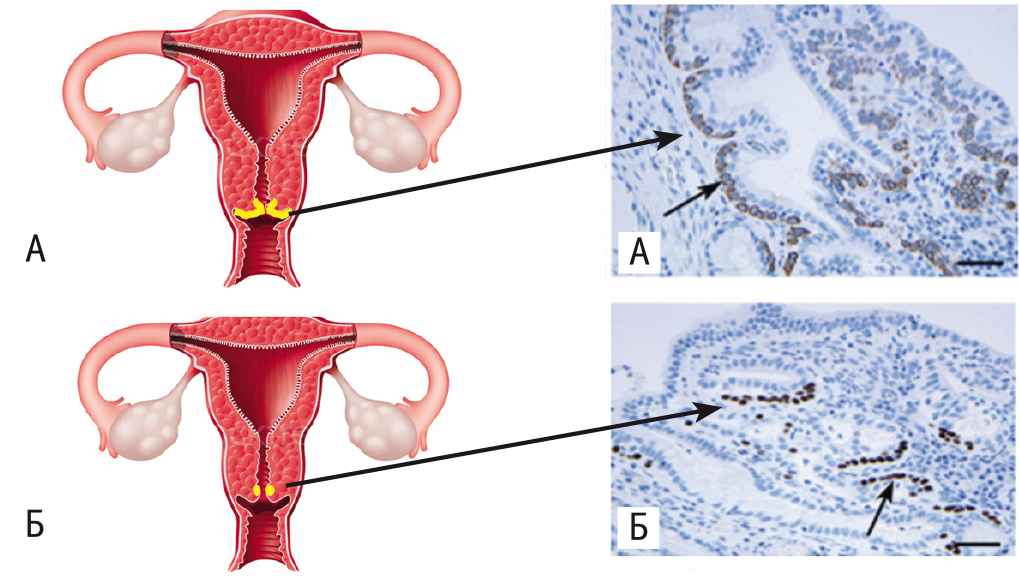
Важно понять взаимосвязь между социально-культурными изменениями и ростом частоты РШМ у девушек до 20 лет. Известна этиологическая роль ВПЧ в развитии РШМ; множество клинических наблюдений и экспериментальных исследований показали, что РШМ развивается за 7–15 лет; однако уже в 18–20 лет, спустя всего 2–4 года после сексуального дебюта в 15–16 лет, может сформироваться клинически выраженный, а чаще всего запущенный онкологический процесс, что связано с особенностями вирусного канцерогенеза в зоне еще не сформированного эпителиального покрова шейки матки, процессами эпигенетики, влиянием поливалентной инфекции, гормонального и энергетического метаболизма ювенильного возраста. У девушек также немалое значение имеет наличие обширной зоны трансформации во влагалищной порции шейки матки и высокой концентрации клеток с признаками стволовости (рис. 4)[3, 4].
Рис. 4. Особенности эпителиального покрова шейки матки у девушек в возрасте до (А) и после (Б) 20–25 лет и конфигурация стволовых клеток в базальном слое эпителия
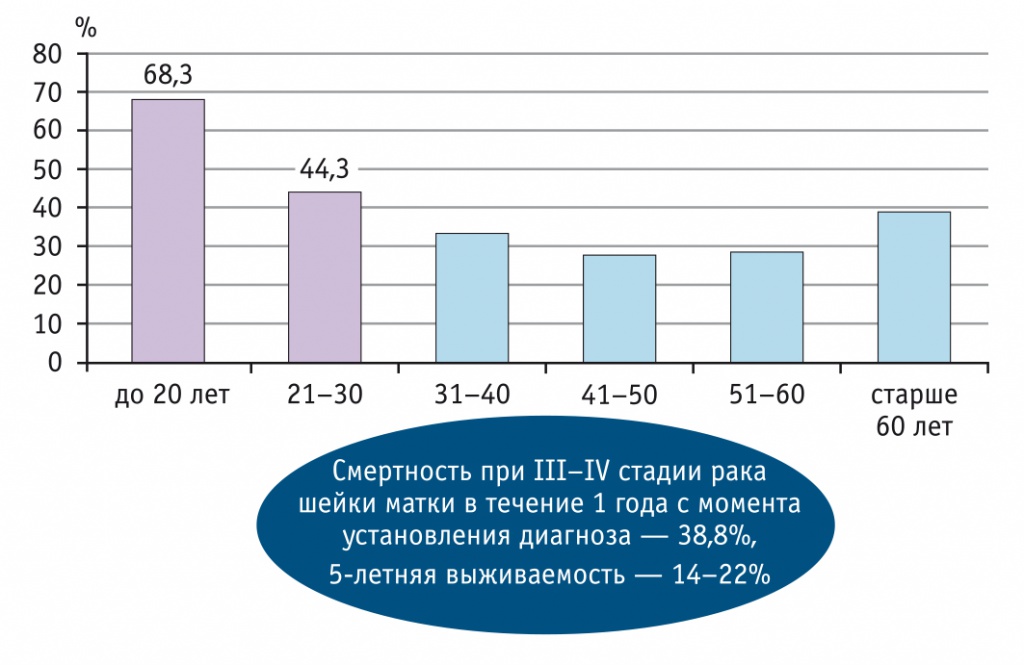
Таким образом, имеются потенциально обширное опухолевое поле (зона трансформации), многочисленный пул стволовых (прогениторных) клеток, особенности вирусного канцерогенеза (быстрая интеграция вирусного генома в геном клеток базального эпителия). При этом инвазивный злокачественный процесс может развиваться, минуя этап интраэпителиальных неоплазий (рис. 5). Это лишь гипотетическая модель, способная отчасти объяснить быстрые темпы развития РШМ у молодых женщин. Согласно данным статистики, до 70% пациенток с запущенными III–IV стадиями РШМ — это пациентки до 20 лет (рис. 6)[1, 2, 5, 6].
Рис. 5. Варианты развития рака шейки матки
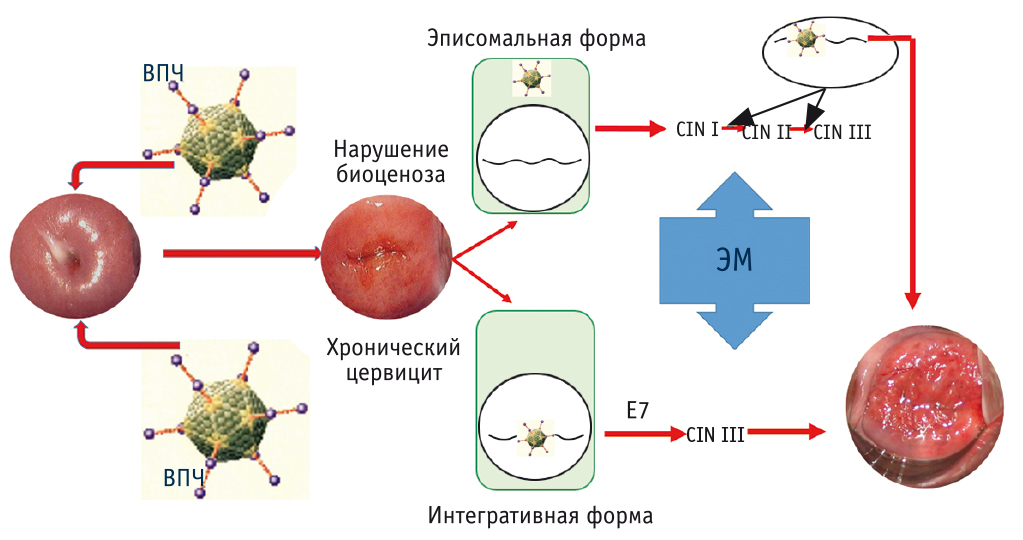
Рис. 6. Удельный вес больных с стадией III–IV рака шейки матки в РФ в 2017 г., %
Современная проблема РШМ обостряется в двух аспектах:
- резкое омоложение заболеваемости;
- преобладание запущенных стадий, особенно в группе больных раннего репродуктивного возраста.
Эксперты на протяжении многих десятилетий говорят о необходимости проведения скрининга РШМ, не учитывая того, что показания к скринингу могут динамично меняться. Как правило, неадекватное отношение к скринингу сопряжено с игнорированием или незнанием принятых в 1968 г. ВОЗ ключевых рекомендаций для его проведения:
- заболевание, являющееся объектом скрининга, должно быть важной проблемой здравоохранения;
- должно существовать достаточно эффективное лечение больных с выявленными при скрининге заболеваниями;
- должны иметься возможности для дальнейшего уточнения и верификации диагноза, а также лечения;
- заболевание должно иметь ясно распознаваемую преклиническую фазу;
- должен существовать эффективный (высокочувствительный) скрининговый тест или исследовательский метод, регистрирующий эту фазу;
- метод обследования должен быть приемлемым для популяции;
- течение заболевания, развитие от преклинической до клинической фазы должны быть достаточно изученными;
- должна существовать общепринятая стратегия в отношении лечения пациентов;
- затраты на больных, включая скрининг, уточнение диагноза и лечение, должны быть экономически оправданы среди общих затрат национальной службы здравоохранения[7, 8].
В России в 2017 г. РШМ заболели 17 586 женщин. Лечение всех больных было сопряжено с затратами в пределах 5 276 100 000 рублей (по расценкам ОМС). Ежегодно скринингу подлежат 17 000 000 женщин, что потребует затрат (цена скринингового теста — 500 руб.) порядка 8 500 000 000 руб (табл. 1)[1, 7, 8].
Таблица 1
Прямой ущерб от одного случая ВПЧ-ассоциированного заболевания
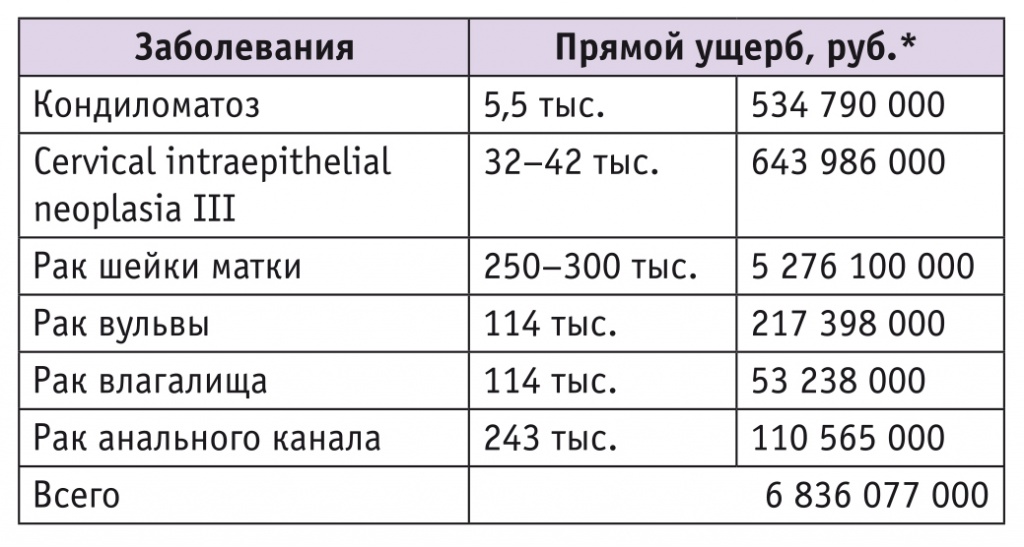
* Расчет по тарифам ОМС и на основе клинических рекомендаций Ассоциации онкологов.
Современный скрининг не только экономически неэффективен и высоко затратен, в нем не соблюдено еще одно важное условие — цитологический метод (РАР-тест) мало чувствителен по отношению к предраку шейки матки. Чтобы преодолеть низкую информативность метода, необходимо или участить рауты обследования, или добавить дополнительные методики, повышающие чувствительность теста, но существенно увеличивающие цену скрининга.
Помимо методологической, в скрининге важна и его организационная составляющая с учетом территориальных различий внутри нашей страны. Большое значение имеет и фактор кадрового обеспечения скрининга: в России недостаточно квалифицированных врачей и лаборантов-цитологов, способных проводить скрининг. Решение этой проблемы затруднено как принципами подготовки специалистов, так и отсутствием в номенклатуре специальностей такой, как врач-цитолог.
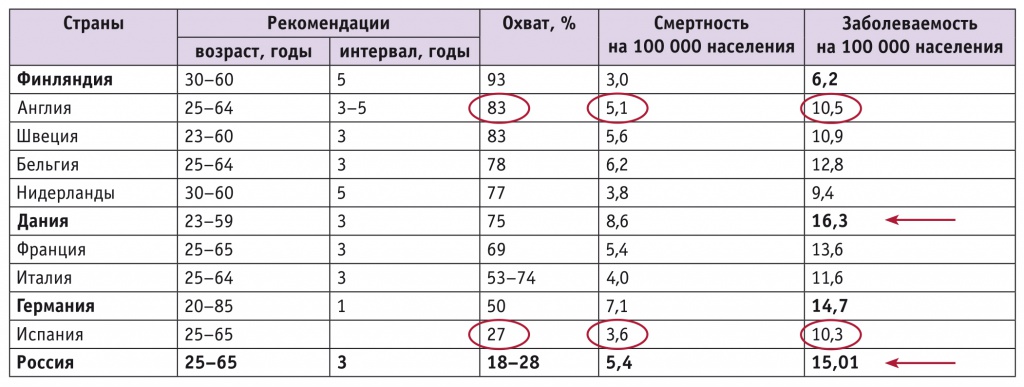
Следует отметить, что за всю историю развития цитологического скрининга идеально его реализовать удалось лишь двум странам: Финляндии и Англии. Сводные данные заболеваемости, смертности и скрининга в Европе представлены в таблице 2[5, 6, 9, 10]. Они ярко иллюстрируют отсутствие существенных различий в показателях заболеваемости и смертности в странах с высоким и низким охватом скрининговыми мероприятиями.
Таблица 2
Скриниг рака шейки матки в странах Европы
Авторы проведенного в Швейцарии крупного национального исследования, касающегося скрининга РШМ, пришли к следующим выводам[11]:
- большое количество конизаций выполняется без необходимости, особенно среди молодых женщин;
- основная проблема, которую необходимо решить для улучшения эффективности скрининга цервикального рака, заключается в привлечении женщин из групп риска к участию в программах скрининга;
- необходимо пересмотреть действующие основные принципы в программах скрининга в соответствии с факторами риска и учитывать необходимость проведения регулярных ВПЧ-тестов, особенно у молодых женщин.
ЗАКЛЮЧЕНИЕ
Мы попытались дать критическую и объективную оценку ситуации с диагностикой рака шейки матки (РШМ) на этапе первичной медико-санитарной помощи. Сегодня наблюдаются:
- выраженная тенденция омоложения больных РШМ;
- высокий удельный вес больных с запущенными стадиями, особенно в группе женщин раннего репродуктивного возраста;
- высокий удельный вес потенциальных репродуктивных потерь;
- низкая чувствительность скринингового теста;
- кадровый дефицит (врачи-цитологи, лаборанты-цитологи, акушерки смотровых кабинетов).
Возникает вопрос: как наиболее эффективно и рационально в краткосрочной перспективе снизить заболеваемость и смертность от РШМ в популяции женщин репродуктивного возраста?
Парадокс заключается в том, что именно при РШМ известен этиологический агент, более того, имеются разновидности профилактических вакцин — для онкологической практики это беспрецедентная ситуация. Тем не менее в рамках национального здравоохранения нам не удалось предусмотреть адекватный маневр, который позволил бы еще лет 10 назад предвидеть и рассчитать развитие этих процессов и вовремя обозначить пути решения проблемы. Нам кажется, что и сегодня стратегические цели и тактические приемы в данном направлении требуют наиболее оптимальных и рациональных решений.
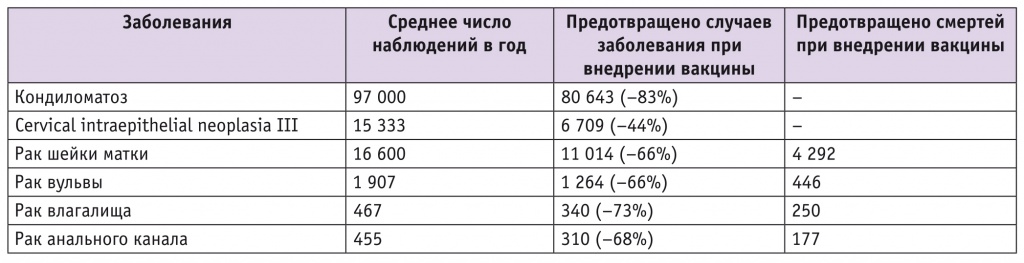
Стратегическим направлением должна стать концепция или глобальная цель — «влагалище должно быть свободно от ВПЧ». При таком подходе мы формируем условия наиболее эффективного снижения распространенности ВПЧ-индуцируемых заболеваний, в том числе и РШМ у молодых. И результаты эти мы можем зафиксировать уже через 5–7 лет. Наши расчеты свидетельствуют о существенной экономической выгоде подобного подхода, что отражено в таблицах 2 и 3[7, 8, 12, 13].
Таблица 3
Перспективы применения вакцинации (охват — 95%)
Другой стратегический рывок связан с развитием эффективной первичной медико-санитарной помощи, ориентированной на выявление ранних онкологических процессов. Следует отметить, что проблема рака репродуктивных органов находится в более благоприятной зоне реализации. Именно гинекологическая служба обеспечена системой женских консультаций, а также развернуты смотровые кабинеты в поликлиниках — это, по сути, уже выстроенная организационная модель, способная при минимальных усилиях заработать в полную силу. Формирование централизованных цитологических лабораторий существенно снизит остроту кадрового дефицита цитологов. Перспективы реальны, но предстоит системная работа, способная качественно изменить раннюю диагностику РШМ. На протяжении многих лет в Национальном медицинском исследовательском центре акушерства, гинекологии и перинатологии имени акад. В.И. Кулакова ведутся исследования, формирующие основу профилактики и ранней диагностики рака репродуктивных органов, которые консолидированы во вновь созданном Институте онкогинекологии и маммологии. Впереди огромное поле деятельности.








