Репродуктивная медицина в XXI веке развивается на фоне ряда социальных и демографических изменений. Популяция неуклонно стареет, и к 2050 году 20% населения планеты будут составлять люди старше 60 лет[1]. Намечается устойчивая тенденция к изменению репродуктивного поведения — отложение реализации репродуктивной функции на более поздний период. В связи с влиянием различных эпигенетических факторов (вредных факторов окружающей среды, особенностей питания и др.) увеличивается доля молодых женщин (до 40 лет) с преждевременным выключением функции яичников, для которых достижение беременности с использованием собственных яйцеклеток, даже с применением методов вспомогательной репродукции, становится невозможным. Ученые всего мира проводят поиск новых методов восстановления репродуктивной функции у пациентов позднего репродуктивного возраста или с преждевременным выключением репродуктивной функции.
Репродуктивное долголетие — неотъемлемая составляющая высокого качества жизни, его обеспечение сегодня возводится в ранг государственной программы. К возможностям восполнения утраченного репродуктивного потенциала можно отнести ряд экспериментальных технологий, таких как получение искусственного эмбриона in vitro, раннее развитие которого повторило этапы естественного эмбриогенеза; создание искусственных гамет из стволовых клеток с естественной или индуцированной плюрипотентностью[2, 3]. Технологии, широко применяемые клинически, в том числе криоконсервация генетического материала, донорские программы и суррогатное материнство, — действенный инструмент в руках специалистов для сохранения репродуктивного долголетия.
Преждевременная недостаточность яичников (ПНЯ) — клинический синдром, объединяющий гетерогенную группу заболеваний, при котором непосредственно овариальная недостаточность может быть следствием различных причин с большой вероятностью вклада наследственности. Под ПНЯ понимают гипогонадизм в возрасте до 40 лет у женщин, ранее имевших нормальный менструальный цикл. Диагноз ПНЯ верифицируеют после установления повышенного уровня ФСГ (> 25 МЕ/л) по результатам минимум двух анализов с интервалом 4 недели[4].
Частота ПНЯ сейчас, по данным разных авторов, колеблется от 1% до 13%[5].
Помимо жалоб, обусловленных дефицитом женских половых гормонов, которые нивелируются путем назначения заместительной гормональной терапии, в репродуктивном возрасте ведущей социально значимой жалобой является бесплодие, зачастую резистентное к стандартным методам лечения.
Таким образом, проблема сохранения и реализации репродуктивного потенциала у пациенток с ПНЯ имеет особое значение; успешная реализация программы ЭКО отмечена лишь у 6% из них[6].
На современном этапе решение проблемы бесплодия у женщин с ПНЯ невозможно без репродуктивной хирургии.
Впервые метод активации фолликулярного роста, подразумевающий хирургическое воздействие, был предложен K. Kawamura и соавт., которые описали активацию in vitro остаточных фолликулов при помощи индуцированных изменений в системе сигнальных путей (PI3K-Akt-Foxo3, PTEN) и предложили его как альтернативный донорским программам метод лечения бесплодия у пациенток с ПНЯ. Изначально методика японских исследователей предполагала проведение односторонней овариоэктомии с последующим этапом демедулляции под гистологическим контролем, криоконсервации коркового слоя яичниковой ткани, его фрагментации и двухдневной активации in vitro (добавление в среду ингибитора PTEN и активатора PI3K-сигнальных путей). Далее производится ипсилатеральная трансплантация фрагментированной размороженной ткани под серозную оболочку маточной трубы лапароскопическим доступом[7].
В исследовании K. Kawamura и соавт. участвовали 152 пациентки (возраст — 37,4 ± 4,9 года) с ПНЯ, длительность аменореи составляла 5,7 ± 3,5 года. У 116 пациенток проведена аутотрансплантация фрагментированной ткани яичников; рост фолликулов обнаружен у 70 из 116 женщин, имевших остаточные фолликулы (по данным гистологического исследования).
Перенос эмбриона в рамках криопротокола ЭКО произведен 28 пациенткам; у 10 из них наступила беременность, которая завершилась живорождениями в 6 случаях и самопроизвольным прерыванием беременности в 4 случаях. Показатели эмбриологического этапа (получение зрелых ооцитов, частота оплодотворения, дробления, культивация эмбриона до 5-х суток развития) не уступают таковым при стандартной программе ЭКО[8].
Соавторами также ведется поиск возможных неинвазивных способов активации фолликулярного роста с использованием метаболитов структур клеточных мембран, коим является сфингозин-1-фосфат, который нарушает передачу сигнала по Hippo пути в ранних фолликулах, стимулируя ядерную транслокацию Yes-ассоциированного белка (YAP) в клетках гранулезы путем увеличения экспрессии фактора роста CCN2, что приводит к стимуляции созревания вторичных фолликулов.
В проведенном японскими учеными исследовании культивирование овариальной ткани с добавлением в среду сфингозин-1-фосфата приводило к повышению экспрессии фактора роста CNN и росту вторичных фолликулов. Существует соответствующий патент на изобретение: PCT/US2013/059800[9].
Дальнейшие молекулярно-генетические исследования показали, что сама по себе процедура фрагментации овариальной ткани приводит к инактивации Hippo сигнального пути с последующим ростом первичных фолликулов вне всякого фармакологического воздействия, что позволило не только сократить объем операции до биопсии коры яичника, но и применять методику у пациенток с «бедным» овариальным ответом яичников на стимуляцию. Данная модификация была также предложена K. Kawamura и описана в литературе как drug-free in vitro activation[10].
Благодаря такому варианту использования методики, именуемой ovarian fragmentation for follicular activation, испанским исследователям удалось добиться 3 спонтанных беременностей у 14 пациенток[11].
Одним из фундаментальных обоснований механизма хирургического воздействия в рамках описанной методики является влияние фрагментации ткани яичников на полимеризацию актина, прекращение передачи сигнала по пути Hippo, повышение концентрации факторов роста CCN и ингибиторов апоптоза BIRС 1, 7[12].
Исследователями во главе с F. Fabregues, представляющими Institut Clinic of Gynecology, Obstetrics and Neonatology, Institut d’Investigacions Biomèdiques August Pi I Sunyer (Барселона), применена хирургическая методика drug-free in vitro activation для активации функции яичников у пациентки с ПНЯ с последующим достижением беременности. Отличительными особенностями операции стали модификация процесса реимплантации, который, помимо интраовариального доступа, был выполнен подбрюшинно, и использование полимерного состава N-Hexyl-2-Cyanoacrylate как альтернативы шовного материала[13].
В качестве активаторов фолликулогенеза в ряде исследований, в том числе под руководcтвом A. Pellicer, применены стволовые клетки, однако заслуживает внимания хирургический (эндоваскулярный) способ их доставки прецизионно в яичниковые сосуды. В одной из последних работ оценивалось влияние трансплантации аутологичных стволовых клеток, мобилизованных из костного мозга (ASCOT), путем инфузии (BMDSC) в яичниковые сосуды. У 81% из 17 женщин с «бедным» овариальным ответом на стимуляцию функции яичников при предыдущих попытках ЭКО инфузия стволовых клеток привела к увеличению числа антральных фолликулов и повышению уровня антимюллерова гормона (АМГ). Влияние инфузии стволовых клеток распространялось также на контрлатеральный яичник, опосредуя вышеописанные эффекты.
В результате данного исследования забеременели 5 женщин, 3 из них — самопроизвольно[14]. Это свидетельствуют о том, что фолликулярный рост можно индуцировать при использовании стволовых клеток, мобилизованных из костного мозга. Описанный эффект может быть связан со способностью овариальной ткани к аттракции недифференцированных стволовых клеток, в частности костномозгового происхождения.
Цель исследования: представить опыт ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова» Министерства здравоохранения Российской Федерации комплексного лечения бесплодия у пациенток с ПНЯ и «бедным» ответом на стимуляцию функции яичников.
МАТЕРИАЛЫ И МЕТОДЫ
Впервые в России 06.03.2019 г. в ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова» Минздрава России проведена операция, направленная на восстановление репродуктивного потенциала у пациентки 36 лет, страдавшей ПНЯ.
В настоящее время проведен ретроспективный анализ результатов 15 гистологических исследований образцов овариальной ткани, полученных в результате проведения хирургического вмешательства в рамках комплексного лечения бесплодия у восьми пациенток с ПНЯ и семи с «бедным» ответом на стимуляцию функции яичников в ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова». Все женщины подписали добровольное информированное согласие на участие в исследовании.
На дооперационном этапе все пациентки проходили общеклиническое, эхографическое, клинико-лабораторное обследование. Всем участницам выполнено оперативное вмешательство в следующем объеме: лапароскопия, ревизия органов малого таза, биопсия коркового слоя обоих яичников с последующей его фрагментацией и одноэтапной реимплантацией в толщу яичника, гистероскопия, биопсия эндометрия, хромогидротубация.
Для гистологической верификации состояния резерва яичниковой ткани исследовалось 10–20% объема каждого фрагмента биоптата яичников.
Состояние овариального резерва всех обследованных оценено с помощью УЗИ органов малого таза в режиме 3D-сканирования, измерения концентрации АМГ в сыворотке крови, подсчета количества фолликулов (КАФ) различных стадий развития и оценки их качества на гистологических срезах биоптатов яичников. УЗИ выполняли на 2–3-й день менструального цикла с помощью ультразвукового аппарата экспертного класса Voluson E10 (GE, США) по стандартной методике с транвагинальным датчиком (3,7–9,3 МГц): подсчитывали количество антральных фолликулов (2–5 мм в диаметре), определяли объем яичника (V).
Оценили состояние овариального резерва у всех пациенток по ультразвуковым параметрам, сравнивая V (см3) яичников и КАФ до проведения хирургического лечения и в процессе динамического наблюдения, в том числе через месяц.
Забор крови для определения концентраций АМГ, ФСГ, ЛГ и эстрадиола выполняли перед оперативным вмешательством, используя метод ИФА (ELISA) с оценкой динамики гормонального статуса пациенток до и после хирургического лечения.
Для определения состояния ооцит-фолликулярной системы яичников исследовалось 10–20% объема каждого фрагмента биоптата яичников во время вышеописанного оперативного вмешательства.
Биоптаты объемом 0,3 см3 фиксировали в 10%-ном растворе нейтрального формалина в течение 24 часов, после стандартного протокола гистологической проводки материал заливали в парафин. Далее серийные срезы толщиной 4–5 мкм окрашивали гематоксилином и эозином. Исследование гистологических препаратов проводили на световом микроскопе при увеличении от ×50 до ×400.
Гистологическое исследование биоптатов яичников выполняли в ФГБУ «НМИЦ АГП им. акад. В.И. Кулакова», в патолого-анатомическом отделении (заведующий отделением — д. м. н., профессор Щеголев А.И.) с помощью микроскопа Axio Scope A1 (Сarl Zeiss, Германия). Подсчет числа примордиальных и растущих, полостных фолликулов, оценку состояния структур ооцитов осуществляли по методу, разработанному для парафиновых срезов яичников при увеличении микроскопа в 100 и 400 раз[6]. Подсчет числа растущих фолликулов производился согласно международной гистологической номенклатуре[7].
Установили ассоциацию количества примордиальных фолликулов с возрастом, наличием сопутствующих гинекологических и экстрагенитальных заболеваний, а также с клинико-лабораторными характеристиками обследуемых пациенток.
Проведен анализ объема яичников, количества антральных фолликулов и концентрации АМГ в сыворотке крови; сопоставлены ультразвуковые параметры и уровень АМГ с количеством фолликулов разных стадий развития на срезах биоптатов яичников.
При гистологическом исследовании в среднем на один биоптат объемом 0,3 см3 приходилось 3–4 серийных среза толщиной 4–5 мкм. Общее число проанализированных срезов у всех пациенток — 60. На срезах подсчитывали количество примордиальных, первичных однослойных, первичных двух-трехслойных, многослойных — вторичных преантральных, вторичных малых антральных фолликулов, измеряли их диаметр, оценивали состояние ооцитов в них.
РЕЗУЛЬТАТЫ
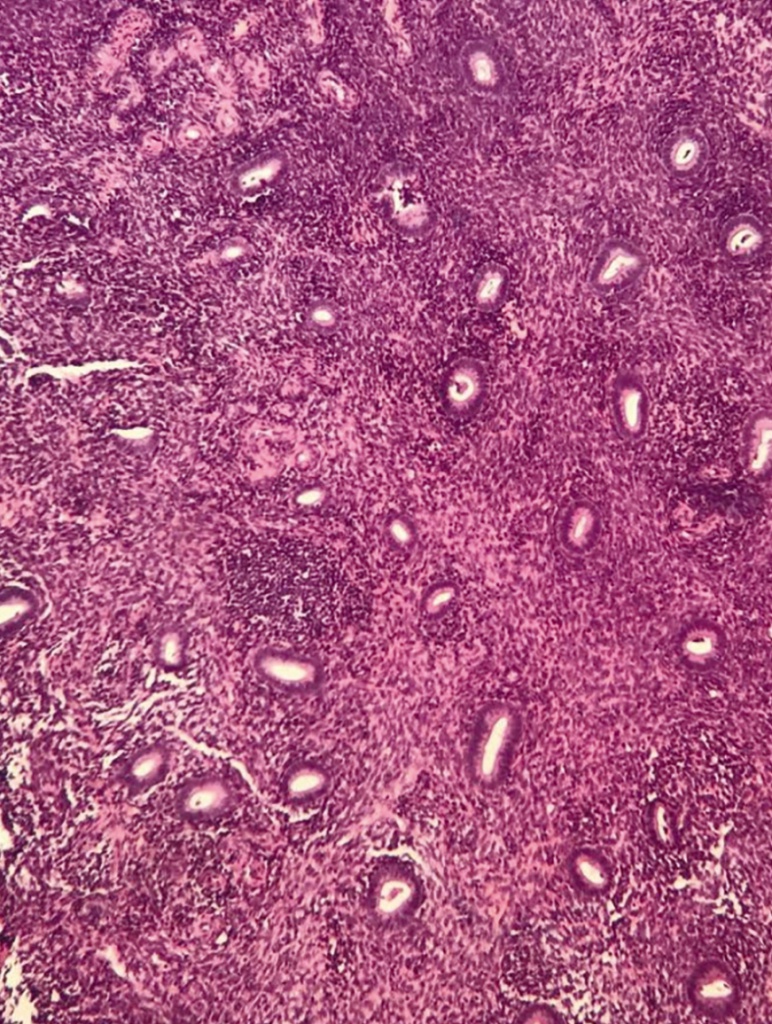
Ткань яичников у обследованных пациенток характеризовалась наличием утолщенной белочной оболочки, плотной (цитогенной) стромы коркового слоя, единичными толстостенными сосудами, более чем в половине случаев фолликулярный аппарат не визуализировался. Более чем у 30% пациенток отмечены признаки хронического эндометрита в виде рассеянной и очаговой инфильтрации лимфоцитами в строме, в том числе вокруг желез, фиброзных изменений в строме и расстройства кровообращения на отдельных участках (рис. 1), что указывает на многофакторную природу бесплодия у большинства обследованных женщин и диктует необходимость комплексного подхода к тактике их ведения.
Рис. 1. Гистологические признаки хронического эндометрита у пациентки с классической преждевременной недостаточностью яичников. Здесь и далее в статье иллюстрации авторов
У пациенток с верифицированным диагнозом ПНЯ количество примордиальных фолликулов было значимо меньше (0–1 в биоптате), чем у женщин с «бедным» ответом на стимуляцию функции яичников (до трех в биоптате), что также значимо коррелирует с возрастом и соответствует литературным данным.
У 9 из 15 участниц ни одного примордиального и растущего фолликула не обнаружено во всем биоптате. У пациенток с ПНЯ наблюдался выраженный фиброз стромы яичниковой ткани с незначительным количеством или отсутствием примордиальных и растущих фолликулов.
У пациенток с интраоперационно обнаруженным наружным генитальным эндометриозом ни одного примордиального и растущего фолликула не было обнаружено во всем объеме биоптата.
Наличие в биоптате примордиальных фолликулов имеет прямую связь с клинико-лабораторными данными пациенток, проанализированными на дооперационном этапе: сохранностью ритма менструаций, анамнезом бесплодия, уровнями гонадотропинов, АМГ и эстрадиола на 2-й день менструального цикла, ультразвуковыми параметрами овариального резерва.
Проанализированы результаты программы ЭКО у 12 пациенток после вышеописанного оперативного вмешательства. При сопоставлении данных гистологического исследования с результативностью последующей программы ВРТ установлено: у всех женщин с отмеченным фолликулярным ростом на фоне стимуляции функции яичников выявлен хотя бы один примордиальный фолликул в объеме исследованного биоптата, а также стигмы функциональной активности разной степени давности в виде желтых и белых тел.
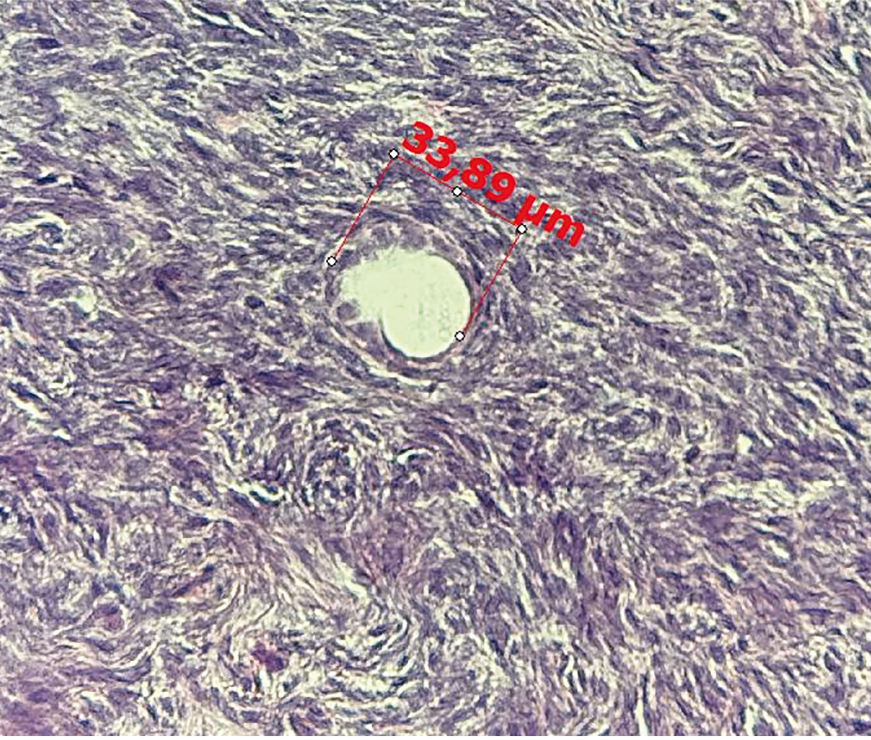
При гистологической оценке фолликулярного аппарата, представленного в полученном объеме биоптата коркового слоя яичников, были определены первичные однослойные фолликулы диаметром от 33,89 до 40,39 мкм, в одном из которых визуализировался ооцит в стадии диктиотены (рис. 2, 3). Полученная характеристика фолликулярного аппарата свидетельствует о благоприятном прогнозе с позиции наступления беременности, так как, по данным Л.Ф. Курило и соавт., большое значение для репродуктивных исходов имеет наличие в яичниках примордиальных фолликулов, первичных однослойных фолликулов средним диаметром менее 62 мкм[9].
Рис. 2. Два первичных однослойных фолликула у пациентки с биохимической преждевременной недостаточностью яичников, один из которых содержит ооцит в стадии диктиотены
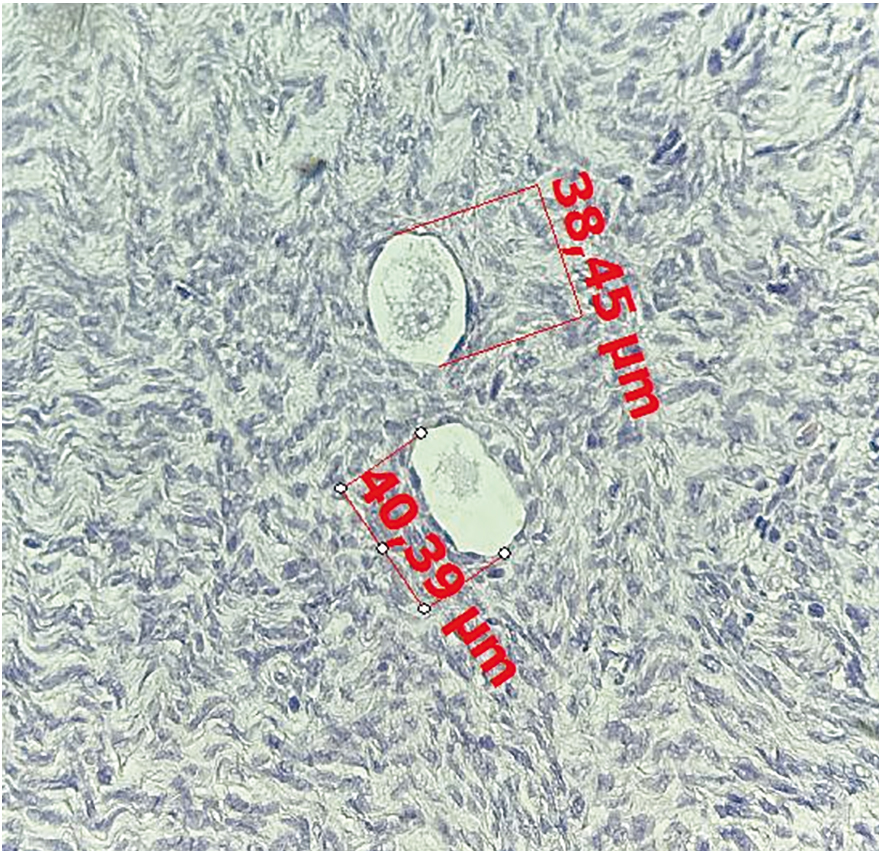
Рис. 3. Первичный однослойный фолликул у пациентки с биохимической преждевременной недостаточностью яичников
Гистологическое подтверждение функциональной активности яичников, полученное в ходе данного исследования, значимо коррелировало с получением клеточного материала в цикле ЭКО. Шесть ооцитов получены у пяти пациенток, что привело к развитию четырех бластоцист хорошего и отличного качества. У одной из пациенток после операции отмечен фолликулярный рост в естественном менструальном цикле с получением при трасвагинальной пункции одного ооцита, однако при эмбриологической характеристике установлено, что яйцеклетка является дегенеративной и непригодна для оплодотворения. Это, по-видимому, можно объяснить наличием наружного генитального эндометриоза, подтвержденного гистологически, что согласуется с данными литературы[15].
Необходимо проведение дальнейших исследований на больших выборках пациенток с целью объективизации полученных прелиминарных данных и проведения полноценного статистического анализа.
ЗАКЛЮЧЕНИЕ
Преодоление стойкого бесплодия как одной из ведущих жалоб у пациенток с преждевременной недостаточностью яичников становится возможным при своевременной постановке вопроса о реализации репродуктивных планов и при применении минимально инвазивной хирургии и ВРТ, использование которых при данной нозологии обосновано результатами молекулярно-генетических исследований.








