ВВЕДЕНИЕ
По данным Всемирной организации здравоохранения, ежегодно в мире более 340 млн мужчин и женщин в возрасте 15–49 лет впервые инфицируются распространенными бактериальными и протозойными инфекциями, передаваемыми половым путем (ИППП): сифилисом, гонореей, хламидийной инфекцией и трихомониазом[1]. ИППП представляют в современном обществе значимую не только медико-социальную, но и психологическую проблему[2, 3]. На сегодняшний день течение урогенитальных инфекций отличается бессимптомными или стертыми формами, но при этом ИППП не становятся менее опасными и могут вызывать тяжелые осложнения, такие как бесплодие, внематочная беременность, хронические болезни, внутриутробное поражение плода, врожденная патология и болезни у новорожденных детей[4].
Течение инфекционных заболеваний женской половой сферы (ЖПС), вызванных этими возбудителями, наличие атипичных или бессимптомно протекающих форм, стертость клинических проявлений, рецидивирующий характер заболевания приводят к длительному хроническому течению и дальнейшему их распространению. Развитие заболевания зависит не только от патогенности и вирулентности инфекционного агента, но и от состояния иммунитета человека[5]. В частности, при урогенитальной микст-инфекции регистрируются выраженные нарушения иммунорегуляции, связанные с угнетением уровня Т-звена и интерферонного статуса пациента[6].
Папилломавирусная инфекция (ПВИ) человека — одна из самых распространенных инфекций в современном мире[7]. Течение ПВИ зависит от состояния иммунной системы и может быть транзиторным, латентным или персистирующим, а клиническая картина обусловлена типом вируса и состоянием иммунитета. Значение ПВИ очень важно в развитии предопухолевых и опухолевых процессов ЖПС, в первую очередь рака шейки матки[8]. Цитологические и морфологические исследования данной патологии являются неотъемлемым звеном в персонализированной диагностике[9, 10].
Герпес-вирусные инфекции — группа инфекционных заболеваний, вызываемых представителями семейства герпес-вирусов (Herpesviridae). Основной возбудитель генитального герпеса — вирус простого герпеса (ВПГ) 2 типа — обладает тропизмом к эпителиальным клеткам и поражает слизистые оболочки области половых органов[11]. Этот тип заболевания характеризуется наиболее выраженными клиническими проявлениями. У женщин чаще всего поражаются вход во влагалище, устье мочеиспускательного канала или половые губы, у 70% женщин диагностируют цервицит. Выделяют первичный генитальный герпес и рецидивирующий генитальный герпес. Наибольшая распространенность ВПГ наблюдается у женщин репродуктивного возраста, что стало серьезной проблемой здравоохранения в связи с потенциальной опасностью передачи вируса от матери к плоду или новорожденному[3–5]. Наряду с типичной клинической картиной заболевания для диагностики герпетической инфекции, помимо молекулярно-генетической и серологической диагностики, необходимы цитоморфологические методы[9, 10, 12].
Урогенитальная хламидийная инфекция — высококонтагиозное инфекционное заболевание, поражающее преимущественно мочеполовую систему, вызываемое определенными серотипами Chlamydia trachomatis, ведущее к развитию воспалительных изменений органов мочеполовой системы[13]. Хламидии — это грамотрицательные (иногда грамвариабельные) кокковидные бактерии. Хламидии являются облигатными внутриклеточными паразитами, обладающими тропизмом к клеткам цилиндрического, а возможно, и переходного эпителия. У 40% женщин нелеченая хламидийная инфекция приводит к развитию воспалительных заболеваний органов малого таза, а у каждой четвертой из них — к бесплодию[14]. Самая частая клиническая форма — хламидийный цервицит, протекающий у большинства женщин (до 80%) бессимптомно и лишь у 20% пациенток регистрируются клинические проявления[13, 14]. Следует отметить, что симптомы урогенитальной хламидийной инфекции не являются специфичными, что говорит о необходимости проведения дифференциальной диагностики с кандидозом, бактериальным вагинозом и уреаплазменной инфекцией[15]. Цитологические и морфологические исследования в диагностике этой инфекции являются вторичными, однако не могут быть не отмечены цитоморфологом при исследовании материала пациентки[11, 16].
В России доля урогенитального трихомониаза составляет более 40% зарегистрированных случаев ИППП. Возбудителем урогенитального трихомониаза является Trichomonas vaginalis — подвижный одноклеточный организм, приспособившийся в процессе эволюции к жизни в органах мочеполовой системы человека. У женщин трихомонады поражают большие вестибулярные железы, преддверие влагалища и само влагалище, могут обнаруживаться в полости матки, маточных трубах. Возможно трихомонадоносительство, поскольку 10–50% трихомонадных инфекций протекают бессимптомно. Хронический мочеполовой трихомониаз представляет собой смешанный протозойно-бактериальный процесс, поскольку трихомонада является резервуаром для хламидий, уреаплазм, гонококков, стафилококков и другой флоры. Только у 10,5% больных трихомониаз протекает как моноинфекция, в 89,5% случаев выявляют смешанные трихомонадные инфекции в различных комбинациях[1–3].
По данным различных авторов, от 15–20 до 40–45% инфекционных поражений ЖПС обусловлены грибковой инфекцией[1]. Поражение чаще всего вызывается дрожжеподобными грибами рода Candida, которые являются гормонозависимым возбудителем и часто обнаруживаются при снижении уровня эстрогенов и высоком уровне прогестеронов. Характерным свойством этого вида возбудителя является также кислотоустойчивость, поэтому различные формы вегетации гриба часто обнаруживаются на фоне обилия лактобацилл. Кроме того, в цитологических мазках и морфологическом материале нередко встречаются другие виды грибов (C. glabrata, мукоры, аспергиллы)[1, 17–19].
Принимая во внимание чрезвычайную актуальность проблемы своевременной диагностики и адекватной коррекции патологии эндоцервикса, отсутствие четких цитоморфологических параллелей с клиническими данными, весьма значимый практический и научный интерес представляет сопоставление результатов цитоморфологического исследования с данными диагностики при помощи полимеразной цепной реакции. Это позволит расширить возможности трактовки цитологического метода как первичного исследования для дальнейшей диагностики и лечения.
Цель исследования — провести анализ результатов цитоморфологических исследований урогенитального тракта женщин с ИППП разной этиологии и оценить их значимость для персонализированного подхода в лечении.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было выполнено на базе ЧУЗ «КБ РЖД-Медицина» г. Ростов-на-Дону. Комплексное цитоморфологическое исследование, включавшее данные по 335 пациентам женского пола (средний возраст 31,6 ± 8,2 года) с неосложненной урогенитальной хламидийной (n = 18), герпетической (n = 26), микотической (n = 41) инфекциями, ПВИ (n = 97), трихомониазом (n = 12) и смешанными формами инфекционного поражения (n = 141), проходивших обследование и дальнейшее лечение в ЧУЗ «КБ РЖД-Медицина» г. Ростова-на-Дону.
Для цитологических исследований пробоподготовка и окрашивание образцов биологического материала осуществлялись с использованием традиционного метода подготовки мазков и автоматизированной системы BD PrepStain и CeLLPrep. Для морфологических исследований была использована автоматизированная система гистологического анализа с использованием аппаратно-программного модуля Leica Application Suite (LAS) на базе микроскопа Leica DM4000B c цифровой камерой Leica DFC490, предназначенная для измерения параметров тканевых и клеточных структур в автоматическом режиме.
Проанализированы материалы традиционной (окраска по Романовскому–Гимзе), жидкостной цитологии (окраска по Папаниколау) и биопсий (классическая гистология с дополнительными гистохимическими окрасками). По данным историй болезни и амбулаторных карт все пациентки имели адекватный протокол кольпоскопии.
Молекулярно-генетическая диагностика инфекционных заболеваний ЖПС выполнена на детектирующем амплификаторе ДТ-96 «ДНК-технологии» методом полимеразной цепной реакции.
РЕЗУЛЬТАТЫ
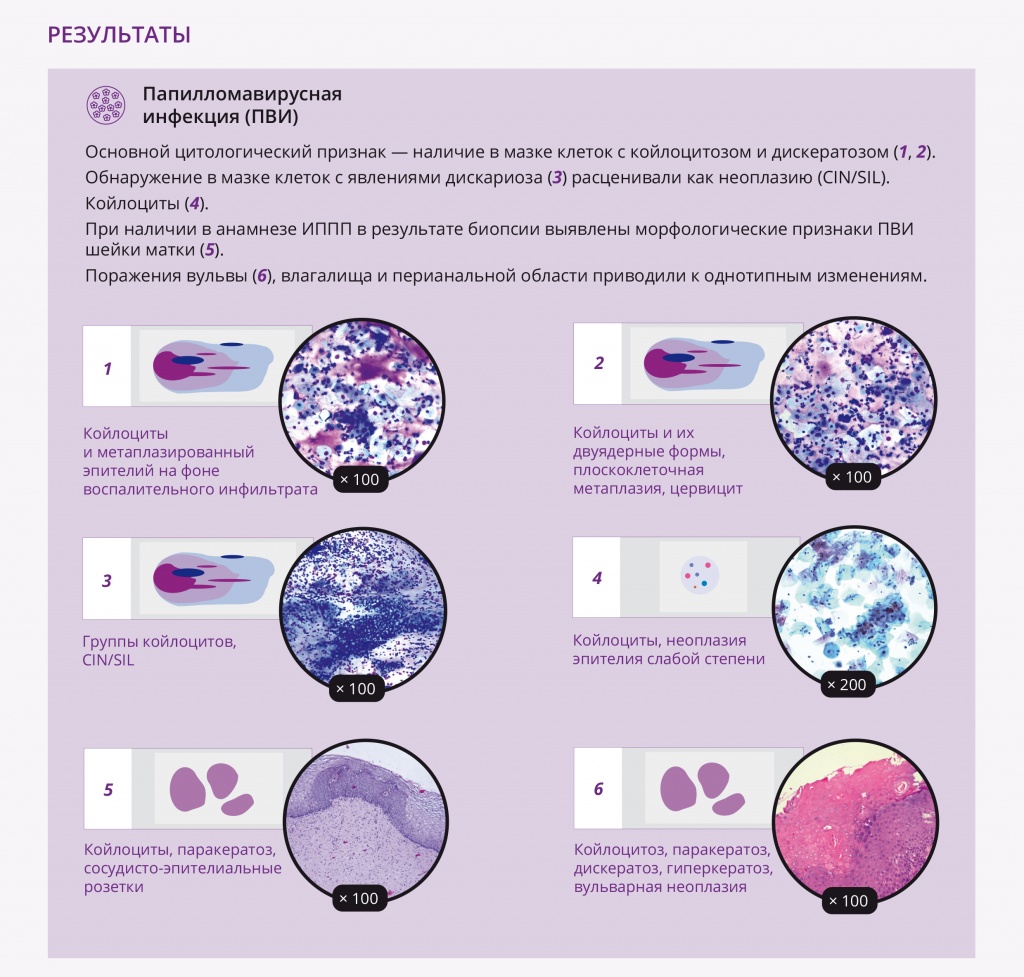
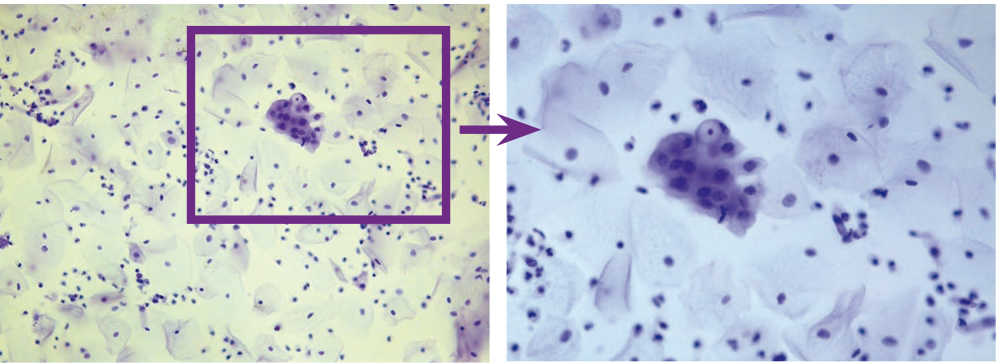
У женщин поражения, вызванные ПВИ, локализовались на шейке матки, вульве, в промежности, перианальной области, стенках влагалища. Субклинические формы ПВИ характеризовались наличием единичных групп койлоцитов на фоне изменений многослойного плоского и метаплазированного эпителия, включая дискератоз, паракератоз, базальноклеточную гиперплазию, цервицит. Основной цитологический признак ПВИ — наличие в мазке клеток с койлоцитозом и дискератозом (рис. 1, 2). Обнаружение в мазке клеток с явлениями дискариоза (рис. 3) расценивали как неоплазию (CIN/SIL).
Рис. 1. Традиционная цитология: койлоциты и метаплазированный эпителий на фоне воспалительного инфильтрата; × 100. Здесь и далее в статье иллюстрации авторов
Рис. 2. Традиционная цитология: койлоциты и их двуядерные формы, плоскоклеточная метаплазия, цервицит; × 100
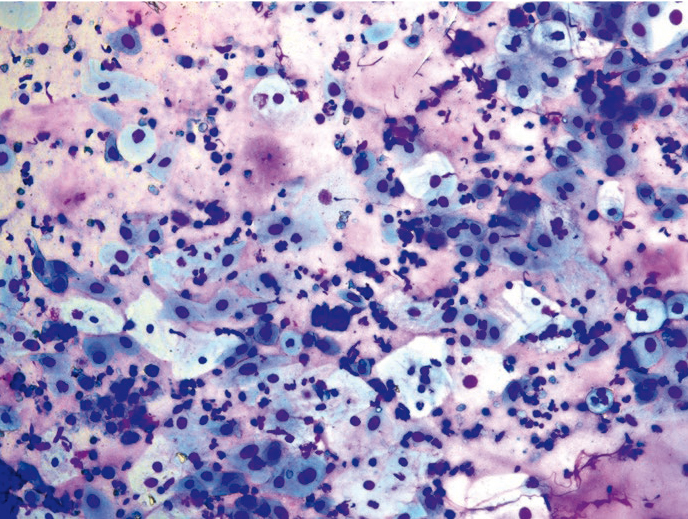
Рис. 3. Традиционная цитология: группы койлоцитов, CIN/SIL; × 100
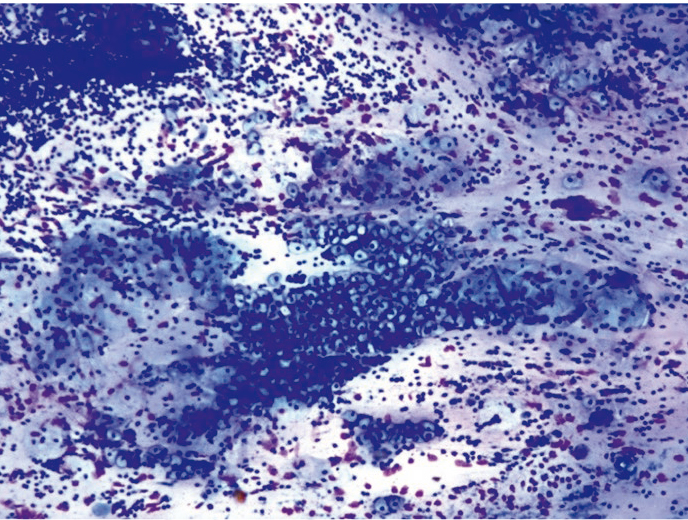
Койлоциты образуются в результате цитоплазматического эффекта ВПЧ и в классическом варианте представляют собой клетки многослойного плоского эпителия преимущественно промежуточного типа с незначительно увеличенными ядрами и обширной околоядерной зоной просветления за счет дегенеративных изменений и некроза разрушенных цитоплазматических органелл (рис. 4).
Рис. 4. Жидкостная цитология: койлоциты, неоплазия эпителия слабой степени; × 200
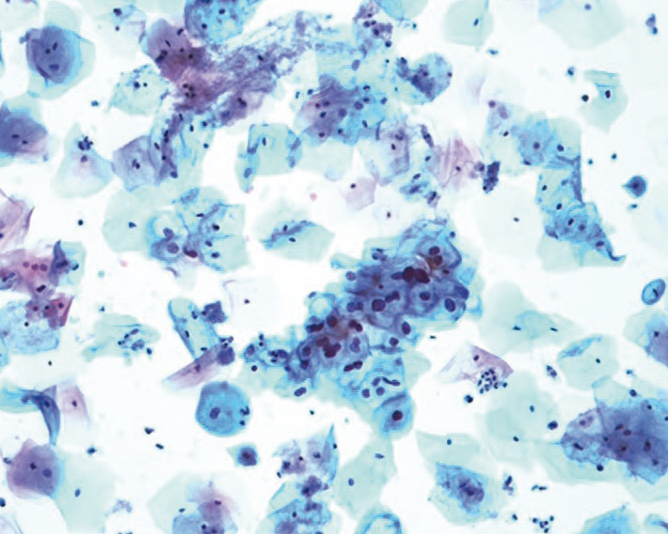
При наличии в анамнезе ИППП возникает необходимость выявления сопутствующих генитальных инфекций и дисбиоза влагалища. Прицельная биопсия шейки матки и выскабливание слизистой оболочки цервикального канала с морфологическим исследованием проводились при выявлении клеток с признаками неоплазии при цитологическом исследовании, при выраженных и слабовыраженных кольпоскопических признаках заболеваний, ассоциированных с ПВИ.
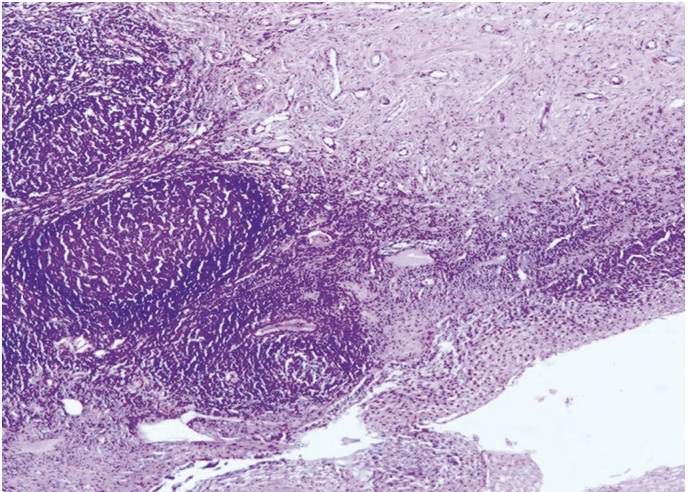
В результате выявлены морфологические признаки ПВИ шейки матки: экзофитные и обычные плоские кондиломы с характерными изменениями в виде дискератоза, паракератоза, вакуолизации и акантоза, формирование сосудисто-эпителиальных розеток, признаки воспалительных изменений, дисплазии различной степени (рис. 5, 6). Поражения вульвы, влагалища и перианальной области приводили к однотипным изменениям, которые мы наблюдали в шейке матки (рис. 7).
Рис. 5. Микроскопическая картина шейки матки: койлоциты, паракератоз, сосудисто-эпителиальные розетки. Окраска гематоксилином и эозином, × 100
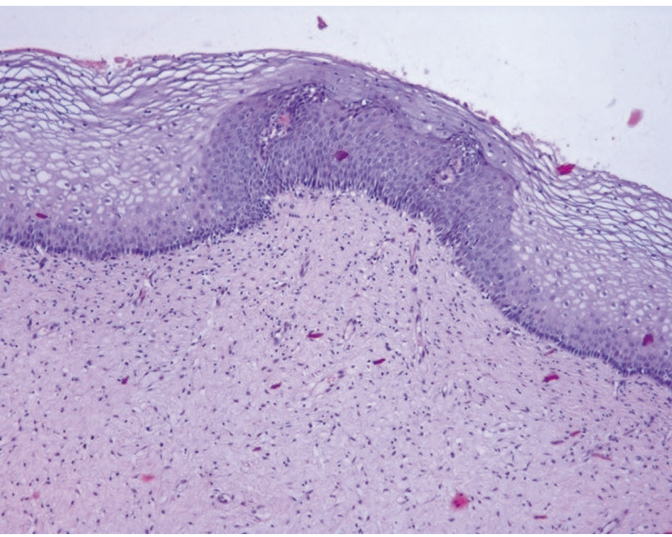
Рис. 6. Микроскопическая картина шейки матки: койлоциты, паракератоз, дискариоз, неоплазия эпителия. Окраска гематоксилином и эозином, × 200
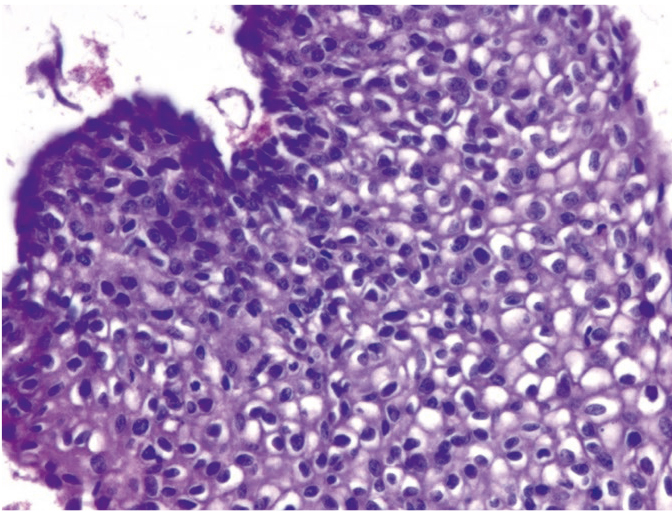
Рис. 7. Микроскопическая картина вульвы: койлоцитоз, паракератоз, дискератоз, гиперкератоз, вульварная неоплазия. Окраска гематоксилином и эозином, × 100
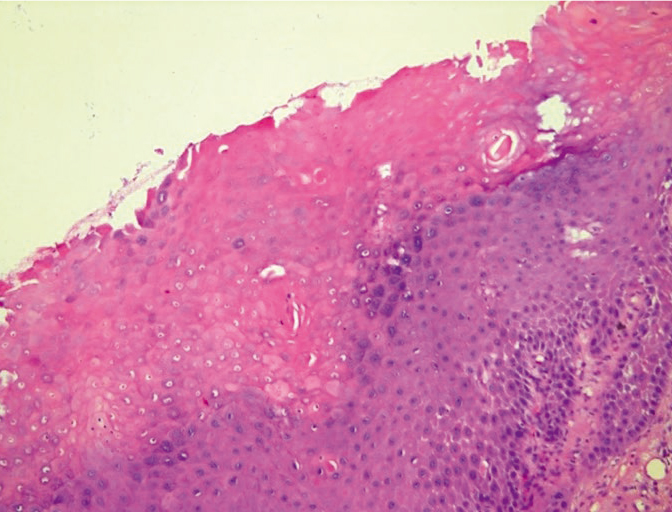
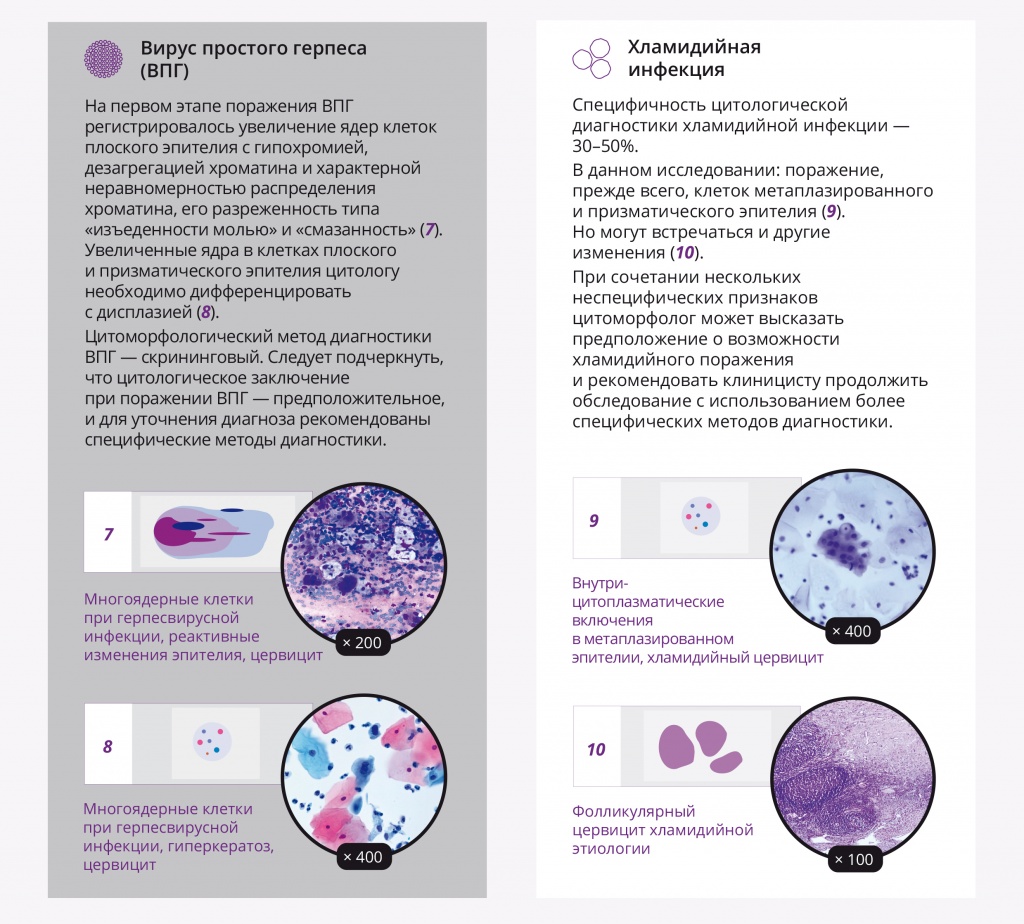
Цитоморфологический метод диагностики ВПГ является скрининговым. На первом этапе поражения ВПГ регистрировалось увеличение ядер клеток плоского эпителия с гипохромией, дезагрегацией хроматина и характерной неравномерностью распределения хроматина, его разреженность типа «изъеденности молью» и «смазанность» (рис. 8, 9).
Рис. 8. Жидкостная цитология: многоядерные клетки при герпесвирусной инфекции, реактивные изменения эпителия, цервицит; × 200
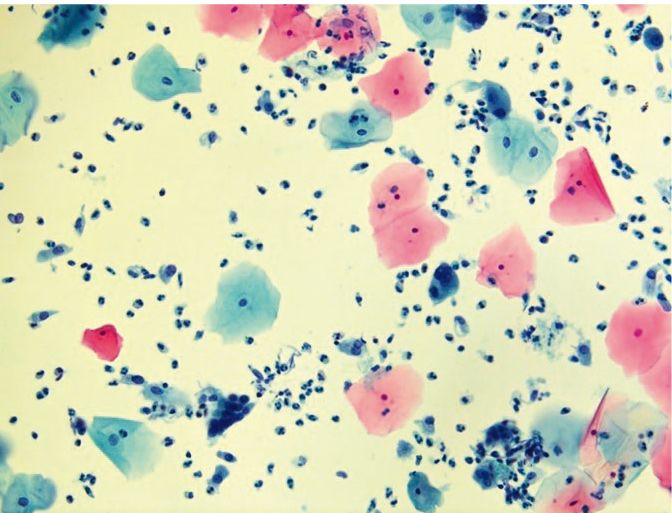
Рис. 9. Традиционная цитология: многоядерные клетки при герпесвирусной инфекции, реактивные изменения эпителия, цервицит; × 200
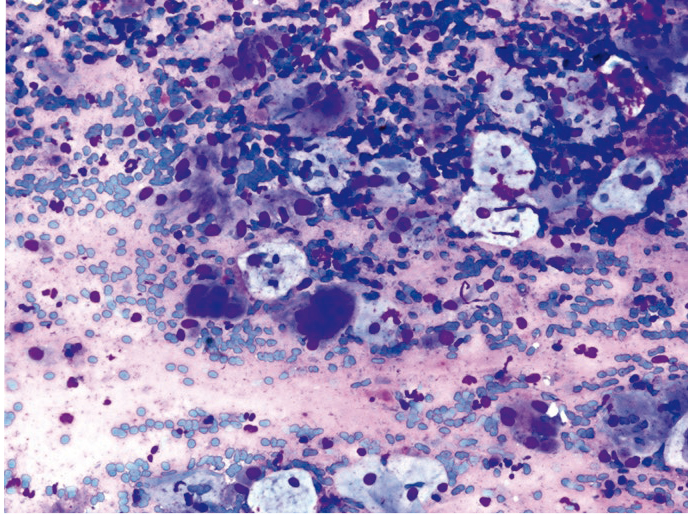
Увеличенные ядра в клетках плоского и призматического эпителия цитологу необходимо дифференцировать с дисплазией (многоядерные клетки больших размеров с характерным «нагромождением ядер»; рис. 10, 11). Фон мазков при герпетическом поражении представлен нейтрофильными гранулоцитами, макрофагами и лимфоцитами. Следует подчеркнуть, что цитологическое заключение при поражении ВПГ — предположительное, и для уточнения диагноза рекомендованы специфические методы диагностики.
Рис. 10. Жидкостная цитология: многоядерные клетки при герпесвирусной инфекции, реактивные изменения эпителия, цервицит; × 400
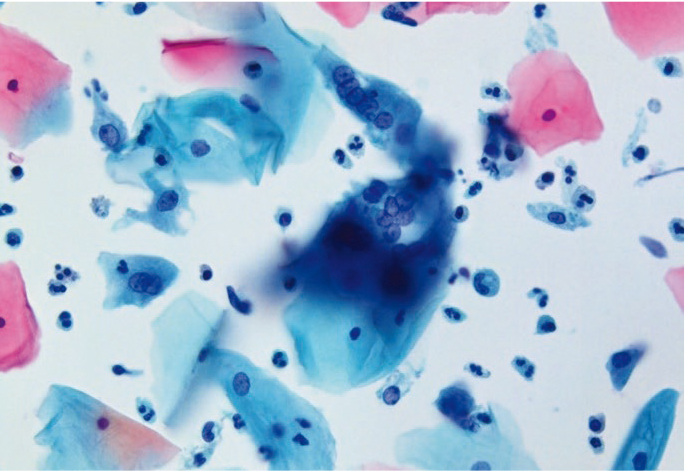
Рис. 11. Жидкостная цитология: многоядерные клетки при герпесвирусной инфекции, гиперкератоз, цервицит; × 400
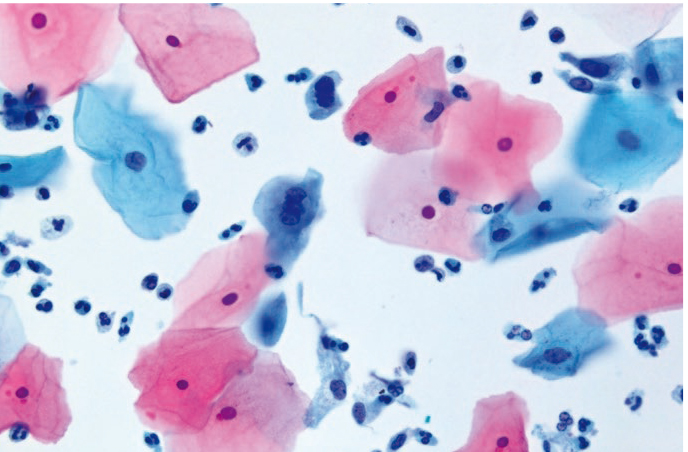
Специфичность цитологической диагностики хламидийной инфекции составляет 30–50%. В нашем исследовании регистрировалось поражение, прежде всего, клеток метаплазированного и призматического эпителия, в цитоплазме которых светооптически выявлялись крупные вакуоли с центральным «мишеневидным» включением либо вакуоли с многочисленными мелкими азурофильными включениями (рис. 12, 13).
Рис. 12. Жидкостная цитология: внутрицитоплазматические включения в метаплазированном эпителии, цервицит; × 200, × 400
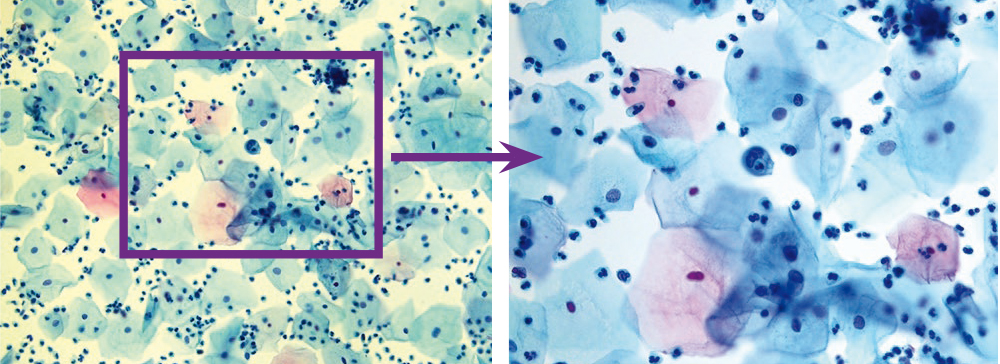
Рис. 13. Жидкостная цитология: внутрицитоплазматические включения в метаплазированном эпителии, хламидийный цервицит; × 200, × 400
Описанные изменения не являются строго специфичными для хламидийной инфекции. Некоторые авторы считают, что хламидии вообще не размножаются в нормально функционирующем плоском эпителии, а также проявляют высокую чувствительность к кислой среде влагалища, поэтому, вероятнее всего, хламидийный кольпит развивается вторично[15]. При хламидийном поражении могут встречаться и другие изменения (рис. 14), в частности, гиперсекреция слизи клетками призматического эпителия в отдаленные от момента овуляции сроки, скопления нейтрофилов или макрофагов.
Рис. 14. Микроскопическая картина шейки матки: фолликулярный цервицит хламидийной этиологии. Окраска гематоксилином и эозином, × 100
При сочетании нескольких неспецифических признаков цитоморфолог может высказать предположение о возможности хламидийного поражения и рекомендовать клиницисту продолжить обследование с использованием более специфических методов диагностики.
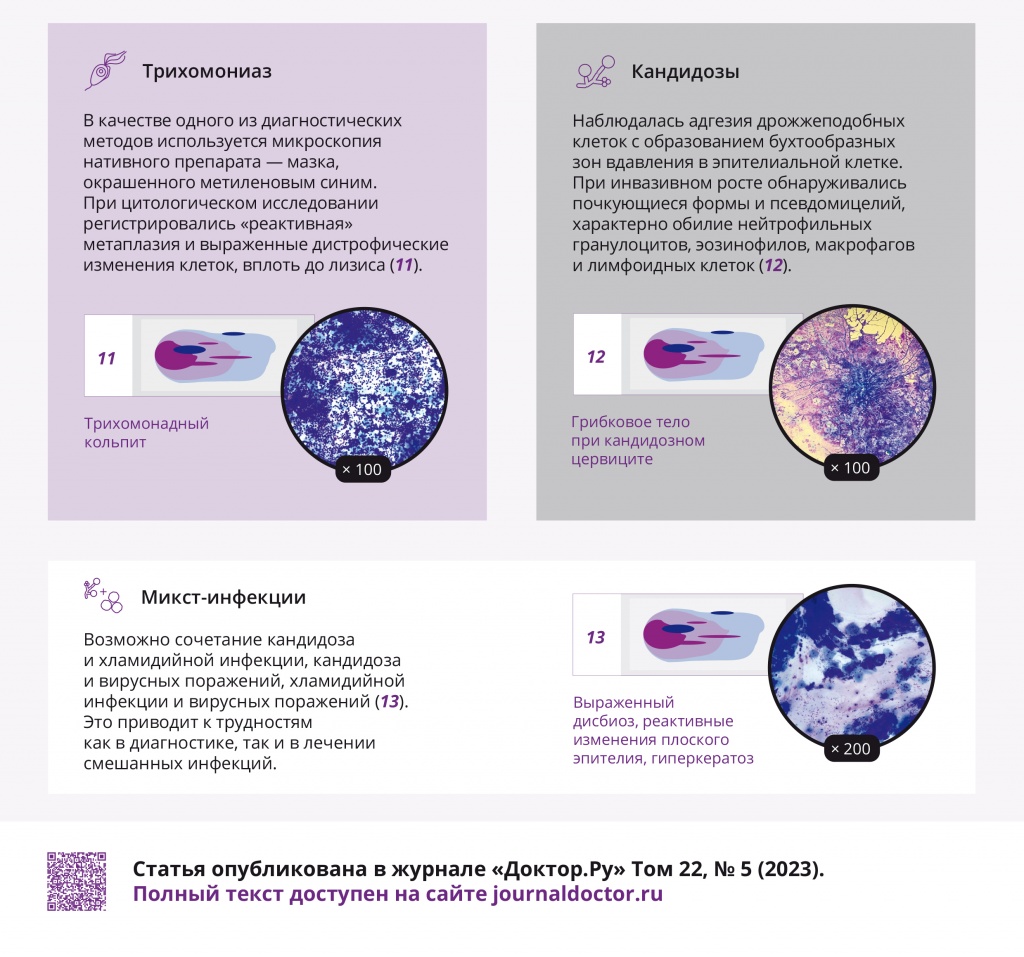
Трихомониаз наиболее часто протекает как микст-инфекция (до 80–90% случаев), в 70–80% случаев — в ассоциации с другими ИППП. В качестве одного из диагностических методов выявления трихомониаза используется микроскопия нативного препарата — мазка, окрашенного метиленовым синим. При цитологическом исследовании регистрировались «реактивная» метаплазия и выраженные дистрофические изменения клеток, вплоть до лизиса (рис. 15, 16).
Рис. 15. Традиционная цитология: одиночные трихомонады на фоне выраженного дисбиоза, отсутствие воспалительного компонента; × 200
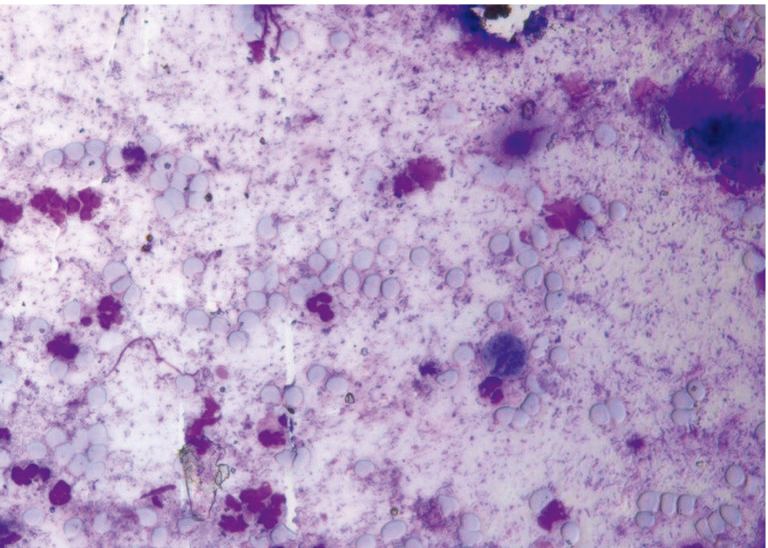
Рис. 16. Традиционная цитология: трихомонадный кольпит; × 100

При диагностике кандидозов наблюдалась адгезия дрожжеподобных клеток с образованием бухтообразных зон вдавления в эпителиальной клетке. При инвазивном росте обнаруживались почкующиеся формы и псевдомицелий, представляющий собой вытянутые в виде неровных нитей почкующиеся клетки гриба, характерно обилие нейтрофильных гранулоцитов, эозинофилов, макрофагов и лимфоидных клеток (рис. 17, 18).
Рис. 17. Традиционная цитология: инвазивный кандидоз на фоне выраженного дисбиоза и цервицита; × 200
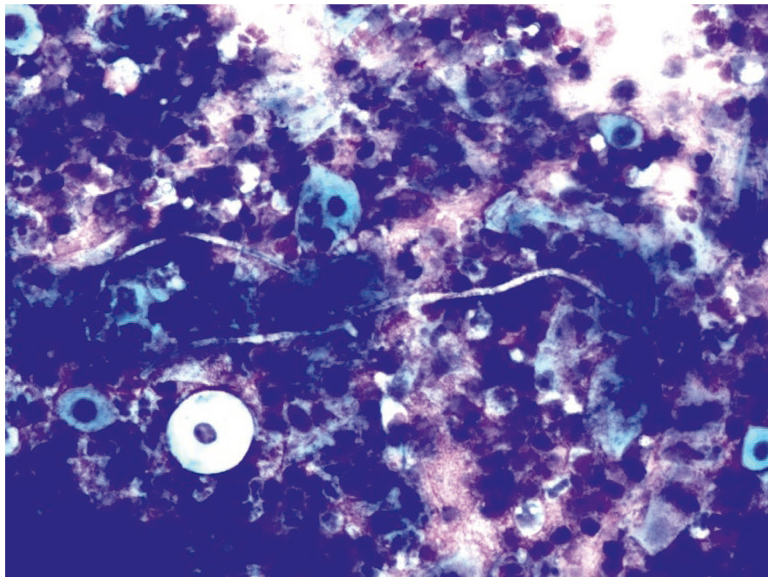
Рис. 18. Традиционная цитология: грибковое тело при кандидозном цервиците; × 100
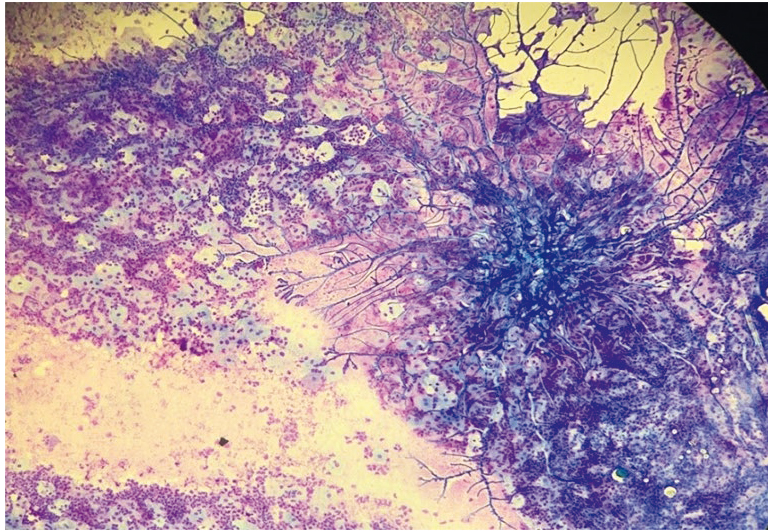
В последние годы отмечается значительный рост микст-инфекций (от 15–20% до 37%). Возможно сочетание самых различных возбудителей. Трудно бывает определить, какой возбудитель вызвал «запуск» воспалительных реакций, а какой присоединился вторично и усугубил течение заболевания. Возможно сочетание кандидоза и хламидийной инфекции, кандидоза и вирусных поражений, хламидийной инфекции и вирусных поражений (рис. 19–22), что приводит к трудностям как в диагностике, так и в лечении смешанных инфекций.
Рис. 19. Традиционная цитология: выраженный дисбиоз, реактивные изменения плоского эпителия, гиперкератоз; × 200
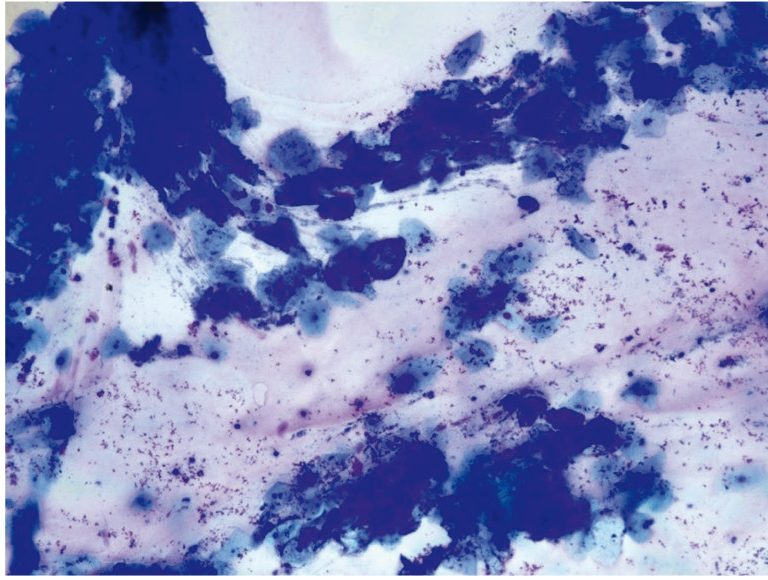
Рис. 20. Традиционная цитология: лактобациллез; × 200
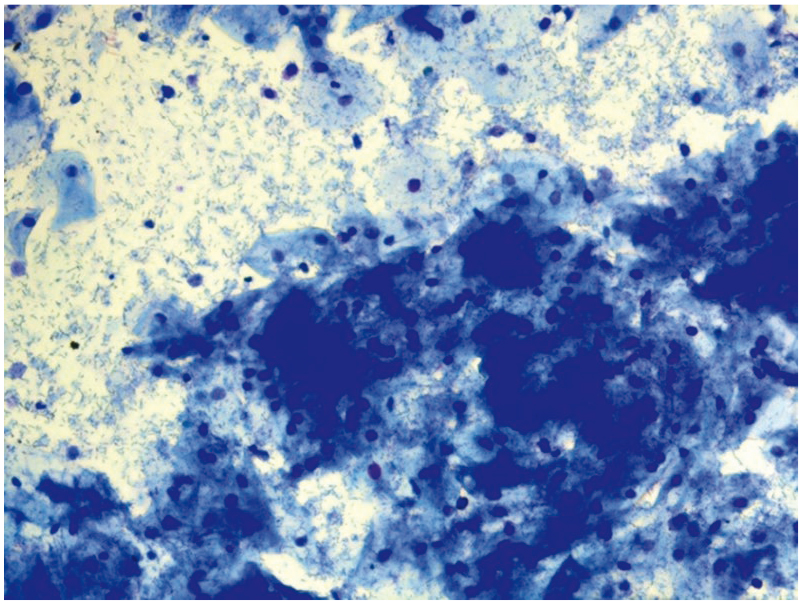
Рис. 21. Традиционная цитология: актиномикоз, дисбиоз; × 100
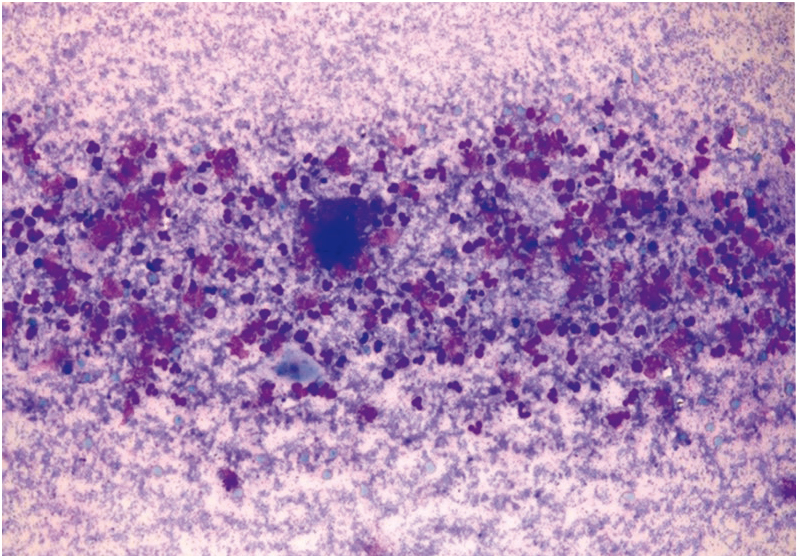
Рис. 22. Жидкостная цитология: гарднереллез, обилие ключевых клеток; × 200
ЗАКЛЮЧЕНИЕ
Инфекционно-воспалительные заболевания ЖПС приводят к нарушению репродуктивной функции и повышают риск развития неопластических процессов в обозначенных локализациях. В связи с этим основными направлениями профилактики онкологических процессов, восходящей инфекции, приводящей к хронизации процесса, необратимым изменениям и бесплодию, развитию спаечного процесса и др., в персонализированной медицине являются своевременная высококачественная диагностика и адекватное лечение фоновых заболеваний, которые требуют контроля излеченности пациенток. Современные цитоморфологические методы диагностики инфекций ЖПС позволяют достаточно быстро и достоверно определить тип возбудителя и характер процесса, что позволит клиницистам правильно расширить обследование и подобрать соответствующую терапию, предотвратить переход заболевания в хроническую стадию, избежать осложнений и развития неопластических процессов.
Поступила: 05.07.2023
Принята к публикации: 18.08.2023