Лечение несостоятельности тазового дна как продрома ПТО и самого ПТО на сегодняшний день не имеет сколь-нибудь ясной концепции. Понятно, что единственным методом излечения от этого заболевания может быть только хирургический. Вместе с тем большое количество существующих оперативных методик дают, с одной стороны, до 40% рецидивов [3], а с другой — интра- и постоперационные осложнения и даже появление жалоб de novo [4, 5], что склоняет хирурга и пациентку откладывать вмешательство до тех пор, пока пролапс не станет значительно ухудшать качество жизни. Эти обстоятельства ставят перед перинеологами задачу поиска факторов патогенеза пролапса для выявления маркеров, зная которые, можно рекомендовать оптимальное время хирургического вмешательства. Но, что не менее важно, эти же маркеры патогенеза могут помочь обосновать применение таких нехирургических методов помощи подобным пациенткам, которые способны задержать манифестацию пролапса и развертывание клинической картины, ухудшающей качество жизни. В любом случае без детального понимания этиологии и патогенеза ПТО о значимом улучшении эпидемиологической ситуации говорить не приходится.
Этиология ПТО неоднозначна и включает в себя ряд предрасполагающих и декомпенсирующих факторов, сочетанное воздействие которых увеличивает риск десценции и, видимо, влияет на сроки манифестации ПТО. Среди таких факторов в первую очередь следует отметить возраст, беременность, роды, травмы тазового дна, а также генетическую предрасположенность, обусловливающую слабость поддерживающих структур [6]. Эти особенности связочного аппарата матки и мышечно-фасциального комплекса тазового дна, включая тазовую фасцию, могут быть врожденными, а могут приобретаться в течение жизни. Стойкие гистологические изменения в различных отделах поддерживающего аппарата, в том числе и в стенках влагалища, были обнаружены многими перинеологами [7–10].
Доказано, что механическая прочность ткани определяется статусом соединительнотканной основы, а значит, активностью фибробластов и соответствующим состоянием внеклеточного матрикса (ВКМ) [7]. ВКМ наряду с основным веществом поддерживает структуру соединительной ткани, обеспечивая ее упругость и эластичность посредством создания «каркаса» из разнообразных компонентов. Среди этих компонентов — гликопротеины, протеогликаны и структурные белки (коллагены). Функциональное состояние самого матрикса, его стабильность и ремоделирование зависят от синтеза фибробластами не только структурных белков, но и эндопептидаз, которые способны разрушать компоненты ВКМ в ответ на механические и биохимические стимулы. Этим стимулом может выступить, например, длительное перерастяжение компонентов волокнистой ткани при недостаточной поддержке тазовых органов, запускающее ряд субкомпенсаторных механизмов качественных ультраструктурных изменений в ответ на стресс.
Получается, что состояние поддерживающих структур тазового дна во многом зависит от баланса синтеза и деградации каркасных веществ. Однако механизм изменений в ВКМ, приводящий к утрате соединительной тканью своих свойств, до конца не установлен [11].
Согласно последним исследованиям, важную роль в вышеописанных процессах играют соотношение коллагенов I и III типа, а также экспрессия матриксных металлопротеиназ MMP-1, MMP-2, MMP-3, MMP-9, разрушающих белки ВКМ, и их ингибиторов — TIMP-1 и TIMP-4 [12, 13].
Замечено, что наряду с активацией фибробластов в условиях механического повреждения ткани происходит не только уменьшение содержания [10], но и фенотипическое изменение гладкомышечных клеток. Исследователи предполагают, что гладкомышечные клетки меняются под контролем тромбоцитарного фактора роста β (platelet-derived growth factor β, PDGF-β) [14]. При этом происходит переход контрактильных гладкомышечных клеток в «синтезирующий» тип миоцитов, способных к пролиферации и производству компонентов ВКМ (в том числе и коллагенов). Кроме влияния митогенной активности PDGF-β, степень пролиферации миоцитов может быть увеличена из-за снижения количества клеток, подвергающихся апоптозу на фоне изменения экспрессии эффекторных каспаз 3 и 9, но это предположение требует дальнейшего подтверждения [15]. Дополнительную роль в реорганизации поддерживающих тканей тазового дна при ПТО может играть гликопротеин ВКМ тенасцин X, кодируемый геном TNXB, поскольку активация этого белка происходит после воздействия на ткани повреждающего фактора [16].
Таким образом, актуальность настоящего исследования обусловлена необходимостью изучения новых маркеров, участвующих в патогенезе десценции тазовых органов, но самое главное, их совокупного функционирования, что позволит сделать еще один шаг в поиске оптимального подхода к лечению ПТО.
Цель исследования: изучить гистологические изменения поддерживающего аппарата органов малого таза при несостоятельности тазового дна для уточнения ультраструктурных компонентов патогенеза ПТО и обоснования применения направленной контактной диатермии на ранних его стадиях.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводили на клинических базах кафедры акушерства и гинекологии с курсом перинатологии Медицинского института РУДН в период с октября 2016 г. по октябрь 2017 г. (ГКБ № 29 им. Н. Э. Баумана ДЗМ, НУЗ ЦКБ № 6 ОАО «РЖД») и в Клинике интегральной медицины.
В исследование на основании добровольного информированного согласия были включены 20 пациенток репродуктивного возраста (35 ± 5 лет), обратившихся для консервативного лечения с диагнозом «Недостаточность мышц тазового дна, старые разрывы мышц тазового дна» (N81.8 по МКБ-10). Исследование одобрено Локальным этическим комитетом и соответствует требованиям Хельсинкской декларации (WMA Declaration of Helsinki — Ethical Principles for Medical Research Involving Human Subjects, 64th WMA General Assembly, Fortaleza, Brazil, October, 2013).
Изучали ткани передней и задней стенок влагалища, полученные методом пункционной биопсии в фазу ранней пролиферации (5–7-й дни менструального цикла), с помощью методов световой микроскопии, иммуногистохимии (ИГХ), а также ПЦР-диагностики. Важными условиями при признании биопсии влагалища удовлетворительной были получение всей толщины его стенки (всех трех оболочек), обязательное присутствие мышечного и фасциального компартментов (их наличие подтверждали гистологически). Биопсийный материал у каждой пациентки с ее согласия брался дважды — до и после курса направленной контактной диатермии на аппарате BTL-6000 TR-Therapy ELITE (Великобритания).
Аппарат BTL-6000 TR-Therapy ELITE имеет применяемые поочередно резистивный электрод диаметром 30 мм, емкостные электроды диаметром 20 и 30 мм, а также нейтральный электрод размером 160 × 240 мм. При проведении процедуры оптимальное положение пациентки — лежа на спине на гинекологическом кресле (литотомическая позиция): ноги согнуты в коленных и тазобедренных суставах и разведены. Согласно инструкции, нейтральный электрод смазывали токопроводящим гелем и располагали в пояснично-крестцовой области. Контактной средой служил специальный токопроводящий гель. Локализация воздействия — зона промежности (включая область проекции Musculus levator ani с обеих сторон), область преддверия влагалища и слизистая влагалища. Глубина воздействия физического фактора — 2,0–3,5 см.
Важно, что применяемая методика лабильна, т. е. подразумевает плавные непрерывные маятникообразные перемещения электродов в зонах воздействия. Последовательность воздействия: резистивный электрод — 3 мин; емкостный электрод диаметром 30 мм — 12 мин; емкостный электрод диаметром 20 мм — 3 мин; резистивный электрод — 5 мин. Мощность определяли во время процедуры — до ощущения умеренного тепла под активным электродом. Общая продолжительность процедуры — 23 мин. Курс состоит из 10 процедур, проводимых через два дня на третий.
Биопсийный материал до и после курса лечебных процедур на указанном аппарате подвергали морфологическому и ИГХ исследованиям с проведением компьютерной морфометрии, а также исследованию методом ПЦР в режиме реального времени (ПЦР-РВ).
Морфологическое исследование производили методом световой микроскопии после поготовки биоптатов согласно стандартной методике (фиксация, проводка, окрашивание, заключение).
ИГХ исследование выполняли после депарафинизации и регидратации парафиновых срезов по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max (Leica, Великобритания). В качестве первичных антител использовали мышиные антитела (Abcam, Великобритания) к коллагену I типа (Anti-Collagen I antibody, Clone abab138492, 1:500), коллагену III типа (Anti-Collagen III antibody, Clone ab23445, 1:750), α-SMA (Anti-alpha smooth muscle Actin antibody, Clone ab7817, 1:200). Вторичные антитела — универсальные Cell Marque (США).
Для каждого маркера выполняли контрольные исследования для исключения псевдопозитивных и псевдонегативных результатов. Титр антител подбирали с использованием раствора для разведения антител (antibody diluents). Ядра клеток докрашивали гематоксилином Mayer, промывали под проточной водой, дегидратировали (спирт 96%), заключали под покровные стекла. Интенсивность ИГХ окрашивания срезов оценивали при помощи 3-балльной шкалы: 1 — слабое окрашивание, 2 — умеренное, 3 — выраженное. Учитывая биохимические особенности и характер расположения окрашиваемых структур (коллагены), определяли соотношение их распределения в собственной пластинке слизистой оболочки и суммарное содержание во всех оболочках стенки влагалища.
Визуализацию биопсийного материала выполняли на светооптическом микроскопе Carl Zeiss Lab.A1 (Carl Zeiss, Германия), совмещенном с видеокамерой AxioCam ERc5s (Carl Zeiss Microscopy GmbH, Германия) и программным обеспечением ZEN Lite.
Компьютерную морфометрию для оценки результатов ИГХ реакции и для определения площади позитивно окрашенных объектов в поле зрения осуществляли при помощи компьютерной системы анализа изображения с открытым кодом Image J 1.51. Для этого проводили микрофотосъемку 10 случайно отобранных полей зрения при 200-кратном увеличении на микропрепаратах после выполненной ИГХ реакции с соответствующими первичными антителами. Далее полученное изображение автоматически подвергали нормализации и переводили из режима цветной 24-битной картинки (RGB) в режим 256 градаций серого (gray scale), выполняли бинаризацию объектов с заданным уровнем чувствительности. При обработке микрофотографий системой анализа изображений отсекали бинарные объекты с уровнем яркости более 150 и определяли суммарную площадь позитивно окрашенных объектов в процентном соотношении от общей площади микрофотографий.
ПЦР-РВ была выполнена для определения экспрессии MMP-1, MMP-2, MMP-3, MMP-9, PDGF-β и TNXB в фрагментах стенок влагалища до и после лечения. Фрагменты биоптатов стенок влагалища были помещены в стабилизирующий раствор RNAlater (QIAGEN, Нидерланды) и хранились при температуре –70 °C. Впоследствии образцы подвергли гомогенизации согласно стандартному протоколу.
Экстракцию тотальной РНК производили с использованием набора готовых реактивов RNeasy Plus Mini Kit (QIAGEN, Нидерланды). Синтез комплементарной ДНК (кДНК) с матрицы полученной РНК осуществляли с помощью набора SuperScript™ VILO™ Master Mix (Invitrogen, США). Выделенные кДНК подверглись ПЦР-РВ с применением готовой смеси реагентов ABsolute Blue QPCR Mix (Thermo Scientific, США) с интеркалирующим флуоресцентным красителем SYBR Green I. ПЦР-РВ проводили при помощи StepOne System (Applied Biosystems, CША) и штатного программного обеспечения.
Экспрессию генов анализировали с использованием метода определения порогового цикла (Ct) и вычисления относительной экспрессии генов согласно протоколу [17]. Нормирование и внутренний контроль выполнены относительно референсного гена «домашнего хозяйства» GAPDH, уровень экспрессии которого по умолчанию считается постоянным. Статистический контроль проводили относительно нормативных значений. Подбор праймеров был осуществлен на основании общедоступных материалов о последовательностях ДНК и матричной РНК (мРНК) генов в базе данных National Center for Biotechnology Information с использованием программы Primer-BLAST.
Полученные результаты статистически обрабатывали с помощью программного пакета SPSS 7.5 for Windows (IBM Analytics, США). Рассчитывали средние арифметические и среднеквадратические отклонения. Соответствие данных нормальному распределению подтвердили с применением критерия Колмогорова — Смирнова. Количественные данные, полученные в ходе ПЦР-РВ, были проанализированы с применением рангового дисперсионного анализа ANOVA. Для сравнения двух выборок использовали t-критерий с уровнем значимости p < 0,05.
РЕЗУЛЬТАТЫ
Микроскопическое описание влагалищных биоптатов пациенток представлено на рисунке 1.
Рис. 1. Стенка влагалища (метод световой микроскопии). Окраска гематоксилином и эозином, 200-кратное увеличение. А — до лечения; Б — после лечения. Здесь и далее в статье фото авторов
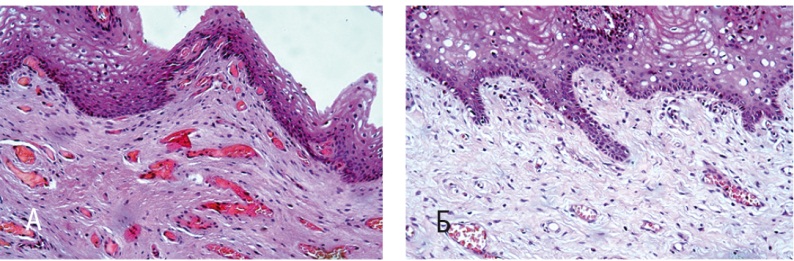
До курса диатермии (рис. 1А) у всех участниц стенка влагалища имела типичное строение и была представлена слизистой, мышечной и адвентициальной оболочками. Слизистая оболочка выстлана многослойным плоским неороговевающим эпителием, состоящим из базального, промежуточного и поверхностного слоев. В поверхностном слое присутствовали единичные кератогиалиновые гранулы, кератинизация не выявлена ни у кого. Ядра определялись во всех эпителиоцитах (вариант нормы: ранняя фаза пролиферации). В базальном слое эпителия обнаружены клетки со слабо и умеренно эозинофильной окраской цитоплазмы — это пролиферирующие клетки на этапе дифференцировки. Базальная мембрана эпителия во всех образцах — непрерывистая, сохранена на всем протяжении.
Собственная пластинка слизистой оболочки влагалища образована волокнистой соединительной тканью с фиброзом и склерозом, в редких фокусах обнаружены сосочки неправильной формы, вдающиеся в эпителиальный пласт, что определяло неравномерность границы эпителия и собственной пластинки. При этом ВКМ визуализировался рыхлым, местами отечным, с клетками фибробластического ряда и гистиоцитами, а также единичными тучными клетками. Здесь же были обнаружены множественные полнокровные кровеносные (преимущественно вены) и лимфатические сосуды с явлениями стаза. Крупные сосуды были расположены в более глубоких регионах собственной пластинки.
Мышечная оболочка представлена пучками гладких миоцитов, формирующих продольные и, реже, цилиндрический слои. Выявлена существенная дезорганизация архитектоники гладкой мышечной ткани с высокой степенью коллагенизации рыхлой волокнистой соединительной ткани среди неравномерно расположенных, разобщенных гладких мышечных клеток как продольного, так и циркулярного слоев. Адвентициальная оболочка богата волокнистым компонентом с высоким индексом васкуляризации (см. рис. 1А).
После диатермии (рис. 1Б) во всех исследованных образцах в собственной пластинке слизистой оболочки влагалища визуализировали множественные эластические волокна, имеющие змеевидный ход и образующие многочисленные сеточки. Индекс васкуляризации умеренный, обнаружены кровеносные сосуды с признаками пролиферации эндотелия. По сравнению с препаратами, взятыми до терапии, основное вещество стало более компактным, а гладкие мышечные клетки расположились упорядоченными пучками, вокруг которых регулярно встречались эластические волокна.
По результатам специфической гистохимической реакции на волокнистый и аморфный компоненты основного вещества (по Ван-Гизону, Массону) в биоптатах влагалищной стенки до и после диатермического лечения также были обнаружены явные различия (рис. 2).
Рис. 2. Стенка влагалища (метод световой микроскопии). Окраска по Массону, 200-кратное увеличение. А — до лечения; Б — после лечения
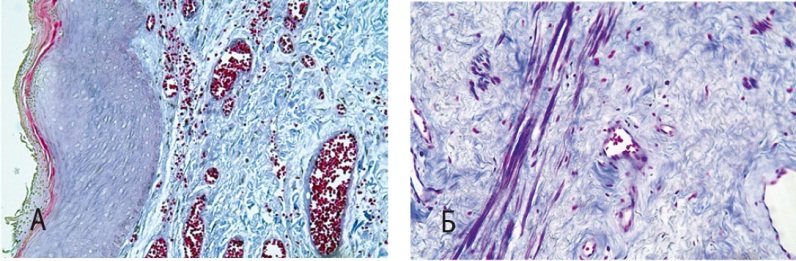
В биоптатах, взятых до курса диатермии (рис. 2А), отмечено преобладание коллагеновых волокон и коллагеновых протофибрилл и незначительное количество разобщенных эластических волокон, число которых значительно возросло после терапии (4,8 ± 0,1% vs 11,7 ± 0,3%, р < 0,05). В некоторых образцах до лечения обращало на себя внимание полное отсутствие эластического каркаса в стромальных структурах стенки влагалища, исключения составляли лишь внутренние оболочки кровеносных сосудов. В биоптатах, взятых у пациенток после лечения (рис. 2Б), мы обнаружили, напротив, преобладание эластических и тонковолокнистых структур (9,2 ± 0,2%, р < 0,05 при сравнении с результатами до терапии).
По результатам ИГХ исследования образцов тканей, взятых как до, так и после терапии, мы выявили иммунопозитивную реакцию на антитела к коллагену I и III типов, однако очевидна была и достоверная разница в степени их иммунореактивности и распределения в стенке влагалища (рис. 3).
Рис. 3. Стенка влагалища (иммуногистохимическое исследование с антителами к коллагену I типа). Докрашивание гематоксилином, 200-кратное увеличение. А — до лечения; Б — после лечения
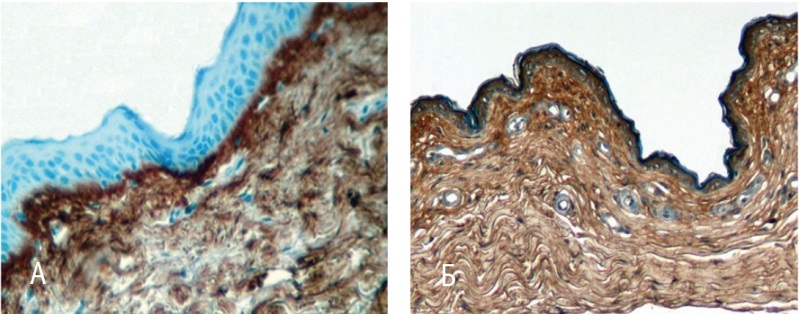
Согласно данным морфометрии в биоптатах, взятых до терапии (рис. 3А), иммуннопозитивные компоненты на антитела к коллагену I типа в клетках фибробластического ряда и в основном веществе собственной пластинки отличались умеренной реакцией, оцененной в 2 балла. После лечения позитивная реакция была заметно интенсивнее (рис. 3Б), что позволило присвоить ей высший показатель иммунореактивности — 3 балла. Эти результаты подтверждены и компьютерной морфометрией: площадь активного свечения коллагена I типа, до лечения равная 22,1 ± 1,7%, увеличилась в 2,4 раза — до 54,2 ± 2,4% (р < 0,05).
Обратный корреляционный результат получен при оценке иммунопозитивной экспрессии на антитела к коллагену III типа (рис. 4).
Рис. 4. Стенка влагалища (иммуногистохимическое исследование с антителами к коллагену III типа). Докрашивание гематоксилином, 200-кратное увеличение. А — до лечения; Б — после лечения
До диатермического воздействия на ткани промежности и влагалища интенсивность иммунореактивности к «молодому» коллагену III типа оценивалась в 3 балла (рис. 4А), после терапии происходило значительное уменьшение интенсивности его свечения — до умеренной реакции в 2 балла (рис. 4Б). Данные компьютерной морфометрии объективизировали эту визуальную оценку, показав уменьшение площади положительной реакции с 44,5 ± 0,3% перед лечением до 27,5 ± 0,7% после курса терапии (p < 0,05).
Соотношение распространенности в образцах тканей коллагена I типа и III типа до лечения составило 0,5, а после применения направленной контактной диатермии — 2,0. Эти результаты указывают на активацию пластических процессов волокнистого компонента стенки влагалища на фоне проведенного лечения.
Кроме коллагеновых структур, анализу подверглась иммунореактивность гладкомышечных клеток в образцах изученных тканей (рис. 5).
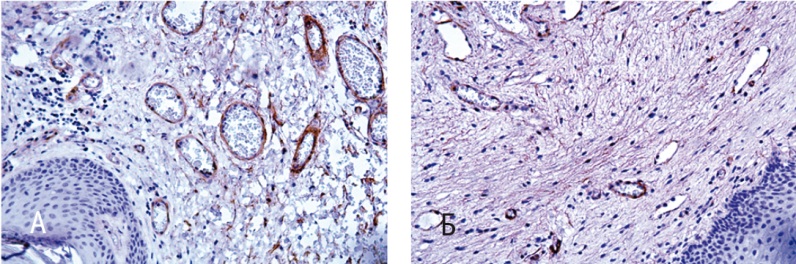
Рис. 5. Стенка влагалища (иммуногистохимическое исследование с антителами к α-SMA). Докрашивание гематоксилином, 200-кратное увеличение. А — до лечения; Б — после лечения
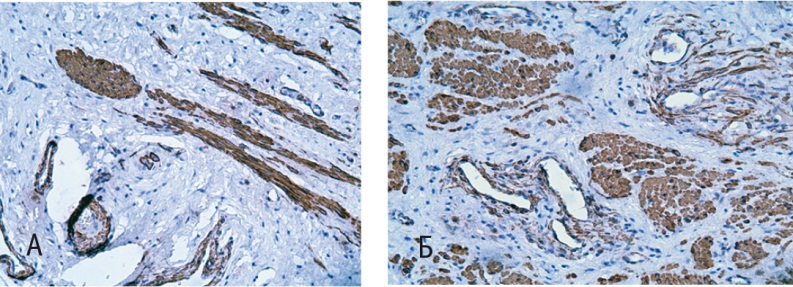
Иммунопозитивные гладкомышечные клетки с выраженной реакцией на антитела к α-SMA, оцененной в 3 балла, визуализировали в образцах как до (53,7 ± 2,7%), так и после терапии (63,7 ± 3,1%). Важно, что на первый взгляд незначительные, но статистически значимые изменения (р < 0,05) подтверждались сразу бросающейся в глаза разной организацией мышечных волокон в изученных препаратах. Если до терапии наблюдалась выраженная дезорганизация гладкомышечных клеток, смещенных в ходе разрастания соединительной ткани, что, вероятно, обусловлено нарушением целостной архитектоники мышечной оболочки стенки влагалища при десценции тазового дна, то после терапии нами выявлена типичная локализация клеток гладкомышечного слоя стенки влагалища с умеренным их распределением, компактной организацией и отчетливыми продольными и циркулярными слоями.
Анализ экспрессии генов методом ПЦР-РВ дал интересные результаты. При оценке уровня экспрессии генов матриксных металлопротеиназ и их ингибиторов с помощью измерения количества мРНК соответствующих генов в биоптатах стенок влагалища до и после терапии найдены достоверные различия между исследованными морфологическими образцами (табл.).
Таблица
Относительная экспрессия генов при несостоятельности тазового дна до и после терапии, у. е. ± SEM
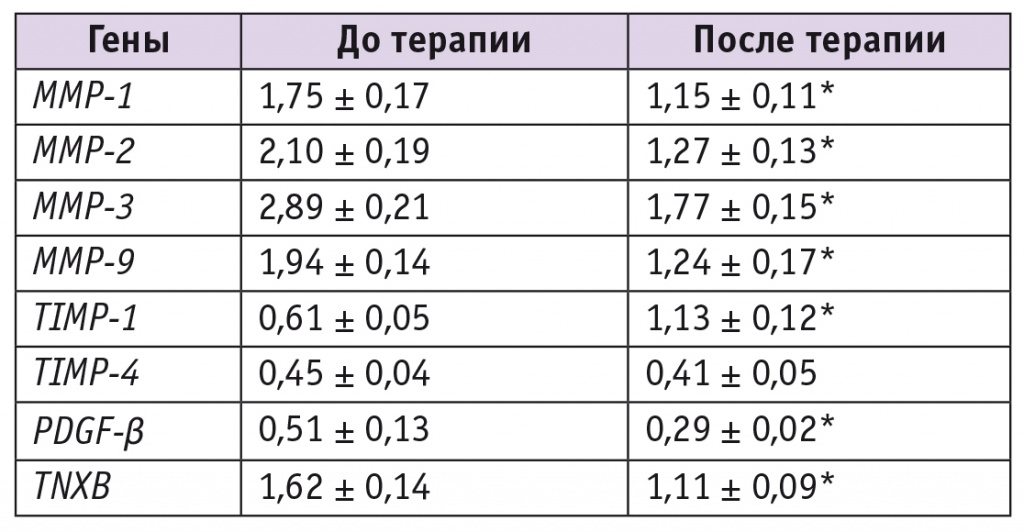
* Отличие от исходного значения статистически значимо (p < 0,05).
Значимые отличия относительной экспрессии генов касались и PDGF-β, и тенасцина X, кодируемого геном TNXB.
Экспрессия MMP-1, MMP-2, MMP-3, MMP-9, TIMP-1, PDGF-β и TNXB в фрагментах стенок влагалища до терапии статистически значимо превышала пороговый уровень внутреннего контроля (GAPDH) и степень экспрессии этих же генов после курса направленной контактной диатермии.
Экспрессия всех изученных металлопротеиназ достоверно уменьшилась после проведенной терапии — в 1,50–1,65 раза. Наиболее значимыми оказались изменения экспрессии MMP-2 и MMP-3. На этом фоне логичным оказалось увеличение экспрессии генов, кодирующих ингибиторы металлопротеиназ. Достоверно возросла (в 1,8 раза) экспрессия TIMP-1, но осталась без изменения после проведенной терапии экспрессия TIMP-4.
Согласно результатам пилотного исследования экспрессии каспаз 3 и 9, которые могли бы свидетельствовать об интенсивности апоптоза в ремоделируемых вследствие несостоятельности в тканях тазового дна, к нашему удивлению, она достоверно не изменилась и не превысила уровень фона.
После терапии экспрессия гена, кодирующего фактор ангиогенеза PDGF-β, уменьшилась в 1,8 раза, а экспрессия гена TNXB, кодирующего гликопротеин ВКМ тенасцин X, — в 1,5 раза (p < 0,05 для обоих показателей), что оказалось интересной исследовательской находкой, требующей обсуждения.
ОБСУЖДЕНИЕ
Полученные в ходе работы данные позволяют дополнить существующее представление о патогенезе ПТО и выделить ключевые ультраструктурные механизмы, связывающие молекулярные изменения и формирование нарушений архитектоники тазового дна и топографии органов малого таза при ПТО на макроуровне.
Нами продемонстрировано, что у пациенток с несостоятельностью тазового дна наблюдаются стойкие морфологические изменения в структурах передней и задней стенок влагалища с характерной дезорганизацией архитектоники мышечной оболочки, что, видимо, обусловлено метаболическими повреждениями ВКМ.
Ключевыми особенностями гисто-биохимической картины стенки влагалища при несостоятельности тазового дна стали:
- неравномерные границы эпителия с рыхлым, отечным ВКМ, содержащим большое количество фибробластов и тучных клеток;
- множество полнокровных сосудов и соответствующее этому увеличение экспрессии гена PDGF-β, отвечающего за производство тромбоцитарного фактора роста сосудов;
- нарушение архитектоники гладкомышечных клеток, их дезорганизация, разобщение, общее снижение абсолютного числа;
- незначительное количество эластических волокон вплоть до их отсутствия;
- коллагенизация рыхлой волокнистой соединительной ткани, большое число протофибрилл с недостатком коллагеновых волокон I типа и избыточным количеством коллагена III типа;
- большая активность металлопротеиназ (деградация коллагеновых молекул и других белков ВКМ) на фоне низкой экспрессии такого их ингибитора, как TIMP-1;
- умеренное увеличение по сравнению с нормой синтеза гликопротеина тенасцина X в ВКМ.
С одной стороны, снижение анаболизма коллагена I типа под прямым воздействием оксидативного стресса приводит к компенсаторному избыточному синтезу коллагена III типа. С другой стороны, уменьшение содержания коллагеновых волокон I типа можно расценивать не как снижение интенсивности его формирования, а напротив, усиление катаболизма этих коллагеновых волокон. Второе предположение можно подтвердить обнаруженным ростом активности матриксных металлопротеиназ, т. е. тех ферментов, которые приводят к деградации коллагеновых фибрилл: внутритканевой коллагеназы MMP-1, желатиназ А и B (MMP-2 и ММР-9), стромелизина 1 (MMP-3). Дополняет картину и явный недостаток экспрессии ингибитора матриксных металлопротеиназ TIMP-1 (экспрессия TIMP-4 не была изменена, что говорит об отсутствии его значимого вклада в этот этап патогенеза ПТО, и здесь он рассматриваться не будет). Отсутствием подавляющего фактора объясняется значительное увеличение активности коллагеназ и прочих металлопротеиназ, а значит, и абсолютное уменьшение содержания коллагена в стенке влагалища.
Но не только синтез/катаболизм коллагена в межклеточном пространстве важен для изучаемого патогенеза. Существенные изменения происходят и с метаболизмом эластина. В ходе научной работы нами выявлено значительное снижение синтеза эластина фибробластами в структурах поддерживающего аппарата органов малого таза у пациенток с ПТО по сравнению с нормой, что подтверждено и другими гистологическими исследованиями [18]. Вместе с тем молекулярные механизмы нарушения клеточной сборки эластических волокон остаются неясными (снижение анаболизма или усиление катаболизма?) и требуют дальнейшего изучения, а визуальное снижение количества эластических волокон диктует необходимость поиска параметрических подтверждений этого факта.
Отдельного внимания заслуживает изменение гликопротеинового состава основного вещества соединительной ткани при несостоятельности тазового дна, в частности изменение содержания тенасцина Х. Последние данные указывают на его функциональную роль в процессах реорганизации архитектоники ткани в посттравматический период [16, 19]. Предположительно, усиление синтеза тенасцина Х фибробластами и повышение его количества в ВКМ в 1,8 раза (p < 0,05 в сравнении с нормой) в нашем исследовании может быть обусловлено микротравмированием тканей при вынужденном растяжении в условиях недостаточной мышечно-фасциальной поддержки со стороны тазового дна.
Обнаруженное увеличение содержания тенасцина Х вполне можно связать с усилением трофики, нарушением коллагенизации и эластинизации, что приводит к еще большей подвижности тканей, разобщению коллагеновых фибрилл и гладкомышечных клеток, а значит, потенциированию развития ПТО. Роль оксидативного стресса в стимуляции экспрессии TNXB остается неподтвержденной, также неясен порядок событий, происходящих в тканях, — первично ли увеличение количества тенасцина Х, которое влечет за собой описанные изменения, или, напротив, нарушение коллагенизации приводит к компенсаторному усилению экспрессии TNXB.
Помня о том, что часть перинеологических исследований фокусируется на проапоптотическом действии оксидативного стресса на фибробласты, мы, проведя пилотное изучение экспрессии эффекторных и инициаторных каспаз 3 и 9, не нашли каких-либо изменений. Вероятно, нарушение баланса компонентов ВКМ при несостоятельности тазового дна скорее связано с вышеизложенными компенсаторными изменениями внутриклеточного метаболизма фибробластов и их активности, нежели с уменьшением абсолютного числа клеток.
В поддержку этого предположения говорят и наши первичные наблюдения изменений в мышечной оболочке стенки влагалища. Мы не обнаружили значимого снижения числа гладкомышечных клеток в биоптатах стенок влагалища, взятых у пациенток с несостоятельностью тазового дна, но увидели безусловное разобщение и дезорганизацию в продольных и циркулярных слоях мышечной оболочки, что подтверждается и другими исследованиями [12]. Остается открытым вопрос, как в условиях отсутствия активности эффекторных каспаз, т. е. в отсутствие апоптоза или каких-либо видимых некротических изменений, происходят нарушение расположения и уменьшение числа α-SMA-позитивных клеток. Это кажущееся несоответствие может быть объяснено не количественными, но качественными изменениями гладкомышечных клеток.
Согласно существующей теории, основным механизмом при тканевой ремодуляции является переход сократительных миофибрилл в миофибробласты синтезирующего типа под воздействием PDGF-β. Рост содержания этого фактора ангиогенеза был зафиксирован нами методом ПЦР-РВ во всех образцах стенок влагалища, первично взятых у пациенток с несостоятельностью тазового дна. Данный механизм изменения качества гладкомышечных клеток может объяснить и обнаруженное нами превалирование коллагена III типа, поскольку миофибробласты способны к внутриклеточному синтезу этого коллагена.
Очень важным результатом нашего исследования оказались позитивные ультраструктурные и генно-биохимические изменения в тканях влагалища, выявленные после курса направленной контактной диатермии, превзошедшие самые смелые наши ожидания.
Гистологическая и биохимическая картина после такого физиолечения имела следующие особенности:
- явно возросло число типичных эластических волокон и тонковолокнистых структур;
- снизился общий уровень васкуляризации, чему соответствовало достоверное уменьшение (в 1,8 раза) экспрессии PDGF-β, но эндотелий имеющихся сосудов был в состоянии пролиферативной активности;
- основное вещество стало компактным, гладкомышечный слой приобрел типичную архитектонику с типичным расположением продольных и циркулярных слоев гладкомышечных клеток, число которых незначительно увеличилось;
- выраженность гистологических признаков активности коллагенизации снизилась, при этом свечение коллагеновых волокон I типа заняло более половины площади поля зрения в препаратах, а распространенность коллагена III типа, напротив, уменьшилась до четверти общей площади, что дополняется снижением экспрессии металлопротеиназ в 1,50–1,65 раза и ростом активности гена-кодировщика их ингибитора TIMP-1;
- экспрессия TNXB, а значит, и производство гликопротеина тенасцина Х значительно уменьшились, что может объясняться только снижением воздействия повреждающего фактора и отсутствием микротравматизации поддерживающих тканей в результате физиолечения.
ЗАКЛЮЧЕНИЕ
Резюмируя достоверные ультраструктурные изменения стенки влагалища при несостоятельности тазового дна, можно расширить представление о патогенезе пролапса тазовых органов (ПТО). Мы считаем, что в основе событий, разворачивающихся в поддерживающих тканях, лежит изменение внутриклеточного метаболизма фибробластов на молекулярном уровне. При этом триггерным звеном этих изменений служит оксидативный стресс, возникающий как следствие усиления васкуляризации в постоянно растягивающихся, а значит, микротравмирующихся тканях при недостаточной поддержке со стороны мышц и фасций тазового дна. Маркером таких повреждений может служить тенасцин Х.
Для более детального изучения механизмов местного ангиогенеза при повреждении тканей влагалища в условии сниженной поддержки со стороны тазового дна стоит определить содержание васкулярно-эндотелиального фактора, являющегося естественным митогеном для эндотелиоцитов сосудистого русла и воздействующего на соответствующий ему рецептор [20]. Тем не менее это предположение требует дальнейшего подтверждения.
Результатом вышеописанного оксидативного стресса и следующим звеном патогенеза становится не апоптоз, а изменение функции фибробластов и гладкомышечных клеток. Проявлениями, а значит, тканевыми маркерами данных функциональных изменений можно считать рост экспрессии металлопротеиназ и снижение таковой их ингибитора TIMP-1 и, как следствие, уменьшение количества зрелого коллагена I типа и значительное увеличение такового юного коллагена III типа, а также общее малое число и разобщенность эластических волокон.
Обнаруженный дисбаланс в клеточных структурах и межклеточном матриксе обусловливает уменьшение прочности поддерживающих структур тазового дна и вторично возникающее разобщение и дезорганизацию тканей и макроструктур, в конечном счете приводя к формированию грыжевых ворот и ПТО.
Примечательно, что с большинством описанных нарушений удалось справиться благодаря воздействию направленной диатермии на ткани влагалища. Полученные результаты исследования биоптатов, взятых после курса терапии, отражают воздействие аппарата на молекулярную составляющую путем компенсации хронического оксидативного стресса. Нивелированием именно этого звена может быть объяснено устранение дисбаланса в производстве коллагена и эластина и упорядочивание архитектоники ультраструктур влагалищной стенки практически до варианта нормы. При этом открытым остается вопрос продолжительности этого эффекта и выбора оптимальных сроков хирургической коррекции несостоятельного тазового дна у подобных пациенток.








