Настоящий обзор имеет своей целью обобщение научных данных о диагностике, лечении, профилактике влагалищных интраэпителиальных неоплазий (vaginal intraepithelial neoplasia, VAIN). Проанализирована доступная медицинская литература с использованием баз данных PubMed, eLIBRARY.RU. В обзор преимущественно включены работы, изданные за последние 10 лет, с учетом их высокой информативности.
Карцинома влагалища — редкая опухоль, среди всех злокачественных новообразований органов малого таза ее доля составляет всего 1–4%[1]. В 2017 году в РФ среди женского населения зарегистрированы 17 587 новых случаев рака шейки матки и 6500 летальных исходов; более 2000 новых случаев рака вульвы, более 500 — влагалища. Следует отметить, что с 2011 года наблюдается прирост заболеваемости злокачественными образованиями влагалища на 16,4%. Так, в 2011 году частота рака влагалища на 100 тыс. населения составила 0,54, а в 2015 году — 0,62[2, 3]. Преинвазивные признаки заболевания диагностируют в виде интраэпителиальных опухолевых изменений, называемых VAIN[1].
Ранее считалось, что VAIN выявляется реже, чем рак влагалища, так как она часто не диагностировалась. В исследованиях сообщалось о снижении распространенности VAIN — 0,2–0,6 на 100 000 женщин, что составляет 0,5% от всех опухолевых поражений нижних отделов половых путей[4]. Однако Y. Hе и соавт. в недавнем исследовании, в которое включены 419 пациенток, доказали, что частота возникновения VAIN высока и всего лишь в 4 раза меньше, чем CIN (12,2% и 48,0% соответственно)[5].
В последнее десятилетие отмечается неуклонное увеличение числа зарегистрированных больных VAIN. Это обусловлено широким применением цитологического исследования, ВПЧ-тестирования и кольпоскопии в скрининге рака шейки матки[1, 6].
Возраст, в котором может возникнуть VAIN, варьирует от 24 до 80 лет, но в настоящее время она выявляется у женщин более молодого возраста, и считается, что это связано с повышением распространенности папилломавирусной инфекции половых путей[7].
КЛАССИФИКАЦИЯ ВЛАГАЛИЩНЫХ ИНТРАЭПИТЕЛИАЛЬНЫХ НЕОПЛАЗИЙ
По МКБ-10, данное заболевание кодируется следующим образом.
N89.0 Слабовыраженная дисплазия влагалища — VAIN I, для которой характерно развитие атипии в нижней трети эпителиального пласта.
N89.1 Умеренная дисплазия влагалища — VAIN II, для которой характерно развитие атипии в двух третях эпителиального пласта.
N89.2 Резко выраженная дисплазия влагалища, не классифицированная в других рубриках, — VAIN III, тяжелая карцинома in situ с атипией по всей толщине эпителия — от базальной мембраны до поверхности.
N89.3 Дисплазия влагалища неуточненная.
Согласно еще одной ориентировочной классификации, в основе которой лежит клинико-патологическое описание, выделяются четыре формы: de novo, или изолированная; ассоциированная с вульварной интраэпителиальной неоплазией (vulvar intraepithelial neoplasia, VIN) или инвазивным раком наружных половых органов; ассоциированная с cervical intraepithelial neoplasia (CIN); ассоциированная с CIN и VIN или их инвазивными вариантами[8].
ЭТИОЛОГИЯ ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
Несмотря на малую изученность данного заболевания, выделяют несколько этиологических факторов развития VAIN. Основной причиной возникновения VAIN является ВПЧ[9]. Всего к настоящему моменту описано свыше 190 типов ВПЧ, среди которых выделяют типы высокого и низкого онкогенного риска.
К онкогенным относят 12 типов ВПЧ, из них наиболее значимы 16-й и 18-й. Они становятся причиной до 80% случаев рака влагалища. Количество выявленных случаев рака влагалища в 2014 и 2015 гг. — 458 и 491 соответственно. Доля ассоциации злокачественного поражения влагалища с ВПЧ 16-го и 18-го типов составляет 40%[3].
Во всех исследованиях, направленных на выявление ВПЧ при VAIN и раке влагалища, ВПЧ 16-го типа был наиболее распространенным. ВПЧ обнаружен у 99–100% женщин с low-grade squamous intraepitelial lesions/VAIN I, у 90–96% с high-grade squamous intraepitelial lesions (HSIL)/VAIN II–III и у 64–75% с инвазивным раком влагалища[10–15].
Высокий риск VAIN наблюдается у женщин, у которых ранее уже была дисплазия шейки матки и вульвы, особенно при консервативном лечении, включая лазер, диатермию петлей или криотерапию. Связь VAIN с CIN встречается в 65% случаев, с VIN — в 10%, тогда как сочетание с сопутствующими CIN и VIN — в 30–80% случаев[9].
Другой немаловажный этиологический фактор — выполненная гистерэктомия по поводу дисплазии шейки матки[1]. После гистерэктомии у 17,8% пациенток наблюдают вагинальную неоплазию, спровоцированную недостаточным иссечением стенки влагалища[6]. В некоторых исследованиях частота выявления VAIN варьирует от 7,4% до 39,5% (такая разница в значениях связана с различным количеством пациенток, которые были охвачены исследованиями)[16–20].
Фактором развития VAIN является и ранее проведенная лучевая терапия по поводу рака шейки матки. Частота VAIN может повышаться через 10–15 лет после лучевой терапии: предполагается, что эпителий влагалища сенсибилизируется низкодозным излучением к последующему развитию неоплазии[7]. VAIN, которая возникает после лучевой терапии гинекологических злокачественных заболеваний, труднее поддается лечению по сравнению с теми, что появляются при отсутствии предварительной обработки излучением, для нее характерны бо’льшая частота рецидивов и, возможно, более выраженная тенденция к прогрессированию[21].
К факторам развития VAIN относят иммуносупрессию после трансплантации почки или других органов либо другие причины иммунодефицита, включая ВИЧ-инфекцию[6]. Установлено, что VАIN I диагностируется у 43–53% женщин, живущих с ВИЧ, а VAIN II–III — у 13–16%[22–24].
Этиологическими факторами считают также внутриутробное воздействие диэтилстильбэстрола и курение. Двадцать пять лет назад повышенный относительный риск развития CIN II–III и VAIN II–III был отмечен у женщин, подвергшихся воздействию диэтилстильбэстрола в утробе матери, и с тех пор это подтвердилось[9, 25]. Связь с курением была обнаружен в 41–51% случаев[9, 26, 27]: курящие женщины с ВПЧ-инфекцией имеют значительно более высокий риск VAIN II–III по сравнению с таковым у некурящих[9, 28].
ЧАСТОТА ПРОГРЕССИРОВАНИЯ ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
Время, за которое развивается патология влагалища, может составлять от 2 до 17 лет. У 1–3% пациенток с CIN уже имеется или в последующем развивается VAIN[7]. По данным исследования 2017 г., в 18,9% случаев одновременно выявляются интраэпителиальные неоплазии шейки матки и влагалища (свода)[5]. Частота VAIN после гистерэктомии с сопутствующей CIN колеблется от 0,9% до 6,8%[19].
В ретроспективном исследовании установлено, что частота прогрессии VAIN у пациенток после лучевой терапии, проведенной по поводу онкогинекологических заболеваний, была в 2 раза выше, чем у женщин, такую терапию не получавших[21]. Средний период от постановки диагноза ВИЧ до развития VAIN — 14 лет[24].
Точный злокачественный потенциал VAIN по-прежнему неизвестен. В то же время в нескольких исследованиях частота прогрессирования VAIN до рака влагалища составляла от 2% до 7%[21, 29, 30].
КЛИНИКА ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
У больных VAIN отсутствуют патогномоничные жалобы. Пациентки могут жаловаться на боли внизу живота и необычные выделения из влагалища, но наличие очагов эндометриоза также может стать основанием для жалоб на боли, кровянистые выделения из половых путей, поэтому диагноз часто бывает случайным[9].
ДИАГНОСТИКА ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
Осмотр. При осмотре в зеркалах очаги VAIN имеют шероховатую поверхность, сероватый или розовый цвет, могут иметь вид остроконечных или плоских кондилом.
Цитология. Цитологический метод исследования может использоваться для скрининга VAIN, особенно у женщин после гистерэктомии, потому что у них он показал не меньшую чувствительность, чем у пациенток, которым гистерэктомия не проводилась. Цитологическая чувствительность к VAIN II–III составила 58,8–80,8% независимо от того, была в анамнезе гистерэктомия или нет[6].
Скрининговая программа в Великобритании недавно рекомендовала включить в протокол наблюдения после гистерэктомии по поводу полностью удаленной CIN результаты цитологии через 6 и 18 месяцев[7].
Оценка точности влагалищной цитологии в прогнозировании HSIL/VAIN II–III ограничена несколькими доступными исследованиями. В одном проспективном исследовании 830 женщин после гистерэктомии чувствительность ее была 83%[10, 31]. Положительная прогностическая ценность цитологии для HSIL/VAIN II–III, по данным нескольких работ, колеблется от 0 до 14%[10].
ВПЧ-тестирование. Инфицированность ВПЧ одинаково распространена среди женщин с интактной маткой и среди женщин после гистерэктомии. Чувствительность ВПЧ-типирования для VAIN II–III составляет 92,3–93,5% независимо от того, была в анамнезе гистерэктомия или нет[6]. Чувствительность положительного ВПЧ-теста варьируется от 15% для прогноза HSIL/VAIN II–III до 75% для прогноза персистенции/прогрессирования VAIN[10].
Вагиноскопия. Представляет собой осмотр слизистой влагалища кольпоскопом под увеличением и с источником света. В большинстве случаев VAIN развивается в верхней трети, а средняя и нижняя трети поражаются менее чем в 10% случаев. VAIN после гистерэктомии, выполненной по поводу CIN, обычно возникает в складках купола влагалища на 3 и 9 ч, так называемых «собачьих ушках» сводов влагалища[7].
При вагиноскопии необходимо использовать дополнительные инструменты, например изогнутые щипцы или щипцы Дежардена либо Когана. Важно нанести разбавленный раствор (3–5%) уксусной кислоты на всю слизистую влагалища. При отсутствии аллергии на йод следует также применять раствор Люголя (проба Шиллера); йод-негативные области видны в очагах VAIN.
Множество влагалищных складок, карманов, мультифокальный характер поражения требуют, чтобы кольпоскопист во время кольпоскопического исследования поворачивал зеркало с полностью открытыми створками на 360 градусов, особенно при его удалении, чтобы увидеть полностью все стенки влагалища[7, 10, 32].
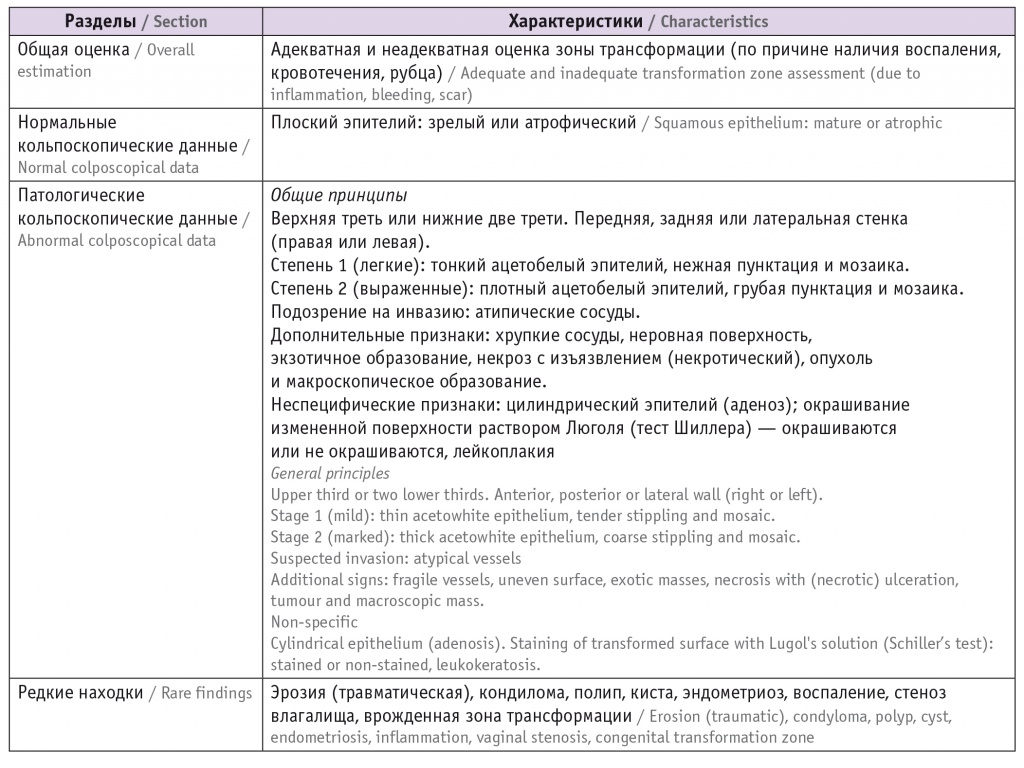
В 2012 г. Международная федерация патологии шейки матки и кольпоскопии опубликовала пересмотренную терминологию для нормальных и патологических кольпоскопических характеристик влагалища, включая VAIN (табл. 1)[33].
Таблица 1
Терминология Международной федерации патологии шейки матки и кольпоскопии для нормальных и патологических кольпоскопических характеристик влагалища
Биопсия. При выявлении поражения во время вагиноскопии необходимо провести биопсию влагалища, так как только результат гистологического исследования поможет различить нормальный эпителий, доброкачественное, продуктивное поражение VAIN I и предрак. Поражения в верхних двух третях влагалища обычно не требуют анестезии перед биопсией, однако в нижней трети влагалища больше нервных окончаний, и перед биопсией может потребоваться местная или инъекционная анестезия.
Выбор биопсийных щипцов зависит от предпочтений врача. Необходимо немного вывести зеркало в среднюю или нижнюю треть влагалища и подтянуть открытые створки, чтобы складки с VAIN приняли выпуклую форму и было легче выполнять биопсию. В таких случаях можно использовать и крючок.
Редко развивается серьезное кровотечение, но оно легко останавливается путем аппликации нитрата серебра или раствора Монселя (сульфат железа).
Лучевые изменения во влагалище трудно оценить, поэтому обязательно проводится многофокусная биопсия любых подозрительных участков[7, 10].
ЛЕЧЕНИЕ ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
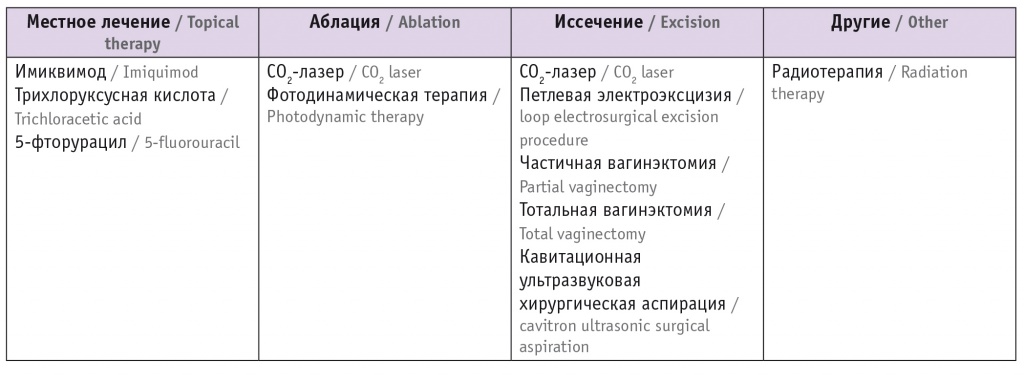
Лечение необходимо индивидуализировать в зависимости от характеристик пациентки, распространения болезни и предыдущих терапевтических процедур. С помощью радикального лечения сложно достигнуть результата, потому что стенки влагалища находятся в тесной связи с мочеиспускательным каналом, мочевым пузырем и прямой кишкой. Это условие также объясняет риск осложнений, связанных с эксцизионной хирургией и радиотерапией (табл. 2)[9].
Таблица 2
Виды лечения влагалищной интраэпителиальной неоплазии
СО2-лазер может быть использован в качестве метода аблации и метода эксцизии, поэтому несколько авторов считают его методом выбора[9, 30, 34, 35].
Сообщалось об использовании лазерной вапоризации для лечения поражений в других местах, помимо сводов влагалища, а также в случае необходимости сохранения половой функции у молодых сексуально активных женщин. CO2-лазер полезен при терапии труднодоступных участков влагалища, таких как угловые карманы свода влагалища после гистерэктомии. Недоступность некоторых поражений является вероятной причиной терапевтической неудачи при использовании данного метода. Поэтому лазерная вапоризация должна выполняться, когда оператор подтверждает, что все поражение полностью визуализировано, когда нет подозрений на инвазию и нет грубых рубцов или деформации свода влагалища[9, 36].
Рекомендуется проводить тщательную вапоризацию свода у женщин после гистерэктомии из-за высокого риска инвазии. Минимальная глубина такой обработки должна составлять 1,5 мм, а толщина поражения эпителия VАIN варьирует от 0,1 до 1,4 мм[9, 37]. Лазер эффективен в 42–90% случаев. Частота рецидивов составляет 0–42%.
Эта процедура имеет много преимуществ: точность в обоих направлениях и точность глубины разрушения, малое количество побочных эффектов, минимальная потеря крови, а также возможность объединения лазерного иссечения и вапоризации. С другой стороны, его недостатками являются высокая стоимость и некоторые пропущенные поражения VAIN[9].
Петлевая электроэксцизия — хирургический эксцизионный метод, который можно применять для выполнения частичной верхней кольпотомии в гистологически подтвержденных единичных очагах VAIN II–III. Лечение проводится вместе с использованием 5-фторурацила[9, 34]. Иссекаются слизистая оболочка влагалища и часть подслизистой ткани. Процедура приводит к минимальному повреждению боковых стенок, подобно воздействию лазера.
Сообщается, что частота рецидивов в исследовании 23 пациенток составила 13% через 12 месяцев и 25% через 24 месяца[9, 38]. Осложнения редкие, но значимые, например перфорация сигмовидной ободочной кишки[9].
Кавитационная ультразвуковая хирургическая аспирация. Техника характеризуется селективным удалением пораженной ткани с минимальным повреждением окружающей здоровой ткани. Выполняется под общей или спинномозговой анестезией в операционной. Количество рецидивов VAIN II–III после кавитационной ультразвуковой хирургической аспирации составляет от 25% до 34%, как при лазерной технике, но с меньшей частотой послеоперационных болей и с лучшим заживлением. Она эффективна приблизительно в 50% случаев рецидива[7, 9, 39].
Лучевая терапия (брахитерапия). Эта техника включает подведение источника излучения близко к участкам поражения VAIN. Обычно используется средняя доза в пределах 48–60 Гр, проводят 2 сеанса с интервалом в неделю. В ряде исследований частота рецидивов варьировала от 93–100%. При 25-летнем наблюдении 28 женщин, которым подводили более высокую дозу, частота возникновения рецидивов составила всего 7%[7].
Фотодинамическая терапия. Осуществляется с помощью лазерного луча с длиной волны 635 нм и выходной мощностью 80–125 Дж/см2 с применением фотосенсибилизатора (например, 10% 5-аминолевулиновой кислоты), который селективно нацелен на пораженные клетки. Фотодинамическая терапия уже активно применяется в лечении CIN и VIN, а также использована в исследованиях больных с VAIN с неубедительными результатами. Время заживления меньше, чем при лечении CO2-лазером[9].
ПРОФИЛАКТИКА ВЛАГАЛИЩНОЙ ИНТРАЭПИТЕЛИАЛЬНОЙ НЕОПЛАЗИИ
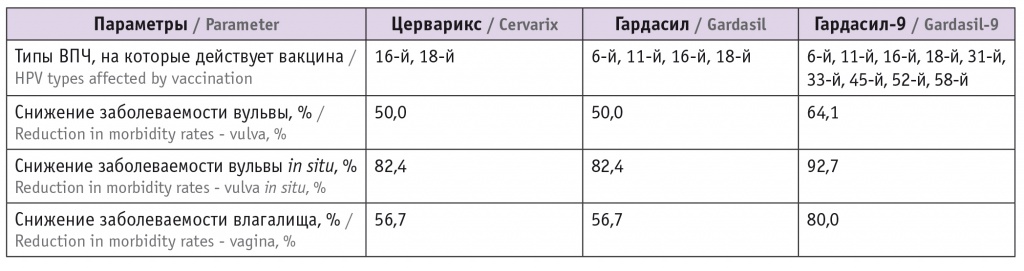
Вакцинация против папилломавирусной инфекции является приоритетной мерой первичной профилактики ВПЧ-ассоциированных раков, в том числе рака шейки матки, вульвы и влагалища. Эффективность вакцины против ВПЧ 16/18 составляет 71% у женщин с уже приобретенными ВПЧ 16/18 при VAIN II–III, она также обеспечивает снижение числа всех случаев VАIN высокой степени поражения независимо от типа ВПЧ на 49%[40]. Гардасил показал 100%-ную эффективность при аногенитальных поражениях, которые включали ВПЧ-ассоциированные заболевания вульвы и влагалища[40–45].
В исследовании, проведенном в четырех скандинавских странах, продемонстрирована эффективность вакцины против ВПЧ типов 6/11/16/18, связанных с CIN, раком вульвы и раком влагалища. Среди женщин, которые получили вакцину против ВПЧ, не было ни одного случая рака влагалища[46].
В таблице 3 представлена сводная информация по эффективности различных вакцин относительно ВПЧ-ассоциированных болезней вульвы и влагалища in situ и инвазивных заболеваний[13].
Таблица 3
Эффективность различных вакцин относительно болезней вульвы и влагалища, ассоциированных с вирусом папилломы человека (ВПЧ)
ЗАКЛЮЧЕНИЕ
Представленный анализ свидетельствует о том, что нельзя недооценивать опасность поражения влагалища у ВПЧ-позитивных пациенток даже после проведенной гистерэктомии. Влагалище следует исследовать во время каждой кольпоскопии.
Вакцинация против ВПЧ является действенной мерой профилактики ВПЧ-ассоциированных раков и предраков, включая влагалищные интраэпителиальные неоплазии.
Поступила: 20.12.2019
Принята к публикации: 26.12.2019








