Генитальный пролапс (ГП) представляет собой не только медицинскую, но и серьезную социально-экономическую и психологическую проблему, существенно снижает качество жизни женщины. Важно отметить, что одна треть пациенток с ГП — женщины до 30 лет[12, 32]. Проблема опущения и выпадения внутренних половых органов обусловлена не только тенденцией к увеличению распространенности и тяжести данной нозологии, но и стабильно большей частотой рецидивов после практически всех видов хирургического лечения ГП (2,3–8,8%)[1, 3, 10]. В России среди всех гинекологических заболеваний выпадения органов малого таза, нуждающиеся в хирургической коррекции, составляют 28–38,9%[1, 10]. В 6–43% случаев после гистерэктомии по поводу различных заболеваний возникает выпадение купола влагалища[2, 10, 19, 31].
Рецидивы после операции проявляются анатомо-функциональными расстройствами — вновь или впервые проявляющимся ГП и/или нарушением функции соседних органов, возникновением эрозии стенок влагалища после установки сетчатых имплантов. У 85,5% пациенток с пролапсом развиваются функциональные расстройства смежных органов: недержание мочи (70,1%), нарушение дефекации (36,5%), диспареуния (53,3%)[14].
Рецидивные формы ГП обусловлены не только погрешностями в выполнении оперативного вмешательства, ожирением, хронически повышенным внутрибрюшным давлением, но и наличием генерализованной дисплазии соединительной ткани (ДСТ) и гипоэстрогенией[2–4, 10, 12, 17]. Под ДСТ подразумевают генетически детерминированную аномалию структуры межклеточного матрикса, обусловленную уменьшением содержания отдельных видов коллагена или нарушением их соотношения, проявляющуюся снижением прочности соединительной ткани[4, 7, 12, 17]. Высокая частота рецидивов при использовании различных методов оперативного лечения ГП стала основанием для использования синтетических имплантов, но и они, по данным литературы, могут приводить к возникновению рецидивов и образованию эрозий стенок влагалища[6, 9, 16, 24, 30].
Некоторые авторы считают, что значимой причиной рецидивов после оперативного вмешательства является ДСТ, которая ассоциируется с генами коллагена III типа (COL3A1) и рецептора эстрогена альфа (ESR1). По мнению исследователей, полиморфизм гена COL3A1 может влиять на прочность и растяжимость коллагеновых волокон и тем самым изменять качество соединительной ткани[12, 22, 28, 29]. Полиморфизм гена ESR1 способен нарушать экспрессию стероидных гормонов, приводя к аномальной сборке коллагена[21, 34]. Анализ литературных данных позволил выявить наиболее перспективные полиморфизмы с точки зрения их ассоциации с ГП — полиморфные локусы rs1800255 в гене COL3A1 и rs2228480 в гене ESR1[21, 23, 28, 29].
В литературных источниках на сегодняшний день нет исследований по сопоставлению полиморфизмов генов COL3A1 и ESR1 у женщин с наличием рецидивных форм ГП и их влияния на отдаленные результаты оперативного лечения. Это стало основанием для проведения настоящего исследования.
Цель работы: оценить значимость полиморфизмов генов COL3A1 и ESR1 для исходов хирургической коррекции ГП.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено в 2010–2011 гг. на базе Центра планирования семьи и репродукции г. Москвы (главный врач — к. м. н. О. А. Латышкевич) и на клинической базе кафедры акушерства и гинекологии Российского национального исследовательского медицинского университета им. Н. И. Пирогова (заведующая кафедрой — академик РАН, профессор Г. М. Савельева). Обследовали 58 пациенток в возрасте от 35 до 75 лет, поступивших для выполнения различных реконструктивно-пластических операций по поводу ГП 2–4-й стадии. Исследуемая группа была сформирована методом сплошной тематической выборки. Е. С. Ли лично курировала всех участниц исследования.
Для определения состояния тазового дна использовали Международную классификацию количественной оценки пролапса тазовых органов (Pelvic Organ Prolapse Quantification)[20].
Критерием включения служили 2-я и более стадии ГП. Критерии исключения: наличие тяжелой соматической и/или эндокринной патологии, онкологические заболевания, беременность. Никто из включенных в исследование не получал заместительную гормональную терапию. Все пациентки подписывали информированное согласие на участие в исследовании.
Средний возраст участниц составил 58,9 года. При этом 5,2% были в возрасте 35–39 лет, 10,3% — в возрасте 40–49 лет. Подавляющее большинство оперированных по поводу ГП были в возрасте 50 лет и старше (84,5%).
Из 58 участниц исследования 49 (84,5%) впервые подверглись хирургической коррекции тазового дна, 9 (15,5%) были оперированы по поводу рецидива ГП. При детальном анализе группы женщин с рецидивными формами пролапса выявлено, что одной пациентке ранее была выполнена манчестерская операция, одной — кольповагинопексия по методике Prolift anterior et posterior без удаления матки, остальным семи — надвлагалищная ампутация матки с последующим укреплением связочного аппарата различными способами: кольпоперинеолеваторопластика (n = 2), сакровагинопексия (n = 3), лигатурная цервикосуспензия (n = 1), вентрофиксация культи шейки матки (n = 1).
Одна из пациенток с рецидивной формой пролапса ранее перенесла три операции по устранению ГП: дважды кольпоперинеолеваторопластику, рецидивы после которой наступили соответственно через 13 лет и 3 года, и сакровагинопексию с одновременной надвлагалищной ампутацией матки, после которой рецидив цистоцеле произошел спустя год.
У 5 из 9 женщин с рецидивными формами ГП были признаки апикального пролапса. Сроки наступления его рецидива составили от 1 года до 15 лет: у 3 женщин рецидивы наступили спустя 11–15 лет, у двух — через 1–3 года.
При обследовании пациенток с признаками ГП обращали внимание на нарушение функции соседних органов. Для оценки типа недержания мочи использовали классификацию, разработанную комитетом стандартов Международного общества по удержанию мочи (International Continence Society). Среди оперированных нами женщин у 33 (56,9%) имели место различные типы нарушения мочеиспускания: стрессовое недержание мочи — у 8 (24,2%), ургентное — у 9 (27,3%), смешанное — у 4 (12,1%), постоянное — у 3 (9,1%), затрудненное мочеиспускание — у 9 (27,3%).
Сексуально активными были 26 из 58 (44,8%) пациенток. В их числе на нарушения сексуальной функции, связанные с ГП, указали 17 (65,4%) женщин.
Известно, что ГП является частным проявлением ДСТ. В нашем исследовании сочетание ГП и малых форм недифференцированной ДСТ было выявлено у 25,9% обследованных.
Выбор вида операции определялся возрастом пациентки, стадией и типом ГП, характером сопутствовавшей гинекологической патологии, наличием или отсутствием половой жизни. Распределение обследованных по стадиям ГП и видам выполненных операций представлено в таблице 1.
Таблица 1
Стадии генитального пролапса и виды операций у обследованных пациенток
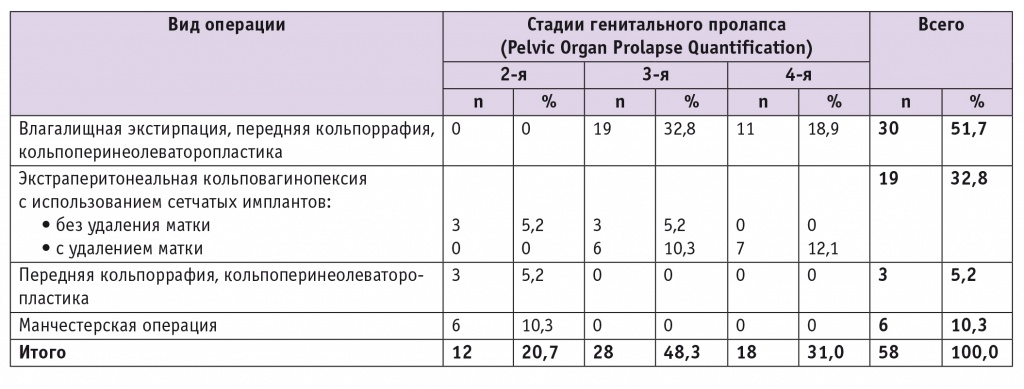
Из данных таблицы 1 видно, что у 67,2% участниц реконструктивно-пластические операции выполняли с помощью собственных тканей. Синтетические импланты были использованы у 32,8% пациенток. Экстраперитонеальная кольповагинопексия 14 (73,7%) пациенткам была выполнена по методике Prolift anterior, posterior, total и 5 (26,3%) — по методике Elevate apical anterior, posterior.
У 25,9% женщин операции по устранению ГП не сопровождались удалением матки.
Всем 9 пациенткам с рецидивными формами ГП были выполнены хирургические вмешательства вагинальным доступом: фиксация и укрепление фасциальных структур и связочного аппарата собственными тканями — у 4, с использованием синтетических имплантов — у 5.
Слинговые операции по поводу стрессового недержания мочи с использованием петлевой методики TVT(O) в сочетании с операцией на тазовом дне по устранению ГП были произведены у 10,3% пациенток исследуемой группы.
В ходе хирургического вмешательства для проведения молекулярно-генетических исследований брали биоптат задней стенки влагалища. Выделение и очистку ДНК из биоптата задней стенки влагалища осуществляли с помощью коммерческого набора реактивов «ДНК/РНК» (НПФ «Литех», Россия). ПЦР, рестрикцию и визуализацию фрагментов ДНК проводили согласно стандартной методике[13] с использованием специфических праймеров (НПФ «Литех», Россия), трансиллюминатора ECX-F20.M и видеосистемы (Vilber Lourmat, Франция).
С целью определения значимости исследуемых однонуклеотидных полиморфизмов rs1800255 гена COL3A1 и rs2228480 гена ESR1 в патогенезе ГП был проведен статистический анализ частот встречаемости аллелей дикого и мутантного типа по генам COL3A1 и ESR1 у обследованных пациенток. Критерий χ2 с одной степенью свободы применяли для анализа частот встречаемости аллелей: (G) — аллель дикого типа полиморфизмов rs1800255, rs2228480, (А) — мутантный аллель полиморфизмов rs1800255, rs2228480. Однонуклеотидные полиморфизмы rs1800255 гена COL3A1 и rs2228480 гена ESR1 представляют собой замену гуанина (G) на аденин (А). Для определения частоты встречаемости генотипов: GG — гомозигота по аллелю дикого типа, GA — гетерозиготный вариант полиморфизма, AA — гомозигота по мутантному аллелю (А) — использовали критерий χ2 с двумя степенями свободы.
Статистическую обработку проводили при помощи программного обеспечения GraphPad Prism. Распределение частот генотипов всех полиморфных локусов в исследуемых группах соответствовало распределению Харди — Вайнберга. Статистически значимыми считали различия при p < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования интраоперационные осложнения не были зарегистрированы. В послеоперационном периоде у одной (1,7%) из 58 пациенток зафиксирован инфильтрат купола влагалища после влагалищной экстирпации матки с кольпоперинеолеваторопластикой. Проведена эффективная противовоспалительная терапия. При подобных операциях существует риск возникновения воспалительных процессов, так как создаются предпосылки для развития послеоперационных осложнений[16].
Нами проведено контрольное обследование пациенток через 2–2,5 года после выполненных операций. Данные представлены на рисунке 1.
Рис. 1. Варианты генитального пролапса у женщин исследованной группы до и после реконструктивно-пластических операций (n = 58), n (%)
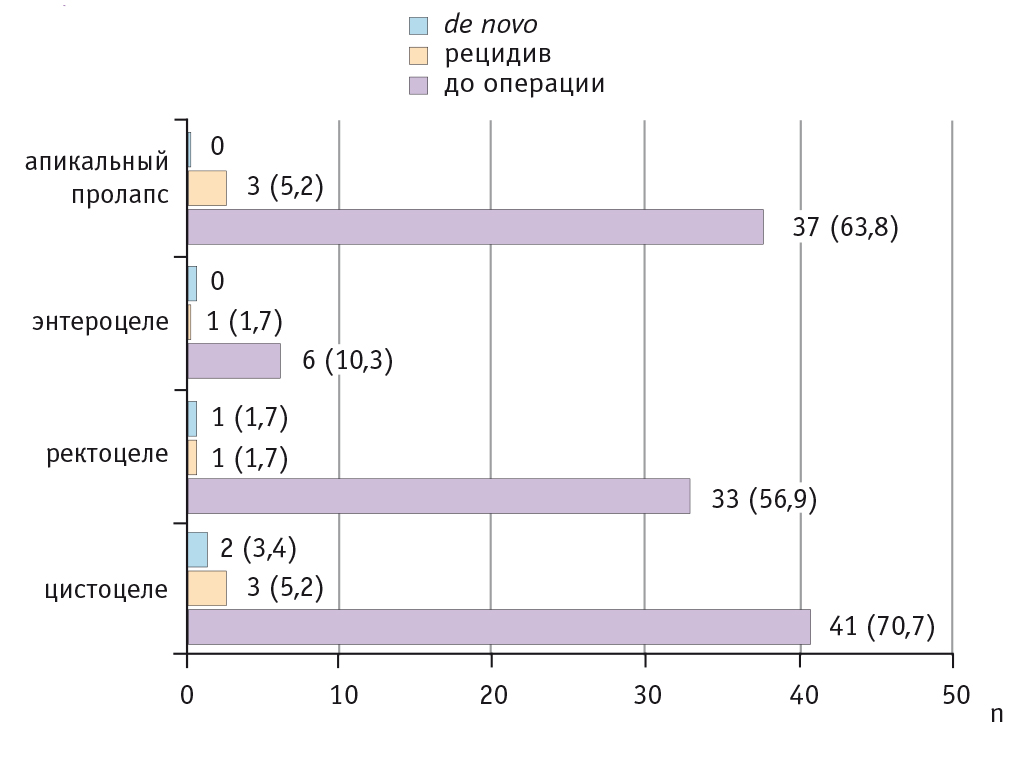
У 47 (81,0%) из 58 пациенток отмечена анатомическая состоятельность тазового дна. Как видно из данных, представленных на рисунке 1, у 11 (19,0%) женщин при динамическом наблюдении выявлены различные варианты ГП, при этом рецидив заболевания у ранее оперированных наступил в 8 (13,8%) случаях, варианты ГП, которых не было ранее, возникли у 3 (5,2%) пациенток.
Рецидив цистоцеле наступил у 3 (7,3%) из 41 больной, имевшей до операции цистоцеле; у двух обследованных за время наблюдения анатомические признаки цистоцеле (2–3-й степени) появились впервые. Рецидив ректоцеле наблюдали у одной пациентки из 33 (3,0%), еще у одной появились признаки ректоцеле, которого не было ранее. Рецидив энтероцеле возник у одной больной. Рецидивы апикального ГП (купола влагалища, матки) спустя 2 года после операций выявлены у 3 (8,1%) из 37 женщин, у которых он был до операции.
У 9 из 11 пациенток c рецидивом и прогрессированием ГП в нашем исследовании были выполнены реконструктивно-пластические операции с помощью собственных тканей. При детальном анализе отдаленных результатов выявлено, что рецидив заболевания наступил у 7 (17,9%) из 39 женщин, у которых операции были произведены с использованием собственных тканей, у остальных 2 (5,1%) пациенток зафиксировано появление анатомических дефектов, которые не определялись при первом вмешательстве.
Среди оперированных с использованием сетчатых имплантов (n = 19) рецидив ГП возник у одной (5,3%) больной в виде цистоцеле после Prolift anterior et posterior и у одной пациентки отмечено ректоцеле de novo после устранения дефекта только передней стенки влагалища (Prolift anterior). У 15,8% женщин после операции с использованием синтетических материалов развилась эрозия стенок влагалища. По данным отечественной литературы, число рецидивов после пластических операций с использованием собственных тканей составляет 7,1–43%, с применением сетчатых протезов — 4,7–29% в сроки наблюдения до 3 лет[4, 8, 15, 18]. По сведениям зарубежных авторов, эти цифры составляют 17,2–36,2% после операций с применением собственных тканей и 3,5–12,8% при использовании синтетических имплантов[25, 33].
Результаты нашего исследования выявили возникновение рецидива ГП у 17,9% пациенток после реконструктивно-пластических операций с использованием собственных тканей и у 5,3% после вмешательств с применением сетчатых имплантов. Более подробный анализ видов рецидива опущения тазовых структур показал, что рецидив апикального пролапса развился у пациенток, оперированных с использованием собственных тканей.
Оперативное лечение у 81,0% женщин было эффективным. У 19,0% участниц нашего исследования функциональное состояние не улучшилось: у 3,4% пациенток это было связано с рецидивом апикального пролапса, у 8,6% — с недержанием мочи, у 1 (1,7%) пациентки появились признаки констипации, у 3 из 26 (11,5%) — нарушения половой функции. Одна участница, несмотря на рецидив апикального пролапса, не отмечала ухудшение качества жизни и жалоб не предъявляла. Данные представлены на рисунке 2.
Рис. 2. Клинические проявления симптомов, сопутствующих генитальному пролапсу, в динамике (n = 58), n (%)
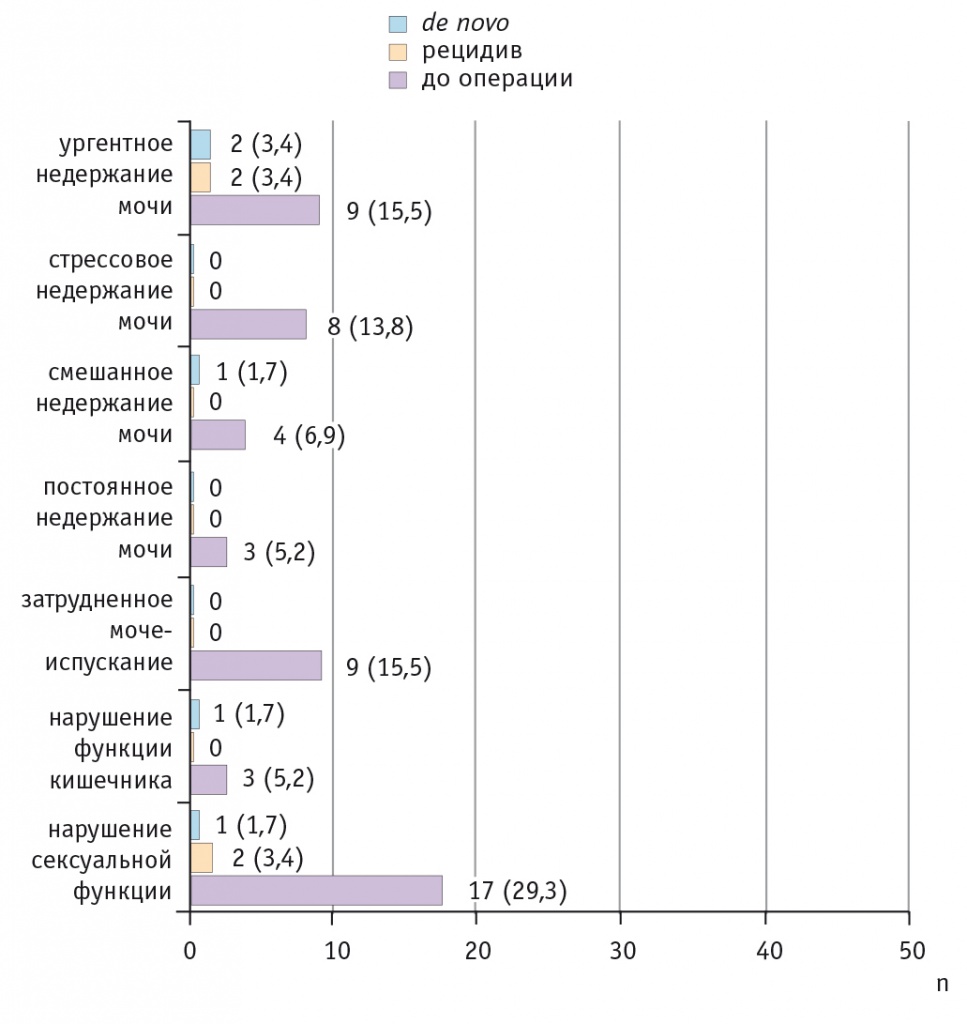
Дизурию до операции наблюдали у 33 (56,9%) из 58 пациенток: у 24 (41,4%) — недержание мочи различного генеза, у 9 (15,5%) — затрудненное мочеиспускание. После оперативного устранения ГП у 31 из этих 33 женщин жалобы исчезли. После хирургического устранения стрессового недержания мочи мочеиспускание восстанавливалось в течение первых двух суток. Послеоперационных осложнений после уретропексии в нашем исследовании не выявлено.
У 2 (3,4%) пациенток сохранились явления ургентного недержания мочи, у 3 (5,2%) появились симптомы недержания мочи: у 2 женщин — ургентного, у одной — смешанного типа (сочетание ургентного и стрессового компонентов). Эти пациентки перенесли влагалищную экстирпацию матки с последующей кольпоррафией (n = 2), кольповагинопексию с использованием сетчатых имплантов (n = 1). Полученные данные не противоречат результатам исследований, проведенных ранее другими авторами[22, 26, 36–38].
У всех 3 (5,2%) пациенток с жалобами на затрудненную дефекацию и констипацию до операции после оперативного лечения наступило клиническое улучшение. У одной (1,7%) больной из 58 выявлены впервые возникшие затруднения акта дефекации после влагалищной экстирпации матки с последующей передней и задней кольпоррафией.
Анализируя влияние оперативного вмешательства на половую жизнь, мы отметили, что после операций с использованием сетчатых имплантов появляется риск развития эрозий стенок влагалища, вызванных наличием инородного материала (3,8–11,9%), что приводит к ухудшению качества жизни пациенток вследствие диспареунии (9,0–17,3%). Это подтверждают некоторые авторы[5, 10, 27]. В нашем исследовании эрозия стенок влагалища возникла у 3 (15,8%) из 19 женщин, диспареуния ввиду наличия данного дефекта — у 2 (10,5%) пациенток.
У 17 обследованных пациенток до операции имели место сексуальные нарушения, связанные с ГП. После экстраперитонеальной кольповагинопексии с использованием сетчатых имплантов 3 женщины отметили ухудшение половой функции, у 2 из 3 пациенток оно было связано с формированием эрозии стенок влагалища.
В ходе статистического анализа частот встречаемости аллелей и полиморфизмов генов COL3A1 (rs1800255) и ESR1 (rs 2228480) установлено, что 53,4% пациенток — носительницы полиморфного генотипа COL3A1, частота встречаемости полиморфизма гена рецептора ESR1 составила 67,2%.
При анализе частот встречаемости полиморфизмов генов COL3A1 и ESR1 у 15 пациенток с косвенными признаками ДСТ обнаружено, что полиморфный генотип ESR1 имел место в 9 (60,0%) наблюдениях, полиморфный генотип COL3A1 — у 2 (13,3%) женщин. Сочетание полиморфизмов генов COL3A1 и ESR1 выявлено у 2 (13,3%) пациенток. Среди женщин без ДСТ полиморфизмы исследованных генов были обнаружены в 52% наблюдений.
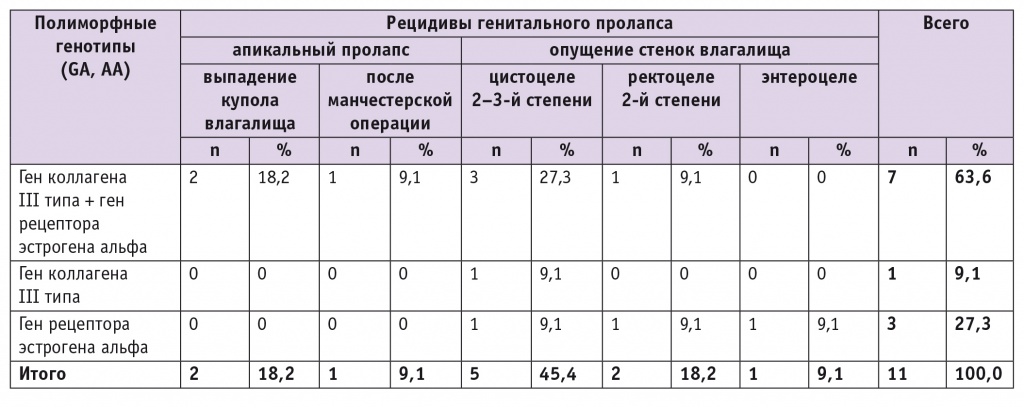
Нами проведено сопоставление отдаленных результатов операций и полиморфизмов генов COL3A1 и ESR1. Данные представлены в таблице 2, откуда видно, что у 63,6% пациенток при рецидивных формах ГП после выполненных операций выявлено наличие одновременно полиморфных генотипов COL3A1 и ESR1. У всех женщин с апикальной формой ГП после операции обнаружено сочетание полиморфизмов исследуемых генов. У участниц нашего исследования полиморфный генотип ESR1 выявлен в 27,3%, COL3A1 — в 9,1% случаев. Наличие полиморфных генотипов COL3A1 и ESR1 у женщин без рецидивов ГП описано нами ранее[11].
Таблица 2
Характер осложнений у оперированных пациенток и частота встречаемости полиморфных генотипов
Мы провели сопоставление вышеописанных типов недержания мочи с наличием полиморфных генотипов СOL3A1 и ESR1 (табл. 3).
Таблица 3
Характер недержания мочи до операции с учетом полиморфных генотипов
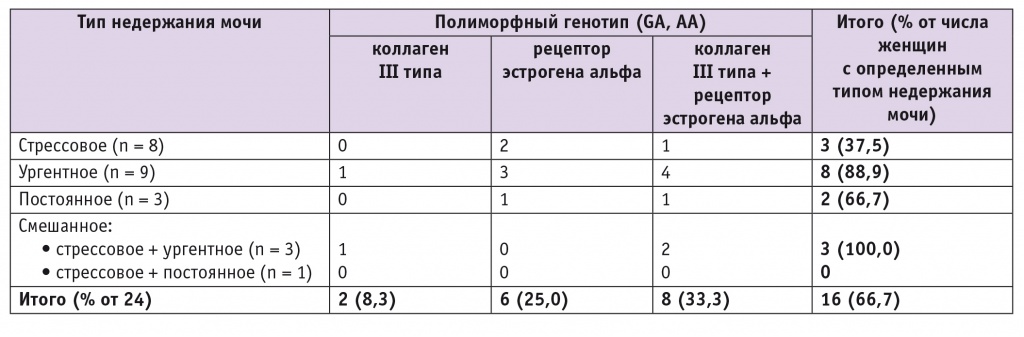
Согласно данным таблицы 3, ургентное недержание мочи до операции было у 9 пациенток, из них у 8 выявлено наличие полиморфных генотипов COL3A1 и ESR1: GA-генотип COL3A1 — у 1, ESR1 — у 3, сочетание COL3А1 и ESR1 — у 4. Смешанный тип недержания мочи с наличием стрессового и ургентного компонентов установлен у 3 женщин, у 2 из них одновременно присутствовали генотипы GA в генах COL3A1 и ESR1. У пациентки с недержанием мочи по смешанному типу, развившимся после операции, установлено одновременное наличие полиморфных генотипов COL3A1 и ESR1.
Нами впервые проведено исследование по обнаружению генетических детерминант как факторов риска развития рецидивов ГП. Работ по изучению полиморфизмов вышеуказанных генов у пациенток с рецидивными формами опущения тазовых структур в литературе на сегодняшний день нет. Отсутствуют и данные по изучению полиморфизмов COL3A1 у женщин с недержанием мочи при ГП. Имеются сведения о низкой экспрессии гена COL3A1 у пациенток с недержанием мочи на фоне ГП[35]. J. N. Cornu и соавт. (2011) не выявили взаимосвязи полиморфизма гена ESR1 с недержанием мочи всех типов[23].
Обобщая вышесказанное, можно предположить, что генотип GA полиморфизмов rs1800255 в гене COL3A1 и rs2228480 в гене ESR1 может являться дополнительным фактором риска, а также выступать в качестве одного из предикторов развития рецидивных форм апикального ГП и ургентного недержания мочи.
ЗАКЛЮЧЕНИЕ
Результатом реконструктивно-пластических операций с точки зрения анатомических изменений может быть как развитие рецидивов тех проявлений пролапса, которые были оперативно устранены ранее, так и прогрессирование заболевания в виде появления новых симптомов.
У пациенток с рецидивными формами генитального пролапса (ГП) и при ургентном недержании мочи наблюдаются полиморфные генотипы коллагена III типа и рецептора эстрогена альфа и их сочетание. Можно полагать, что одновременное присутствие полиморфизмов этих генов является дополнительным фактором риска развития более тяжелых рецидивных форм ГП, в частности апикальной формы. Выявление данных полиморфизмов может быть использовано в качестве прогностического теста для выделения группы риска рецидивов ГП.
Использование генетических маркеров для прогноза развития рецидивных форм ГП и возникновения недержания мочи после операции с целью определения алгоритма ведения пациенток является перспективным направлением научного поиска.








