В настоящее время бронхиальная астма (БА) представляет собой серьезную и все более нарастающую угрозу общественному здоровью. На лечение пациентов с астмой и ассоциированными с ней состояниями, по некоторым данным, расходуется до 10% ресурсов общественного здравоохранения [1, 2].
В литературе имеются сведения о наличии системного воспаления при БА [3]. В исследовании, проведенном S. Kony и соавт. (2004), показано, что бронхиальная гиперреактивность и снижение показателя ОФВ1 были более значимыми в группе больных БА с повышенным содержанием СРБ в сыворотке крови [4]. Роль ФНО-α в развитии бронхообструктивных нарушений подтверждена исследованием, в котором использовались антитела к рецептору ФНО-α у больных с тяжелой БА. На фоне их применения отмечалась положительная динамика, в том числе и снижение гиперреактивности дыхательных путей [5].
Повышение концентрации ИЛ-6 в сыворотке крови при БА ранее установлено J. Ghaffari и соавт. [6]. Основным инициирующим механизмом для развития системной воспалительной реакции при БА является поступление в системный кровоток из очага воспаления отдельных цитокинов и некоторых других медиаторов воспаления.
В исследовании C.E. Green и A.M. Turner (2017) установлена взаимосвязь между нарушениями ФВД, периодически возникающей гипоксемией и формированием окислительного стресса [7]. В свою очередь, накопление продуктов перекисного окисления липидов усугубляет эндотелиальную дисфункцию, способствует прогрессированию АГ, развитию сердечно-сосудистых осложнений (атеросклероза, атеротромбоза) [8]. Особенности формирования и клинические проявления эндотелиальной дисфункции у больных БА молодого возраста требуют дальнейшего изучения, в частности уточнения взаимосвязи уровней провоспалительных цитокинов, СРБ и дислипопротеинемии для подтверждения патогенетического механизма развития сердечно-сосудистых осложнений у пациентов, страдающих БА различной степени тяжести.
Цель настоящего исследования: изучить уровни липидных фракций, провоспалительных цитокинов, СРБ в периферической крови больных БА молодого возраста для выявления возможной взаимосвязи между данными показателями.
МАТЕРИАЛЫ И МЕТОДЫ
На базе аллергологического отделения Краевой клинической больницы г. Красноярска под руководством д. м. н., проф. И.В. Демко и д. м. н., доц. Е.А. Собко обследованы 149 человек: 123 больных БА различной степени тяжести вне обострения заболевания и 26 практически здоровых добровольцев.
Больные БА в зависимости от степени тяжести заболевания были распределены на три группы. В 1-ю группу вошли 29 человек с БА легкого течения, во 2-ю — 64 пациента с БА средней тяжести, в 3-ю — 30 пациентов с БА тяжелого течения. Характеристика участников представлена в таблице 1.
Таблица 1
Характеристика обследуемых групп (Собко Е.А., 2018)
|
Показатели |
1я группа (n = 29) |
2я группа (n = 64) |
3я группа (n = 30) |
Контрольная (4я) группа (n = 26) |
Р |
|---|---|---|---|---|---|
|
Пол, n (%): • женщины • мужчины |
11 (37,9) 18 (62,1) |
35 (54,7) 29 (45,3) |
21 (70,0) 9 (30,0) |
13 (50,0) 13 (50,0) |
р1–2 = 0,1343 р1–3 = 0,0134 р1–4 = 0,3676 р2–3 = 0,1585 р2–4 = 0,6862 р3–4 = 0,1264 |
|
Возраст, годы (Ме [Q1; Q3]) |
22 [20; 25] |
31 [24; 37] |
39 [28; 43] |
33 [30; 35] |
р1–2 = 0,0001 р1–3 = 0,0001 р1–4 = 0,0001 р2–3 = 0,0100 р2–4 = 0,3000 р3–4 = 0,1800 |
|
Давность заболевания, годы (Ме [Q1; Q3]) |
7 [1; 13] |
4 [1; 13] |
15 [10; 19,75] |
– |
р1–2 = 0,4400 р1–3 = 0,0003 р2–3 = 0,0001 |
Примечание. Различия между группами по количественным признакам рассчитаны с использованием критерия Манна — Уитни, по качественным признакам — с помощью критерия χ2.
Критерии включения:
- ранее установленный диагноз БА легкого, среднетяжелого и тяжелого течения;
- возраст 18–44 года;
- подтвержденная данными спирографии бронхиальная обструкция, носящая обратимый характер;
- возможность правильного использования базисных препаратов;
- адекватная оценка своего состояния (по мнению исследователя);
- получение информированного согласия на участие в исследовании.
Критерии исключения: обострение БА, злокачественные новообразования, тяжелая почечная и печеночная недостаточность, беременность и лактация, ХОБЛ.
У всех пациентов проводился тест по контролю над астмой (АСТ), при результате < 19 баллов БА оценивалась как неконтролируемая.
Параметры ФВД регистрировали на аппарате общей плетизмографии ErichEger (Германия). Состояние бронхиальной проходимости оценивали методом спирометрии с бронходилатационным тестом (400 мкг сальбутамола). Тест считали положительным при увеличении ОФВ1
на 12% и 200 мл.
Содержание ФНО-α и ИЛ-6 в плазме периферической крови определяли методом твердофазного иммуноферментного анализа eBioscience (США); общего холестерина, ЛПВП, ЛПНП, триглицеридов — на биохимическом анализаторе Hitachi-512.
Концентрация СPБ в плазме крови оценивалась методом кинетики фиксированного времени путем фотометрического измерения реакции «антиген — антитело» между антителами к человеческому СРБ.
Качественные переменные описаны абсолютными и относительными частотами. При сравнительном анализе групп по количественным признакам использовали непараметрический U-критерий Манна — Уитни. Статистическая обработка была выполнена с помощью программ Microsoft Office Excel и Agricultural Statistics 2009. Количественные значения представлены в виде медианы (Ме) и интерквартильного интервала (Q1 и Q3), где Q1 — 25-й процентиль, Q3 — 75-й процентиль.
РЕЗУЛЬТАТЫ
Согласно результатам АСТ, в 1-й группе полный контроль над заболеванием был достигнут у 24,2% больных, частичный контроль — у 75,8%. Среди пациентов 2-й группы полный контроль наблюдался у 25%, частичный контроль — у 42,2%, а у 32,8% контроль отсутствовал. При тяжелом течении БА в 80% случаев контроль над симптомами заболевания отсутствовал. Клинико-функциональная характеристика, пациентов, включенных в исследование, представлена в таблице 2.
Таблица 2
Клинико-функциональные показатели участников исследования (Собко Е.А., 2018)
|
Показатели |
1я группа (n = 29) |
2я группа (n = 64) |
3я группа (n = 30) |
Контрольная (4я) группа (n = 26) |
Р |
|---|---|---|---|---|---|
|
Число дневных приступов удушья, Ме [Q1; Q3] |
0 |
3 [2; 4] |
7 [5; 10] |
– |
р1–2 = 0,0001 р1–3 = 0,0001 р2–3 = 0,0001 |
|
Число ночных приступов удушья, Ме [Q1; Q3] |
0 |
1 [0; 2] |
3 [2; 4] |
– |
р1–2 = 0,0001 р1–3 = 0,0001 р2–3 = 0,0001 |
|
Потребность в короткодействующих β2агонистах (количество вдохов в сутки), Ме [Q1; Q3] |
0 |
3,5 [1; 6] |
10 [8; 12] |
– |
р1–2 = 0,0001 р1–3 = 0,0001 р2–3 = 0,0001 |
|
Объем форсированного выдоха за 1ю секунду, % (Ме [Q1; Q3]) |
99,9 [92,7; 105,1] |
98,7 [93,2; 107,1] |
81,2 [69,8; 97,1] |
119,9 [98,7; 120,8] |
р1–2 = 0,5200 р1–3 = 0,0055 р1–4 = 0,7500 р2–3 = 0,0001 р2–4 = 0,1000 р3–4 = 0,0020 |
|
Объем форсированного выдоха за 1ю секунду/форсированная жизненная емкость легких, % (Ме [Q1; Q3]) |
84,5 [75,9; 91,4] |
80,04 [67,7; 84,8] |
70,32 [61,6; 79,5] |
84,75 [81,8; 87,1] |
р1–4 = 0,9000 р1–2 = 0,0110 р1–3 = 0,0001 р2–3 = 0,0001 р2–4 = 0,0026 р3–4 = 0,0001 |
Примечание. Различия между группами по количественным признакам рассчитаны с использованием критерия Манна — Уитни.
Полученные нами данные еще раз подтверждают, что с утяжелением течения заболевания возможность достижения контроля астмы затрудняется (рис. 1).
Рис. 1. Корреляционные взаимосвязи между клинико-функциональными параметрами и маркерами системного воспаления в группе больных тяжелой бронхиальной астмой (Собко Е.А., 2018)
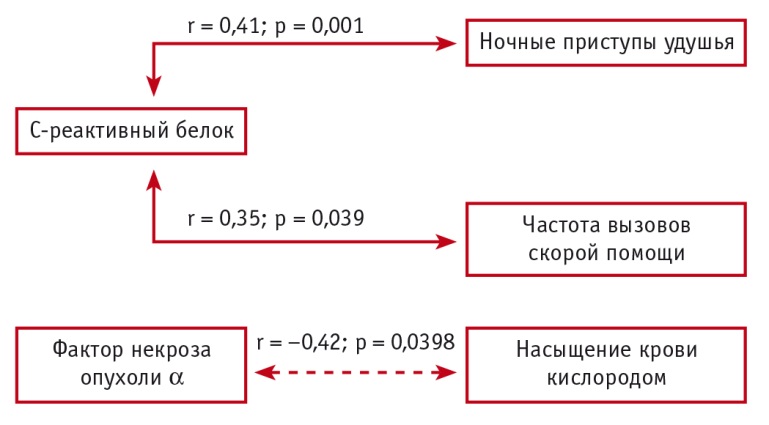
При анализе содержания провоспалительных цитокинов в плазме периферической крови отмечено увеличение концентраций ФНО-α и ИЛ-6, причем наиболее высокие уровни изучаемых цитокинов зарегистрированы в группах больных со среднетяжелым и тяжелым течением БА. Концентрация СРБ в плазме крови увеличивалась в группах пациентов с БА среднетяжелого и тяжелого течения в сравнении с показателями участников контрольной группы и больных БА легкого течения.
Результаты корреляционного анализа подтвердили взаимосвязь между клинико-функциональными показателями и уровнями провоспалительных цитокинов, СРБ в плазме периферической крови пациентов с тяжелым течением БА. Как показано на рисунке 1, в группе больных тяжелой БА установлены положительные взаимосвязи между содержанием в плазме крови СРБ и частотой ночных приступов удушья, а также потребностью в короткодействующих β2-агонистах и отрицательная взаимосвязь между содержанием ФНО-α в плазме крови и насыщением крови кислородом.
При изучении уровней ЛПВП, холестерина в плазме периферической крови не выявлены значимые изменения по сравнению с показателями практически здоровых лиц (р > 0,05). В то же время нами отмечен более высокий уровень триглицеридов у больных БА тяжелого течения в сравнении с показателями пациентов 1-й и 2-й групп (табл. 3).
Таблица 3
Содержание провоспалительных цитокинов, С-реактивного белка, липопротеидов в плазме крови у участников исследования (Собко Е.А., 2018)
| Показатели |
1я группа (n = 29) |
2я группа (n = 64) |
3я группа (n = 30) |
Контрольная (4я) группа (n = 26) |
Р |
|
Фактор некроза опухоли α, пкг/мл |
2,85 [1,8; 5,3] |
13,88 [6,6; 30,8] |
28,51 [15,6; 46,7] |
6,75 [1,2; 8,6] |
р1–2 = 0,0001 р1–3 = 0,0001 р1–4 = 0,1400 р2–3 = 0,2000 р2–4 = 0,0007 р3–4 = 0,0001 |
|
Интерлейкин 6, пкг/мл |
0,97 [0,5; 1,7] |
4,03 [1,6; 6,4] |
3,28 [2,4; 4,5] |
1,61 [0,7; 4,6] |
р1–2 = 0,0002 р1–3 = 0,0007 р1–4 = 0,0500 р2–3 = 0,5700 р2–4 = 0,0050 р3–4 = 0,2700 |
|
Среактивный белок, мг/л |
0,80 [0,3; 2,2] |
1,11 [0,6; 2,4] |
2,25 [0,9; 3,9] |
0,65 [0,4; 1,2] |
р1–2 = 0,1100 р1–3 = 0,0270 р1–4 = 0,7300 р2–3 = 0,0700 р2–4 = 0,0400 р3–4 = 0,0040 |
|
Липопротеины низкой плотности, ммоль/л |
2,75 [2,2; 3,1] |
3,09 [2,4; 3,4] |
2,74 [2,2; 3,4] |
2,41 [2,2; 3,5] |
р1–2 = 0,0001 р1–3 = 0,6700 р1–4 = 0,6500 р2–3 = 0,7400 р2–4 = 0,8600 р3–4 = 0,8600 |
|
Липопротеины высокой плотности, ммоль/л |
1,50 [1,2; 1,6] |
1,41 [1,3; 1,8] |
1,64 [1,3; 1,9] |
1,49 [1,1; 1,8] |
р1–2 = 0,5700 р1–3 = 0,1900 р1–4 = 0,9500 р2–3 = 0,4200 р2–4 = 0,6600 р3–4 = 0,2400 |
|
Холестерин, ммоль/л |
4,59 [3,9; 5,3] |
5,08 [4,4; 5,6] |
5,07 [4,5; 6,2] |
4,44 [4,1; 5,1] |
р1–2 = 0,4400 р1–3 = 0,3100 р2–3 = 0,4800 р1–4 = 0,9500 р2–4 = 0,2600 р3–4 = 0,1500 |
|
Триглицериды, ммоль/л |
0,81 [0,6; 1,2] |
0,93 [0,6; 1,1] |
1,28 [0,8; 1,5] |
0,79 [0,6; 1,3] |
р1–2 = 0,5800 р1–3 = 0,0530 р1–4 = 0,8200 р2–3 = 0,0300 р2–4 = 0,6700 р3–4 = 0,1200 |
Примечание. Множественное межгрупповое сравнение выполнено методом Краскела — Уоллиса. Различия между группами по количественным признакам рассчитаны с использованием критерия Манна — Уитни.
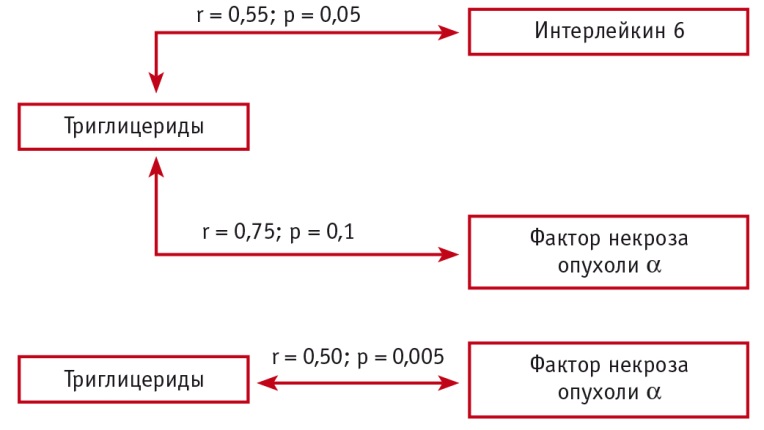
Результаты корреляционного анализа позволили установить взаимосвязи между концентрациями провоспалительных цитокинов, СРБ и содержанием липопротеидов в плазме крови у больных БА молодого возраста различной степени тяжести (рис. 2, 3).
Рис. 2. Корреляционные взаимосвязи между концентрациями провоспалительных цитокинов, С-реактивного белка и содержанием липопротеинов при бронхиальной астме средней тяжести (Собко Е.А., 2018)
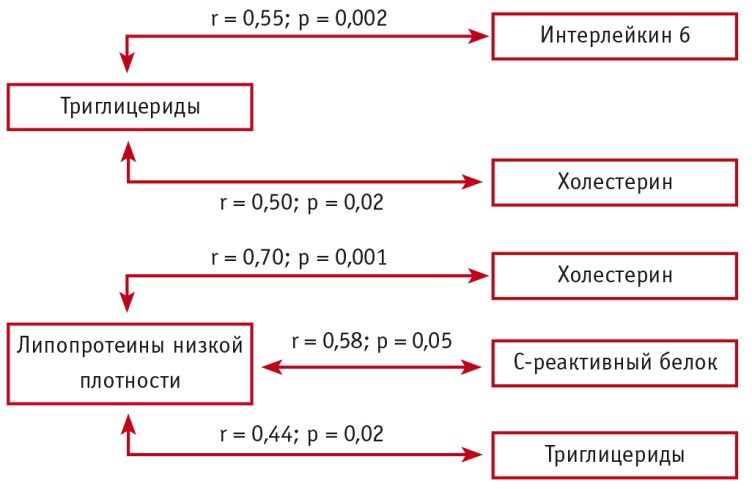
Рис. 3. Корреляционные взаимосвязи между концентрациями провоспалительных цитокинов и триглицеридов при тяжелой бронхиальной астме (Собко Е.А., 2018)
ОБСУЖДЕНИЕ
У больных БА молодого возраста с увеличением тяжести течения заболевания наблюдается рост содержания провоспалительных цитокинов в плазме крови. Повышенный уровень ИЛ-6 может выступать в роли хемоаттрактанта для макрофагов и нейтрофилов, которые продуцируют ФНО-α. Данный цитокин способен проявлять аутокринные свойства, снижая при этом активность липопротеинлипазы, препятствуя поглощению адипоцитами триглицеридов из-за экспрессии транспортеров свободных жирных кислот.
Липопротеинлипаза — фермент, активирующий расщепление липидных комплексов в плазме крови, но в случае ее ингибирования ЛПНП накапливаются в плазме периферической крови, усиливая повреждение сосудистой стенки. Известно также, что СРБ может повышать уровень ЛПНП за счет участия в привлечении моноцитов, которым для образования пенистых клеток необходимы ЛПНП. Этот процесс способствует развитию дисфункции эндотелия.
ЗАКЛЮЧЕНИЕ
Полученные нами результаты еще раз подтверждают наличие системного воспаления даже у молодых пациентов с бронхиальной астмой, которое усиливается с тяжестью течения заболевания и регистрируется вне периода обострения. Повышенные уровни ИЛ-6, ФНО-α и СРБ могут быть пусковыми факторами, влияющими на активацию липидного обмена с последующим повышением риска сердечно-сосудистых осложнений.








