ВВЕДЕНИЕ
Острые формы ИБС стойко занимают первое место в структуре причин смертности от болезней системы кровообращения[1]. Известно, что ближайший и отдаленный прогноз при инфаркте миокарда (ИМ) во многом зависит от сохранности фракции выброса (ФВ) ЛЖ[2]. Однако, несмотря на широкое внедрение методов реваскуляризации, у 25–35% пациентов в течение острого периода ИМ осложняется развитием левожелудочковой сердечной недостаточности (СН)[3].
Пациенты со снижением ФВ ЛЖ менее 40%, особенно при необходимости инотропной поддержки, составляют группу наиболее высокого риска плохого исхода при ИМ[4, 5]. Известно, что 3-летняя выживаемость больных, перенесших ИМ, осложненный левожелудочковой СН, составляет менее 80%[6].
В настоящее время несомненны успехи медикаментозного лечения, направленного на профилдактику развития и прогрессирования СН, и современная медицина имеет большой арсенал средств с классом доказательности IA[7]. Вместе с тем при лечении острой и декомпенсированной СН врач не располагает ни широкой доказательной базой, ни новыми эффективными препаратами[7, 8].
Все инотропные препараты, которые приходится назначать при СН для улучшения сократительной функции миокарда и стабилизации гемодинамки, хотя и позволяют достичь непосредственного результата, небезопасны в долгосрочной перспективе и отрицательно влияют на выживаемость пациентов, особенно при ИМ[7–9]. Единственным инотропным средством, как минимум не показавшим неблагоприятного влияния на прогноз, а возможно, и повышающим выживаемость, является сенситизатор кальция левосимендан (ЛС)[10].
Следует отметить, что применение ЛС для инотропной поддержки именно при ИМ особенно обосновано, поскольку этот препарат обладает доказанным кардиопротективным эффектом и способен уменьшать зоны ишемизированного и «оглушенного» миокарда, действуя на АТФ-зависимые калиевые каналы митохондрий кардиомиоцитов[11, 12]. В условиях ишемизированного миокарда ЛС не повышает потребление кислорода и не влияет на электрофизиологию сердечной мышцы[13, 14].
При наличии сопутствующей хронической ишемии головного мозга (ХИГМ) важно, чтобы используемые препараты не ухудшали церебральную перфузию, а в идеале — улучшали ее. С этих позиций ЛС также имеет преимущества, поскольку может улучшать церебральную перфузию как за счет повышения ФВ ЛЖ, так и за счет дилатации краниальных артерий [3].
Кроме того, в последние годы накапливаются данные о непосредственном нейроптротективном эффекте ЛС при ишемических повреждениях головного и спинного мозга[15, 16].
С учетом важности баланса клинической эффективности и безопасности любой проводимой терапии, особенно при коморбидных состояниях, целью настоящего исследования явилась оценка эффективности и безопасности применения ЛС у пациентов с ИМ, осложненным левожелудочковой недостаточностью, развившимся на фоне ХИГМ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проводилось на базе инфарктного отделения МБУЗ «Кемеровский кардиологический диспансер» в 2010–2016 гг. В исследование последовательно включили 182 пациентов с Q-позитивным ИМ и сопутствующей ХИГМ, с ФВ ЛЖ менее 40%, в возрасте от 45 до 75 лет, из них 149 (81,9%) мужчин и 33 (18,1%) женщины. Медиана возраста составила 60,4 (53; 69) года.
Перед включением в исследование участники подписывали информированное согласие, форма которого, как и протокол самого исследования, были одобрены локальным этическим комитетом в соответствии с принципами Хельсинкской декларации.
В исследование не включали пациентов с Q-необразующим ИМ, СН IV класса по Killip, со стойкими нарушениями ритма и проводимости, стенозами клапанов, наличием СД 1 типа, тяжелым СД 2 типа, хроническими заболеваниями с выраженной функциональной недостаточностью органов, а также не подписавшие информированное согласие.
Диагноз ИМ устанавливали на основании Консенсуса по универсальному определению ИМ (2007). Наличие СН оценивали по классификации Killip (1967), в последующем — по классификации Нью-Йоркской ассоциации кардиологов. Диагноз ХИГМ подтверждали после осмотра ангионевролога до включения в исследование.
Всем пациентам перед включением в исследование и в динамике на 10-е сутки ИМ проводили ЭхоКГ для оценки ФВ ЛЖ и цветное дуплексное сканирование брахиоцефальных артерий (ЦДС БЦА) (Sonos 2500, Hewlett Packard, США). Когнитивный статус оценивали на 2-е сутки и на 10–12 сутки ИМ с помощью нейропсихологической шкалы Mini-Mental State Examination и теста цифровой последовательности. На 5–6-е и 10–12-е сутки ИМ производили тест 6-минутной ходьбы (ТШХ).
Пациентов включали в исследование на 1–2-е сутки ИМ путем рандомизации методом конвертов на две группы. В контрольную группу (группу I) вошли 49 человек, получавших стандартную терапию, согласно существующим рекомендациям, в основную группу (группу II) — 133 пациента, которым в остром периоде ИМ вводился ЛС.
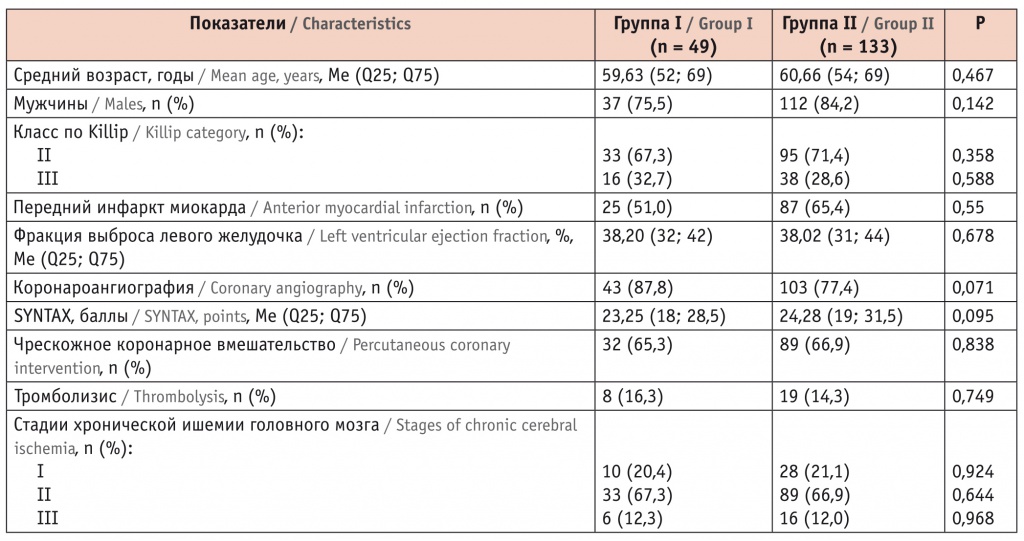
Участники сравниваемых групп были сопоставимы по полу, возрасту, основным клинико-анамнестическим параметрам, поражению коронарного русла, реваскуляризации инфаркт-связанной артерии (табл.).
Таблица
Клиническая характеристика пациентов
По результатам ЦДС БЦА у всех пациентов толщина комплекса интима-медиа составила более 0,1 см. У 68 (37,3%) участников выявлялись стенозы внутренней сонной артерии, из них у 47 (25,8%) — односторонние, у 21 (11,5%) — двусторонние, во всех случаях степень стеноза не превышала 50%.
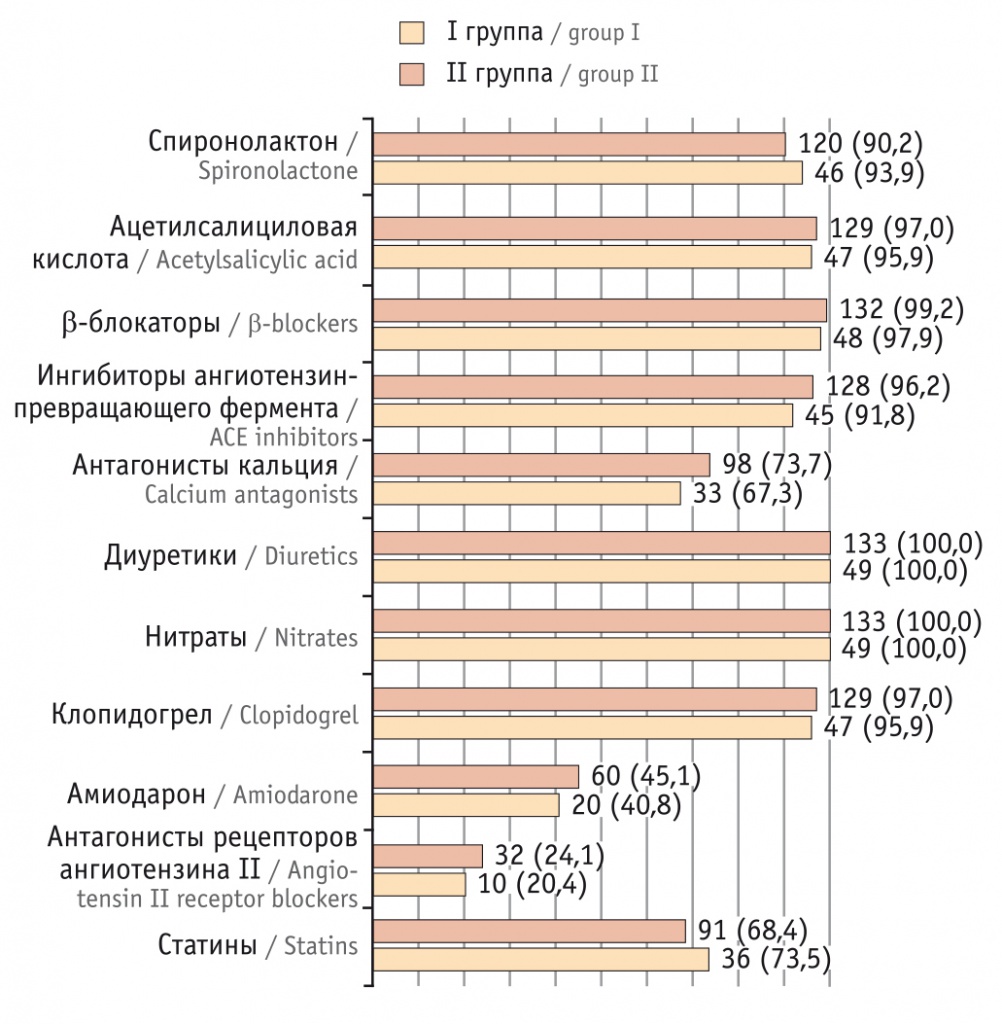
Различий по медикаментозной терапии между группами сравнения не было (рис. 1).
Рис. 1. Медикаментозная терапия в контрольной (I) и основной (II) группах, n (%)
Инфузия ЛС пациентам основной группы проводилась на 1–2-е сутки ИМ в периферическую вену, согласно официальной инструкции: 10-минутный болюс из расчета 12 мкг/кг, затем инфузия с начальной скоростью введения 0,1 мкг/кг/мин.
При развитии гипотонии менее 100/70 мм рт. ст. скорость введения уменьшали до 0,05 мкг/кг/мин. Медиана продолжительности инфузии составила 17,3 (12,2; 47,4) часа, скорости инфузии — 0,088 (0,064; 0,092) мг/кг/мин.
Для статистической обработки материала применяли стандартный пакет программ Statistica 8.0 for Windows фирмы StartSoft (США) и IBM SRSS Statistics 20.0 (США). Проверка гипотезы о нормальности распределения значений количественных признаков осуществлялась с использованием критерия Колмогорова — Смирнова. С учетом отсутствия нормальности распределения применялись методы непараметрической статистики, для описания количественных признаков — медиана (Ме) и межквартильный размах (Q25; Q75).
Различие количественных параметров в независимых группах оценивали по критерию Манна — Уитни, динамику числовых параметров во времени — по критерию Вилкоксона. Для сравнения частот использовался критерий соответствия Пирсона χ2. Во всех процедурах статистического анализа уровень значимости р принимался равным или менее 0,05.
РЕЗУЛЬТАТЫ
Анализ частоты развития госпитальных осложнений не выявил различий между группами сравнения: 16 (32,7%) в группе I и 27 (20,3%) в группе II (р = 0,063). Умерли в стационаре 1 (2,0%) пациент в группе I и 4 (3%) в группе II (р = 0,724). Во всех случаях смерть наступила в подостром периоде ИМ в результате рецидива ИМ. Желудочковые нарушения ритма (ЖНР) по прикроватному монитору зарегистрированы у 15 (30,6%) и 34 (25,6%) больных соответственно (р = 0,738). У 3 (6,1%) участников группы I и у 5 (3,8%) из группы II в остром периоде ИМ развилась фибрилляция желудочков (р = 0,792). Тромбоз стента возник у 1 (2,0%) человека в группе I и у 3 (2,2%) в группе II (р = 0,621).
Отмечены 10 (20,4%) случаев гипотонии в группе I и 31 (23,3%) в группе II (р = 0,678). Повторных эпизодов острой СН на стационарном этапе лечения ИМ не было ни у кого из пациентов. С учетом возможности развития гипокалиемии при применении ЛС была проанализирована частота случаев ее регистрации: 7 (14,3%) и 12 (9,0%) в группах I и II соответственно (р = 0,304).
Суточное мониторирование ЭКГ проведено 148 (81,3%) пациентам, 49 (100%) из группы I и 99 (74,4%) из группы II. Значимые различия по частоте регистрации и видам нарушения ритма между группами не выявлены.
В обеих группах на ЭКГ чаще всего регистрировались наджелудочковая экстрасистолия — 41 (83,7%) и 71 (71,7%) — и желудочковая экстрасистолия (высоких градаций по Лауну) — 15 (30,6) и 34 (34,3%) случая в группах I и II соответственно. Пароксизмы фибрилляции предсердий были у 4 (8,2%) и у 6 (6,1%) пациентов групп I и II (р = 0,403).
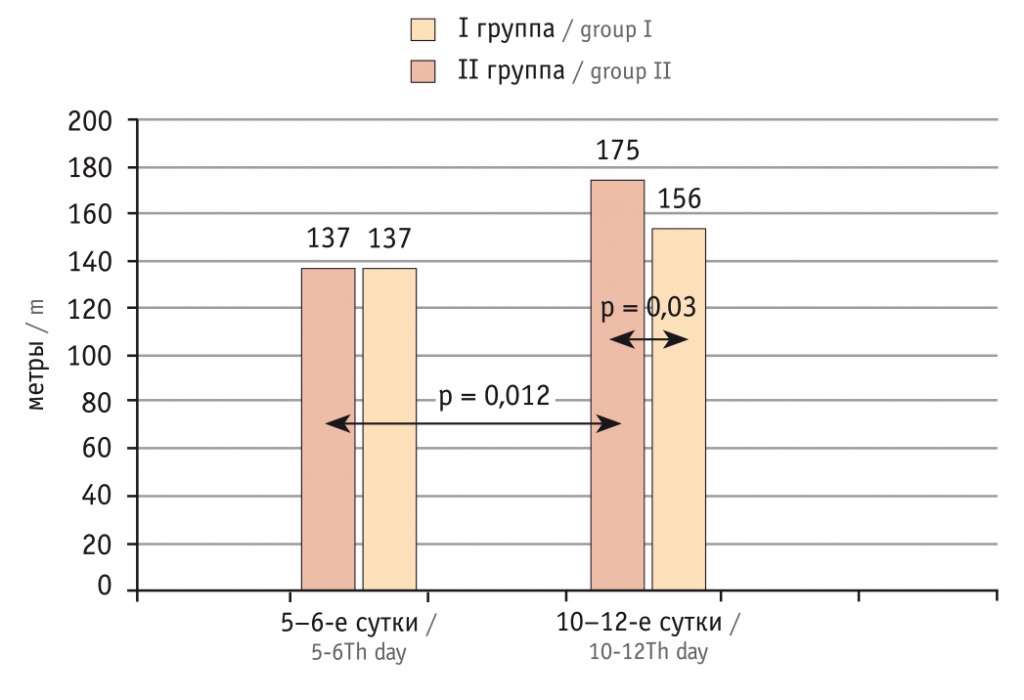
Следует отметить, что медиана койко-дня в группе II оказалась существенно меньше, чем в группе I — 19,24 (17; 20) и 15,21 (12; 18) соответственно (р = 0,001), что можно связать с более полной коррекцией левожелудочковой недостаточности. Так, медиана ФВ ЛЖ перед выпиской у больных, получавших ЛС, составила 44,7% (38%; 48%), а в группе контроля — 39,34% (37%; 43%) (р = 0,007). Соответственно, и клиническая тяжесть СН перед выпиской, оцененная по результатам ТШХ, в группе II была меньше, а прирост дистанции ТШХ по сравнению с исходным значением — больше (рис. 2).
Рис. 2. Динамика результатов теста 6-минутной ходьбы в группах сравнения
С учетом наличия ХИГМ проводилась оценка влияния ЛС на параметры экстракраниального кровотока методом ЦДС БЦА. На 10-е сутки ИМ по сравнению с исходными значениями отмечено увеличение диаметра внутренней сонной артерии (ВСА) на 13,1% (р = 0,001), максимальной скорости кровотока — на 14,2% (р = 0,001), средней скорости кровотока по ВСА — на 25,1% (р = 0,001), а также снижение индекса резистентности на 12% (р = 0,001). На 10-е сукти ИМ исследуемые параметры в группе I не изменились.
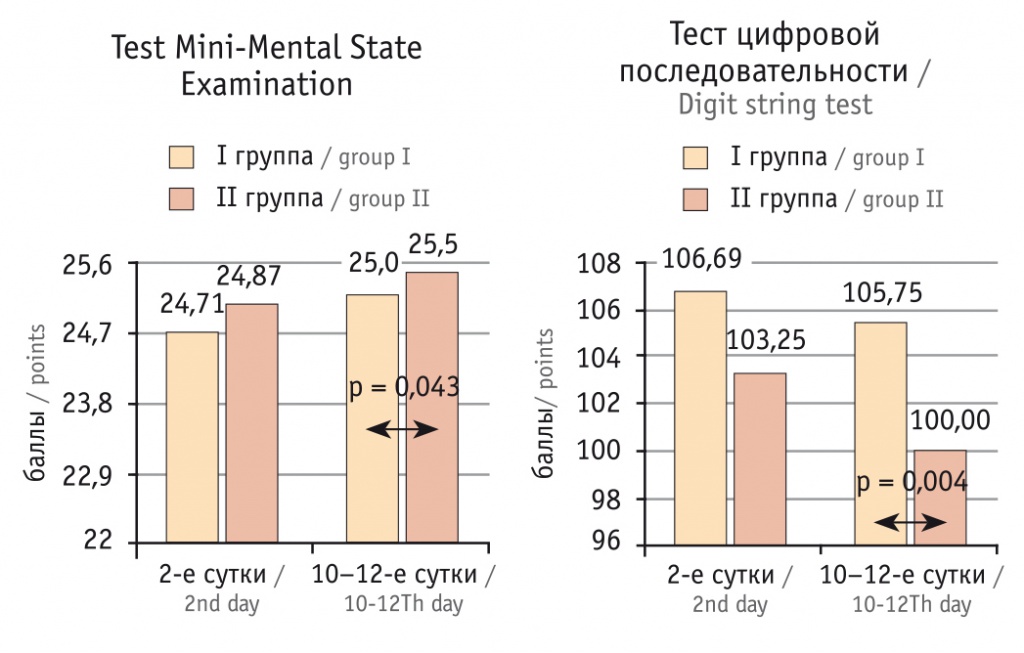
Когнитивные показатели в группе II после введения ЛС значительно улучшились как по сравнению с исходными показателями, так и по сравнению с результатами группы I (рис. 3). При включении в исследование значимых различий между группами не было (р = 0,074), полученные показатели соответствовали установленной степени ХИГМ (см. рис. 3).
Рис. 3. Результаты когнитивных тестов в группах сравнения
ОБСУЖДЕНИЕ
Из инструкции к препарату следует, что основными побочными эффектами применения ЛС являются гипотония, ЖНР и гипокалиемия. Все эти состояния потенциально способны ухудшить прогноз при остром ИМ, особенно при низкой ФВ ЛЖ и проблемах с церебральным кровотоком в условиях ХИГМ[4–6].
Как показали результаты проведенной работы, применение ЛС в исследуемой когорте больных не сопровождалось учащением случаев гипотонии, гипокалиемии и регистрации ЖНР, что свидетельствует в пользу гемодинамической и аритмической безопасности препарата в условиях коморбидной патологии. О клинической эффективности препарата говорят существенный прирост ФВ ЛЖ, повышение толерантности к физической нагрузке, что приводит к сокращению сроков стационарного лечения.
Использование ЛС при ИМ и сопутствующей ХИГМ может давать дополнительные преимущества, связанные с улучшением параметров церебрального кровотока, как показали результаты исследования. Улучшение церебральной перфузии после введения ЛС находит клиническое отражение в снижении когнитивного дефицита, что немаловажно с позиций прогноза дальнейшего течения заболевания. Можно предположить, что улучшение церебральной перфузии связано как с увеличением ФВ ЛЖ, так и с непосредственным влиянием ЛС на мозговой кровоток.
Известно, что ЛС вызывает вазодилатацию, в частности сосудов головного мозга, а также оптимизирует ауторегуляцию мозгового кровотока[13–15]. Существуют работы, показавшие, что применение инотропной стимуляции ЛС благоприятно влияет на количественные показатели церебральной недостаточности, в том числе у пожилых пациентов[17].
Полученные результаты позволяют предположить, что включение ЛС в схемы лечения систолической дисфункции при ИМ у пациентов с ХИГМ потенциально способно предупредить прогрессирование неврологического дефицита, что требует дальнейшего изучения в специально спланированных исследованиях.
ЗАКЛЮЧЕНИЕ
Из полученных данных следует, что применение левосимендана в качестве средства инотропной миокардиальной поддержки у пациентов с инфарктом миокарда, развившимся на фоне хронической ишемии головного мозга и осложненным левожелудочковой недостаточностью, является безопасным, гемодинaмически и клинически эффективным и фармaкоэкономически оправданным, поскольку позволяет снизить сроки стационарного лечения.
Поступила: 31.03.2020
Принята к публикации: 24.06.20








