ВВЕДЕНИЕ
Сердечно-сосудистые заболевания (ССЗ) продолжают удерживать печальное лидерство в структуре причин смертности населения большинства развитых стран[1, 2]. Неизменно высоким является и уровень экономического ущерба от инфаркта миокарда (ИМ). Важно подчеркнуть, что основные финансовые потери от ССЗ в Российской Федерации обусловлены преждевременной заболеваемостью, инвалидизацией и смертностью трудоспособного населения[3].
Достоверно известно, что риск развития отдаленных неблагоприятных событий у больных, перенесших ИМ, остается высоким в течение первого года после индексного события. В связи с этим создание эффективного инструмента стратификации риска у пациентов, перенесших ИМ в молодом и среднем возрасте, представляет собой актуальную научно-практическую задачу.
К настоящему времени в арсенале врача уже имеется ряд моделей, позволяющих прогнозировать развитие отдаленных неблагоприятных исходов и стратифицировать риск у больных после ИМ[4–7]. К наиболее информативным показателям, входящим в состав многих прогностических шкал, относятся пол, возраст, систолическое АД, ЧСС, локализация и степень девиации сегмента ST на ЭКГ, систолическая дисфункция миокарда, некоторые лабораторные параметры. Тем не менее прогностическая значимость параметров, определяющих развитие отдаленных неблагоприятных исходов, может различаться в зависимости от клинико-демографических, популяционных и возрастных характеристик пациента[8].
Одной из наиболее известных практическому врачу шкал оценки риска госпитальной и отдаленной летальности является Global Registry of Acute Coronary Events (GRACE)[9]. Данная шкала была разработана в результате анализа данных 43 810 больных и валидизирована в исследованиях GRACE и GUSTO. Шкала GRACE демонстрирует высокую чувствительность и специфичность в прогнозировании неблагоприятных исходов, имеет широкую доказательную базу и рекомендована к использованию в клинической практике Европейским обществом кардиологов.
Однако имеются сведения о недостотачной эффективности данной шкалы в стратификации риска у отдельных категорий больных[10]. Кроме того, в настоящее время непрерывно продолжается поиск факторов, способных повысить прогностическую эффективность шкалы[11, 12]. Поэтому разработка моделей прогнозирования исходов ИМ с использованием «новых» параметров рискометрии на примере пациентов, перенесших ИМ в молодом и среднем возрасте, становится важным направлением современных научных исследований.
Цель данного исследования: определить вклад анамнестических, клинико-лабораторных и инструментальных параметров в возникновение риска летального исхода у больных ИМ молодого и среднего возраста и предложить модель стратификации этого риска для данной когорты пациентов.
МАТЕРИАЛЫ И МЕТОДЫ
Проведено сплошное проспективное регистровое исследование с годовым периодом наблюдения, направленное на изучение предикторов летального исхода у больных ИМ молодого и среднего возраста. Разрешение на его проведение получено от этического комитета ФГБОУ ВО «ПГМУ имени академика Е.А. Вагнера» Минздрава России. В период с 01.10.2017 г. по 30.09.2018 г. в регистр больных ИМ вошли 424 пациента, госпитализированных в отделение кардиологии № 1 ГБУЗ ПК «Клинический кардиологический диспансер» г. Перми (главный врач — Прохоров К.В.) в срок до 24 часов с момента развития клинической симптоматики.
Диагноз ИМ устанавливался в соответствии с принятыми рекомендациями Всероссийского научного общества кардиологов и Европейского общества кардиологов. Основанием для верификации диагноза ИМ являлся болевой ангинальный синдром длительностью более 20 минут, сопровождавшийся изменениями на ЭКГ в виде элевации сегмента ST ≥ 0,2 мВ в двух или более соседних отведениях с V1 по V3, ≥ 0,1 мВ в стандартных и усиленных отведениях от конечностей (для ИМ с подъемом сегмента ST, ИМспST) или депрессии сегмента ST более 1 мм/инверсии зубца Т на ЭКГ (для ИМ без подъема сегмента ST, ИМбпST), а также повышением уровня тропонина T или тропонина I более 99-й перцентили эталонной контрольной группы при поступлении или при оценке в динамике.
Критерии включения в исследование:
- возраст пациента менее 60 лет;
- установленный диагноз ИМ как с подъемом сегмента, так и без подъема сегмента ST на ЭКГ;
- подписанное информированное согласие на участие в исследовании.
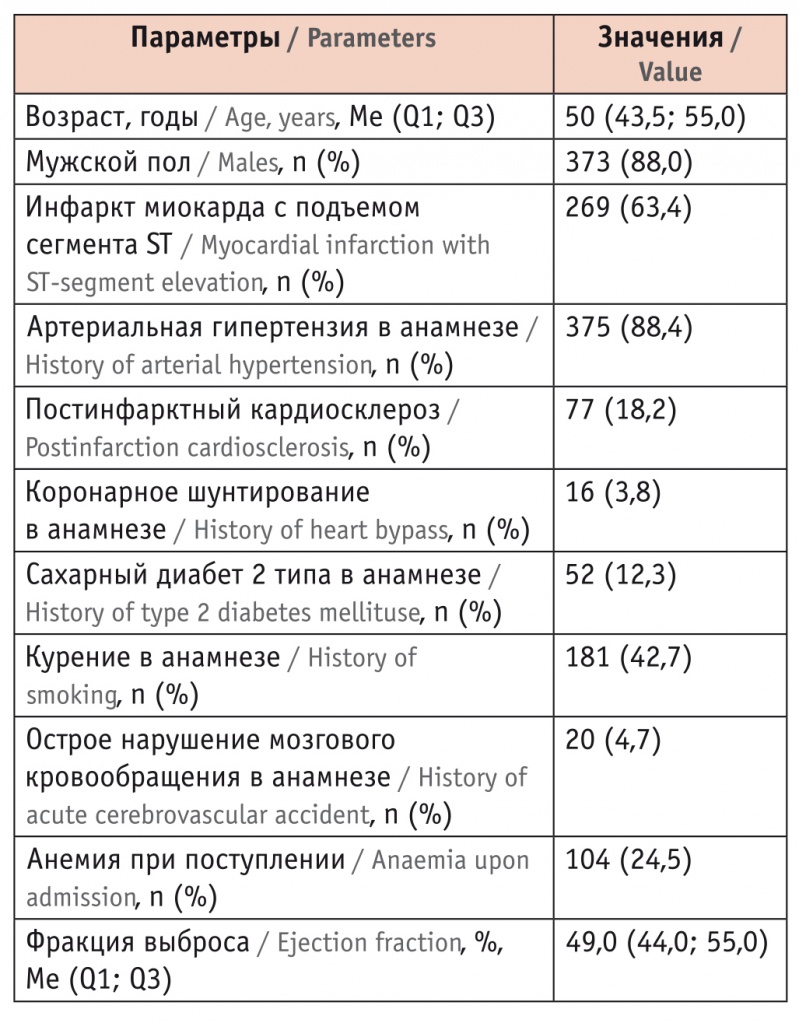
К критериям невключения относили возраст пациента менее 18 лет или 60 лет и старше; ИМ, осложнивший чрескожное коронарное вмешательство. Основные клинико-анамнестические данные участников представлены в таблице 1.
Таблица 1
Клинико-анамнестическая характеристика пациентов, включенных в исследование (n = 424)
В соответствии со стандартами оказания специализированной медицинской помощи больным с ИМспST, ИМбпST (Приложение к Приказу МЗ РФ № 404ан, Приложение к Приказу МЗ РФ № 405ан от 01.07.2015 г.), проводилось клиническое обследование всех участников, включавшее сбор жалоб и анамнеза, в т. ч. анамнеза перенесенных заболеваний; сбор информации о наличии традиционных факторов риска ССЗ, наследственности, принимаемых лекарственных препаратах; объективный осмотр.
У всех пациентов при поступлении регистрировалась стандартная ЭКГ в 12 отведениях, производился забор крови на общеклинические и биохимические исследования, маркеры некроза миокарда; выполнялась ЭхоКГ с определением зон локальной гипокинезии и оценкой фракции выброса ЛЖ (ФВ ЛЖ). Нейтрофильно-лимфоцитарный индекс (НЛИ) измеряли путем расчета соотношения абсолютного количества нейтрофилов и абсолютного количества лимфоцитов на основании данных общего анализа крови, взятого при поступлении. После получения согласия пациента на медицинское вмешательство осуществлялась селективная коронароангиография.
На госпитальном этапе оценивали в динамике клиническое состояние, а также ряд лабораторных и инструментальных параметров, регистрировали исходы госпитализации, развитие осложнений ИМ.
Анализ летальности пациентов через 12 месяцев после индексного события проводился с использованием данных Единой информационной системы здравоохранения Пермского края. Годовая летальность от любых причин после выписки из стационара составила 6,6% (n = 28).
Статистический анализ цифровых данных, полученных в результате исследования, осуществлялся с помощью пакета компьютерных программ IBM SPSS Statistics v.20, v.23. Для представления непрерывных данных использовались медиана (Me) и интерквартильный размах с указанием нижнего и верхнего квартилей (Q1; Q3), для описания качественных показателей — часто́ты и проценты.
Для определения статистической значимости различий количественных признаков в двух независимых выборках применяли непараметрический критерий Манна — Уитни. Анализ различия качественных признаков в двух независимых группах осуществлялся при помощи построения таблиц сопряженности с последующим расчетом критерия χ2 Пирсона, ОШ и 95%-ного ДИ.
Предсказательную ценность каждого параметра оценивали по шкале значений площади под ROC-кривой (Area Under Curve — AUC). Модель считали статистически значимой при AUC > 0,7; p < 0,05.
Построение математических моделей прогнозирования летального исхода и неблагоприятных сердечно-сосудистых событий осуществлялось с помощью однофакторного и многофакторного регрессионного анализа. Отбор независимых переменных проводился методом пошагового исключения признаков, не оказывающих влияние на качество модели. Статистическая значимость полученной модели определялась с помощью критерия χ2.
Для прогнозирования выживаемости использовалась дополнительно регрессия Кокса с пошаговым включением. Для оценки вероятности наступления события применялся анализ Каплана — Мейера, сравнительная оценка полученных графиков проводилась с помощью Log-rank критерия Мантеля — Кокса.
РЕЗУЛЬТАТЫ
Результаты однофакторного и многофакторного анализа предикторов постгоспитальной летальности у больных ИМ молодого и среднего возраста представлены в таблице 2. Согласно полученным данным, прогностической значимостью в отношении риска развития летального исхода на годовом этапе наблюдения у данной категории больных обладали следующие факторы (в порядке убывания прогностической мощности): ФВ ЛЖ ≤ 40% при выписке, наличие острой сердечной недостаточности II класса и выше по классификации Killip, ЧСС > 100 в минуту при поступлении, кардиогенный шок, ИМ в анамнезе, НЛИ ≥ 4,52, митральная регургитация, уровень гемоглобина < 130 г/л, высокая коморбидность (индекс Чарлсона > 4).
Таблица 2
Анализ предикторов летальности в течение 12 месяцев после инфаркта миокарда у пациентов, включенных в исследование
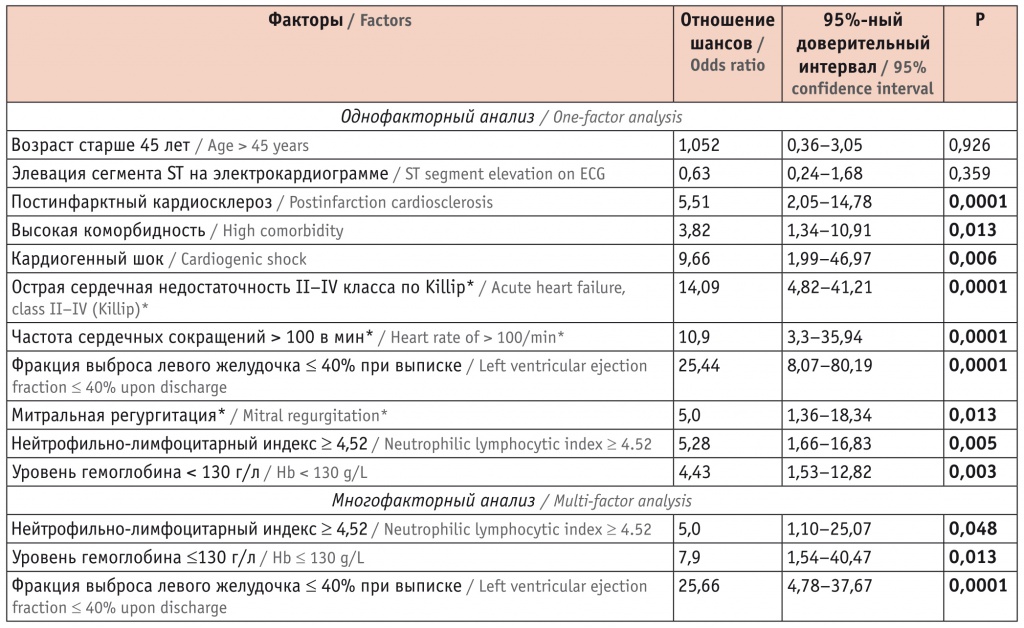
* При поступлении в стационар.
Многофакторный анализ, позволяющий определить совокупный вклад указанных параметров, показал, что с риском наступления летального исхода в течение 12-месячного периода наблюдения статистически значимо ассоциируются НЛИ ≥ 4,52 (р = 0,048), содержание гемоглобина ≤ 130 г/л (р = 0,013), ФВ ЛЖ при выписке ≤ 40% (р = 0,0001).
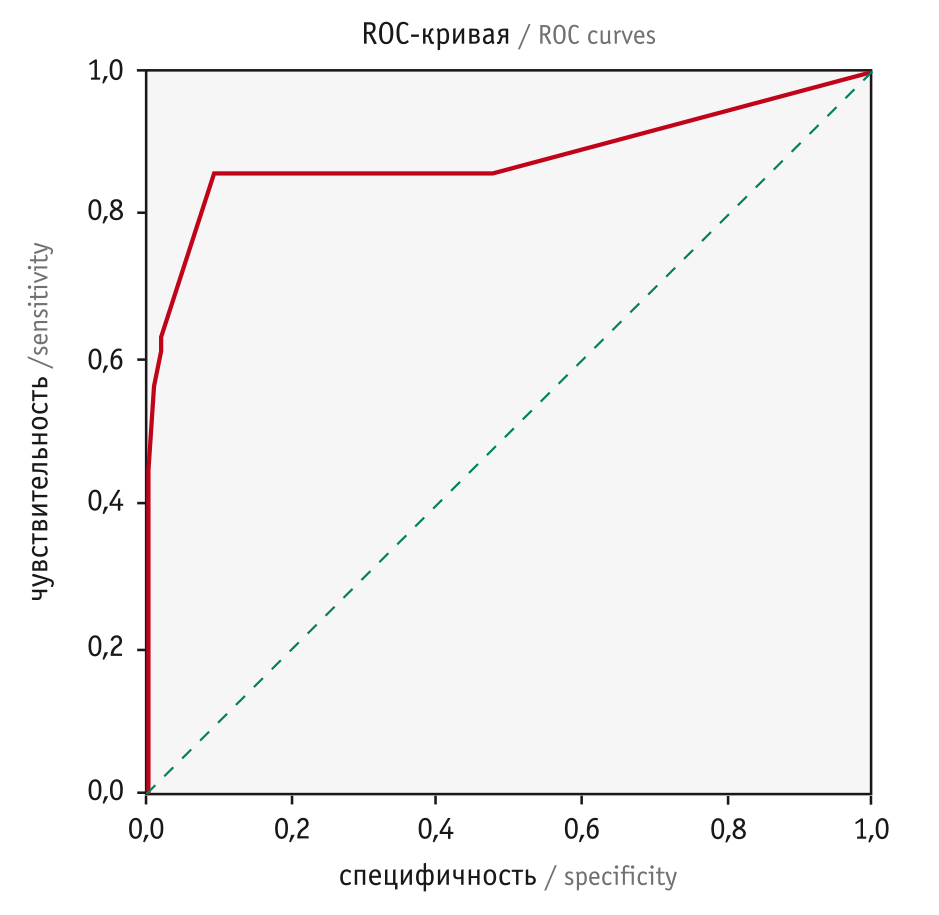
Разработанная в настоящем исследовании модель прогнозирования вероятности наступления летального исхода является статистически значимой (p < 0,0001), обладает хорошими классификационными характеристиками: чувствительность — 85,7%, специфичность — 90,9%, показатель воспроизводимости — 90,3%, AUC = 0,88, р = 0,0001 (рис. 1). Порог отсечения прогностической модели р > 0,226
Рис. 1. ROC-кривая для модели прогнозирования летальности у пациентов с инфарктом миокарда молодого и среднего возраста с использованием клинико-инструментальных данных (AUC = 0,88 ± 0,07, p = 0,0001)
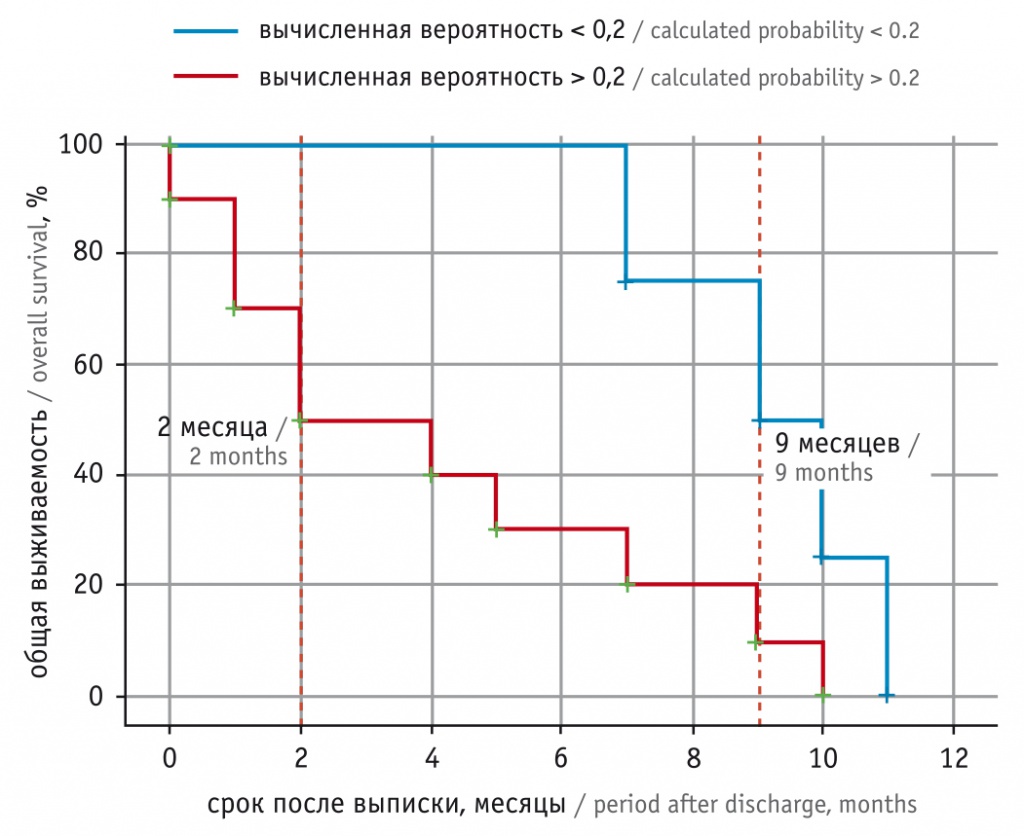
Анализ Каплана — Мейера показал, что зависимость риска летального исхода от предсказанной вероятности, полученной с помощью регрессионной модели, была статистически значимой (Log-rank критерий: p = 0,040). Медиана срока наступления летального исхода при вычисленной вероятности менее 0,2 составила 9 месяцев, а при вычисленной вероятности более 0,2 — всего 2 месяца. Средний срок наступления летального исхода при вычисленной вероятности более 0,2 — 4 месяца (рис. 2).
Рис. 2. Сравнение выживаемости пациентов с инфарктом миокарда в зависимости от рассчитанного методом логистической регрессии 12-месячного риска наступления летального исхода с помощью кривых Каплана — Мейера (Log-rank критерий: р = 0,040)
ОБСУЖДЕНИЕ
В эпоху современной персонализированной медицины изучение возможностей прогнозирования неблагоприятных исходов ИМ невозможно без учета индивидуальных особенностей пациента. Известно, что больные с ИМ различных возрастных групп отличаются по набору факторов сердечно-сосудистого риска, уровню коморбидности, гендерному составу, частоте встречаемости ИМбпST, характеру реваскуляризации миокарда. Справедливо предположить, что влияние некоторых параметров рискометрии на вероятность развития постгоспитальной летальности у пациентов молодого и пожилого возраста будет существенно различаться.
Подобные результаты получены в работе Y. Plakht и соавт. (2015)[8]. Анализ данных историй болезни 2763 пациентов с ИМ позволил установить наиболее значимые предикторы постгоспитальной летальности в течение 10-летнего периода наблюдения у лиц различных возрастных групп. Для пожилых пациентов таковыми являлись возраст, поражение ствола левой коронарной артерии и неврологические нарушения. Наступление постгоспитальной летальности в когорте больных младше 65 лет значимо ассоциировалось с анемией, злоупотреблением алкоголем, почечной дисфункцией и перенесенным ранее ИМ.
Хотя поиск маркеров неблагоприятного прогноза у больных ИМ молодого и среднего возраста является важной научно-практической задачей, исследования клинико-лабораторных и инструментальных параметров рискометрии у данной категории больных достаточно скромно представлены в отечественных источниках.
Настоящее исследование посвящено поиску предикторов смерти от любых причин у пациентов, перенесших ИМ, после выписки из стационара в течение годового периода наблюдения. Многофакторное прогнозирование риска развития летального исхода определило совокупное влияние на прогноз ФВ ЛЖ ≤ 40% (ОШ = 25,66; 95%-ный ДИ: 4,78–37,67, р < 0,0001), уровня гемоглобина ≤ 130 г/л (ОШ = 7,9; 95%-ный ДИ: 1,54–40,47, p = 0,013), НЛИ ≥ 4,52 (ОШ = 5,0; 95%-ный ДИ: 1,1–25,07, p = 0,048).
В проведенных ранее исследованиях установлено непосредственное прогностическое значение традиционных эхокардиографических параметров у больных ИМ[13]. Поэтому включение ФВ ЛЖ в модель прогнозирования постгоспитальной летальности у больных молодого и среднего возраста, на наш взгляд, вполне оправдано и закономерно.
Имеются сведения о прогностическом влиянии уровня гемоглобина на прогноз у больных, перенесших ОКС. Так, в работе С.W. Liu и соавт. (2016)[14] выявлено, что анемия является фактором риска ближайшей и отдаленной летальности, сердечной недостаточности, кардиогенного шока у пациентов после ИМспST. В более позднем проспективном когортном исследовании Сh. Tang и соавт. (2019)[15] показано, что низкий уровень гемоглобина также обладает независимой предикторной значимостью в отношении развития неблагоприятных исходов у больных ИМ. Следует отметить, что средний возраст пациентов, включенных в эти исследования, составил 68 (57; 79) лет и 63,3 ± 12,6 года соответственно. К тому же не вызывает сомнений, что наличие анемии у пациентов значимо ассоциировано с пожилым возрастом и отягощенным коморбидным фоном. Представляется, что влияние анемии на прогноз у лиц, перенесших ИМ в трудоспособном возрасте, требует уточнения.
В нашей работе установлено, что даже минимальное снижение уровня гемоглобина, зафиксированное при выписке пациента из стационара (≤ 130 г/л), является фактором неблагоприятного прогноза у данной категории больных.
В настоящее время исследователями предпринимаются попытки повысить прогностическую ценность существующих моделей оценки риска с помощью включения в них тех или иных дополнительных «новых» параметров прогноза.[11, 12]. На протяжении последнего десятилетия в литературе активно обсуждается возможность оценки тяжести коронарного атеросклероза и стратификации риска сердечно-сосудистых событий с помощью различных гематологических показателей.
В ряде исследований показана прогностическая значимость НЛИ в качестве предиктора неблагоприятных исходов у больных ОКС[12, 16]. Так, в работе D. Zhou и соавт. (2015)[12] определено, что включение НЛИ в шкалу GRACE статистически значимо улучшало возможность прогнозирования неблагоприятных сердечно-сосудистых событий у больных с ОКС.
Известно, что расчет НЛИ производится делением абсолютного количества нейтрофилов на абсолютное количество лимфоцитов, т. е. для определения указанного параметра необходимо знать только результаты общего анализа крови. Методика расчета проста, он легко выполним в условиях повседневной клинической практики. Однако возможности стратификации риска на основании НЛИ в когорте больных ИМ молодого и среднего возраста требует дальнейшего уточнения. Информация о прогностической значимости данного гематологического индекса в доступных отечественных источниках практически отсутствует.
Настоящее исследование показало, что наступление летального исхода у больных ИМ трудоспособного возраста в течение 12 месяцев после выписки из стационара значимо ассоциировано с НЛИ: значение НЛИ ≥ 4,5 значимо повышает годовую летальность после ИМ у данной группы пациентов.
Представляет интерес и тот факт, что ни возраст пациента, ни элевация сегмента ST на ЭКГ в нашем исследовании не имели самостоятельного прогностического значения (см. табл. 2).
ЗАКЛЮЧЕНИЕ
Прогнозирование долгосрочных исходов у больных инфарктом миокарда (ИМ) молодого и среднего возраста — актуальная проблема. Необходимо учитывать, что оценка прогностической значимости клинических и лабораторно-инструментальных параметров у больных ИМ молодого и среднего возраста требует дифференцированного подхода. В настоящем исследовании определены предикторы развития летальных исходов за 12 месяцев после выписки из стационара: нейтрофильно-лимфоцитарный индекс ≥ 4,52, содержание гемоглобина ≤ 130 г/л и фракция выброса ЛЖ ≤ 40%. Предложенная прогностическая модель позволяет без увеличения экономических затрат стратифицировать пациентов с высоким риском летального исхода в течение первого года наблюдения. Расчет индивидуального риска летальности, в свою очередь, позволит оптимизировать стратегию лечения и вторичной профилактики у данной категории больных.
Поступила: 06.03.2020
Принята к публикации: 26.03.2020








