ВВЕДЕНИЕ
Необычная губчатая структура миокарда с большим количеством трабекул впервые была описана R. Grant еще в 1926 г. [1]. В 1984 г. R. Engberding и F. Bender представили случай с наличием в миокарде синусоид, характерных для эмбрионального периода развития сердца [2]. В нашей стране первое описание заболевания было сделано в 1998 г. [3].
Данную патологию считали «верхушечной формой» гипертрофической кардиомиопатии (КМП), пока в 1990 г. T. Chin не предложил термин «изолированная некомпактность миокарда» [1, 4, 5]. В 1995 г. Всемирной организацией здравоохранения (англ. World Health Organization) и Международным обществом и федерацией кардиологов (англ. International Society and Federation of Cardiology) некомпактный миокард был включен в группу неклассифицируемых КМП. В последующем, в 2006 г., Американская кардиологическая ассоциация (англ. American Heart Association) отнесла его к генетически детерминированным первичным КМП, а в классификации Европейского общества кардиологов (англ. European Society of Cardiology), опубликованной в 2008 г., некомпактный миокард вновь был причислен к группе неклассифицируемых КМП [6-8].
В настоящее время под некомпактным миокардом, или некомпактной кардиомиопатией (НКМП), понимают наличие выраженной трабекулярности и глубоких межтрабекулярных полостей (лакун или синусоидов) в толще миокарда левого (ЛЖ) и/или правого желудочка (ПЖ), часто в сочетании со вторым тонким компактным слоем миокарда, соседствующим с эпикардом [5, 7]1. В качестве механизма развития НКМП рассматривается нарушение формирования нормального миокарда из эмбрионального (губчатого) миокарда, который в отсутствие коронарных сосудов кровоснабжается из полостей сердца [1, 5, 9]. Процесс уплотнения протекает в направлении от основания сердца к верхушке и от эпикарда к эндокарду. В результате в сердце остаются зоны некомпактного миокарда с повышенной трабекулярностью и глубокими межтрабекулярными пространствами [4]2.
Выделяют следующие морфологические типы НКМП: 1) лакунарный, при котором некомпактный миокард представлен сетью хорошо визуализирующихся трабекул с широкими, глубокими лакунами, 2) губчатый, при котором некомпактный миокард представлен чередованием множества мельчайших лакун (менее 1 мм) и трабекул, трудно отличимых друг от друга, и 3) смешанный, когда визуализируются трабекулы и лакунарные пространства, но менее выраженные, чем при лакунарном типе3. В детской популяции распространенность НКМП составляет 1,26%, или 9,2% всех случаев КМП; по распространенности заболевание занимает третье место после гипертрофической и дилатационной КМП. Во взрослой популяции НКМП выявляется у 0,014% населения, однако истинные цифры могут быть существенно выше. Заболевание чаще встречается у мужчин — в 56–82% случаев [4]4.
Этиологические факторы некомпактного миокарда еще недостаточно изучены, но очевидным является наследственный характер этого заболевания [1, 5, 9]. Описаны как спорадические, так и семейные случаи НКМП, причем на долю последних приходится от 26% до 64%. В настоящее время выявлено свыше 60 генов, связанных с развитием семейных случаев НКМП [1, 5, 10]. Установлены множественные мутации в генах саркомерных белков, белков — переносчиков кальция и в других генах, включая LMNA, LDB3 и ген тафазина [11]. Выделяют два типа наследования: аутосомно-доминантный тип и наследование, сцепленное с Х-хромосомой (около 44% случаев) [4, 5]5. В то же время при генетическом тестировании семейных форм патогенные мутации в уже известных генах выявляются не более чем в половине случаев, что свидетельствует о наличии других, еще не изученных генетических маркеров [10].
В большинстве случаев некомпактность миокарда ассоциируется с дилатацией или гипертрофией желудочков сердца, снижением их глобальной сократимости, а также с нарушением диастолической функции по рестриктивному типу [10-12]6. У некоторых пациентов в патологический процесс может вовлекаться миокард обоих желудочков [1, 10]7. НКМП может присутствовать как в изолированной форме, так и в сочетании с другой патологией, прежде всего с врожденными пороками сердца и нейромышечными заболеваниями [1, 4, 7]8.
Клиническая картина НКМП может быть разной [5, 7, 9]. Встречаются как бессимптомные формы, так и варианты с прогрессирующим течением, осложняющимся развитием сердечной недостаточности, тромбоэмболиями и желудочковыми аритмиями [11, 12]. В некоторых случаях заболевание дебютирует внезапной сердечной смертью [1, 5, 9].
Цель публикации: показать особенности клинического течения и фенотипических проявлений НКМП у монозиготных близнецов.
КЛИНИЧЕСКИЙ СЛУЧАЙ
В Клинике военно-морской терапии Военно-медицинской академии им. С.М. Кирова (ВМедА им. С.М. Кирова) в период с ноября 2017 г. по февраль 2018 г. было проведено клинико-инструментальное обследование двух сестер с НКМП. Сестры являются монозиготными близнецами, во время обследования им было 34 года. Обе женщины подписали информированное согласие на участие в исследовании и обработку персональных данных.
Обследование включало в себя рутинные клинические анализы крови и мочи, биохимическое исследование крови, ЭКГ в покое, рентгенографию органов грудной клетки, суточное мониторирование ЭКГ, трансторакальную ЭхоКГ, МРТ сердца и забор крови для генетического анализа.
Диагноз НКМП устанавливался на основании выявления двухслойной структуры миокарда утолщенной стенки желудочка — некомпактного и компактного слоев в соотношении более чем 2:1, повышенной трабекулярности в желудочках в направлении от верхушки к папиллярным мышцам и визуализации кровотока в межтрабекулярных пространствах [1, 5, 10]9. У матери, старшей сестры и детей пациенток по результатам амбулаторного обследования (ЭхоКГ) данных, указывающих на наличие некомпактного миокарда, не получено.
Из анамнеза жизни известно, что сестры родились в г. Ленинграде. В умственном и физическом развитии от сверстников не отставали. От занятий по физической подготовке в период обучения в школе и вузе не освобождались. В. замужем, имеет двоих здоровых детей; Л. воспитывает одного здорового ребенка, не замужем. В период обследования обе сестры не работали. Гинекологический, аллергологический и эпидемиологический анамнез без особенностей. Сестры не курят, алкоголь не употребляют. Наследственность отягощена по линии отца, который умер в возрасте 49 лет (со слов пациенток, от острого инфаркта миокарда).
Анамнез заболевания пациентки В. До 2013 г., несмотря на постепенно усиливавшуюся в течение нескольких лет общую слабость и утомляемость, считала себя здоровым человеком, не обследовалась.
Заболевание дебютировало остро — с развития 09.01.2013 пароксизма фибрилляции/трепетания предсердий (ФП/ТП) с частотой 150 уд/мин. По этому поводу обследовалась в Городской Покровской больнице (г. Санкт-Петербург). При ЭхоКГ выявлено увеличение объема обоих предсердий, в большей степени левого (ЛП), при сохраненных размерах ЛЖ, а также обнаружены признаки выраженной диастолической дисфункции по рестриктивному типу и повышенная трабекулярность ЛЖ. Сократительная функция ЛЖ была снижена (ФВ — 49% по Симпсону), среднее расчетное давление в легочной артерии составило 54 мм рт. ст.
Далее наблюдалась в Национальном медицинском исследовательском центре им. В.А. Алмазова Министерства здравоохранения Российской Федерации (НМИЦ им. В.А. Алмазова МЗ РФ) с диагнозом «рестриктивная кардиомиопатия». При суточном мониторировании ЭКГ 27.02.2013 на фоне персистирующей ФП/ТП были зарегистрированы неустойчивые пароксизмы желудочковой тахикардии. Регулярно получала варфарин, бисопролол, спиронолактон, рамиприл и амиодарон.
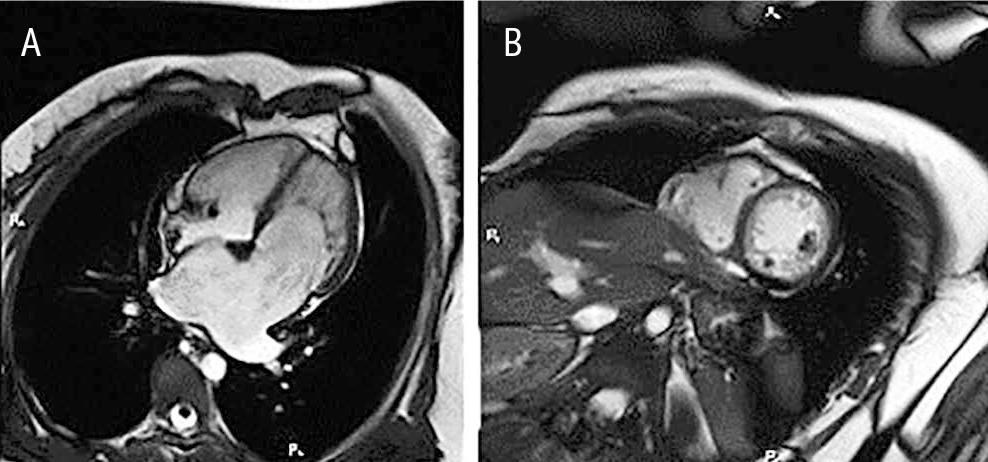
18.02.2014 выполнена МРТ сердца с контрастным усилением. Фиброзных изменений в миокарде очагового или диффузного характера не выявлено. Имели место выраженная дилатация ЛП (длина — 57 мм, ширина — 68 мм), снижение систолической функции ЛЖ (до 50%) и ПЖ (до 37%), повышенная трабекулярность ЛЖ и некомпактность миокарда обоих желудочков (толщина некомпактного слоя в ЛЖ составила 30 мм, в ПЖ — 16 мм) (рис. 1). Установлен диагноз «некомпактный миокард, рестриктивная кардиомиопатия».
Рис. 1. Магнитно-резонансная томограмма сердца пациентки В. от 18 февраля 2014 г. Проекция по длинной оси (A) и по короткой оси на уровне папиллярных мышц (B). Иллюстрация авторов
03.04.2014 при плановой регистрации ЭКГ зафиксировано восстановление синусового ритма, после чего прием амиодарона был прекращен.
С мая 2014 г. вновь начали беспокоить сердцебиения и перебои в работе сердца, появились одышка при физических нагрузках, отеки стоп и лодыжек. В феврале 2015 г. стационарно лечилась в НМИЦ им. В.А. Алмазова МЗ РФ по поводу длительно персистирующей ФП. При повторной госпитализации с целью планового восстановления синусового ритма 05.05.2015 внезапно развился устойчивый пароксизм желудочковой тахикардии с частотой 200 уд/мин, потребовавший перевода в ОРИТ, где он был купирован амиодароном. Продолжено консервативное лечение, на фоне которого 08.05.2015 произошло восстановление синусового ритма. Принято решение об имплантации антиаритмического устройства. 12.08.2015 В. был установлен имплантируемый кардиовертер-дефибриллятор (ИКД) Protecta D364TRG (Medtronic, США) с режимом стимуляции AAI-DDD, после чего пациентку выписали на амбулаторное лечение.
В дальнейшем чувствовала себя удовлетворительно, рекомендации выполняла. Однако 27.11.2017 внезапно появились учащенное сердцебиение, резкая общая слабость, головокружение, одышка при незначительной физической нагрузке — бригадой скорой помощи В. была доставлена в Клинику военно-морской терапии ВМедА им. С.М. Кирова.
Результаты обследования пациентки В. При поступлении на ЭКГ регистрировались ФП со средней частотой 130 уд/мин, отклонение электрической оси сердца влево, неполная блокада правой ножки пучка Гиса и неспецифические изменения процессов реполяризации в области верхушки ЛЖ. Рутинные клинические и биохимические анализы, включая липидный профиль и маркеры повреждения миокарда, были в норме, структурно-функциональное состояние щитовидной железы — без особенностей.
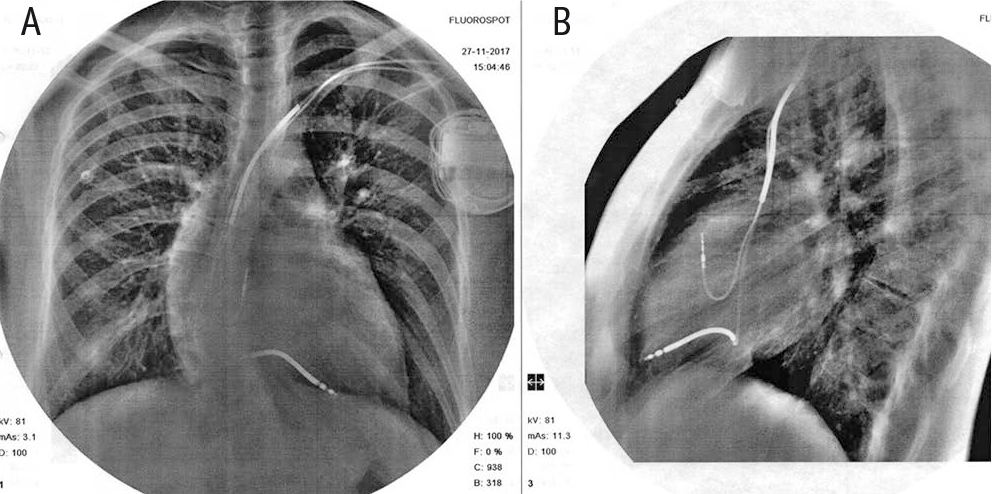
В легочной ткани очаговых и инфильтративных изменений не наблюдалось, корни легких были четкими и структурными, синусы свободными, тень сердца была расширена за счет ЛП. Визуализировался ИКД с двумя электродами, установленными в правых камерах сердца (рис. 2).
Рис. 2. Рентгенограмма органов грудной полости пациентки В. от 27 ноября 2017 г. Иллюстрация авторов
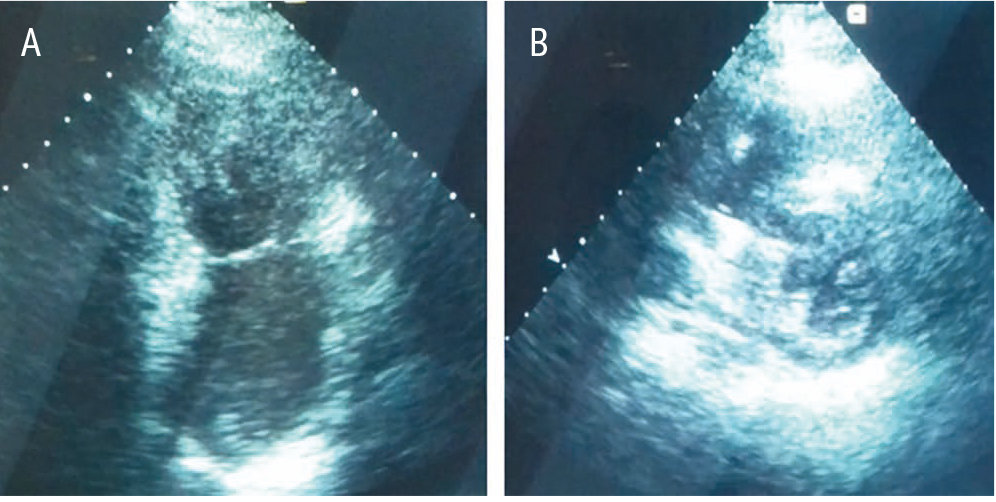
При ЭхоКГ (28.11.2017) отмечалась резко выраженная дилатация ЛП и в меньшей степени — правого предсердия. Желудочки нормальных размеров. Нарушений локальной сократимости ЛЖ не обнаружено. Наблюдались повышенная трабекулярность ЛЖ, преимущественно в области верхушки, признаки некомпактного миокарда. Глобальная сократительная функция ЛЖ была несколько снижена (ФВ — 49% по Симпсону). Имелась аневризма межпредсердной перегородки. В правых камерах сердца визуализировались электроды ИКД, среднерасчетное давление в легочной артерии — 45 мм рт. ст. Трикуспидальная регургитация 2-й степени. Митральная регургитация 1-й степени. Оценка диастолической функции ЛЖ на фоне ФП была затруднена (рис. 3).
Рис. 3. Эхокардиограмма пациентки В. от 28 ноября 2017 г. Двухкамерная верхушечная проекция (A) и проекция по короткой оси на уровне папиллярных мышц (B). Иллюстрация авторов
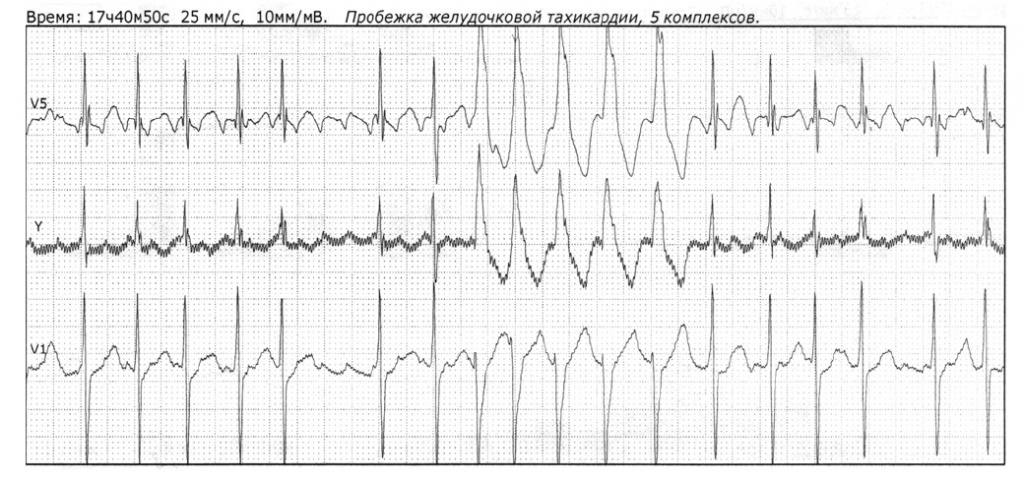
При суточном мониторировании ЭКГ (29–30.11.2017) в течение всего периода наблюдения регистрировались ФП/ТП со средней частотой 104 уд/мин, эпизоды эффективной работы ИКД по требованию в режиме желудочковой стимуляции с частотой 50 уд/мин. На фоне редкой одиночной и парной мономорфной желудочковой экстрасистолии отмечено 17 пробежек неустойчивой желудочковой тахикардии (до пяти комплексов) с частотой до 225 уд/мин. Нагрузки не выполнялись (рис. 4).
Рис. 4. Суточное мониторирование электрокардиограммы у пациентки В. (29–30 ноября 2017 г.). Иллюстрация авторов
Анамнез заболевания пациентки Л. С 2015 г. стала ощущать перебои в работе сердца, кратковременные эпизоды сердцебиения, одышку при физических нагрузках и повышенную утомляемость.
В январе 2017 г. в Санкт-Петербургской городской поликлинике № 38 были выполнены ЭхоКГ и суточное мониторирование ЭКГ. Выявлены значительное увеличение объема ЛП, признаки некомпактного миокарда и повышенная трабекулярность апикального отдела ЛЖ с сохранением глобальной систолической и диастолической функции. Митральная регургитация 1–2-й степени. Среднерасчетное давление в легочной артерии — 23 мм рт. ст. Обнаружены частые одиночные желудочковые экстрасистолы, одиночные, парные и групповые наджелудочковые экстрасистолы, а также три неустойчивых пароксизма наджелудочковой тахикардии с максимальной частотой 123 уд/мин.
С августа 2017 г. амбулаторно наблюдается в НМИЦ им. В.А. Алмазова МЗ РФ. В феврале 2018 г. в плановом порядке поступила в Клинику военно-морской терапии ВМедА им. С.М. Кирова для углубленного обследования.
Результаты обследования пациентки Л. На ЭКГ (07.02.2018) регистрировался синусовый ритм с частотой 62 уд/мин, имели место единичные предсердные экстрасистолы, отмечалось нормальное положение электрической оси сердца. Зубец Р был расширен до 0,16 сек. и деформирован (P-mitrale). Достоверные нарушения процессов реполяризации отсутствовали. Результаты рутинных анализов крови соответствовали норме. В легочной ткани очаговых и инфильтративных изменений не наблюдалось, корни легких были четкими и структурными, синусы свободными, тень сердца была расширена за счет ЛП.
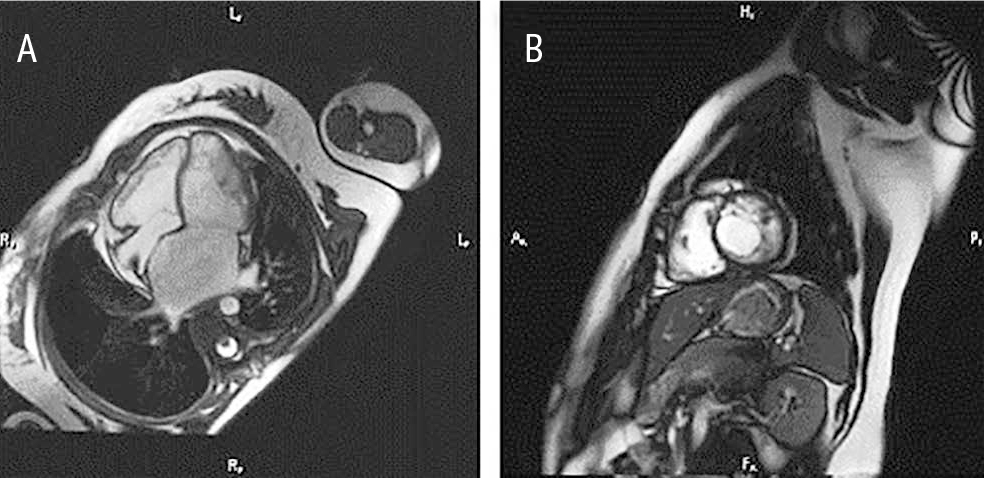
07.02.2018 выполнена МРТ сердца с контрастным усилением. Отмечены выраженная дилатация ЛП (длина — 71 мм, ширина — 73 мм), нормальная систолическая функция ЛЖ (68%), повышенная трабекулярность миокарда, наиболее выраженная в апикальных отделах, и признаки некомпактности миокарда обоих желудочков (соотношение некомпактной и компактной частей составило 3:1 и более). Фиброзных изменений в миокарде очагового или диффузного характера не определялось (рис. 5).
Рис. 5. Магнитно-резонансная томограмма сердца пациентки Л. от 7 февраля 2018 г. Проекция по длинной оси (A) и по короткой оси на уровне папиллярных мышц (B). Иллюстрация авторов
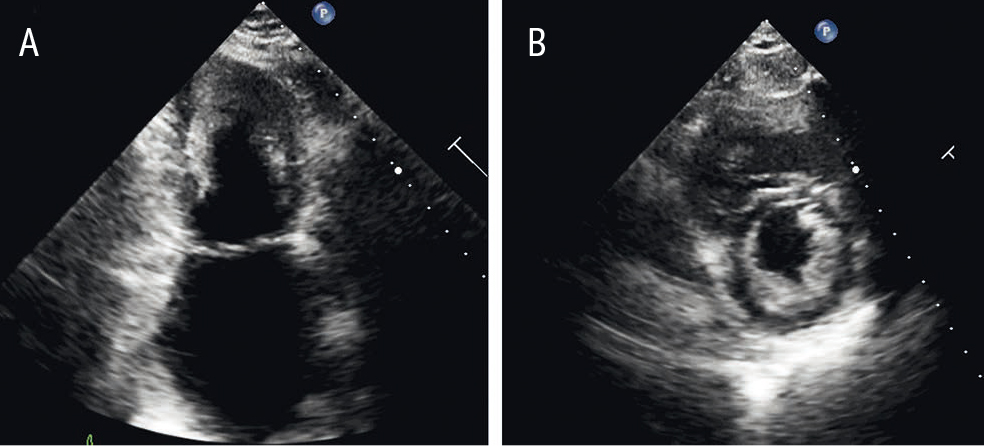
При ЭхоКГ (12.02.2018) отмечалась резко выраженная дилатация ЛП. Правые камеры сердца и ЛЖ не были увеличены. Наблюдались повышенная трабекулярность ЛЖ и признаки некомпактного миокарда, преимущественно в области верхушки ЛЖ. Глобальная сократительная функция ЛЖ была в норме (ФВ — 66% по Симпсону), регистрировалась диастолическая дисфункция по рестриктивному типу. Среднерасчетное давление в легочной артерии — 44 мм рт. ст. Митральная регургитация 2-й степени. Трикуспидальная регургитация 1-й степени. Межпредсердная перегородка аневризматически выбухала в полость правого предсердия на всем протяжении (рис. 6).
Рис. 6. Эхокардиограмма пациентки Л. от 12 февраля 2018 г. Двухкамерная верхушечная проекция (A) и проекция по короткой оси на уровне папиллярных мышц (B). Иллюстрация авторов
При суточном мониторировании ЭКГ (13–14.02.2018) на фоне синусового ритма регистрировались четыре неустойчивых пароксизма ФП и 11 неустойчивых пароксизмов наджелудочковой тахикардии, а также частая одиночная и парная желудочковая экстрасистолия (264 в час) и частая одиночная, парная и групповая наджелудочковая экстрасистолия (381 в час).
Молекулярно-генетическое обследование. На момент окончания описываемого обследования материал находился на изучении в Институте молекулярной биологии и генетики НМИЦ им. В.А. Алмазова МЗ РФ.
Обсуждение
Диагноз НКМП совсем недавно вошел в клиническую практику, и сведения о нем только накапливаются. Ввиду высокой смертности и серьезных осложнений некомпактный миокард представляет большую проблему в кардиологии [10, 11]. Установлено, что это генетически гетерогенная первичная КМП, которая встречается как у детей, так и у взрослых и отличается выраженным клиническим полиморфизмом [5, 9, 10]. Ключевым звеном в прогрессировании заболевания считают субэндокардиальную ишемию, вызванную нарушением микроциркуляции непосредственно под некомпактным слоем миокарда, которая является основным механизмом развития аритмий и сердечной недостаточности. В качестве других причин рассматриваются наличие «аритмогенного» гена натриевых каналов SCN5A, воспалительные изменения в миокарде и нарушение вегетативной иннервации сердца [5, 9].
В представленном клиническом случае ввиду отсутствия результатов молекулярно-генетического исследования не имелось убедительных данных, подтверждающих семейный вариант НКМП, — можно было говорить о спорадическом развитии изолированной НКМП у монозиготных близнецов. С учетом этого обеим пациенткам установлен диагноз «некомпактная кардиомиопатия левого и правого желудочков, смешанный морфологический вариант, рестриктивная форма».
Признаков нейромышечных заболеваний, а также врожденных пороков сердца, за исключением аневризмы межпредсердной перегородки, в обоих случаях выявлено не было. В ходе МРТ участков фиброза в миокарде не определялось. Однако если структурные изменения со стороны сердца и признаки некомпактности миокарда у сестер были практически идентичными, то по скорости развития и степени выраженности клинических проявлений заболевания пациентки существенно различались.
Прогноз при НКМП зависит от объема пораженных сегментов ЛЖ, сократительной способности миокарда, времени возникновения и скорости нарастания симптомов сердечной недостаточности. Он наиболее неблагоприятен при ФВ ЛЖ менее 35% и дилатации ЛЖ [1, 9, 11]10. В этом случае спасти пациента может только трансплантация сердца [3, 12]. Помимо декомпенсации кровообращения, пациенты погибают от рефрактерных к лечению нарушений сердечного ритма и тромбоэмболий [3, 10, 11]. Факторами риска летального исхода при НКМП также являются постоянная или персистирующая ФП, блокада ножек пучка Гиса и сопутствующие нервно-мышечные заболевания [1, 5, 11].
ЗАКЛЮЧЕНИЕ
В клинической картине у обеих пациенток преобладали проявления аритмического синдрома, в меньшей степени был выражен синдром сердечной недостаточности. Входящего в классическую клиническую триаду некомпактной кардиомиопатии (НКМП) тромбоэмболического синдрома не наблюдалось.
У В. НКМП дебютировала на 4 года раньше с появления персистирующей фибрилляции предсердий, к которой достаточно быстро присоединилась пароксизмальная желудочковая тахикардия, в том числе гемодинамически значимая, потребовавшая имплантации кардиовертера-дефибриллятора. Поражение миокарда характеризовалось стойким снижением сократительной функции обоих желудочков с клиническими проявлениями сердечной недостаточности 2–3-го функционального класса.
У Л. заболевание развивалось медленнее и протекало более «доброкачественно». По данным проведенного обследования, глобальная сократимость левого и правого желудочков была в норме и, несмотря на наличие неустойчивых пароксизмов фибрилляции предсердий и наджелудочковой тахикардии, желудочковые нарушения ритма высоких градаций и пароксизмальная желудочковая тахикардия отсутствовали. Вместе с тем в обоих случаях имелись предпосылки для неуклонного прогрессирования заболевания и неблагоприятного прогноза.
Молекулярно-генетические исследования последних лет произвели революционный переворот в понимании этиопатогенеза кардиомиопатии. Клинические и фенотипические проявления кардиомиопатии могут широко варьировать вследствие влияния специфических генов-модификаторов и внешних причин. Большинство модифицирующих факторов остаются неизвестными. Выраженная генетическая и фенотипическая гетерогенность НКМП, а также спорные вопросы, касающиеся патогенеза клинических проявлений и прогноза у пациентов с некомпактным миокардом, делают крайне актуальным проведение генетического тестирования, особенно при семейной форме заболевания.
Поступила: 01.04.2021
Принята к публикации: 15.04.2021
_______
1Союз педиатров России, Ассоциация детских кардиологов России. Федеральные клинические рекомендации по оказанию медицинской помощи детям с кардиомиопатиями. М.; 2014. 22 с.
2 Там же.
3 Там же.
4 Там же.
5Там же.
6Там же.
7Там же.
8Там же.
9Там же.
10Там же.








