ВВЕДЕНИЕ
Тромбоэмболия легочной артерии (ТЭЛА) остается на протяжении многих десятилетий одним из самых тяжелых и внезапных сосудистых заболеваний с малопредсказуемым прогнозом[1]. В последнее десятилетие значительно изменились подходы к ведению пациентов с ТЭЛА[2]. С 2019 года медицинские эксперты Европы ввели в клиническую практику новые рекомендации для врачей по ведению больных с ТЭЛА, основанные на принципах доказательной медицины и оценке степени риска неблагоприятного исхода в госпитальном периоде1.
Особую ценность для изучения закономерностей течения заболевания имеют регистровые исследования. В 2015 году были опубликованы результаты регистра PREFER венозных тромбоэмболий (ВТЭ) в европейской популяции[3], с 2001 по 2017 год происходил набор в регистр RIETE, в который включены 91 056 пациентов с ВТЭ[4]. В конце 2020 года закончился набор больных с ВТЭ в глобальный регистр GARFIELD, в который планировалось включить более 8000 человек из 28 стран мира.
Однако не всегда данные, полученные у пациентов зарубежных регистров, возможно экстраполировать на российскую популяцию. В связи с этим назрел вопрос о создании российского регистра пациентов с ТЭЛА, который был инициирован в 2016 году. В регистр СИРЕНА, объединивший усилия 21 стационара по набору пациентов с доказанными случаями ТЭЛА, вошли 660 человек. Наибольший интерес как научного сообщества, так и практикующих врачей вызывают анализ данных, связанных с неблагоприятным течением госпитального периода, качество оценки риска смертельного исхода и тактики ведения пациентов на территории Российской Федерации.
Цель нашего исследования: изучить подходы к ведению пациентов с ТЭЛА на госпитальном этапе с разной степенью риска смертельного исхода в реальной клинической практике российских стационаров.
МАТЕРИАЛЫ И МЕТОДЫ
Из базы данных многоцентрового регистра СИРЕНА, сформированного на базе 21 российского стационара в 2018–2019 гг. методом сплошного включения[5], был выбран 571 пациент. У всех больных рассчитан риск смерти по Pulmonary Embolism Severity Index (PESI). Исследование выполнено в соответствии со стандартами Хельсинкской декларации Всемирной медицинской ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 года и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ от 19.06.2003 г. № 266. Протокол исследования одобрен локальным этическим комитетом учреждения. Все пациенты, включенные в исследование, подписали добровольное информированное согласие на участие.
В таблице 1 представлена клиническая характеристика изучаемой выборки. Чуть более половины пациентов — мужчины, 66% больных имели артериальную гипертензию (АГ), около 30% — сахарный диабет (СД) 2 типа и варикозную болезнь. Частота таких сопутствующих заболеваний, как застойная хроническая сердечная недостаточность (ХСН), онкологическая патология и фибрилляция предсердий, составила около 20% в выборке.
Таблица 1
Клиническая характеристика выборки пациентов (n = 571)
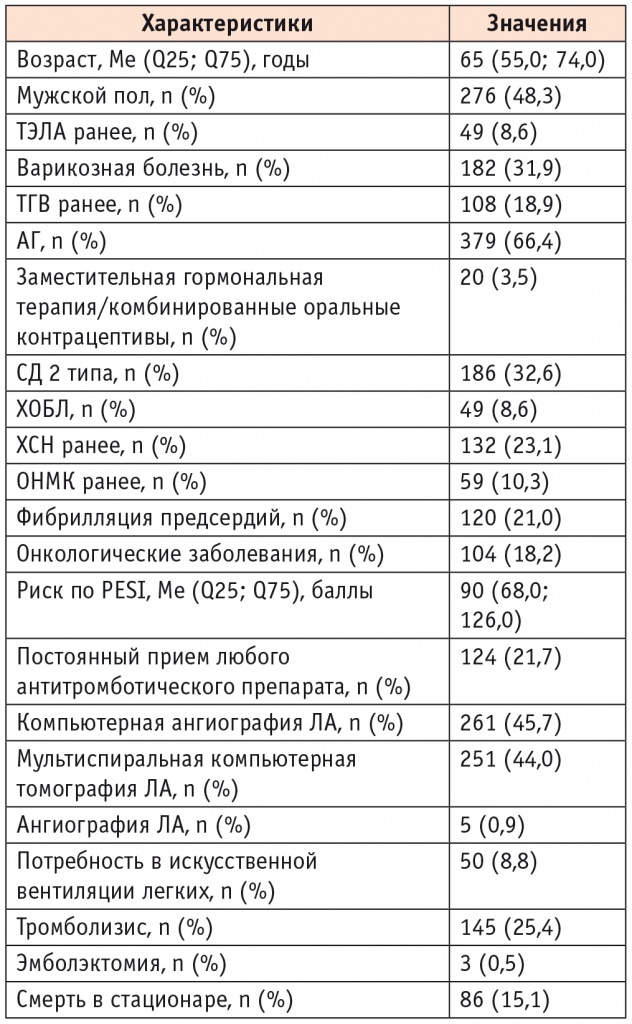
Примечание. Здесь и в таблице 2: АГ — артериальная гипертензия, ЛА — легочная артерия, ОНМК — острое нарушение мозгового кровообращения, СД — сахарный диабет, ТГВ — тромбоз глубоких вен, ТЭЛА — тромбоэмболия легочной артерии, ХОБЛ — хроническая обструктивная болезнь легких, ХСН — хроническая сердечная недостаточность, PESI — Pulmonary Embolism Severity Index.
Классификация риска по PESI проводилась следующим образом: сумма баллов ≤ 65 — I класс (очень низкий), 66–85 баллов — II (низкий), 86–105 баллов — III (умеренный), 106–125 баллов — IV (высокий), более 125 баллов — V (очень высокий). Средний показатель по PESI в изучаемой выборке составил 90 баллов (средний риск). Тромболизис проводился в 25,4% случаев, умерли 15,1% больных.
До госпитализации 124 (21,7%) больных ТЭЛА получали антитромботическую терапию. Так, наиболее часто пациенты принимали ацетилсалициловую кислоту (n = 77; 62,1%), по 10 (10,5%) — варфарин и ривароксабан, постоянно получали клопидогрел, а также другие виды антикоагулянтов (дабигатран и апиксабан) около 5% участников.
Статистическая обработка результатов исследования осуществлялась с помощью пакета программ MedCalc Version 16.2.1 (Softwa, Бельгия). Качественные показатели представлены в виде частот и процентов, количественные показатели — в виде медианы (Ме) с указанием квартильного размаха [Q25; Q75]. Сравнение в двух группах проводили с помощью критерия Манна — Уитни для количественных данных. Качественные данные сравнивали по таблицам сопряженности 2 × 2 с использованием критерия Пирсона и точного критерия Фишера при количестве наблюдений в группе менее 5. Для всех видов анализа статистически значимыми считались различия при р < 0,05.
РЕЗУЛЬТАТЫ
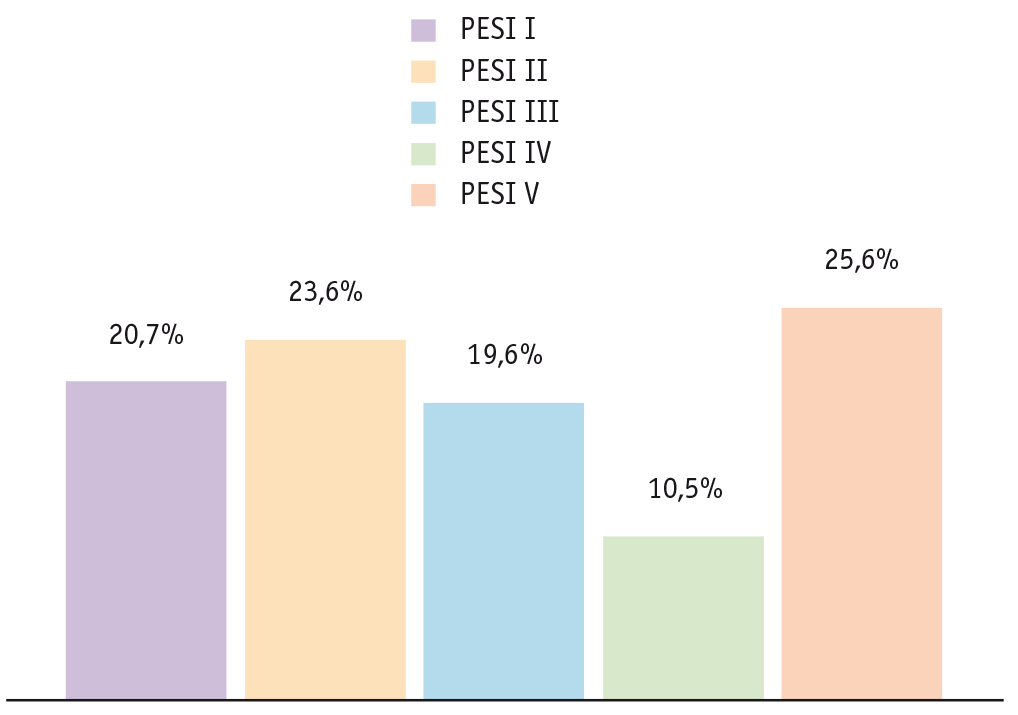
Четверть пациентов изучаемой выборки имели очень высокий риск смерти (V класс), при этом к категории высокого риска (V и IV класс) относились 206 (36,1%) больных (рис. 1), к категории низкого риска (I и II класс) — 253 (44,3%), а промежуточного — 112 (19,6%).
Рис. 1. Распределение пациентов по степени риска, согласно Pulmonary Embolism Severity Index (PESI) (p < 0,0001). Проведено множественное сравнение в трех и более группах по критерию Краскела — Уоллиса — проверка гипотезы, что между группами есть значимые различия. В последующем происходит попарное сравнение, если оно нужно. В нашем исследовании мы объединили риски I + II, IV + V, выделив отдельно риск III (указано в тексте)
Далее сравнительный анализ проводился в трех группах пациентов: с низким (I + II), промежуточным (III) и высоким риском (IV + V) (табл. 2). Установлено, что пациенты низкого риска статистически значимо моложе, реже имели АГ, СД 2 типа, хроническую обструктивную болезнь легких (ХОБЛ), ХСН, онкологические заболевания, наименьшее значение систолического давления в легочной артерии (сДЛА), но у них чаще был тромбоз глубоких вен в анамнезе, а у 16,6% больных наблюдалось повышение уровня маркера некроза миокарда.
Таблица 2
Сравнение пациентов с тромбоэмболией легочной артерии по клиническим, тактическим параметрам и исходам заболевания на госпитальном этапе в разных группах риска по Pulmonary Embolism Severity Index
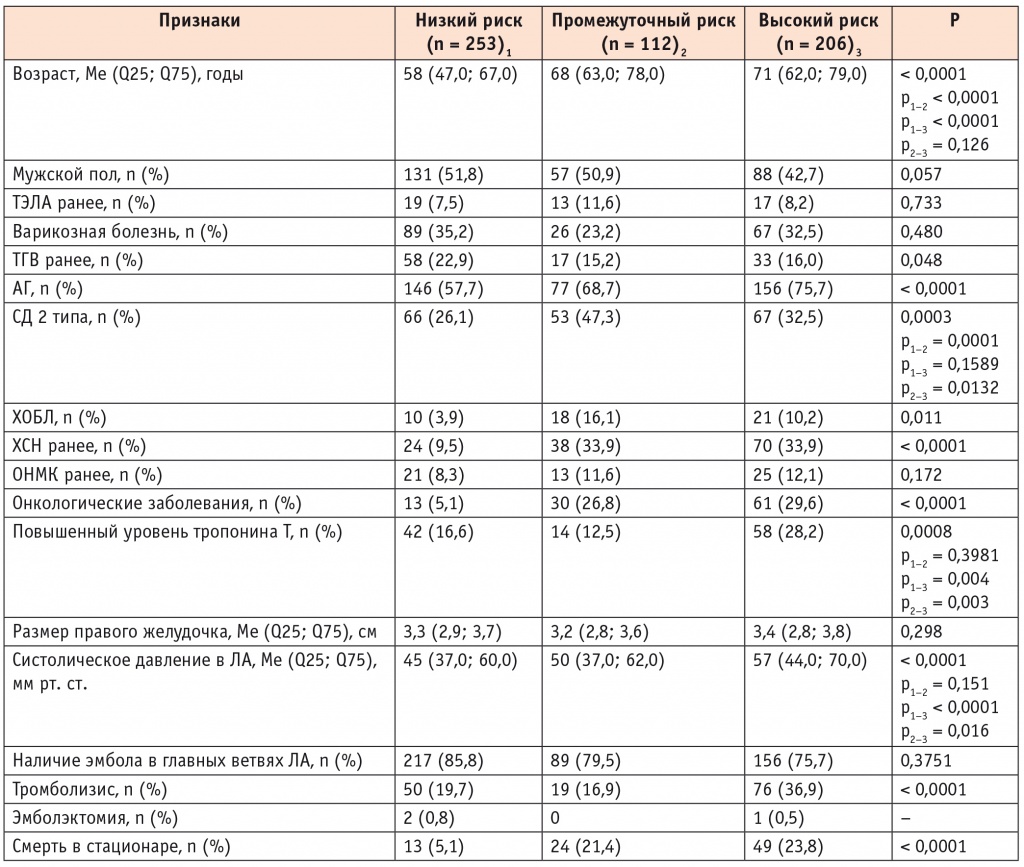
Пациенты с ТЭЛА высокого риска были наиболее старшего возраста, у них чаще всего встречались АГ и онкологические заболевания, а также в данной группе зарегистрирована самая высокая медиана сДЛА, у 28,2% пациентов — повышение содержания маркера некроза миокарда (тропонина T).
В группе пациентов низкого риска по PESI умерли 13 (5,1%), в группе умеренного риска — 24 (21,4%), в группе высокого риска — 49 (23,7%) человек.
Наиболее интересны характеристики больных промежуточного риска, так как по клиническим параметрам они были близки к пациентам высокого риска и у них зафиксирована наибольшая частота коморбидных заболеваний, таких как СД 2 типа, ХОБЛ и ХСН, по сравнению с таковой в других группах.
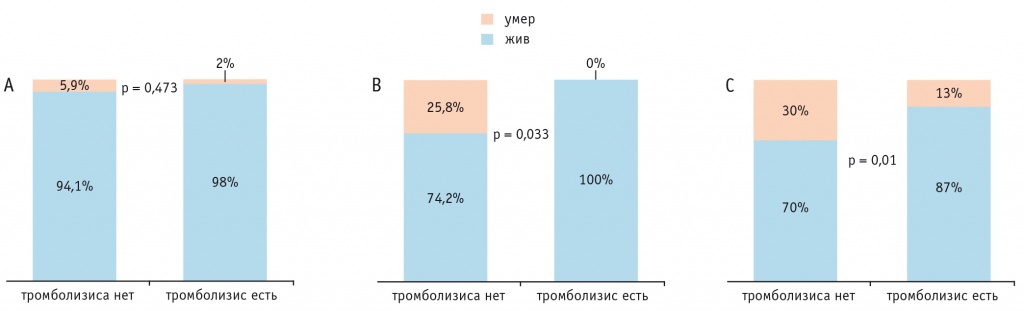
Среди больных с низким и высоким риском по PESI, получавших тромболитическую терапию (ТЛТ), умерло меньше людей, чем среди не получавших: 2 против 5,9% соответственно и 13 против 30% (р = 0,01) соответственно. В группе пациентов промежуточного риска, прошедших тромболизис, все остались живы, а среди не прошедших умерли 25,8% (р = 0,033) (рис. 2).
Рис. 2. Зависимость частоты смертельных исходов от проведенного тромболизиса у пациентов с низким (А), промежуточным (В) и высоким (С) риском по Pulmonary Embolism Severity Index
Изучение причин проведения тромболизиса, указанных в регистре, показало, что у пациентов с низким риском по PESI наиболее часто причинами являлись массивный тромбоз главных ветвей и ствола ЛА (n = 10; 3,9%), первый диагноз острого коронарного синдрома с элевацией ST (n = 2; 0,8%) и сохраняющиеся признаки дыхательной недостаточности на фоне антикоагулянтной терапии (n = 14; 5,5%).
При промежуточном риске по PESI наиболее частыми поводами для проведения тромболизиса послужили наличие дыхательной недостаточности с низким артериальным давлением (n = 7; 6,2%) и массивный тромбоз ветвей ЛА (n = 3; 2,7%).
ОБСУЖДЕНИЕ
По данным литературы, индекс PESI наиболее четко классифицирует пациентов с низким риском 30-дневной смертности при острой ТЭЛА2. Тактика лечения больных с ТЭЛА определяется риском внутригоспитальной летальности. При стабильной гемодинамике этот риск минимален. Низкое значение индекса PESI (< 85 баллов, классы риска I–II) и Simplified PESI (sPESI) = 0 являются критериями для лечения антикоагулянтами пациентов с острой ТЭЛА без ТЛТ[6].
Пациентам с ТЭЛА высокого риска по индексу PESI (классы IV, 106–125 баллов, и V, > 125 баллов) рекомендуется проведение тромболизиса в условиях стационара, а у больных со средним (промежуточным) риском (класс III, 86–105 баллов) должна быть также рассмотрена необходимость проведения тромболизиса и дополнительных обследований (эхокардиографии (ЭхоКГ), определения уровня тропонина). По современным клиническим рекомендациям, ТЛТ и дополнительные исследования производятся у всех пациентов с индексом PESI > 85 баллов[6, 7]3.
Один из путей повышения эффективности лечения и профилактики осложнений ТЭЛА — точная клиническая оценка степени тяжести ТЭЛА, основанная на совокупном определении клинических, лабораторных, инструментальных показателей. Имеются данные, что клинические прогностические модели наиболее эффективно идентифицируют пациентов низкого риска, что дает возможность лечить больных этой категории амбулаторно или рассматривать раннюю выписку из стационара[8].
Существует множество шкал клинического прогнозирования ранней смертности и осложнений при острой ТЭЛА (GPS, PESI, sPESI, Prognostic Algorithm, PREP, RIETE, AMAPI, HOPPE), но нет единого мнения о том, какая из них лучше[9–13].
В представленном нами регистровом исследовании пациенты умеренного и высокого риска имели схожие показатели летальности. В работе И.С. Мулловой и соавт. (2018) у 45,4% больных был очень низкий и низкий риск летального исхода по индексу PESI, что сопоставимо с результатами представленного нами исследования. Однако в публикации И.С. Мулловой и соавт. больше пациентов имели умеренный риск (24,5%), и меньше больных относились к категориям высокого и очень высокого риска (30,1%). В группах очень низкого и низкого риска умерших не было в отличие от нашего исследования, в группе умеренного риска умерло также значительно меньше пациентов (2,1%)[14].
P.M. Erkens и соавт. (2012) показали, что индекс PESI помогает достаточно точно идентифицировать низкий и высокий риск краткосрочных нежелательных событий у лиц с острой ТЭЛА[15]. Однако для прогнозирования летальных исходов у больных с ТЭЛА промежуточного риска использование индекса PESI недостаточно эффективно. Так, у гемодинамически стабильных пациентов с промежуточным риском частота развития осложнений оказалась в 2 раза ниже, чем при использовании прогностической шкалы Geneva и шок-индекса (10,7% против 20,1 и 24,1% соответственно).
В последнее время доказано, что учет лабораторных и инструментальных клинических критериев значимо повышает прогностическую возможность PESI. Так, частота верного прогнозирования летального исхода у пациентов с промежуточно-высоким риском по индексу PESI возрастает с 25 до 71% при учете значений лабораторных кардиомаркеров и признаков дисфункции правых отделов сердца[8].
В метаанализе А. Elias и соавт. (2016), проведенном среди более 44 тыс. пациентов, наибольшую ценность для определения вероятности неблагоприятного исхода показал индекс PESI, как полная, так и упрощенная версия. Общая 30-дневная смертность составила 2,3% в группе низкого риска и 11,4% в группе высокого риска по PESI (9 исследований), а также 1,5% в группе низкого риска и 10,7% в группе высокого риска по sPESI (11 исследований), т. е. в группе высокого риска процент летальности оказался значительно меньше, чем по результатам регистра СИРЕНА[16].
В бразильском исследовании (2019) в кластерном анализе по классам риска общая 30-дневная смертность по индексу PESI составила 2,4% для классов I–II по сравнению с 20,0% для классов III–V (относительный риск = 5,9; 95% доверительный интервал: 1,88–18,51; р = 0,0002), что коррелирует с результатами, полученными в российском регистре[17]. В исследовании B. Tamizifar и соавт. (2016) смертность пациентов с ТЭЛА как низкого, так и высокого риска по индексу PESI была выше (около 4 и 33% соответственно)[18]. В исследовании США индекс PESI хорошо идентифицировал пациентов с ТЭЛА, которые имели низкий риск 30-дневной смертности. Однако по sPESI многие больные с низким риском смерти оказались ошибочно классифицированы в группы с более высоким риском, что могло привести к ненужной тактике более частого проведения ТЛТ[19].
Следует отметить, что в проведенные исследования входили больные разного возраста, с различными соотношениями по полу и клиническим характеристикам. Так, например, в работе L. De Araujo Soriano и соавт. средний возраст составил 57 лет, преобладали женщины (60%)[17]. В исследование M. Koć и соавт. включены 138 пациентов (50% женщин) в возрасте 62 лет[11], в исследование M. Zuin и соавт. — 209 человек (44% мужчин и 56% женщин, средний возраст — 70,58 года)[12].
В публикации T. Dahhan и соавт. средний возраст пациентов — 55 лет, при этом 48% составили женщины[20]. В исследовании L. Jara-Palomares и соавт. 5822 (17%) участника были в возрасте менее 50 лет[9].
В российском регистре СИРЕНА пациенты с ТЭЛА высокого риска характеризовались наиболее старшим возрастом, наибольшей частотой АГ и онкологических заболеваний в анамнезе. Больные промежуточного риска по клиническим параметрам были близки к пациентам высокого риска, и у них наблюдалась наибольшая частота коморбидных заболеваний, таких как СД 2 типа, ХОБЛ и ХСН. Наиболее вероятно, это и объясняет практически одинаковую смертность в группах высокого и промежуточного риска.
В исследовании O. Al Dandan наиболее распространенными факторами риска осложнений ТЭЛА являлись ожирение (в 37,6% случаев) и наличие серповидно-клеточной анемии (9,4%). Данное исследование также указывает на необходимость оценки сопутствующей патологии у пациентов с ТЭЛА[21].
В группе больных высокого риска наблюдались самая высокая медиана сДЛА (57 мм рт. ст.), наиболее высокий процент повышения уровня тропонина T (28,2%), что согласуется с проведенным ранее исследованием И.С. Мулловой и соавт.[14]. Следует отметить, что у пациентов группы низкого риска по PESI чаще выявляли ТГВ, чем у участников промежуточного и высокого риска, что может рассматриваться как фактор увеличения риска повторных неблагоприятных событий у данных больных.
ТЛТ чаще проводилась в группах низкого (19,7%) и высокого риска (36,9%). Анализ показал, что такая тактика лечения объясняется наличием эмбола в главных ветвях ЛА у 217 (85,7%) пациентов. Подобные результаты опубликованы исследователями госпитального регистра ТЭЛА в Нижнем Новгороде. Установлено, что в реальной клинической практике тромболизис проводили пациентам не только высокого и промежуточного высокого, но и промежуточного низкого и даже низкого риска. Основным показанием для ТЛТ было наличие центрального расположения тромбов, которое наблюдалось почти в 60% случаев[22].
В регистре СИРЕНА отмечено, что врач принимал решение о проведении тромболизиса на основании массивного тромбоза в главных ветвях ЛА, а также при наличии дыхательной недостаточности у пациентов с низким риском (I и II класс), и это вполне оправдано, так как число летальных исходов оказалось ниже среди пациентов, прошедших ТЛТ.
В группе промежуточного риска умерли 25,8% больных, не получавших ТЛТ, а среди получавших ее все остались живы, это свидетельствует, что требуется более тщательная оценка необходимости данного лечения. Среди пациентов высокого риска, у которых не проводилась ТЛТ, смертность составила 30%, а при проведении тромболизиса — лишь 13%.
В недавно обновленных рекомендациях Европейского общества кардиологов подчеркивается важность клинического прогнозирования в сочетании с процедурами визуализации (оценкой функции правого желудочка) и оценкой лабораторных биомаркеров (показывающих стресс или повреждение миокарда) для дифференцировки пациентов промежуточного и низкого риска с целью точного определения неблагоприятного раннего исхода.
Показано, что при ТЭЛА средней степени и высокого риска, определяемой наличием как дисфункции правого желудочка на ЭхоКГ (или компьютерной томограмме), так и положительного теста на кардиомаркеры, риски кровотечения при лечении полными фибринолитиками перевешивают его потенциальную клиническую пользу при отсутствии клинических признаков гемодинамической декомпенсации (спасительный фибринолиз).
Классический системный тромболизис не может быть рекомендован в качестве рутинной тактики лечения для пациентов с низким риском или субмассивной ТЭЛА нецентральной локализации. Больные, принадлежащие к этой группе риска, должны получать парентеральный гепарин и тщательно мониторироваться в течение 48–72 ч, и спасительный фибринолиз следует рассматривать при появлении клинических признаков гемодинамической декомпенсации[23].
Недавно опубликованные исследования показывают, что катетер-направленный, управляемый ультразвуком местный фибринолиз в низких дозах может обеспечить эффективный и особенно безопасный вариант лечения данных групп пациентов[24].
Первичный системный фибринолиз имеет неблагоприятное соотношение риска и пользы при ТЭЛА промежуточного риска; катетер-направленные методы являются вариантом для больных с декомпенсацией гемодинамики и высоким риском кровотечения. Новые пероральные антикоагулянты — эффективные и безопасные альтернативы стандартным режимам антикоагуляции. Данные недавних испытаний не подтверждают безопасность применения кава-фильтров у пациентов, которые могут получать лечение антикоагулянтами[22].
Таким образом, учет наличия массивного тромбоза главных ветвей ЛА необходим для рассмотрения вопроса о ТЛТ при любом риске по клиническим шкалам. Наиболее перспективным методом в настоящее время является катетерный локальный тромболизис, изучение которого набирает обороты.
ЗАКЛЮЧЕНИЕ
В ходе проведенного исследования показана значимая эффективность проведения системной ТЛТ в отношении снижения госпитальной смертности у пациентов промежуточного и высокого риска. Установлена необходимость более тщательного анализа наличия сопутствующей патологии и факторов риска, дополнительных инструментальных и лабораторных показателей у пациентов низкого и промежуточного риска по индексу PESI.
При наличии отягчающих факторов у больных низкого и промежуточного риска по индексу PESI, таких как центральный массивный тромбоз ЛА в сочетании с клиникой дыхательной недостаточности, возможно рассмотреть вопрос о проведении ТЛТ при отсутствии высокого риска развития кровотечений после данной процедуры.
Поступила: 14.10.2022
Принята к публикации: 18.12.2022
________
1 Авдеев С.Н., Вавилова Т.В., Гончарова Н.С., Карелкина Е.В. и др. Европейские рекомендации по диагностике и лечению острой тромбоэмболии легочной артерии 2019 года: комментарии специалистов Российского кардиологического и респираторного обществ. Артериальная гипертензия. 2019;25(6):584–603. DOI: 10.18705/1607-419X-2019-25-6-584-603
2 Konstantinides S.V., Meyer G., Becattini C., Buena H. et al. 2019 ESC Guidelines for the diagnosis and management of acute pulmonary embolism developed in collaboration with the European Respiratory Society (ERS): The Task Force for the diagnosis and management of acute pulmonary embolism of the European Society of Cardiology (ESC). Eur. Heart J. 2020;41(4):543–603. DOI: 10.1093/eurheartj/ehz405
3 Там же.








