ВВЕДЕНИЕ
Продолжительность пандемии новой коронавирусной инфекции (COVID-19) демонстрирует, что несмотря на элиминацию SARS-CoV-2 пациенты продолжают предъявлять различные жалобы[1, 2]. Предполагается, что распространенность остаточных симптомов после выздоровления составляет до трети случаев среди лиц, перенесших COVID-19[3]. Спустя 6 мес после COVID-19 жалобы на учащенное сердцебиение регистрируются у 9% переболевших, на боль в груди — у 5%[4]. Через 12 мес после пернесенного COVID-19 только 22,9% пациентов полностью избавляются от остаточных симптомов заболевания[5]. В исследовании Y. Xie и соавт. показано, что пациенты, переболевшие COVID-19, имеют повышенный риск возникновения сердечно-сосудистых осложнений, в частности, аритмий, ишемической болезни сердца, миокардита, сердечной недостаточности и тромбоэмболических событий[6]. Патогенетические механизмы развития рассматриваемых осложнений после элиминации SARS-CoV-2 продолжают активно обсуждаться медицинским сообществом. С одной стороны, их развитие можно связать с осложнениями острого периода COVID-19: цитокиновым штормом, системной гипоксемией, микрососудистым повреждением сердца, коронарным спазмом и электролитными нарушениями[7, 8]. С другой стороны, определенную роль играет аутоиммунный механизм, запускаемый в ходе формирования эндотелиальной дисфункции при вирусемии SARS-CoV-2 с поражением эндотелиальных клеток сосудов[9, 10].
Дисфункция эндотелия может являться пусковым звеном развития нарушений липидного обмена при COVID-19[11]. Для острого периода COVID-19 характерна тенденция к снижению общего холестерина (ХС), ХС липопротеинов низкой плотности (ЛПНП) и ХС липопротеинов очень низкой плотности (ЛПОНП), степень изменения которых коррелирует с тяжестью и прогнозом заболевания[12].
Результатами инфицирования организма SARS-CoV-2 могут являться различные изменения со стороны сердечно-сосудистой системы, которые выявляются при электрокардиографическом (ЭКГ) исследовании: нарушения сердечного ритма и проводимости, изменения сегмента ST, зубца Т, интервалов и расположения электрической оси сердца (ЭОС)[13]. В исследовании S.A. McCullough и соавт. с участием 756 пациентов, госпитализированных с COVID-19, по результатам ЭКГ были диагностированы фибрилляция предсердий (5,6% случаев), предсердная (7,7%) и желудочковая (3,4%) экстрасистолии, блокада правой (7,8%) и левой (1,5%) ножек пучка Гиса, неспецифические нарушения процессов реполяризации в виде изменения зубца Т (29,1%)[14].
Исследования динамики изменения ЭОС среди пациентов, перенесших COVID-19, нами не обнаружены. ЭОС определяется согласно углу α (∠α). Выделяют следующие положения ЭОС: вертикальное (∠α = 70–90°), нормальное (∠α = 30–69°), горизонтальное (∠α = 0–29°), отклонение влево (∠α от –1° до –90°) и вправо (∠α = 91–180°)[15]. Поражение сердечной мышцы у пациентов, перенесших COVID-19, протекая в большинстве случаев без симптомов, может развиваться в любом возрасте вне зависимости от наличия сердечно-сосудистых заболеваний в анамнезе[16].
Цель исследования: изучить взаимосвязь лабораторно-инструментальных показателей с тяжестью течения COVID-19 и оценить динамику изменений липидного профиля и ЭОС у пациентов в остром периоде заболевания и после выздоровления.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ историй болезни 30 пациентов молодого возраста (18–44 лет) без сердечно-сосудистых заболеваний в анамнезе, проходивших двухэтапное лечение в Военно-медицинской академии им. С.М. Кирова с диагнозами: «Коронавирусная инфекция COVID-19, вирус идентифицирован» (U07.1, МКБ-10) и «Состояние после новой коронавирусной инфекции» (U09.9, МКБ-10) в апреле–декабре 2021 г. Для изучения взаимосвязи маркеров воспаления — скорости оседания эритроцитов (СОЭ) и С-реактивного белка (СРБ), а также объема поражения легочной ткани по данным компьютерной томографии с тяжестью течения COVID-19, основная выборка пациентов (n = 30) была разделена на 3 группы в соответствии со степенью тяжести острого периода заболевания: легкой (n = 16), среднетяжелой (n = 9) и тяжелой (n = 5).
В динамике проанализированы следующие клинико-лабораторные и инструментальные данные: жалобы со стороны сердечно-сосудистой системы, систолическое артериальное давление (АД), диастолическое АД, ЧСС, липидный профиль, включающий в себя общий ХС, триглицериды, ХС ЛПНП, ХС ЛПОНП, ХС липопротеинов высокой плотности (ЛПВП), а также результаты ЭКГ-исследований, основное внимание в которых было уделено оценке изменения ∠α и ЭОС. Автоматически определенный ∠α при помощи экспертного 12-канального электрокардиографа ELI 250c (Mortara Instrument, Inc.) проверялся вручную графическим методом специалистами в области функциональной диагностики.
Статистический анализ проводили в программе IBM SPSS Statistics 23.0. Нормальность распределения переменных оценивали с помощью W-критерия Шапиро–Уилка. При нормальном распределении непрерывные переменные представлялись как среднее значение (М) и стандартное отклонение (σ), а если распределение отличалось от нормального — медианы (Ме) с указанием интерквартильного интервала [Q25–Q75]. Категориальные данные описывали как частоты и проценты. Сравнение между тремя выборками проводили на основании H-критерия Краскела–Уоллиса. Различия между зависимыми выборками определяли с помощью T-критерия Вилкоксона. Корреляционный анализ проводили с использованием ρ-коэффициента ранговой корреляции Спирмена. За критический уровень значимости принимали значение р < 0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
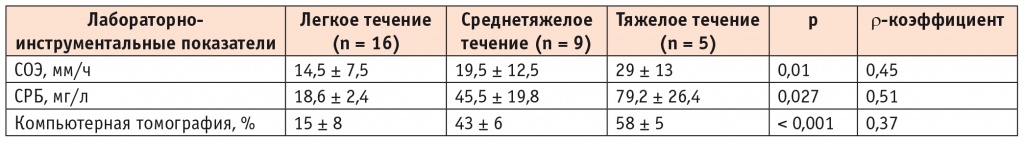
Средний возраст пациентов (80% — мужчины) составил 36 ± 7 лет. Среднее время с момента элиминации SARS-CoV-2 до поступления на второй этап лечения составило 6 ± 2 дня. В остром периоде COVID-19 жалобы на боль в груди отмечали 3 (10%) пациента, учащенное сердцебиение — 5 (17%), а после выздоровления они регистрировались в 4 (13%) и 8 (27%) случаях соответственно. Наследственная отягощенность по сердечно-сосудистым заболеваниям была отмечена у 3 (10%) пациентов. У 5 (17%) пациентов, перенесших COVID-19, в ходе проведения эхокардиографического исследования выявлено незначительное увеличение давления в легочной артерии. В ходе корреляционного анализа установлена положительная связь степени тяжести COVID-19 с объемом поражения легочной ткани (ρ = 0,37; р < 0,001) и концентрацией маркеров воспаления — СОЭ (ρ = 0,45; р = 0,01) и СРБ (ρ = 0,51; р = 0,027) (табл. 1). В исследовании Н.С. Губенко и соавт. была продемонстрирована в том числе отчетливая корреляция изменений маркеров воспаления (СОЭ, СРБ) и поражения легочной ткани по данным компьютерной томографии с тяжестью течения COVID-19[17].
Таблица 1
Изменение маркеров воспаления и объема поражения легочной ткани у пациентов (n = 30) в зависимости от степени тяжести течения СOVID-19 в остром периоде
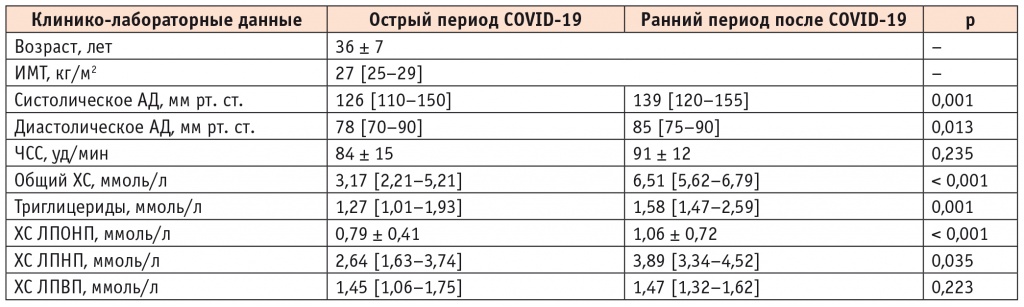
В результате ретроспективного анализа динамики изменения липидного профиля у пациентов, перенесших COVID-19, отмечено повышение концентрации в плазме крови общего ХС (6,51 [5,62–6,79] ммоль/л; p < 0,001), ХС ЛПНП (3,89 [3,34–4,52] ммоль/л; p = 0,035) и ХС ЛПОНП (1,06 ± 0,72 ммоль/л; p < 0,001) в отличие от острого периода заболевания, где липидный спектр оставался в пределах нормальных значений (табл. 2). Схожие результаты были продемонстрированы A.V. Sorokin и соавт., которые отметили у пациентов в остром периоде COVID-19 склонность к снижению общего ХС, ХС ЛПНП и ХС ЛПОНП, а к моменту выздоровления — тенденцию к возвращению данных показателей до исходных значений[18]. Примечательно, что концентрация ХС ЛПВП в плазме крови при COVID-19 практически не изменялась, что также было выявлено в нашем исследовании (табл. 2). Необходимо отметить, что применение антикоагулянтной терапии, проводимой 14 (47%) пациентам из группы среднетяжелого и тяжелого течения в остром периоде COVID-19 с их последующей отменой после элиминации SARS-CoV-2, могло повлиять на различия в концентрации липидов крови (общего ХС, ХС ЛПНП, ХС ЛПОНП), выявленных в нашем исследовании.
Таблица 2
Клинико-лабораторные данные пациентов (n = 30) в остром периоде COVID-19 и в раннем периоде после лечения COVID-19
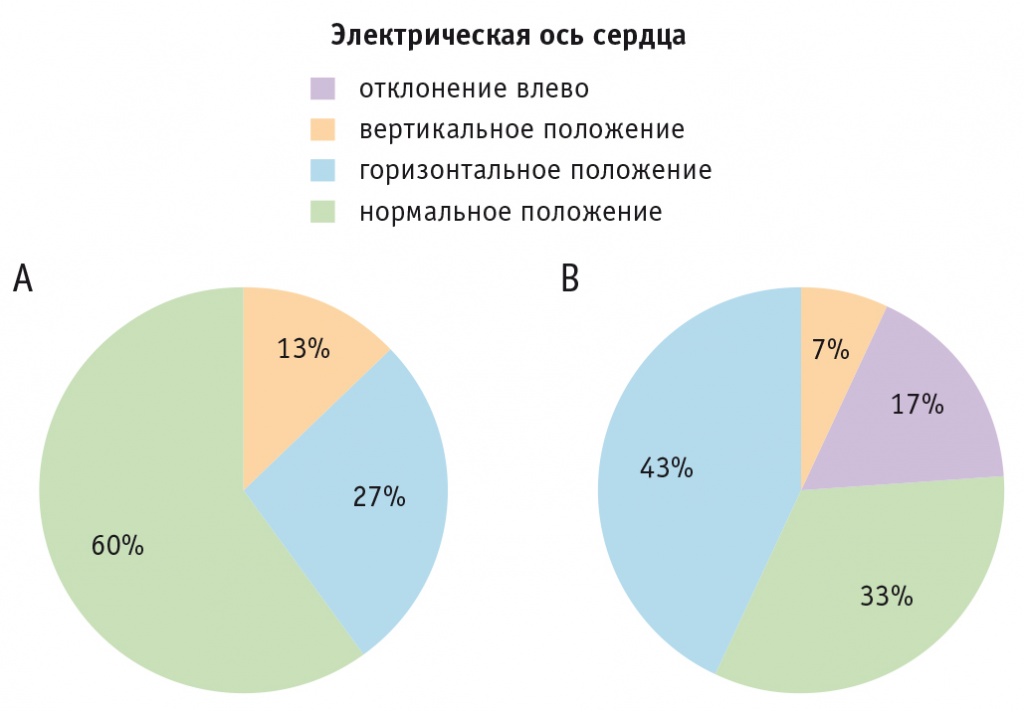
Анализ ЭКГ продемонстрировал динамику изменения ∠α у пациентов в остром периоде COVID-19 в сравнении с периодом выздоровления с 42 ± 11° до 25 ± 17° (p = 0,001; табл. 3). В остром периоде заболевания ЭОС имела следующее расположение: нормальное — в 18 (60%) случаях, горизонтальное — в 8 (27%), вертикальное — в 4 (13%), а после выздоровления — 10 (33%), 13 (43%) и 2 (7%) соответственно. После элиминации SARS-CoV-2 ЭОС имела тенденцию к смещению из нормального положения в горизонтальное и отклонению влево. Стоит отметить, что отклонение ЭОС влево было выявлено впервые у 5 (17%) пациентов, перенесших COVID-19 (рис. 1). Однако на результаты ЭКГ (∠α и ЭОС) могло повлиять предшествующее лечение антибактериальными препаратами (респираторные фторхинолоны) у 14 (47%) пациентов.
Таблица 3
Электрокардиографические показатели пациентов (n = 30) в остром периоде COVID-19 и в раннем периоде после лечения COVID-19
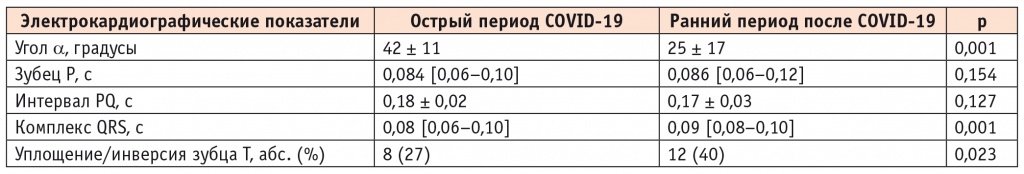
Рис. 1. Расположение электрической оси сердца у пациентов (n = 30) в остром периоде COVID-19 (А) и в раннем периоде после лечения COVID-19 (В)
Кроме этого, проанализированные ЭКГ-заключения показали, что после элиминации SARS-CoV-2 чаще наблюдались синдром ранней реполяризации желудочков — в 4 (13%) случаях, нарушения внутрижелудочковой проводимости — в 3 (7%), синусовая брадикардия — в 2 (7%), однако данные результаты оказались статистически незначимы (табл. 4). Корригированный интервал QT у пациентов, включенных в исследование, оставался нормальным как в остром периоде COVID-19, так и после выздоровления. Нами выявлено увеличение частоты регистрации диффузных неспецифических нарушений процессов реполяризации в виде уплощения и инверсии зубца Т у 12 (40%) пациентов, перенесших COVID-19, в сравнении с острым периодом заболевания, где данные изменения были отмечены в 8 (27%) случаях (p = 0,023; табл. 3, 4). В исследовании L.A. Sechi и соавт. с оценкой ЭКГ у 105 пациентов спустя 41 (37–44) день после COVID-19 изменение зубца Т регистрировалось у 14 (13%) переболевших[19].
Таблица 4
Электрокардиографические заключения пациентов (n = 30) в остром периоде COVID-19 в ранний период после лечения COVID-19
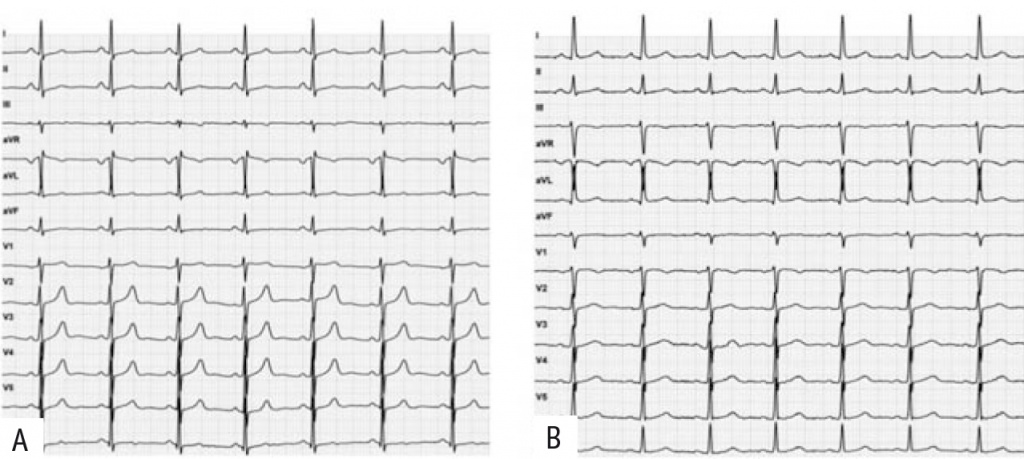
Представляем динамику изменения ∠α и ЭОС по данным ЭКГ у мужчины 38 лет без сердечно-сосудистых заболеваний в анамнезе в остром периоде COVID-19 тяжелого течения (рис. 2, А) и спустя 8 сут после выздоровления (рис. 2, В).
Рис. 2. ЭКГ мужчины 38 лет, скорость записи 25 мм/с, в острый период COVID-19 (А) и на 8-е сутки после COVID-19 (В).
А: ритм синусовый, ЧСС 74 уд/мин, горизонтальное положение электрической оси сердца (ЭОС) (∠α +24º); В: ритм синусовый, ЧСС 81 уд/мин, ЭОС отклонена влево (∠α –5º).
К ограничениям настоящей работы стоит отнести небольшой размер выборки и ретроспективный характер исследования. Гипотеза о возможности применения в рутинной практике изменения ЭОС и липидограммы в качестве маркеров поражения сердечно-сосудистой системы у пациентов, перенесших COVID-19, нуждается в дальнейшем изучении.
ЗАКЛЮЧЕНИЕ
ЭКГ, являясь простым и общедоступным методом исследования, должна применяться в оценке риска сердечно-сосудистых осложнений у пациентов, перенесших COVID-19. Впервые выявленные отклонение ЭОС влево и дислипидемия у переболевших COVID-19 могут быть косвенным отражением поражения сердечно-сосудистой системы de novo.
Таким образом, лица, перенёсшие COVID-19, у которых впервые были выявлены нарушения липидного обмена и отклонение ЭОС влево в совокупности с высокими уровнями маркеров воспаления могут рассматриваться как кандидаты для проведения высокотехнологических методов визуализации с целью исключения поражения сердечно-сосудистой системы.
Поступила: 24.11.2022
Принята к публикации: 09.02.2023








