Инфаркт миокарда (ИМ) является одной из самых распространенных причин смерти и инвалидизации населения. Среди факторов, влияющих на продолжительность жизни и смертность при ИМ, наиболее серьезные — острая сердечная недостаточность, нарушения ритма сердца и повторные коронарные атаки. У пациентов с ОКС и признаками сердечной недостаточности риск смерти в условиях стационара увеличивается в 4 раза.
Кардиогенный шок, согласно разным данным, наблюдается у 5–20% больных ИМ[1]. Летальность при нем остается высокой и находится в пределах 40–60%.
Раннее выявление предвестников острой сердечной недостаточности, своевременная ее коррекция в настоящее время становятся весьма актуальными задачами. Кроме того, имеют большое научноприкладное значение особенности острой сердечной недостаточности, механизмы ее регуляции. Некроз кардиомиоцитов и выброс протеиназ в циркуляцию приводят к развитию воспалительной реакции, сопровождающейся активацией синтеза цитокинов, хемокинов, факторов роста, белков острой фазы[1–4]. Однако большинство современных исследователей акцентируют внимание на изменениях цитокинового профиля без учета уровней белков[4–7], синтез которых стимулируется цитокинами, а также без учета осложнений ИМ[8]. В результате общей воспалительной реакции отмечается повышение или снижение в крови концентраций белков острой фазы воспаления. Нами детально изучено их изменение у больных с ИМ.
Цель исследования: изучить уровни белков острой фазы воспаления в сыворотке крови у пациентов с ИМ.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнено на базе кардиологического отделения № 1 МБЛПУ «Городская клиническая больница № 1» г. Новокузнецка в период с 2008 по 2012 г. Белки острой фазы исследовали в сыворотке крови, полученной в 1е, 7е и 14е сутки от возникновения заболевания, у 97 пациентов (средний возраст — 58,5 ± 1, 06 года). Из них 57 человек были с неосложненным ИМ, 40 человек — с осложненным острой сердечной недостаточностью: 30 — с отеком легких и 10 — с кардиогенным шоком. В качестве контроля использовали сыворотку крови 26 практически здоровых мужчиндобровольцев сравнимого возраста (53,3 ± 2,2 года), не имевших в анамнезе ИБС.
Уровни α2макроглобулина (α2МГ) и α1антитрипсина (α1АТр) в сыворотке крови оценивали методом низковольтного ракетного иммуноэлектрофореза с использованием моноспецифических поликлональных кроличьих антисывороток против данных белков. Концентрацию лактоферрина (ЛФ) определяли при помощи твердофазного ИФА с применением наборов тестсистем ЗАО «ВекторБест» (Новосибирск).
Тромболитическая терапия (ТЛТ) была проведена 29 больным (29,9%), включенным в исследование (19 — стрептокиназой в дозе 1,5 млн Ед, 10 — тканевым активизатором плазминогена, тенектоплазой (Метализе) в дозе 50 мг) по стандартным схемам, рекомендованным ВНОК. Показания и противопоказания для ТЛТ определяли по критериям ВНОК. ТЛТ проведена 11 пациентам с неосложненным ИМ и 18 с ИМ, осложненным острой сердечной недостаточностью.
Временны’м стандартом для проведения ТЛТ являлся срок до 6 часов от начала клиники ОКС. Средние сроки госпитализации больных, получивших ТЛТ, в нашем исследовании составили 4,4 ± 1,3 часа. У 18 (62,1%) пациентов ТЛТ проведена на догоспитальном этапе кардиологическими бригадами скорой помощи.
Анализ данных проводили с использованием статистического пакета программ Statistica 6.0 и с помощью сертифицированной программы биостатистики InStat II (Sigma, США). Вычисляли среднее арифметическое значение (М), выборочное стандартное отклонение (STD) и ошибку средней арифметической величины (m). Данные в таблице представлены в виде М ± m.
Все полученные результаты проверяли на нормальность распределения с помощью критерия Колмогорова — Смирнова. В случае, когда закон распределения измеряемых величин можно было считать нормальным, использовали tкритерий Стьюдента. Для признаков, не отвечающих требованиям нормального распределения, применяли непараметрический тест Манна — Уитни (Uтест) для независимых совокупностей и Ттест Вилкоксона для попарно связанных выборок. Для исследования зависимостей между переменными использовался коэффициент ранговой корреляции Спирмена. Критический уровень значимости (р) при проверке статистических гипотез принимался равным 0,05.
РЕЗУЛЬТАТЫ
У пациентов после проведения ТЛТ в 1е сутки ИМ отмечались статистически значимо более низкие показатели белков острой фазы по сравнению с не получившими ТЛТ. Следовательно, ТЛТ интенсивно подавляет происходящее воспаление в миокарде в течение первых часов (острейшего периода ИМ) и суток развития ИМ (табл.).
Таблица
Влияние тромболитической терапии (ТЛТ) на белки острой фазы воспаления у больных инфарктом миокарда (ИМ)
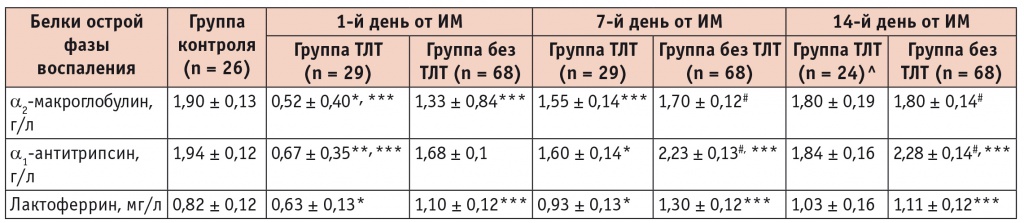
^ Пять пациентов не дожили до 14-го дня от развития инфаркта миокарда.
# Отличие от значения в 1-е сутки и развития инфаркта миокарда статистически значимо (p < 0,05).
* Отличие от группы больных, не получавших тромболитическую терапию, статистически значимо (р = 0,03).
** Отличие от группы больных, не получавших тромболитическую терапию, статистически значимо (р = 0,02).
*** Отличие от группы контроля статистически значимо (p < 0,05).
На 7е сутки ИМ в группе ТЛТ уровень α2МГ был ниже, чем у больных, не получивших ТЛТ, но эта разница не была статистически значимой. На 14сутки наблюдения у пациентов двух групп различий в показателях по уровню α2МГ не наблюдалось.
После проведения ТЛТ на 7е сутки отмечали более низкие показатели белков острой фазы, чем при отсутствии ТЛТ, при этом различия в концентрациях α1АТр и ЛФ были статистически значимы (в обоих случаях р = 0,03). Это связано с тем, что в остром периоде ИМ возрастают уровни неспецифических показателей некроза и асептического воспаления, получивших название биохимических маркеров воспаления.
На 14е сутки в группе ТЛТ уровни α1АТр и ЛФ повысились, но содержание α1АТр все еще было меньше контрольных значений, а ЛФ на всех этапах наблюдения оставалось выше нормы. У пациентов, которым ТЛТ не проводили, концентрация α1АТр на 14е сутки была повышена и превышала значения группы контроля (p < 0,05). Уровень ЛФ в данной группе на 14е сутки наблюдения снизился, но оставался выше нормы (p < 0,05).
У больных, не получивших ТЛТ, в 1е сутки ИМ концентрации α2МГ и α1АТр были статистически значимо снижены по сравнению с таковыми на 7е и 14е сутки (во всех случаях p < 0,05). Это связано с тем, что в 1е сутки заболевания подавляется иммунологический статус больного с крупноочаговым ИМ.
Уровень ЛФ в 1е сутки ИМ в группе не получивших ТЛТ также был снижен по сравнению с таковым в этой группе на 7е сутки, несмотря на то, что ЛФ — быстро реагирующий на воспаление белок острой фазы. Возможно, это связано с объемом поражения миокарда, с молниеносным развитием иммунологических механизмов в миокарде. Показатели ЛФ на 14е сутки ИМ у больных, которые не получали ТЛТ, были почти равны таковым в 1е сутки.
Это объясняется тем, что в 1е сутки ИМ происходит подавление иммунологических механизмов в миокарде, к 7м суткам активизируются воспалительные механизмы в кардиомиоцитах, а к 14м суткам при формировании рубца на месте некротизированной ткани миокарда происходит затухание всех процессов.
ЗАКЛЮЧЕНИЕ
У пациентов, получивших тромболитическую терапию (ТЛТ), отмечали более низкие уровни α1антитрипсина и лактоферрина на всех этапах исследования и α2макроглобулина (α2МГ) на 1е и 7е сутки развития инфаркта миокарда (ИМ) по сравнению с пациентами, не получившими ТЛТ. Исключением стали показатели α2МГ на 14е сутки наблюдения: они были примерно одинаковыми у больных обеих групп. Это объясняется тем, что к 14м суткам ИМ происходит затухание всех процессов, так как формируется рубец на месте некроза.
Исследование сывороточной концентрации белков острой фазы воспаления может применяться для оценки эффективности тромболитических препаратов.








