Форматы современных моделей медицинской помощи с их общей направленностью на сокращение расходов на лечение хронических заболеваний во многом определяются уровнем технологических решений и становятся все более регулируемыми. Их целевой установкой является сохранение качества жизни пациента, поддерживаемого мероприятиями первичной и вторичной профилактики и непрерывным контролем уровней физического и психосоциального функционирования. Важность реализации описанного подхода усиливается общемировой тенденцией к старению населения и ростом распространенности кардиоваскулярных заболеваний, обусловленных факторами образа жизни[1]. Это вводит в число первостепенных задач национальных систем здравоохранения разработку наиболее эффективных методов, побуждающих людей к более активному участию в процессе собственного лечения[2].
Перечисленные позиции имеют непосредственное отношение к оказанию реабилитационнопрофилактической помощи больным с кардиоваскулярными заболеваниями как к значимой технологической области процесса наблюдения пациентов с хроническими болезнями. Анализ результатов 3летнего (2013–2015) периода кардиологической реабилитации (КР) в рамках пилотного проекта «Развитие системы реабилитации больных с сердечнососудистыми заболеваниями в лечебных учреждениях субъектов Российской Федерации» обнаружил множество проблем, касающихся организации КР, особенно ее амбулаторнополиклинического этапа. Налицо практически полное отсутствие физической реабилитации (ФР) на этом этапе, обусловленное низким уровнем развития инфраструктуры, дефицитом квалифицированных кадров и сложностями применения существующих организационнометодических подходов[3].
Участие пациентов после инфаркта миокарда с подъемом сегмента ST (ИМсST) в хорошо структурированной программе КР с регулярными физическими упражнениями и другими мероприятиями вторичной профилактики следует рассматривать как возможность повышения приверженности к терапевтическим планам в целом (класс IIа, уровень А)[4]. В условиях разнообразия клинических ситуаций даже в пределах этой категории пациентов формирование программ ФР, особенно выполняемых вне стационара, требует тщательной оценки риска осложнений, связанных с объемом и мощностью рекомендуемой физической нагрузки (ФН)[4].
Существующие критерии стратификации пациентов с ИМсST позволяют выделять группы умеренного и высокого риска осложнений на этапах ФР, требующие наиболее тщательного кардиологического контроля[5]. В связи с этим дистанционный мониторинг (ДМ) основных клиникоинструментальных показателей приобретает дополнительное значение для обеспечения клинической стабильности больного на амбулаторнополиклиническом этапе реабилитации, особенно в домашних условиях. Эффективность такого «удаленного» управления КР определяется ранним выявлением и своевременной коррекцией нарушений еще на стадии невыполнения пациентом врачебных назначений и в итоге направлена на превенцию ситуаций госпитализации[6]. В дополнение к этому ДМ важен как ответ на проводимые лечебнореабилитационные мероприятия, поскольку является инструментом объективизации выполнения врачебных рекомендаций в домашних условиях[7].
Общепринятое определение самопомощи трактует ее как «процесс самостоятельного принятия решений пациентами с целью поддержания своей физиологической стабильности», в котором ключевая роль отводится приемам самоконтроля (своевременному приему лекарственных препаратов, регулярным ФН, рациональному питанию, контролю массы тела и т. п.)[8]. Исходя из этого, концепцию кардиореабилитационного ДМ можно охарактеризовать как «поддерживаемую самопомощь», т. е. предоставление больному квалифицированной телемедицинской помощи на основе полученной от него информации в процессе выполнения реабилитационнопрофилактических программ.
Возможности современных дистанционных технологий позволяют не просто вывести КР за пределы медицинского учреждения, приблизив ее к месту проживания пациента, но и превратить его в равноправного участника лечебного процесса путем удовлетворения потребностей в объеме и качестве непрерывного врачебного наблюдения. Появление медицинских цифровых устройств с возможностью передачи данных регистрации без «ручного» ввода и интернетприложений для их обработки создало объективные условия для организации КР на новых принципах. В основу такой цифровой трансформации положена идея объединения на общей платформе данных, полученных в процессе взаимодействия врача и пациента, и результатов аналитического процесса с участием этих данных[9].
Простота использования приборов домашнего самоконтроля позиционируется как наиболее значимое условие успешности их применения[10]. Данные метаанализа, построенного на результатах 15 обзоров[11], исследующих эффективность домашних вмешательств на основе ДМ у пациентов очень высокого риска (с ИМсST, ХСН), свидетельствуют о снижении ОР общей смертности и госпитализации в связи с обострением (интервалы: 0,60–0,85 и 0,64–0,86 соответственно). В рейтинге анализируемых неинвазивных технологий ДМ (видеоконсультации, мобильный телемониторинг, автоматизированный телемониторинг на основе устройств, интерактивные речевые контакты, интернеттелемониторинг) наиболее значимыми для уменьшения риска смерти от всех причин и госпитализаций в связи с осложнениями были признаны только автоматический телемониторинг с приборами домашнего наблюдения и мобильный телемониторинг. При этом наибольшее снижение риска отмечено у пациентовучастников программ, недавно выписанных (≤ 28 дней) из стационара после острого коронарного события.
Значительная часть проблем, связанных с реализацией ДМ в системе КР, касается особенностей коммуникации «больной — врач». Являясь отражением личностного осмысления заболевания и его последствий, уровень мотивации — изменчивый показатель, детерминированный динамикой поведения пациента, факторами образа его жизни и комплексом мероприятий по восстановлению здоровья и качества жизни[12]. В контексте этого положения эффективность КР может дополнительно оцениваться показателями динамики ценностносмысловой сферы личности больного, его отношением к своему заболеванию, конкретным целям реабилитации и лечения, к здоровью в целом[13].
Цель исследования: оценка возможностей использования мобильных технологий в процессе ДМ домашних программ ФР у пациентов, перенесших ИМсST.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование выполнялось в НИИ кардиологии ФГБОУ ВО «СарГМУ им. В. И. Разумовского» Минздрава России как проспективное (продолжительность наблюдения — 3 месяца) в рамках научноисследовательских работ государственного задания «Разработка пациенториентированной модели реабилитационной помощи пациентам с кардиоваскулярными заболеваниями на основе технологий электронного и мобильного здравоохранения». Письменное информированное согласие было получено от всех участников.
В исследование первоначально были включены 24 пациента (22 мужчины и 2 женщины, средний возраст — 55,3 ± 8,3 года), выписанные из реабилитационного стационара и не имевшие противопоказаний к проведению мероприятий ФР на амбулаторнополиклиническом этапе. Дополнительные условия включения: наличие у пациента или у членов его семьи мобильного устройства (смартфона, планшетного компьютера) с операционной системой Android не ниже 4.3 и выходом в Интернет. Критериями исключения являлись IV функциональный класс ХСН, отсутствие навыков работы с мобильными устройствами, наличие когнитивной дисфункции.
Оценка уровня когнитивных функций проводилась по шкале Minimental State Examination[14]. Сумма 27–30 баллов оценивалась как отсутствие дисфункции/легкий когнитивный дефицит, свыше 30 баллов — как когнитивная дисфункция.
Первичное реабилитационное консультирование (включение в исследование) выполнялось в рамках оригинального компьютеризированного алгоритма «Выбор программы физической реабилитации для пациентов с инфарктом миокарда с подъемом сегмента ST» (Свидетельство о государственной регистрации программы для ЭВМ № 2016618410 от 28.07.2016 г.), включающего электронные опросники и калькуляторы. По итогам консультирования автоматически формировалась «Реабилитационная карта пациента», содержащая программу ФР и сохраняющаяся в его профиле как «История реабилитации». Протокол консультирования включал также инструктаж и обучение больного навыкам самоконтроля, предусмотренным дизайном исследования. Бумажная копия карты выдавалась на руки пациенту.
Толерантность к ФН оценивали по результатам теста с 6минутной ходьбой (ТШХ) исходно и по окончании ДМ.
Дистанционное реабилитационное наблюдение осуществлялось на фоне стандартной оптимальной лекарственной терапии. Телемониторинг ЭКГ выполнялся по принципу аутотрансляции с использованием мобильных устройств (смартфона, планшетного компьютера) и интернетприложения ECG Dongle («НордавиндДубна», Россия). Для хранения информации с целью дальнейшего анализа и телемедицинского консультирования использована асинхронная телекардиологическая платформа CardioСloud. Данные самостоятельной регистрации ЭКГ анализировались внешним врачом (сотрудником НИИ кардиологии Саратовского государственного медицинского университета имени В. И. Разумовского). Частота регистрации не ограничивалась, однако принципиальным моментом являлась регистрация ЭКГ при/после развития кардиологических симптомов.
В программах ФР использовалась дозированная ходьба в оптимальном для пациента темпе; частота занятий — 5 раз в неделю. С целью объективизации ежедневного объема ФН в рамках рекомендованной программы ФР применялся цифровой шагомер Beurer AS80 (Beurer GmbH, Германия) с возможностью переноса данных на смартфон с помощью Bluetooth® Smart и мобильного приложения Easyfit. Регистрировались количество шагов, пройденное расстояние, продолжительность физической активности (ФА), число потраченных калорий. Частота передачи данных шагомера выбиралась пациентом (ежедневная, еженедельная). Индивидуальная переносимость ФН оценивалась в баллах по шкале Борга. Характер патологических симптомов, возникающих в связи с ФН, дополнительно описывался в комментариях, сопровождающих регистрацию ЭКГ.
Информация о физиологических параметрах доставлялась путем заполнения электронной формы «Дневник самоконтроля пациента». В дневнике фиксировались АД, ЧСС, количество приступов стенокардии, доза нитроглицерина в виде таблеток (нитроспрея), использованная для купирования приступа или превентивно. Дистанционная коррекция реабилитационных назначений проводилась в режиме отложенного (асинхронного) телемедицинского консультирования; коррекция лекарственной терапии и принятие решений о госпитализации — в рамках офисного консультирования.
Тип отношения к болезни и связанные с ним личностные отношения определяли с использованием личностного опросника Бехтеревского института (ЛОБИ)[15]. Анализировалась динамика шкальных оценок отношения пациента к самой болезни, лечению и реабилитации, врачам и медперсоналу, родным и близким, окружающим, работе, одиночеству и будущему, а также к своим физическим функциям.
Завершил исследование 21 (87,5%) больной из 24; выбыли 3 (12,5%) человека. Во всех случаях причиной была потеря контакта с пациентом.
Эффективность домашних программ ФР оценивалась по дистанции ТШХ после 3 месяцев ДМ, динамике мотивационной готовности пациента к лечению и реабилитации; а также по количеству консультаций, фактов аутотрансляции ЭКГ, фактов передачи данных «Дневника самоконтроля» в процессе ДМ.
Статистический анализ данных проводили с помощью пакета программ Statistica 6.0 (StatSoft). Рассчитывались средние величины (М) и стандартная ошибка средних (m). Средние величины сравнивали с использованием tкритерия Стьюдента. Различия считались статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
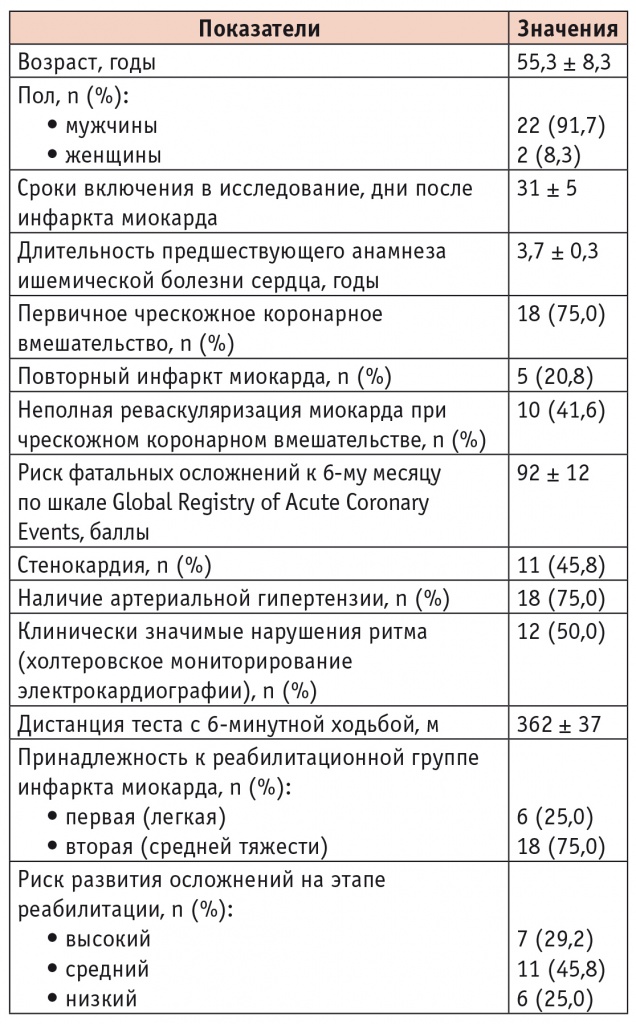
Пациенты включались в программу ДМ после выписки из кардиологического санатория, на 31 ± 5 сутки ИМсST. Группа исследования была представлена пациентами старшего трудоспособного возраста (91,7% мужчин, средний возраст — 55,3 ± 8,3 года), в основном перенесшими первичное чрескожное коронарное вмешательство (75%), с анамнезом ИБС 3,7 ± 0,3 года и низким/промежуточным 6месячным риском фатальных осложнений по шкале Global Registry of Acute Coronary Events (средний балл — 92 ± 12). Клиническая реабилитационная характеристика соответствовала критериям среднетяжелой группы ИМсST и высокого/промежуточного риска развития кардиоваскулярных осложнений на этапах КР (табл. 1).
Таблица 1
Клиническая характеристика пациентов, включенных в исследование
По данным компьютеризированного анализа опросника ЛОБИ была сформирована мотивационнопсихологическая характеристика группы. Исходно превалировали дезадаптивные поведенческие реакции (87,5%) при незначительной доле пациентов с отсутствием признаков личностной дезадаптации (12,5%). Так, чаще всего диагностировали смешанный/диффузный типы с интрапсихической направленностью в отношении заболевания (66,7%) при преобладании неврастенического и тревожного типов; 20,8% пациентов имели интерпсихическую направленность дезадаптивных нарушений.
После 4 ± 1,2 недели передачу данных прекратили 3 (12,5%) участника. Несмотря на этот факт, показатели участия остальных на протяжении всего периода исследования оставались достаточно стабильными (табл. 2). Высокий показатель активности относился к аутотрансляции ЭКГ (4,3 ± 0,9 эпизодов/нед/чел.); в течение всего периода исследования эта функция была стабильно востребована большинством пациентов и инициировала значительный объем телемедицинских консультаций.
Таблица 2
Показатели дистанционного мониторинга мероприятий физической реабилитации пациентов
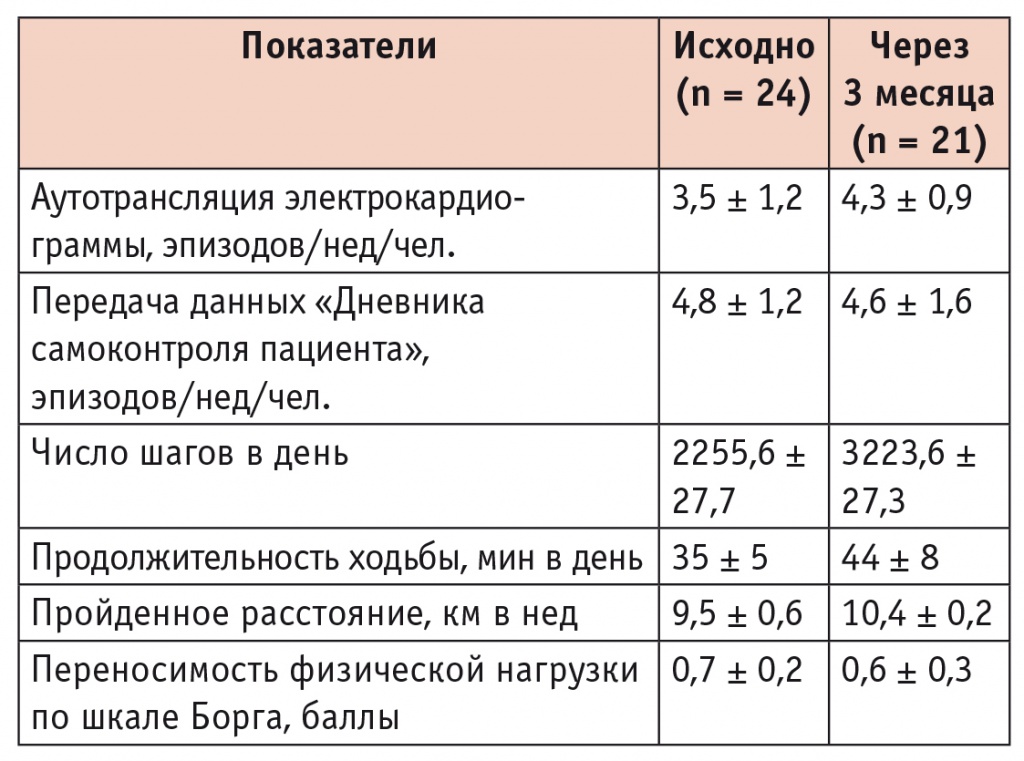
Оценка клинической эффективности программы ФР определялась в первую очередь, динамикой показателей ТШХ: после 3 месяцев ФР наблюдалась отчетливая положительная тенденция к повышению ФА, характеризующаяся увеличением средней дистанции ходьбы до 443 ± 32 м против исходных 362 ± 37 м (р < 0,05). По данным ДМ, переданным с цифрового трекера ФА, уровень выполнения рекомендованных ФН оценивался как достаточно высокий. Полученные параметры ФА были близки к рекомендованным: продолжительность ходьбы — 44 ± 8 мин в день при среднем числе шагов 3223,6 ± 27,7 в день и общем пройденном расстоянии 10,4 ± 0,2 км в нед. При этом информация, извлеченная из «Дневника самоконтроля», указывала на стабильность субъективной реакции на ФН: переносимость по шкале Борга изменилась с 0,7 ± 0,2 балла в начале исследования до 0,6 ± 0,3 балла в конце 3го месяца. По данным аутотрансляции ЭКГ, зарегистрированной в связи с ФН, у некоторых больных были выявлены изменения, не сопровождавшиеся субъективными ощущениями. Так, бессимптомные эпизоды ишемии миокарда отмечались у 2 (9,5%) пациентов, нарушения ритма — у 8 (38,1%).
В течение всего периода исследования не было ни одного сердечнососудистого события или случая экстренной госпитализации. Решение о необходимости офисной консультации принималось врачом на основании полученных данных «Дневника самоконтроля пациента» и аутотрансляции ЭКГ, а также по инициативе больного. Средняя потребность в офисных консультациях врачакардиолога составила 2,2 ± 0,4 визита за 3 месяца. Плановая госпитализация (выполнение коронароангиографии, коронарного стентирования) потребовалась 2 пациентам с неполной анатомической реваскуляризацией в связи с выявленной при аутотрансляции ЭКГ ишемией миокарда.
Через 3 месяца дистанционного наблюдения за выполнением программ ФР наблюдалась следующая динамика типов реагирования на болезнь: доля пациентов с минимальными проявлениями социальной дезадаптации увеличилась до 33,3% (против исходных 12,5%) при небольшом снижении (до 61,9% от исходных 66,7%) количества участников с интрапсихической направленностью дезадаптивных нарушений. Доля пациентов с интерпсихической направленностью уменьшилась с 20,8% до 4,8%: это произошло за счет выбывших из исследования (3 человека) и частичного перехода в группу с интрапсихической направленностью (1 человек).
Следует подчеркнуть, что выбывшие из исследования (прекратившие передачу данных и контакты с врачом) имели длительный анамнез ИБС и низкую исходную мотивацию к лечебнореабилитационным мерам: у всех пациентов диагностировался смешанный тип с доминированием сенситивного и эгоцентрического (интерпсихическая направленность).
ОБСУЖДЕНИЕ
Дизайн исследования базировался на доказательствах эффективности сочетания адекватных клиническому статусу больного аэробных ФН и полифункционального мониторинга (включая дистанционный вариант) у пациентов с ИМсST с высоким риском реабилитационных осложнений.
К числу наиболее трудных задач ФР относится определение уровня допустимых ФН с позиции безопасности пациента. Эта задача приобретает особую важность в условиях самостоятельного выполнения ФН. Критериями выбора тренирующей нагрузки в исследовании выступали доказанное улучшение после мероприятий ФР прогноза у больных с ИМсST[4], пригодность методики к выполнению в домашних условиях[16] и возможность контроля параметров безопасности средствами мобильного ДМ.
Таким образом, выбранный для ФР метод дозированной ходьбы соответствовал требованиям: 1) доступности и доказанной безопасности; 2) преемственности: ходьба была использована у большинства пациентов на стационарном (санаторном) этапе; 3) возможности объективного контроля объема ФН посредством цифрового шагомера; 4) возможности использования удаленного интра и постсобытийного ЭКГмониторинга (аутотрансляции).
Установлено, что высокая степень удовлетворенности больных использованием телемониторинговых систем определяется добавлением к основным измерениям функциональных показателей элементов коммуникации, предусматривающих обучение, информирование, консультирование и совместное принятие решений. При соблюдении означенных условий большинство пациентов готовы к применению дистанционной формы наблюдения в дополнение к стандартному лечению[17, 18]. В проведенном исследовании мотивация к повышению вовлеченности пациентов в реабилитационный процесс формировалась уже с момента первичного консультирования в процессе участия в генерации программы ФР, информирования и обучения навыкам самоконтроля (аутотрансляции ЭКГ, пользования трекером ФА, заполнения электронной формы «Дневника самоконтроля пациента»).
Наиболее привычной и рациональной формой представления данных ДМ является метод «ручного» ввода с последующей передачей информации, он в наибольшей мере соответствует традиционному процессу медицинской помощи. В современной практике, ориентированной на пациента, данным электронных отчетов придается большое клиническое и аналитическое значение. В оценке эффективности КР эти документы могут выступать в роли первичной или вторичной конечной точки: к примеру, жалобы в субъективной оценке реакции на ФН могут выступать реальной конечной точкой при малочисленности маркеров, подлежащих инструментальному измерению[19].
В настоящей работе использованы данные электронных отчетов пациентов, собранные в том числе и с целью извлечения подобных оценок. Проанализированные в соответствии с доказательными критериями, они позволили сформировать динамическую характеристику субъективной реакции пациентов на автоматически сформированную программу ФР. Так, переносимость нагрузки по шкале Борга изменилась незначительно: от 0,7 ± 0,2 балла в начале исследования до 0,6 ± 0,3 балла в конце 3го месяца, т. е. была стабильной в течение всего периода ДМ. При этом после 3 месяцев домашней ФР наблюдалась отчетливая тенденция к повышению уровня ФА пациентов, характеризующаяся увеличением средней дистанции ходьбы до 443 ± 32 м (р < 0,05).
Активность использования мобильных приборов самоконтроля в процессе ДМ определяется их возможностями по обеспечению необходимой обработки и хранения данных регистрации, а также передачи их врачу[20]. При частоте передачи данных о ФА, близкой к рекомендованной врачом (4,8 ± 1,2 эпизодов/нед/чел. в начале ДМ и 4,6 ± 1,6 эпизодов/нед/чел. на последней неделе ДМ), информация о ФА, полученная с цифрового трекера, оказалась вполне пригодной для традиционного врачебного контроля выполнения и принятия решений по коррекции программ ФР.
Включение метода аутотрансляции ЭКГ, кроме решения задач врачебного контроля, показало его значимость как важного фактора вовлеченности пациента в процесс ДМ. Так, мониторинг ЭКГ позволил амбулаторно зарегистрировать у 2 пациентов связанную с ФН ишемию миокарда. В ходе наблюдения число ЭКГрегистраций несколько возросло — с 3,5 ± 1,2 до 4,3 ± 0,9 эпизодов/нед/чел. Причиной этого, вероятнее всего, явилась понятая участниками значимость дистанционного контроля ЭКГ как объективного метода оценки работы сердца. Разумеется, это не единственный фактор приверженности в исследовании.
Фактор взаимодействия между пациентом и врачом определяется в настоящее время как детерминанта успеха любого терапевтического вмешательства[21]. В системе дистанционной КР он приобретает особую значимость, поскольку используемые «удаленные» подходы заметно отличаются от традиционных представлений больного о лечении и реабилитации.
В связи с этим первостепенной задачей становится формирование у пациента с ИБС ощущения контроля над основными симптомами и течением заболевания. Возрастает важность повышения качества коммуникации «врач — пациент» при условии активного вовлечения больного в лечебный процесс[22]. В предлагаемой системе реабилитационного наблюдения использовалось сочетание методов ДМ, самоконтроля, дистанционных и офисных консультаций. Модель дистанционного наблюдения при проведении домашней ФР, построенная исключительно на «удаленном» консультировании, представляется нам нецелесообразной. Включение офисного компонента продиктовано не только особенностями правового регулирования российской телемедицины, но и необходимостью решения задач исследования:
1) обучение (первичное реабилитационное консультирование);
2) коррекция лекарственной терапии;
3) решение технических вопросов;
4) совместное принятие решения о необходимости госпитализации.
В связи с таким разделением компетенций роль асинхронных (отложенных) телеконсультаций состояла в интерпретации ЭКГ и коррекции параметров реабилитационных программ.
Известно, что максимальный положительный результат комплекса лечебнореабилитационных мероприятий можно ожидать у больных с отсутствием или минимальными проявлениями социальной дезадаптации, а также у лиц с интрапсихической направленностью реагирования на заболевание. У пациентов с сенсибилизированным отношением к болезни, связанным с преморбидными психологическими особенностями личности, восстановительная терапия оказывается недостаточно эффективной и требует индивидуального подхода в оценках функциональных резервов и формировании программ ФР[20].
В дизайне нашего исследования не было предусмотрено специальное использование методов психологической реабилитации, что приближало его к условиям реальной амбулаторной реабилитации. Включение анализа личностного реагирования на болезнь было направлено на получение динамических оценок основных аспектов мотивации к выполнению лечебнореабилитационным рекомендаций в рамках домашних программ. Практически 3кратное возрастание доли участников с минимальными признаками социальной дезадаптации, уменьшение числа участников с интерпсихической направленностью реагирования на болезнь и увеличение такового с интрапсихической позволяют предположить, что систематическое реабилитационное наблюдение в дистанционном формате может быть достаточно эффективным.
Индивидуальный характер внутреннего реагирования пациента на изменение своего состояния под влиянием мероприятий ФР, фактор собственного участия в контроле здоровья и возможность врачебного наблюдения в различных вариантах — все это в совокупности способствует изменению характера мотивационного компонента как фактора эффективности реабилитационного процесса. Больным с выраженными нарушениями социального функционирования требуется дополнительное включение индивидуальных психокоррекционных методик в программы ФР.
ЗАКЛЮЧЕНИЕ
Представленная система дистанционного наблюдения, основанная на использовании мобильных технологий, целесообразна для использования в системе амбулаторной реабилитационной помощи пациентам с инфарктом миокарда с подъемом сегмента ST (ИМсST), имеющим высокий риск реабилитационных осложнений. Применение цифровых устройств с целью поддержки процесса самоконтроля пациента в процессе дистанционного мониторинга позволяет получить информацию, необходимую для анализа и коррекции мероприятий домашней реабилитации и принятия тактических решений. Комплексным благоприятствующим фактором развития дистанционного формата кардиологической реабилитации является повышение мотивированности больных с ИМсST путем обучения их навыкам самоконтроля и улучшения качества коммуникации «врач — пациент».








