С момента своего появления в 2019 году коронавирусная инфекция COVID-19 оказала огромное давление на системы здравоохранения во всем мире[1]. В 2021 году дельта-штамм SARS-CoV-2 стал преобладающим в этиологической структуре новой коронавирусной инфекции[2].
Несмотря на то что COVID-19 представляет угрозу для популяции в целом, лица в возрасте 60 и более лет, а также в возрасте 18–59 лет с сопутствующими АГ, злокачественными новообразованиями, ХОБЛ, СД, ожирением и сердечно-сосудистыми заболеваниями (ССЗ) подвержены высокому риску тяжелого течения COVID-19. Отмечено и повышение риска у жителей крупных городов и мегаполисов[3].
Помимо респираторной системы, SARS-CoV‑2 способен воздействовать на различные другие органы и системы, в том числе на сердечно-сосудистую. Пациенты с ССЗ и факторами риска (мужской пол, пожилой возраст, ожирение, АГ, СД) не только склонны к тяжелому течению инфекционного заболевания, но и имеют высокий риск госпитальной летальности. По некоторым данным, при сопутствующих ССЗ риск смерти возрастает в 2,4 раза[4, 5].
Среди различных коморбидных состояний у умерших больных COVID-19 лидирующие позиции занимают АГ, СД и ИБС. ХСН отмечена в анамнезе у 17,1% пациентов (рис.)[3]. По данным F. Zhou и соавт., ХСН выявлена у 23% больных COVID-19[6].
Рис. Сопутствующие заболевания у умерших пациентов с COVID-19[3]
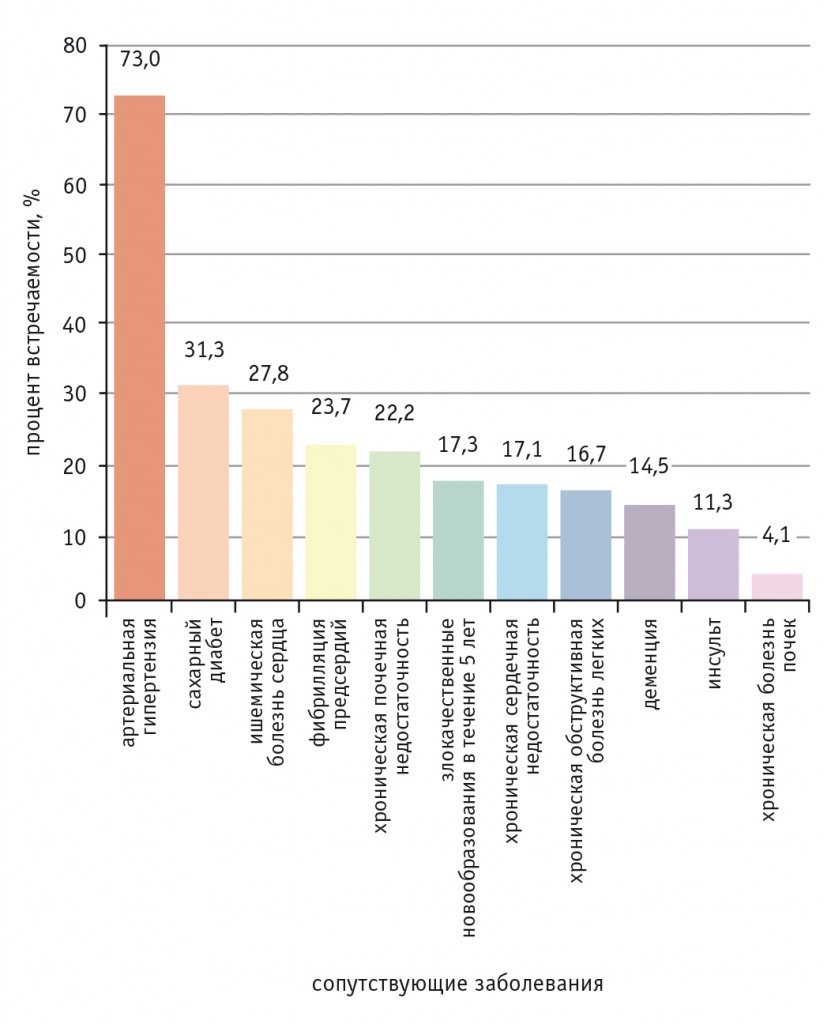
Согласно мнению исследователей (С. Huang и соавт., 2020), пожилые пациенты с коронавирусной инфекцией, страдающие АГ и другими ССЗ, а также ХОБЛ и СД, нередко подвержены риску развития острого респираторного дистресс-синдрома (ОРДС), септического шока, трудно корригируемого метаболического ацидоза и коагуляционной дисфункции[7].
В то же время ХСН является предиктором неблагоприятного исхода у больных коронавирусной инфекцией. Так, по некоторым сведениям, ХСН встречалась как сопутствующее заболевание при 51,9% летальных исходов, в то время как острое повреждение почек диагностировано в 11,7% случаев[8]. Пациенты с ХСН, перенесшие COVID-19, повторно госпитализируются в течение первых 6 месяцев после выписки примерно в 50% случаев[9].
Согласно анализу P. Goyal и соавт., из 8920 человек, госпитализированных с COVID-19, у 11% в анамнезе отмечалась ХСН. Наличие сердечной недостаточности также повышало риск смерти по сравнению с таковым у лиц без ХСН в анамнезе практически в 2 раза (31,6 против 16,9% соответственно)[10].
Необходимо подчеркнуть, что период клинических проявлений COVID-19 не ограничивается моментом получения отрицательного лабораторного результата. По данным M. Tempany и соавт., из 139 пациентов, перенесших данную инфекцию, 19% отметили, что чувствуют себя не полностью выздоровевшими, а 71% сообщили о стойких сохраняющихся симптомах[11]. В связи с этим постковидный синдром представляет актуальную проблему, в отношении которой проводятся многочисленные исследования.
Цель нашего обзора — рассмотреть патогенетическую связь COVID-19 и сердечной недостаточности, понятие «постковидный синдром», особенности ведения данной группы пациентов.
КЛИНИКО-ПАТОГЕНЕТИЧЕСКАЯ СВЯЗЬ МЕЖДУ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ И НОВОЙ КОРОНАВИРУСНОЙ ИНФЕКЦИЕЙ COVID-19
По некоторым данным, несмотря на активное изучение, непосредственные механизмы поражения сердца и сосудов при воздействии SARS-CoV-2 полностью не установлены[8]. Поэтому понимание патогенеза COVID-19 является основой диагностики и профилактики[12].
Считается, что ангиотензинпревращающий фермент 2-го типа (АПФ 2), регулирующий ренин-ангиотензин-альдостероновую систему (РААС), играет ключевую роль в связывании с вирусными частицами SARS-CoV-2 и проникновении последних в клетку. АПФ 2 обнаруживается в тканях головного мозга, почек, сердца, легких и яичек. Кроме того, АПФ 2 экспрессируется особенно выраженно в альвеолоцитах 2-го типа, эпителиальных клетках подвздошной и толстой кишки, пищевода, а также в холангиоцитах[13]. Существуют сведения о том, что более 80% АПФ 2 представлено именно в альвеолоцитах 2-го типа и эндотелиоцитах, в связи с чем респираторная и сердечно-сосудистая системы в большей мере подвержены поражению[8].
При воздействии SARS-CoV-2 на кардиомиоциты не исключается прямое повреждение. Сообщается также об обнаружении вирусной РНК в образцах аутопсии сердца умерших пациентов с коронавирусной инфекцией. Помимо прямого повреждающего воздействия, рассматривается роль гипоксемии при пневмонии и ОРДС в развитии внутриклеточного ацидоза и перекисного окисления липидов с повреждением фосфолипидов мембраны кардиомиоцитов и апоптозом последних. С другой стороны, лактацидоз, по данным Е.Д. Баздырева и соавт., способен привести к диастолической дисфункции и нарушению коронарной перфузии[8].
Согласно материалам E. Nakou и соавт., к числу основных предполагаемых патофизиологических механизмов, вызывающих сердечно-сосудистые осложнения, связанные с COVID-19, относятся:
-
прямое цитотоксическое повреждение миокарда;
-
подавление АПФ 2, выполняющего кардиопротекторную функцию (антифибротический, антиоксидантный и противовоспалительный фактор);
-
повреждение эндотелиоцитов, тромбоз и воспаление;
-
избыточная продукция провоспалительных цитокинов, приводящая к дисфункции эндотелия и активации путей комплемента, тромбоцитов, фактора фон Виллебранда и тканевого фактора, что в совокупности увеличивает риск тромбоза;
-
гипоксическое повреждение;
-
побочные эффекты лекарственных препаратов (обсуждается роль азитромицина, тоцилизумаба, хлорохина и гидроксихлорохина)[14].
Предполагаемым механизмом также считается дестабилизация атеросклеротических бляшек[15].
В недавних исследованиях сообщается о возможном опосредованном кардиотоксическом воздействии противовирусной терапии. В частности, противовирусные препараты, такие как лопинавир и ритонавир, способны приводить к удлинению интервалов QT и PR, особенно у пациентов с удлиненным интервалом QT или подверженных риску нарушения проводимости[8].
Коронавирусная инфекция, в свою очередь, может спровоцировать декомпенсацию ХСН. По данным М.Г. Бубновой и Д.М. Аронова, ХСН встречалась у 52% умерших от COVID-19 и у 12% выживших. Возможно, на фоне вирусной инфекции и исходной систолической дисфункции, ОРДС существует высокая вероятность развития острой сердечной недостаточности. Кроме того, рассматривается и механизм правожелудочковой ХСН, опосредованной легочной гипертензией ввиду гипоксии или ТЭЛА[4].
Однако в настоящее время не выяснено, возникает ли ХСН чаще из-за усиления ранее существовавшей дисфункции левого желудочка или из-за развившейся дисфункции de novo[16, 17].
На сегодняшний день все больший интерес представляют механизмы развития сердечно-сосудистых последствий COVID-19. Считается, что воспалительная реакция приводит к гибели кардиомиоцитов и фиброзно-жировому замещению десмосомальных белков. Изменения в сердце вызывают также снижение резерва миокарда, дизрегуляция РААС, терапия глюкокортикоидами. Развивающийся фиброз в миокарде угрожает возникновением реципрокных нарушений ритма. Кроме того, аритмии поддерживаются гиперкатехоламинемией, повышением содержания провоспалительных цитокинов[18].
ПОНЯТИЕ «ПОСТКОВИДНЫЙ СИНДРОМ»
В связи с обнаружением сохраняющихся симптомов COVID-19 на протяжении длительного времени после выздоровления Национальный институт здоровья Великобритании предложил классификацию постковидных состояний (2020):
-
острый COVID-19 (симптомы, длящиеся до 4 недель);
-
продолжающийся симптоматический COVID-19 (симптомы, продолжающиеся от 4 до 12 недель);
-
постковидный синдром (симптомы, длящиеся свыше 12 недель, не объяснимые альтернативным диагнозом, способные изменяться со временем).
Продолжающийся симптоматический COVID-19 и постковидный синдром иногда объединяют понятием «долгий COVID» (long COVID)[19].
Согласно определению ВОЗ, постковидные состояния — это симптомы, обычно возникающие через 3 месяца после начала COVID-19, которые длятся ≥ 2 месяцев и не могут быть объяснены альтернативным диагнозом[20]. В связи с введением понятия «постковидный синдром» в сентябре 2020 г. в МКБ-10 был внесен код для обозначения данного состояния: U09.9 — состояние после COVID-19[21].
Это расстройство привело к пониманию того, что отсутствие SARS-CoV-2 после COVID-19 не обязательно означает полное выздоровление[22].
По данным D.V. Parums, медиана срока возникновения постковидного синдрома после появления первых симптомов инфекции составила 219 дней[23]. В проспективном когортном исследовании пациентов, перенесших COVID-19, через 77 дней после выздоровления постковидный синдром был выявлен у 50,9%[24].
В многочисленных клинических исследованиях указывается на различные неспецифические проявления постковидного синдрома. Так, по материалам J.H. Becker и соавт., обнаруживалась высокая частота когнитивных нарушений через несколько месяцев после заражения COVID-19[25]. А.П. Казарина и В.М. Селиханова подчеркивают появление психиатрических проблем не только у больных, но и у лечащих их врачей[26]. В исследовании, представленном M. Taquet и соавт., показано, что почти у 20% лиц с диагнозом COVID-19 в течение 3 месяцев диагностируются психические расстройства, такие как тревога, депрессия или бессонница[27].
По данным M. Luo и соавт., распространенность тревожности и депрессии была самой высокой среди пациентов с ранее существовавшими заболеваниями и инфекцией COVID-19 (56 и 55% соответственно). Исследования, проведенные в Китае, Италии, Турции, Испании и Иране, свидетельствуют, что частота данных состояний у медицинских работников в совокупности выше, чем у населения в целом[28].
По результатам амбулаторного наблюдения в Италии, в среднем через 2 месяца после первых проявлений COVID-19 87,4% пациентов, выписанных из больницы, сообщали о сохранении симптомов. Наиболее частыми симптомами являлись утомляемость (53,1%), одышка (43,4%), артралгии (27,3%) и боль в груди (21,7%). Более 50% больных испытывали 3 и более симптомов[29].
По данным проспективного когортного исследования, проведенного в Ухане (Китай), через 6 месяцев после перенесенного COVID-19 76% пациентов сообщали по меньшей мере об одном стойком симптоме. Наиболее частыми проявлениями были утомляемость/мышечная слабость (63%), диссомния (26%) и беспокойство/депрессия (23%)[30].
Согласно результатам швейцарского исследования, 39% больных отмечали сохраняющиеся симптомы через 7–9 месяцев после постановки диагноза новой коронавирусной инфекции COVID-19. Наиболее часто упоминались утомляемость (20,7%), агевзия или аносмия (16,8%), одышка (11,7%) и головная боль (10,0%)[31].
Y.M. Zhao и соавт. описывают наличие фибротических изменений в легких, по данным КТ, через 3 месяца после перенесенного COVID-19 легкой и средней степени тяжести (25 и 65% случаев соответственно)[32]. В другом проспективном когортном исследовании у 62% пациентов наблюдались остаточные изменения, по данным КТ, спустя 6 месяцев, как то: наличие паренхиматозных полос, нерегулярных границ раздела (бронховаскулярные, плевральные или средостенные), тракционные бронхоэктазы, легочные соты, «матовое стекло» и утолщение интерстициальной ткани[33]. Кроме того, по некоторым данным, у 20–30% пациентов встречается микро- и макротромбоз легочных сосудов[34].
E.L. Graham и соавт. описывают неврологические симптомы после перенесенного COVID-19: «мозговой туман» (81%), головную боль (68%), парестезии (60%), дисгевзию (59%), аносмию (55%), миалгию (55%), головокружение (47%), боль (43%), помутнение зрения (30%), шум в ушах (29%)[35].
В литературе описаны также проявления постковидного синдрома со стороны ЖКТ: потеря аппетита (24%), тошнота (18%), кислотный рефлюкс (18%), диарея (15%), вздутие живота (14%), отрыжка (10%), рвота (9%), боль в животе (7%) и кровавый стул (2%)[36].
Со стороны сердечно-сосудистой системы последствия COVID-19 проявляются аритмией, мио- и перикардитом, а также кардиомиопатией (КМП). Сердечная недостаточность может проявиться через несколько недель после выписки из больницы. По данным K.S. Bhatia, у 4% пациентов после перенесенного COVID-19 впервые диагностированы фибрилляция и трепетание предсердий. У 0,5% развилась впервые атриовентрикулярная блокада высокой степени: II (Mobitz II) и III степени. В 2% случаев вновь диагностируются КМП и сердечная недостаточность[37].
ВЕДЕНИЕ ПАЦИЕНТОВ С СОЧЕТАНИЕМ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ И ПОСТКОВИДНОГО СИНДРОМА
Инфекция COVID-19 может иметь долгосрочные последствия для сердца. Возможно, что острое сердечное событие способствует переходу ранее бессимптомной сердечной недостаточности в клинически выраженную. Кроме того, стойкое повреждение миокарда, вызванное инфекцией, способно увеличить риск декомпенсации ХСН. Многие выжившие после тяжелого COVID-19 могут быть подвержены риску правожелудочковой ХСН ввиду легочной гипертензии[38].
Больным с изменениями на ЭКГ, кардиомегалией, нарушением ритма или ХСН следует проводить ЭхоКГ, а также плановую вакцинацию против гриппа и пневмококковой инфекции[3].
Пациентам с постковидным синдромом и сопутствующей ХСН рекомендовано полное клиническое обследование. ЭКГ в 12 отведениях следует всегда повторять и сравнивать с ЭКГ острой фазы, если таковая имеется. При повышенной концентрации BNP/NT-proBNP в сочетании с одышкой после COVID-19 полезно оценить систолическую и диастолическую функцию миокарда и произвести трансторакальную ЭхоКГ.
Особого внимания при проведении ЭхоКГ заслуживает определение размеров и функции правого желудочка, включающее комплексную оценку вероятности легочной гипертензии. Нарушения легочной гемодинамики следует рассматривать и интерпретировать в контексте дисфункции левого желудочка и клапанных аномалий, а также с точки зрения заболеваний легких (как паренхиматозных, так и сосудистых).
КТ грудной клетки может использоваться в качестве комплексного неинвазивного метода визуализации, который позволяет оценить паренхиму легких, а также легочные и коронарные артерии. Многочисленные исследования разделили результаты КТ на несколько этапов в зависимости от времени с момента появления симптомов: ранний, промежуточный, поздний, а также этап восстановления.
Показания для МРТ при оценке поздней клинической фазы COVID-19 включают точное определение размера и функции камеры, выявление ишемии, инфаркта миокарда, миокардита и стрессовой КМП.
Переносные устройства следует предусмотреть у пациентов с ХСН для регулярного мониторинга таких жизненно важных показателей, как сатурация, частота дыхания, кровяное давление, температура тела, ЭКГ (например, для измерения интервала QT), а также оценки положения и движений, аускультации легких и мониторинга кашля.
По данным D. Richter и соавт., в позднюю фазу COVID-19 лечение заболеваний сердца и сосудов, диагностированных до острой фазы или возникающих в острой фазе, следует продолжать, как и при лечении без инфекции[38]. Однако стоит подчеркнуть некоторые особенности.
В настоящее время известно, что отмена приема блокаторов РААС у пациентов с COVID-19 может увеличить риск сердечно-сосудистых осложнений, особенно при наличии АГ, ХСН, перенесенного инфаркта миокарда[4]. Резкая отмена препаратов данных классов, назначенных по показаниям, может быть связана с более высокой смертностью в острой и подострой фазе COVID-19[39]. Поэтому необходимо продолжать прием ингибиторов АПФ или сартанов[4]. Установлено также, что ингибиторы АПФ играют важную противовоспалительную роль, участвуя в работе РААС путем преобразования ангиотензина II в ангиотензин 1–7, обладающий противовоспалительными свойствами[3].
Кроме того, при декомпенсации ХСН важны ежедневный контроль диуреза и соблюдение рационального питьевого режима[4].
На сегодняшний день остается спорным вопрос о применении кортикостероидов. Сообщалось о ХСН как о потенциальном факторе риска ухудшения исходов у больных, госпитализированных с COVID-19. Высокие дозы кортикостероидов способны вызывать задержку натрия и воды у пациентов с ХСН, что потенциально может привести к декомпенсации заболевания. Поэтому необходимы высококачественные рандомизированные клинические исследования эффективности и безопасности указанных препаратов у пациентов с высоким риском осложнений.
Согласно результатам работы L.M. Pérez-Belmonte и соавт., лечение ХСН у госпитализированных с COVID-19 больных осуществлялось блокаторами РААС[40]. Недавнее наблюдательное исследование с участием госпитализированных пациентов с COVID-19 показало, что применение ингибиторов РААС и β-блокаторов связано с более низкой смертностью[41].
По данным В.И. Подзолкова и А.И. Тарзимановой, при наличии АГ у пациентов с сердечной недостаточностью, перенесших COVID-19, с целью профилактики сердечно-сосудистых осложнений рекомендован прием антигипертензивных препаратов в соответствии с ранее осуществленным назначением. Активно изучается и влияние статинов на течение инфекции. Помимо известного плейотропного эффекта в отношении сердечно-сосудистой системы, обсуждается снижение статинами способности SARS-CoV-2 к репликации посредством прямого ингибирования основной вирусной протеазы[42].
ЗАКЛЮЧЕНИЕ
Изучая данные многочисленных современных исследований, посвященных новой коронавирусной инфекции и постковидному синдрому, можно лишь в очередной раз убедиться в том, что проблема COVID-19 является чрезвычайно актуальной и ее дальнейшее исследование имеет глобальные перспективы.
С учетом значимости сердечной недостаточности, распространенность которой неуклонно увеличивается, а проявления выступают одной из ведущих причин инвалидизации и смертности, можно сделать вывод о том, что пациенты с сочетанием ХСН и постковидного синдрома представляют особую группу с высоким риском сердечно-сосудистых осложнений и смерти.
Таким образом, требуется тщательная разработка тактики ведения больных ХСН в сочетании с постковидным синдромом и эффективных реабилитационных мер для предотвращения у них отдаленных неблагоприятных последствий.
Поступила: 05.03.2022
Принята к публикации: 17.06.2022








