Часть 1 настоящей статьи опубликована в журнале «Доктор.Ру». 2020. Т. 19. № 5. С. 35–41. — Прим. ред.
В настоящее время, в условиях пандемии COVID-19, особенно остро стоит вопрос оказания медицинской помощи больным сердечно-сосудистыми заболеваниями (ССЗ). Одним из основных путей повышения эффективности лечения становится использование телемедицинских технологий. Дистанционное наблюдение с применением устройств персонального телемониторинга, проведение консультаций специалистами на удалении посредством видеосвязи, обмен печатной информацией, записанной на цифровых носителях, самоконтроль больных с передачей данных лечащему врачу могут существенно сократить количество визитов в медицинское учреждение, способствовать своевременной корректировке лечения и недопущению развития тяжелых сердечно-сосудистых осложнений.
Вопросы дистанционного контроля ЭКГ рассмотрены нами ранее[1], в настоящей части статьи внимание уделено вопросам дистанционного наблюдения за больными артериальной гипертонией (АГ) и хронической сердечной недостаточностью (ХСН).
ПЕРСОНАЛЬНЫЕ УСТРОЙСТВА ДЛЯ УДАЛЕННОГО МОНИТОРИНГА АРТЕРИАЛЬНОГО ДАВЛЕНИЯ
В соответствии с клиническими рекомендациями Минздрава России по АГ у взрослых (2020) для повышения эффективности антигипертензивной терапии и приверженности лечению следует проводить мониторинг показателей системной гемодинамики и телеметрически передавать результаты измерения артериального давления (АД) непосредственно в лечебное учреждение для оперативной обработки информации и незамедлительного принятия решений1. С целью снижения риска развития таких осложнений, как инфаркт миокарда, инсульт, у больных АГ (особенно у пациентов с метаболическим синдромом, сахарным диабетом, синдромом обструктивного апноэ во время сна, хронической болезнью почек 3–5-й стадии) особое внимание рекомендуется уделять показателям АД в ночное время и в ранние утренние часы2.
Дистанционное мониторирование АД позволит значительно увеличить долю больных АГ, находящихся на диспансерном наблюдении, будет способствовать достижению большей комплаентности и существенному повышению эффективности гипотензивной терапии, что приведет к уменьшению нагрузки на неотложную и скорую помощь, сокращению трудовых потерь, а в конечном счете — к снижению сердечно-сосудистой смертности[2].
Согласно рекомендациям Европейского общества по гипертонии (англ. European Society of Hypertension, ESH) и Американской кардиологической ассоциации (англ. American Heart Association, AHA) при выборе устройств для контроля АД в домашних условиях предпочтение следует отдавать аппаратам с функцией автоматического сохранения результатов измерения или передачи данных посредством мобильного телефона, персонального компьютера по сети Интернет[3, 4].
В 6-месячном исследовании A. Stoddart и соавт. сравнивалась эффективность стандартного лечения АГ и лечения с применением дистанционного контроля АД (пациенты самостоятельно измеряли АД с помощью автоматического прибора с функцией передачи данных). У больных с неконтролируемой АГ дистанционное мониторирование АД сопровождалось ростом эффективности терапии. Однако вопрос о том, сохраняется ли данный эффект в течение более длительного времени, требует дальнейшего изучения[5].
В отечественном исследовании В.Э. Олейникова и соавт. в течение 24 недель велось наблюдение за больными АГ I–II степени, распределенными в две группы: в одной группе пациентам на 12 недель выдавали тонометры-автоматы (Tensiophone, Венгрия) с функцией передачи данных по телефону, в другой пациенты измеряли АД дома собственными тонометрами. По результатам работы, использование автоматической системы дистанционного контроля АД у больных АГ способствовало сокращению сроков подбора фармакотерапии и достижению более высокой приверженности лечению[6].
АД может измеряться прямым и непрямыми способами. Единственный прямой способ измерения АД — инвазивный, метод предполагает введение датчика непосредственно в просвет артерии. Проводятся исследования, направленные на разработку имплантируемых аппаратов для прямого измерения АД с функцией дистанционной передачи данных[7].
В обычной практике для наблюдения за больными применяются непрямые способы измерения АД — традиционные манжеточные (осциллометрический и аускультативный) и относительно новые безманжеточные.
Осциллометрический способ основан на определении колебаний сосудистой стенки артерии (осцилляций) при ее пережатии и расслаблении, аускультативный — на выслушивании систолического и диастолического тона после пережатия артерии манжетой по методу Н.С. Короткова. Осциллометрический метод принят за стандартный и применяется в большинстве электронных тонометров, однако существуют устройства со встроенным алгоритмом аускультативного измерения АД (C&S). Важно отметить, что в современных приборах, как правило, предусмотрена коррекция измерений с учетом аритмии.
В соответствии с обновленными клиническими рекомендациями Европейского общества кардиологов (англ. European Society of Cardiology, ESC) по диагностике и лечению АГ (2018) для телеметрического контроля АД следует применять именно валидированные манжеточные устройства[8]. Позиция ESС основана на доказанной высокой точности измерений и положительных результатах клинических исследований, полученных для таких устройств.
При этом дистанционная передача информации об уровне АД может осуществляться путем ручного ввода в смс-сообщении или с помощью приложения для смартфона, а также автоматически — при применении тонометров со встроенным GSM-модулем либо с возможностью подключения к смартфону или персональному компьютеру (A&D, Omron, Xiaomi, Microlife и др., рис. 1).
Рис. 1. Автоматический тонометр с функцией телеметрии. Из открытого доступа в сети Интернет

К безманжеточным технологиям измерения АД относятся специальные приложения для смартфонов, использующие оптические датчики, а также различные компактные носимые устройства (часы, браслеты, напальчники и др.). Метод измерения АД, применяемый в таких устройствах, производителями нередко не указывается, однако известно, что их действие преимущественно основывается на определении времени распространения пульсовой волны (ВРПВ) (рис. 2)[9].
Рис. 2. Приложение для смартфона, определяющее уровень артериального давления по времени распространения пульсовой волны[9]
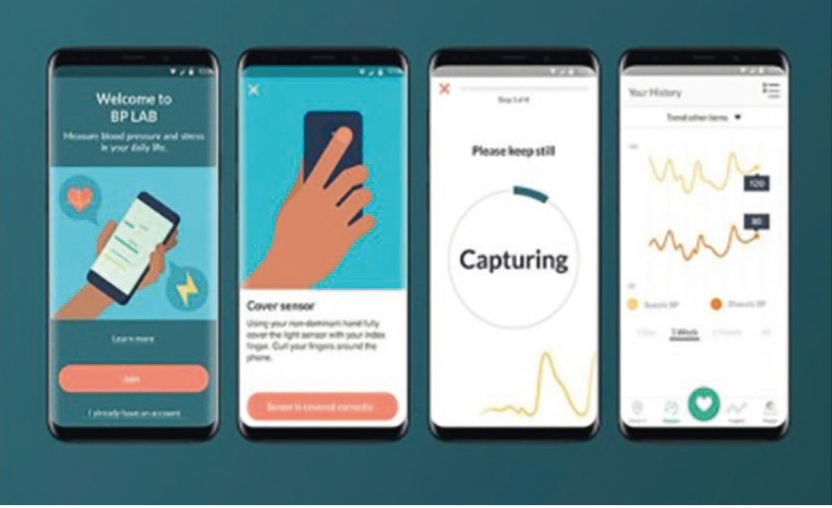
Показатель ВРПВ характеризует время, в течение которого волна давления распространяется от левого желудочка (ЛЖ) до дистальной артерии, и обратно связан с уровнем АД. Он рассчитывается с помощью данных регистрации ЭКГ (момент изгнания крови из ЛЖ) и фотоплетизмографии (момент достижения пульсовой волной дистальной артерии). Зависимость ВРПВ от эластических свойств артерии, ее толщины и ширины просвета, вязкости крови определяет необходимость индивидуальной калибровки устройства для каждого обследуемого.
Большинство подобных устройств не валидированы в клинических исследованиях, но при валидации одного из них — приложения для iOS Instant Blood Pressure — расхождение с референсным прибором составило 12,4 мм рт. ст. для систолического АД и 10,1 мм рт. ст. — для диастолического[10].
Другим подходом к безманжеточному определению АД является измерение силы, необходимой для сдавления артерии при прохождении пульсовой волны, — тонометрия (рис. 3). Учитывая важность адекватного позиционирования регистратора над проекцией артерии, рекомендуется фиксировать его пластырем. При этом методе также необходима индивидуальная калибровка прибора[9].
Рис. 3. Принцип тонометрии[9]
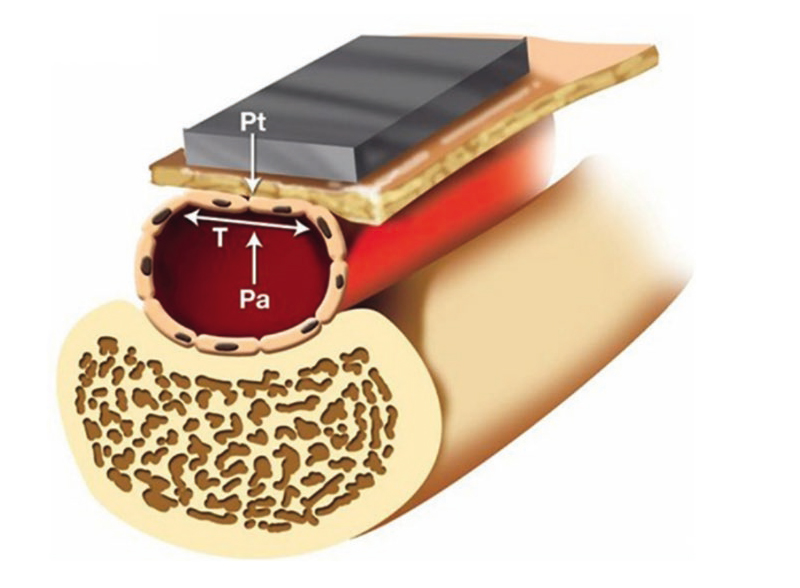
Умные часы BPro (HealthSTATS Technologies, Лондон, Великобритания) с описанным алгоритмом определения АД были апробированы в соответствии с протоколами Ассоциации по развитию медицинского оборудования (англ. Association for the Advancement of Medical Instrumentation, AAMI) — допустимое расхождение с аускультативным методом составило от ≤ 5 до ≤ 8 мм рт. ст. — и ESC (допустимое расхождение не превышало 5 мм рт. ст.). При выполнении исследований специально обученным персоналом результаты соответствовали требуемым критериям, однако в амбулаторных условиях расхождение было выше допустимых значений[11, 12].
Вместе с тем разработка персональных компактных носимых безманжеточных мониторов АД имеет широкие перспективы: изучается возможность сопоставления ВРПВ в динамике с биологическими сигналами, полученными в ходе одномоментной регистрации ЭКГ и баллистокардиографии, с применением радаров и др.; ведется поиск калибра артерий, оптимального для применения данного метода; устанавливается зависимость связи между ВРПВ и АД от времени, возраста, а также разрабатываются новые подходы к валидации безманжеточных устройств при различных значениях АД. В частности, Институтом инженеров в области электротехники и электроники (англ. Institute of Electrical and Electronics Engineers, IEEE) предложен специальный протокол валидации безманжеточных устройств для измерения АД3.
В настоящее время ESH и AHA использование безманжеточных аппаратов для самостоятельного измерения АД не рекомендуют[3, 4].
ПЕРСОНАЛЬНЫЕ УСТРОЙСТВА ДЛЯ УДАЛЕННОГО МОНИТОРИНГА ЛЕГОЧНОЙ ГЕМОДИНАМИКИ
ХСН — одна из основных причин госпитализации и преждевременной смерти больных ССЗ. Своевременное выявление ухудшения состояния у таких пациентов может привести к уменьшению числа их госпитализаций и улучшению прогноза заболевания [13]. Применение дистанционного наблюдения позволяет повысить информированность и приверженность лечению среди больных ССЗ, а также вовремя выявить необходимость в оказании им медицинской помощи, но данная методика должна быть адаптирована и внедрена в имеющуюся систему здравоохранения[14]. Приоритетная тактика Минздрава России сегодня предусматривает более тщательную подготовку к выписке пациентов, перенесших декомпенсацию ХСН, с последующим наблюдением на дому, в специализированных амбулаторных центрах ХСН, а также использование телемедицинских технологий4.
Различные подходы к удаленному наблюдению за пациентами с ХСН включают регулярные телефонные опросы (структурированная поддержка по телефону), контроль физической активности, телемониторинг ЭКГ, веса, диуреза, АД, сатурации и некоторых других показателей, а также применение имплантируемых антиаритмических устройств — мониторинг с использованием имплантируемых кардиовертеров-дефибрилляторов (ИКД), сердечную ресинхронизирующую терапию (СРТ)[13].
Ежедневный контроль веса у больных ХСН позволяет как можно раньше выявить признаки декомпенсации недостаточности кровообращения. Наиболее соответствующим этой цели может быть использование беспроводных умных весов (например, BodyTrace Scale, BodyTrace, Inc., США)5, измеряющих вес и через модем автоматически передающих информацию в базу данных, к которой есть доступ у врача.
Кроме того, существуют технологии динамического контроля легочной гемодинамики, среди которых можно выделить устройства для контроля внутригрудного и трансторакального импеданса, имплантируемые мониторы легочной гемодинамики и технологию удаленного диэлектрического сенсинга (англ. Remote Dielectric Sensing, ReDS).
Показатели интра- и трансторакального импеданса, характеризующие электрическое сопротивление тканей грудной клетки, измеряются с помощью имплантированного либо наружного датчика. Для их определения применяют современные ИКД и СРТ-устройства с соответствующей функцией, имплантируемые мониторы (OptiVol, Medtronic, США), состоящие из электрода, устанавливаемого в правый желудочек (ПЖ), и генератора электрических импульсов (CorVue, St. Jude Medical, США, и др.), а также носимые устройства, выполненные в виде ожерелья (CoVa, toSense™, Inc., США), жилета и т. д.
Жидкость в грудной клетке может влиять на результаты биоимпеданса, по изменениям интра- и трансторакального импеданса можно предположить приближающееся прогрессирование застойных явлений в легких. Однако при относительно высокой чувствительности (признаки возможной декомпенсации определяются в среднем за 2 недели до развития симптомов) эти показатели недостаточно специфичны в отношении застоя в малом круге кровообращения: аналогичные изменения могут наблюдаться при плевральном выпоте, пневмонии, анемии и некоторых других состояниях.
Согласно клиническим рекомендациям ESC (2021) у пациентов с ХСН для снижения риска повторных госпитализаций по поводу ССЗ и ХСН возможно применение неинвазивного телемониторинга в домашних условиях (класс рекомендаций — IIb)[14]. У симптомных пациентов с ХСН со сниженной (≤ 35%) фракцией выброса ЛЖ для улучшения клинических исходов может использоваться мониторинг давления в легочной артерии при помощи беспроводных систем мониторинга гемодинамики (класс рекомендаций — IIb)[14].
Весьма перспективным может быть анализ динамики импеданса в составе комбинированных шкал. Так, в исследовании MultiSENSE (900 пациентов) чувствительность алгоритма HeartLogic (Boston Scientific, США), учитывающего аускультативные признаки, ЧДД, ЧСС, уровень активности и интраторакальный импеданс, в прогнозировании острой декомпенсации ХСН за 2 недели до ее наступления составила 70% при 1,5 случая ошибочного прогноза на 1 пациенто-год [15].
В числе имплантируемых мониторов легочной гемодинамики предложены Chronicle (Medtronic, США) для определения давления в ПЖ с последующим расчетом систолического давления в легочной артерии, HeartPOD (St. Jude Medical, США), имплантируемый в левое предсердие, и CardioMEMS HF System (Abbott Vascular, США), имплантируемый непосредственно в легочную артерию.
В исследовании COMPASS-HF (274 пациента, наблюдение в течение 6 месяцев) уменьшение на 21% числа событий комбинированной конечной точки (госпитализации по поводу ХСН, госпитализации в блок интенсивной терапии) при применении Chronicle не достигло критериев достоверности (p = 0,33). В связи с этим устройство не было одобрено Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (англ. Food and Drug Administration, FDA)[16].
Исследование LAPTOP-HF по изучению эффективности применения HeartPOD было остановлено досрочно (486 пациентов из запланированных 730) ввиду большого количества осложнений, связанных с пункцией межпредсердной перегородки. При этом госпитализации по поводу ХСН в группе вмешательства происходили на 41% реже, чем в контрольной группе (0,40 в год против 0,68 в год, p = 0,005)[17].
CardioMEMS является единственным имплантируемым монитором легочной гемодинамики, одобренным FDA (рис. 4). В ходе исследования CHAMPION (550 пациентов, наблюдение в течение 18 месяцев) после установки устройства (под контролем ангиоскопии) количество госпитализаций по поводу ХСН статистически значимо уменьшилось на 33% (95%-й ДИ [20–45], p < 0,0001)[18]. В настоящее время эффективность устройства оценивается на более крупных выборках пациентов в рамках исследований GUIDE-HF (3600 человек в США) и MEMS-HF (285 человек в Европе и Австралии).
Рис. 4. Имплантируемый монитор легочной гемодинамики CardioMEMS с системой передачи данных6
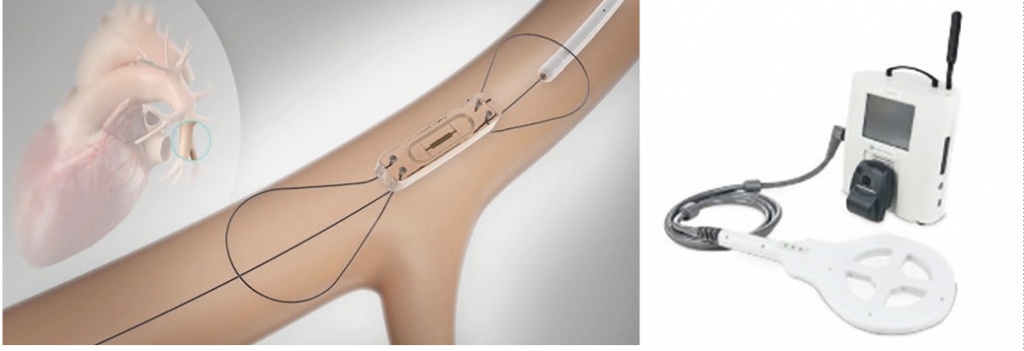
Следует отметить, что экономическая эффективность CardioMEMS остается под вопросом ввиду высокой стоимости этого монитора (около 17 000 долларов США). В согласованном заявлении Американского общества специалистов по сердечной недостаточности (англ. Heart Failure Society of America, HFSA), опубликованном в 2018 г., его применение рассматривается в качестве возможной тактики у избранной когорты пациентов в рамках комплексного наблюдения[19].
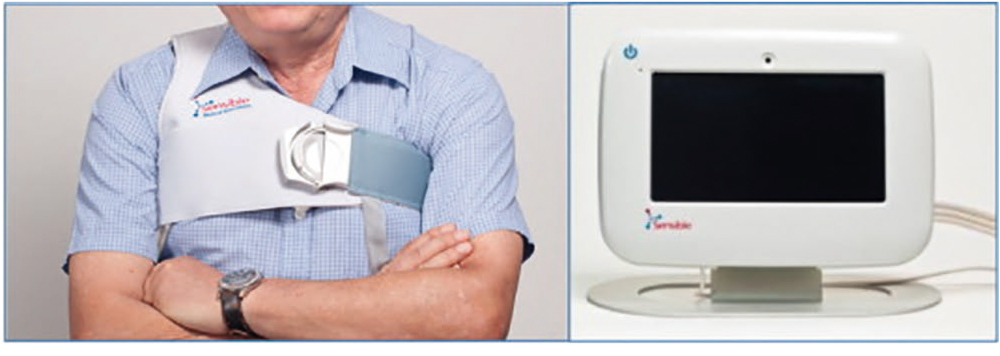
Среди носимых устройств для динамического дистанционного контроля легочной гемодинамики перспективна система ReDS (Sensible Medical Innovations Ltd, Kfar Netter, Израиль) (рис. 5). В основе ReDS лежат различия в электромагнитных свойствах тканей, результатом измерения является коэффициент, характеризующий количество жидкости внутри грудной клетки. Показана корреляция коэффициента с данными КТ легких и результатами катетеризации сердца[20, 21]. Продемонстрировано положительное влияние технологии на клинические исходы[22].
Рис. 5. Система удаленного диэлектрического мониторинга (ReDS) c дисплеем для отображения результатов измерений[20]
ЗАКЛЮЧЕНИЕ
Внедрение телемедицинских технологий в повседневную клиническую практику является перспективным направлением развития здравоохранения. Необходимо более широко включать системы телеметрического наблюдения в лечение больных сердечно-сосудистыми заболеваниями (ССЗ). Дистанционное наблюдение за такими пациентами позволит улучшить качество медицинской помощи, снизить частоту сердечно-сосудистых осложнений, уменьшить нагрузку на систему здравоохранения.
Необходимо проводить дальнейшие исследования для определения показаний к телеметрическому наблюдению и разработки протоколов дистанционного наблюдения за больными ССЗ, а также создавать центры или отделения, занимающиеся дистанционным наблюдением за больными. Актуальную задачу представляет также разработка систем дистанционного наблюдения за больными ССЗ, в том числе с целью снижения стоимости и увеличения доступности этих устройств.
Поступила: 07.10.2021
Принята к публикации: 28.10.2021
________
1 Клинические рекомендации МЗ РФ. Артериальная гипертензия у взрослых. М.; 2020. 136 с. https://scardio.ru/content/Guidelines/Clinic_rek_AG_2020.pdf (дата обращения — 06.07.2021).
2 Там же.
3 IEEE 1708-2014 — IEEE Standard for Wearable Cuffless Blood Pressure Measuring Devices. https://standards.ieee.org/findstds/standard/1708-2014.html (дата обращения — 06.07.2021).
4 Клинические рекомендации МЗ РФ. Хроническая сердечная недостаточность. М.; 2020. 183 с. https://scardio.ru/content/Guidelines/2020/Clinic_rekom_HSN.pdf (дата обращения — 06.07.2021).
5 Body Trace Scale. https://www.bodytrace.com/medical/ (дата обращения — 06.07.2021).
6 CardioMEMS HF System for Pulmonary Artery Pressure Monitoring. https://www.cardiovascular.abbott/us/en/hcp/products/heart-failure/pulmonary-pressure-monitors/cardi... (дата обращения — 18.05.2021).








