Старение сосудов — процесс, связанный с увеличением артериальной жесткости и ремоделированием сосудов, маркером которых является увеличение скорости распространения пульсовой волны (СРПВ) [1, 2]. При каждом возрастании СРПВ на 1 м/с риск всех сердечно-сосудистых событий, включая смерть, увеличивается на 14–15% [3].
Процесс нормального сосудистого старения может быть ускорен кумулятивным воздействием различных факторов, которые повреждают артериальную стенку, имеет значение и время их воздействия [4, 5]. Это отразилось в создании концепции синдрома раннего сосудистого старения, которая формируется вокруг накапливающихся данных о сосудистой жесткости как о суррогатной конечной точке и независимом предикторе общей сердечно-сосудистой заболеваемости и смертности [6–8].
Эпидемиологические исследования говорят о широком распространении синдрома раннего сосудистого старения у лиц молодого и среднего возраста [9, 10]. При этом наличие коморбидной патологии, особенно СД 2 типа, является независимым фактором риска раннего старения сосудов, а следовательно, развития сердечно-сосудистых событий. Доказано, что гипергликемия в сочетании с другими классическими факторами риска (АГ, ожирением, дислипидемией) ускоряет увеличение сосудистой жесткости и сосудистое старение в любом возрасте [11]. Так, взрослые пациенты с СД в 2–4 раза чаще страдают сердечно-сосудистыми заболеваниями [12]. В большом популяционном ретроспективном исследовании пациенты с СД были отнесены в группу высокого сердечно-сосудистого риска на 15 лет раньше, чем участники без СД [13].
Связанные с СД патологические изменения, которые обеспечивают функциональный и структурный фон клинических событий, включают эндотелиальную дисфункцию, утолщение и повышение жесткости стенок артерий, а также образование сложных и нестабильных атеросклеротических бляшек. В исследовании MDC [14] были выявлены более высокие уровни сосудистой жесткости у пациентов с СД или у лиц с впервые выявленным СД по сравнению с группой без него.
В 1998 г. британское проспективное исследование убедительно продемонстрировало роль гликемического контроля в коррекции микрососудистых осложнений СД 2 типа [15]. На основании результатов исследования сформулирован алгоритм, направленный на достижение нормогликемии путем поэтапного назначения все более сильнодействующих препаратов и их комбинаций. Однако крупномасштабные исследования (ACCORD, ADVANCE и VADT) показали неэффективность глюкозоцентрической модели коррекции сосудистых осложнений и увеличения продолжительности жизни пациентов [16–18].
Таким образом, алгоритмы, направленные исключительно на гликемический контроль, не способны повлиять на распространение и прогноз СД 2 типа. На смену глюкозоцентрической модели терапии постепенно приходит гравицентрическая концепция, основанная на необходимости первостепенной терапии ожирения при СД 2 типа [19, 20]. Использование гравицентрической концепции в клинической практике предполагает достижение следующих целей: нормализовать ИМТ у всех пациентов (или по крайней мере строго избегать возрастания ИМТ); использовать антигипергликемические, а не гипогликемизирующие препараты.
В настоящее время большое внимание привлекает новейший класс пероральных сахароснижающих препаратов для лечения СД 2 типа — ингибиторы натрий-глюкозного котранспортера 2 типа (SGLT2). Механизм действия данного класса основан на ингибировании белка SGLT2, ответственного за реабсорбцию глюкозы в проксимальных канальцах почек, где происходит 90% реабсорбции глюкозы. При ингибировании этого белка возникает искусственная глюкозурия, что и обеспечивает гипогликемический эффект. Ингибиторы SGLT2 — единственный класс сахароснижающих препаратов, обладающий инсулин-независимым механизмом действия, что дает возможность эффективно сочетать их с другими сахароснижающими препаратами. Ингибиторы SGLT2 столь же эффективны, как и другие антидиабетические средства, в снижении уровня гликированного гемоглобина (HbA1c) [15], при этом их использование позволяет контролировать и гликемию, и массу тела [21–23].
На данный момент среди всех сахароснижающих препаратов, а не только ингибиторов SGLT2, первым и единственным препаратом для лечения СД, одобренным для снижения сердечно-сосудистой смертности, признан эмпаглифлозин. По результатам исследования EMPA-REG OUTCOME, прием эмпаглифлозина статистически значимо уменьшил сердечно-сосудистую (на 38%) и общую (на 32%) смертность. Кроме того, количество госпитализаций по поводу сердечной недостаточности сократилось на 35% [24]. В течение всего периода исследования с приемом эмпаглифлозина было ассоциировано снижение массы тела, окружности талии, уровня мочевой кислоты, систолического АД (САД) по сравнению с плацебо без увеличения ЧСС, однако с незначительным, но статистически значимым увеличением фракции ЛПВП.
Исследователи предполагают, что кардиоваскулярные преимущества эмпаглифлозина многомерны и, возможно, связаны с изменением сосудистой жесткости, улучшением кардиоренальных эффектов и функции сердца, уменьшением альбуминуриии, уровня мочевой кислоты, а также установленным воздействием на уровень глюкозы, массу тела, висцеральный жир и АД. Эти выводы подтверждены тем, что эмпаглифлозин действительно оказывает благоприятное влияние на маркеры сосудистой жесткости и резистентности сосудов: пульсовое давление, среднее дневное давление и кардиоваскулярный продукт (рассчитывается по формуле: кардиоваскулярный продукт = ЧСС × САД; используется для определения нагрузки на миокард) [25].
Вышеперечисленные данные нашли отражение в обновленном 8-м выпуске Алгоритмов специализированной медицинской помощи больным сахарным диабетом [26], в котором впервые была опубликована таблица «Персонализация выбора сахароснижающих препаратов в зависимости от доминирующей клинической проблемы», созданная для того, чтобы облегчить специалисту подход к лечению больных СД 2 типа, сочетающимся с другими клиническими проблемами, например подтвержденным сердечно-сосудистым заболеванием, хронической болезнью почек, ожирением.
Тем не менее до сих пор нет данных о влиянии эмпаглифлозина на основную детерминанту сосудистого старения — СРПВ.
Цель данного исследования: оценить возможности эмпаглифлозина в достижении ангиопротекции у пациентов с СД 2 типа, ранее получавших монотерапию метформином.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было выполнено на базе кафедры терапии и эндокринологии факультета усовершенствования врачей ФГБОУ ВО «Волгоградский государственный медицинский университет» Минздрава России в 2016–2018 гг. В исследование включены 50 пациентов (22 мужчины и 28 женщин, средний возраст — 56,4 ± 10,2 года) с метаболическим синдромом (МС) (International Diabetes Federation, 2005) и СД 2 типа, находившиеся на монотерапии метформином не менее 6 месяцев, но не достигшие целевого уровня HbA1c (на момент включения > 7,5%, но < 9%). Сосудистый возраст, рассчитанный по алгоритму SCORE, у всех участников был более чем на 3 года больше паспортного.
Включенным в исследование пациентам на 24 недели был назначен эмпаглифлозин в дозе 25 мг 1 раз в сутки. Данная дозировка оставалась стандартной для всех больных вплоть до конца исследования. Пациенты продолжали получать назначенную ранее гипотензивную, гиполипидемическую терапию на протяжении всего исследования без ее коррекции.
Исходно и после курсовой терапии проводились физикальное обследование всех участников с определением содержания жировой ткани (импедансный метод), исследование сосудистой эластичности (оценка СПВ, поток-зависимой вазодилатации; аппланационная тонометрия с определением индекса аугментации (ИА), центрального пульсового давления (цПД) и центрального САД), УЗИ брахиоцефальных артерий (с определением толщины интима-медиа (ТИМ) каротидной артерии, мм) и лабораторное обследование (оценка индекса инсулинорезистентности (Homeostatic Model Assessment for Insulin Resistance, HOMA-IR), уровней HbA1c, провоспалительных маркеров (вчСРБ) и адипокинов (лептина), трансаминаз (АЛТ, АСТ), креатинина с измерением скорости клубочковой фильтрации (СКФ), а также общий анализ мочи).
Все лабораторные показатели, уровень офисного САД, ЭКГ, биоимпедансометрия, а также физикальные данные отслеживались на 4-й, 12-й и 24-й неделях исследования. Другие инструментальные исследования проводили только исходно и спустя 24 недели.
СПВ измеряли с помощью компьютеризированного устройства Colson (протокол исследования и оборудование, аналогичные таковым в исследовании Complior), которое автоматически рассчитывало СПВ. ИА и центральное давление в аорте определяли на приборе SphygmoCor. Эндотелиальную функцию оценивали посредством измерения скорости поток-зависимой вазодилатации на плечевой артерии на аппарате Aloka ProSound a7.
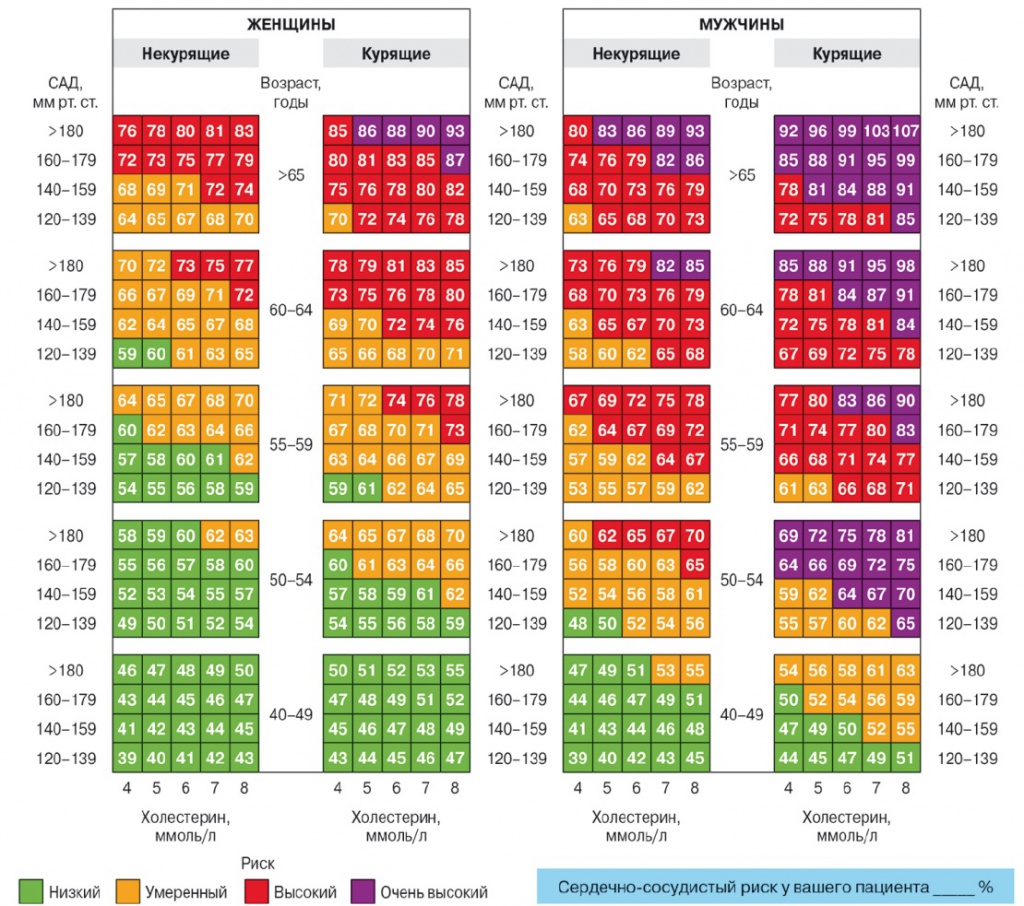
Сосудистый возраст рассчитывали с помощью таблиц SCORE (рис.) [27].
Рис. Таблицы для определения сосудистого возраста [27]
Уровень лептина в сыворотке измеряли методом иммуноферментного анализа с использованием наборов фирмы Mediagnost «Лептин, высокочувствительный (0,05–5 нг/мл)», уровень инсулина плазмы — также с помощью иммуноферментного анализа (Insulin ELISA, Mercodia AB, Швеция).
Индекс HOMA-IR рассчитывали по формуле:
HOMA-IR = глюкоза натощак (ммоль/л) × инсулин натощак (мкЕд/мл)/22,5.
Содержание СРБ оценивали с помощью иммунотурбидиметрического анализа (hs-CRP ELISA, Biomerica, США).
Пациенты не имели в анамнезе указаний на другие сердечно-сосудистые заболевания, кроме АГ, а также сердечно-сосудистые осложнения и ассоциированные клинические состояния. Лабораторно-инструментальное исследование на этапе скрининга также не выявило у них манифестацию клинической патологии.
В исследование не включались лица, имевшие СКФ < 45 мл/мин на 1,73 м2, редкие наследственные нарушения (дефицит лактазы, непереносимость лактозы, глюкозо-галактозную мальабсорбцию), а также другие противопоказания к приему эмпаглифлозина, указанные в инструкции по его применению.
Всем включенным в исследование пациентам назначалась гипокалорийная диета с ограничением употребления легкоусвояемых углеводов и насыщенных жиров (1200–1800 ккал/сутки, расчет суточной калорийности рациона проводился по формуле, рекомендованной ВОЗ (1998), для каждого пациента индивидуально), также были даны рекомендации по расширению объема физической активности (ходьба по 30–45 мин ежедневно).
Статистическую обработку результатов исследования проводили с использованием пакета статистических программ BMDP. Непрерывные количественные исходные и демографические признаки были протестированы простым t-критерием для независимых выборок. В случае распределения значений признака, отличного от нормального, был использован критерий Манна — Уитни. Для качественных признаков применяли либо точный критерий Фишера, либо тест χ2, в зависимости от количества наблюдений в каждой ячейке таблицы сопряженности. Данные представлены в виде M ± m, где М — среднее, m — стандартная ошибка. Для выявления достоверности изменений до и после лечения использовали парный t-критерий Стьюдента.
Ограничение исследования
Дизайн настоящего исследования не предполагал наличие контрольной группы/группы сравнения, что может повлиять на интерпретацию результатов.
РЕЗУЛЬТАТЫ
В таблице 1 показана динамика массы тела, окружности талии, ИМТ, содержания общей жировой ткани и висцерального жира при добавлении к терапии эмпаглифлозина.
Таблица 1
Динамика антропометрических показателей при добавлении к терапии эмпаглифлозина, M ± m
| Показатели | Исходно | Через 24 недели | Δ % |
| Масса тела, кг | 101,45 ± 11,4* | 97,75 ± 10,5** | –3,7 |
| Окружность талии, см | 109,62 ± 9,3* | 107,50 ± 8,8** | –1,9 |
| Индекс массы тела, кг/м2 | 34,21 ± 2,6* | 32,90 ± 2,0** | –3,8 |
| Процент общей жировой ткани | 37,90 ± 7,8* | 36,97 ± 6,4** | –2,5 |
| Процент висцерального жира | 16,00 ± 4,2* | 15,37 ± 4,7** | –3,9 |
* Здесь и в таблицах 2, 3: отклонения от нормы статистически значимы (р < 0,05).
** Здесь и в таблицах 2–4: отличия от исходных показателей статистически значимы (p < 0,05).
Как видно из данных таблицы 1, эмпаглифлозин при добавлении к терапии метформином оказывает значимое (p < 0,05) положительное влияние на антропометрические показатели. Наибольшие изменения наблюдались по содержанию висцерального жира (–3,9%).
В таблице 2 представлена динамика биохимических показателей крови после добавления к терапии эмпаглифлозина.
Таблица 2
Динамика уровней биохимических маркеров сосудистого старения при добавлении к терапии эмпаглифлозина, M ± m
| Показатели | Исходно | Через 24 недели | Δ % |
| Гликированный гемоглобин, % | 7,9 ± 0,37* | 7,1 ± 0,52** | –10,13 |
| Общий холестерин, ммоль/л | 4,62 ± 1,5* | 4,25 ± 0,5** | –8,00 |
| Липопротеины низкой плотности, ммоль/л | 2,37 ± 0,50 | 2,19 ± 0,60** | –7,60 |
| Липопротеины высокой плотности, ммоль/л | 0,92 ± 0,26* | 0,99 ± 0,20** | +7,60 |
| Лептин, нг/мл | 18,40 ± 4,4* | 15,12 ± 3,4** | –17,80 |
| Homeostatic Model Assessment for Insulin Resistance, мкЕД/мл | 6,38 ± 2,5* | 4,84 ± 1,6** | –24,13 |
| Высокочувствительный Среактивный белок, мг/л | 3,25 ± 1,1* | 2,12 ± 0,8** | –34,77 |
При анализе полученных результатов зафиксировано выраженное статистически значимое (p < 0,05) положительное влияние эмпаглифлозина на биохимические маркеры сосудистого старения [28, 29]. Наиболее существенным следует считать положительное воздействие эмпаглифлозина на уровни HbA1c, маркеров хронического неспецифического воспаления (вчСРБ) и инсулинорезистентности (лептин, HOMA-IR). Следует отметить, что у 88% пациентов через 6 месяцев приема эмпаглифлозина был достигнут уровень HbA1c менее 7,5%.
В таблице 3 показана динамика офисного САД, ЧСС, ключевых показателей сосудистой жесткости и центральной гемодинамики, а также сосудистого возраста после добавления к терапии эмпаглифлозина.
Таблица 3
Динамика показателей офисного артериального давления (АД), частоты сердечных сокращений (ЧСС), параметров сосудистой жесткости и центральной гемодинамики, M ± m
| Показатели | Исходно |
Через 24 недели |
Δ % |
| Офисное систолическое АД, мм рт. ст. | 138,3 ± 12,9 | 135,7 ± 10,4 | –1,90 |
| Офисное диастолическое АД, мм рт. ст. | 89,3 ± 9,8 | 87,6 ± 9,3 | –2,01 |
| ЧСС, уд/мин | 67,14 ± 11,1 | 67,60 ± 10,8 | +0,68 |
| Скорость распространения пульсовой волны на каротиднофеморальном участке, м/c | 12,38 ± 1,2* | 11,28 ± 1,0** | –8,88 |
| Индекс аугментации, % | 29,0 ± 7,8 | 27,1 ± 6,4** | –6,55 |
| Центральное пульсовое давление, мм рт. ст. | 37,2 ± 7,2 | 34,3 ± 7,4** | –7,80 |
| Интимамедиа, мм | 1,04 ± 0,12 | 1,01 ± 0,09 | –2,88 |
| Сосудистый возраст (SCORE), годы | 59,31 ± 8,3* | 57,28 ± 7,2 | –3,42 |
Офисное САД, ЧСС и ТИМ через 24 недели после добавления к терапии эмпаглифлозина статистически значимо не изменились. Наблюдалось статистически значимое (p < 0,05) снижение СРПВ на каротидно-феморальном участке (СРПВкф) и показателей центральной гемодинамики — цПД и ИА.
При анализе безопасности приема эмпаглифлозина отмечено, что исследование завершили все участники, ни у одного из них не зафиксированы побочные явления. Более того, для оценки безопасности приема эмпаглифлозина на каждом визите у пациентов оценивался общий анализ мочи, в котором не было статистически значимых отклонений ни у одного из участников. Динамика показателей общего анализа мочи после начала приема эмпаглифлозина отражена в таблице 4.
Таблица 4
Динамика показателей общего анализа мочи на фоне приема эмпаглифлозина, M ± m
| Показатели | Исходно | Через 24 недели | Δ % | ||
| pH | 6,1 ± 0,4 | 5,9 ± 0,3 | –3,28 | ||
| Глюкоза, ммоль/л | 8,3 ± 2,25 | 53,5 ± 14,13** | +544,58 | ||
| Лейкоциты, количество в поле зрения | min | max | min | max | –8,75 |
| 2 ± 1 | 5,37 ± 2,40 | 2 ± 1 | 4,90 ± 0,83 | ||
| Белок, г/л | 0,055 ± 0,019 | 0,064 ± 0,031 | +16,36 | ||
Проведенное исследование подтвердило, что на фоне приема эмпаглифлозина возникает статистически значимая (p < 0,05) глюкозурия (+544,57%), что обусловлено механизмом действия исследуемого препарата. Но возрастающая глюкозурия не приводит к учащению эпизодов инфекций мочевыводящих путей (по признакам статистически незначимых изменений в содержании лейкоцитов и белка в разовой порции утренней мочи).
При оценке безопасности/переносимости эмпаглифлозина обращали внимание также на показатели креатинина сыворотки/СКФ. Статистически значимых изменений данных показателей у наших пациентов не было.
Влияние различных факторов сердечно-сосудистого риска на сосудистое старение и значение полученных результатов
Многомерный регрессионный анализ показал, что у пациентов с СД 2 типа, включенных в настоящее исследование, СРПВкф, цПД, ИА, САД, общий холестерин (ОХ), ЛПВП и ИМТ являются независимыми детерминантами сосудистого возраста, рассчитанного по алгоритму SCORE, причем с ЛПВП данная связь обратная, с остальными параметрами — прямая.
При этом в разные возрастные периоды компоненты МС имеют различный удельный вес в формировании раннего сосудистого старения. Так, у мужчин с СД 2 типа в возрасте от 40 до 49 лет основными предикторами повышения сосудистого возраста являются АГ, ожирение и гиперлипидемия (ОХ) в равной степени; у женщин — только АГ и гиперлипидемия (ОХ). У мужчин в возрасте от 50 до 54 лет свою роль сохраняют ожирение и дислипидемия (ОХ, ЛПВП), при этом роль АГ становится менее значимой; у женщин сохраняется влияние АГ и дислипидемии (ОХ, ЛПВП).
У мужчин с МС в возрасте от 55 до 59 лет основной вклад в повышение сосудистого возраста вносит дислипидемия (ОХ, ЛПВП), при этом влияние ожирения становится менее выраженным, а АГ — исчезает; у женщин сохраняется роль АГ и дислипидемии (ОХ, ЛПВП), но последняя вносит больший вклад.
В возрасте от 60 до 64 лет при МС ключевое значение в повышение сосудистого возраста у мужчин имеет дислипидемия (ОХ, ЛПВП), однако значимое влияние АГ и ожирения не обнаруживается; у женщин сохраняется роль дислипидемии (ОХ, ЛПВП), а роль АГ продолжает уменьшаться.
Как у мужчин, так и у женщин с МС старше 65 лет ключевой детерминантой раннего сосудистого старения становится дислипидемия (ОХ, ЛПВП).
Стоит отметить, что корреляционная связь между САД и СРПВкф была наиболее сильной у пациентов с МС в возрасте от 40 до 49 лет, а затем с увеличением паспортного возраста уменьшалась. Однако связь между САД и параметрами центральной гемодинамики (цПД и ИА) усиливалась с возрастом, особенно после 50 лет. Сила корреляционной связи между уровнем ОХ и СРПВкф, ИА и цПД возрастала в период от 40 до 59 лет, а после 60 лет постепенно снижалась.
Сила обратной корреляционной связи между уровнем ЛПВП и СРПВкф, ИА и цПД росла с увеличением паспортного возраста. Наиболее сильная корреляционная связь между ИМТ и СРПВкф зарегистрирована у мужчин в возрасте от 40 до 49 лет.
У женщин и мужчин других возрастных групп корреляция между ИМТ и СРПВкф, цПД и ИА была относительно равной, но ниже, чем у мужчин в возрасте от 40 до 49 лет. Сильная корреляционная связь между сосудистым возрастом, рассчитанным по алгоритму SCORE, и СРПВкф прослеживалась во всех возрастных группах. Однако корреляция между сосудистым возрастом и ИА, цПД увеличивалась с паспортным возрастом, достигнув максимальной силы у лиц старше 65 лет.
Таким образом, в возрасте до 65 лет при МС определяющими сосудистую жесткость и раннее сосудистое старение выступают потенциально модифицируемые метаболические факторы риска (в первую очередь, ожирение и дислипидемия) и АГ. Фактор возраста (паспортного) ожидаемо наиболее весомый вклад в формирование сосудистой жесткости вносит у пациентов старшей возрастной группы (более 60 лет), но при сохранении значимого влияния ожирения и АГ. Значит, превентивными механизмами предотвращения раннего сосудистого старения при СД 2 типа следует считать антигипертензивную и гиполипидемическую терапию, а также применение гиполипидемических препаратов, оказывающих плейотропное влияние на классические сердечно-сосудистые факторы риска.
ЗАКЛЮЧЕНИЕ
Добавление эмпаглифлозина к терапии СД 2 типа у пациентов с нецелевым уровнем HbA1c помогает его снизить, обеспечивает эффективную ангиопротекцию, а именно улучшение показателей эластичности сосудов как основного критерия раннего сосудистого старения. Однако прием эмпаглифлозина статистически значимо не влияет на сосудистый возраст по алгоритму SCORE, так как показатели метаболизма глюкозы и наличия/отсутствия СД 2 типа не учитываются в данном алгоритме, что является одним из серьезных ограничений его использования.
Добавление эмпаглифлозина к терапии СД 2 типа также способствует коррекции основных факторов сердечно-сосудистого риска, а именно выраженности ожирения, атерогенной дислипидемии, инсулинорезистентности и неинфекционного малоинтенсивного воспаления.








