Травматическая болезнь спинного мозга (ТБСМ) в последние десятилетия является серьезнейшей медико-социальной и финансово-экономической проблемой [6, 9]. В мире за период с 1950 по 2012 г. произошел рост заболеваемости и распространенности травмы спинного мозга более чем в 30 раз [12]. В России по частоте встречаемости ТБСМ занимает третье место среди всех видов травм [4].
Разработка эффективных технологий медицинской реабилитации лиц с травматическими поражениями спинного мозга актуальна для современной нейрохирургии, травматологии и неврологии [15, 16]. Реабилитация пациентов при ТБСМ должна быть системной, непрерывной и длительной [3, 6].
Инновационным направлением в нейрореабилитации является активная механотерапия с биологической обратной связью (БОС) под контролем электромиографии (ЭМГ) [2, 11]. В работах ряда авторов показана целесообразность длительных многократных повторений однотипных движений с помощью механотерапии и электростимуляции [5, 10]. Одним из доказанных методов активной реабилитации является электростимуляция с БОС под контролем ЭМГ [13]. В работе U. S. Hofstoetter и соавт. показано, что чрескожная стимуляция спинного мозга у пациентов с ТБСМ, имеющих частично сохраненную двигательную функцию, увеличивает произвольную двигательную активность [14]. Разработка комплекса активной медицинской реабилитации в зависимости от уровня, степени повреждения и реабилитационного потенциала является одной из важнейших задач нейрореабилитации.
Один из критериев эффективности современных технологий реабилитации — повышение реабилитационного потенциала и степени независимости больных в повседневной жизни. В число основных методологий, позволяющих оценить эффективность медицинской реабилитации, в настоящее время входит применение Международной классификации функционирования, ограничений жизнедеятельности и здоровья (МКФ) [1, 6–8]. МКФ представляет собой объективный инструмент оценки качества жизни пациента на медицинском, социальном и психологическом уровнях и позволяет определить степень восстановления нарушенных функций и уровень здоровья в целом.
Целью настоящей работы явилась оценка эффективности активной медицинской реабилитации с применением БОС под контролем ЭМГ у пациентов с ТБСМ.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении медицинской реабилитации ГАУЗ «Госпиталь для ветеранов войн» г. Казани Министерства здравоохранения Республики Татарстан обследованы 212 пациентов с ТБСМ: 39 женщин и 173 мужчины, средний возраст которых составил 32,3 ± 10,7 года. Больные находились в позднем восстановительном периоде после перенесенной травмы (от 3 месяцев до 6 лет).
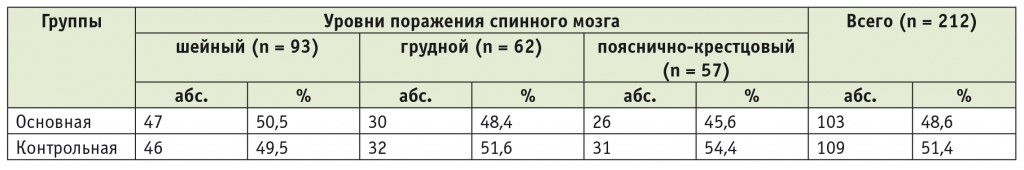
Пациенты были рандомизированы на две группы: основную (103 чел.) и контрольную (109 чел.). Характеристика групп по уровням поражения спинного мозга представлена в таблице 1.
Таблица 1
Распределение больных в основной и контрольной группах по уровням поражения спинного мозга
У больных основной группы на фоне стандартной терапии, включавшей медикаментозное лечение, лечебную гимнастику и массаж, применяли активно-пассивную электростимуляцию с применением БОС под контролем ЭМГ на аппарате Endomed 682id (Нидерланды), активную механотерапию с БОС под контролем ЭМГ с помощью комплекса EN-TreeM (Нидерланды), а также тренировку ходьбы на телескопическом подъемнике «ТРАМ» (Великобритания).
Пациентам основной группы с поражением шейного отдела (n = 47) проводили активно-пассивную электростимуляцию с БОС под контролем ЭМГ мышц спины, дельтовидной мышцы, мышц верхних конечностей с несущей частотой воздействия импульсов 2,5–4,0 кГц премодулированным прерывистым переменным током в изопланарном векторном поле с частотой 10–30 Гц, соотношением интервала 1 : 2, при волновой программе интенсивностью 4–5 мА/мин, максимальной силе тока 35 мА до появления безболезненного видимого сокращения. Длительность процедур составляла от 6–8 до 10–12 минут на поле, количество процедур — 10–12 с повторными курсами через 2–3 месяца.
Активная механотерапия назначалась при наличии активных движений и адекватной реакции на тестирование. При разработке тренировочной программы проводили тест на однократное максимальное усилие. После этого на тренировочной системе устанавливали нагрузку меньше ожидаемой предельной величины и предлагали пациенту повторить упражнение с данной нагрузкой максимально возможное число раз. Интенсивность подхода при выполнении упражнений согласовывали с задачами тренировки. Длительность тренировки составляла 10–20 минут, продолжительность курса — 8–12 занятий на увеличение мышечной силы и 10–12 занятий на повышение выносливости (длительность тренировки и продолжительность курса зависели от степени повреждения).
В основной группе с поражением грудного отдела (n = 30) пациенты получали активно-пассивную электростимуляцию с БОС под контролем ЭМГ мышц спины, ягодиц, четырехглавых мышц с несущей частотой воздействия импульсов 2,5–4,0 кГц премодулированным прерывистым переменным током в изопланарном векторном поле с частотой 20–40 Гц, соотношением интервала 1 : 2, при волновой программе интенсивностью 5–6 мА/мин, максимальной силе тока 50 мА до появления безболезненного видимого сокращения. Длительность процедур — от 8–10 до 12 минут на поле, количество процедур — 10–12 с повторными курсами через 2–3 месяца.
После предварительного тестирования проводили активную механотерапию с БОС под контролем ЭМГ мышц спины и нижних конечностей. Длительность тренировки — 15–25 минут, продолжительность курса — 10–12 занятий на увеличение мышечной силы и 10–12 занятий на повышение выносливости (длительность тренировки и продолжительность курса зависели от степени повреждения).
Обучение ходьбе выполняли на телескопическом подъемнике «ТРАМ» с электронным доводчиком. Во время ходьбы пациента с помощью подъемника проводили электромиостимуляцию, для которой применяли аппарат Cefar Rehab (Швейцария), частота импульсов составляла 2–10 Гц, продолжительность импульса — 120 мс. Процедуры длились по 8–10 минут, количество ежедневных процедур — 10–15.
Пациенты основной группы с поражением пояснично-крестцового отдела (n = 26) получали активно-пассивную электростимуляцию с БОС под контролем ЭМГ мышц спины, нижних конечностей с несущей частотой воздействия импульсов 2,5–4,0 кГц премодулированным прерывистым переменным током в изопланарном векторном поле с частотой 30–50 Гц, соотношением интервала 1 : 2, при волновой программе интенсивностью 5–6 мА/мин, максимальной силе тока 60 мА до появления безболезненного видимого сокращения. Длительность процедур — 10–12 минут на поле, количество процедур — 10–12 с повторными курсами через 2–3 месяца.
Активную механотерапию с БОС под контролем ЭМГ мышц спины и нижних конечностей проводили при длительности тренировки 45–60 минут, продолжительности курса 10–12 занятий на увеличение мышечной силы и 10–12 занятий на повышение выносливости (длительность тренировки и продолжительность курса зависели от степени повреждения).
Длительность тренировок ходьбы на телескопическом подъемнике «ТРАМ» составляла 15–40 минут, количество ежедневных процедур — 10–15.
Больные контрольной группы (n = 109) получали стандартную медикаментозную терапию, электромиостимуляцию без БОС с помощью аппарата «Стимул-1» (Россия) с частотой 30 Гц и силой тока 15–20 мА, пассивную механотерапию без БОС голеностопного или коленного сустава с применением аппарата Artromot (Германия) в течение 20–30 минут, индивидуальную и групповую лечебную гимнастику, массаж.
Для оценки статистической значимости различий между показателями до и после проведения активной медицинской реабилитации с БОС в основной группе и реабилитации без БОС в контрольной группе использовали непараметрический критерий Вилкоксона для зависимых переменных.
Статистическую значимость различий между показателями основной и контрольной групп до и после проведения реабилитации оценивали с использованием непараметрического U-критерия Манна — Уитни.
Для всех сравнений выбранный уровень статистической значимости составлял 5% (p ≤ 0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Клинико-инструментальная оценка выявила поражение шейного утолщения у 43,9% пациентов с ТБСМ (n = 93), из них у 81,7% (n = 76) отмечались симметричные парезы и параличи в верхних конечностях по типу смешанных. Обращало на себя внимание наличие гипотрофий и атрофий мышц верхних конечностей, которые преобладали в дистальных отделах. При этом атрофии и выраженные гипотрофии имели место у пациентов с параличами и встречалисьу 55,9% пациентов (n = 52) при грубых парезах (1 балл по шестибалльной оценке мышечной силы) и у 53,7% (n = 50) — при выраженных парезах (2 балла). При умеренных парезах (3 балла) определялись умеренные гипотрофии мышц.
У всех пациентов с поражением шейного отдела были выявлены проводниковые двигательные нарушения с развитием центральных парезов и параличей в нижних конечностях. В большинстве (88,2%) наблюдений определялись симметричные грубые парезы и параличи.
Наряду с двигательными нарушениями у всех пациентов с шейным уровнем повреждения определялись расстройства поверхностной и глубокой чувствительности. На руках они были преимущественно сегментарными, часто имели асимметричный характер, преобладая на одной из сторон. На туловище и ногах начиная с уровня на 2 сегмента ниже поврежденного сегмента спинного мозга отмечались чувствительные расстройства проводникового типа. В 18,3% наблюдений (n = 17) регистрировались гиперестезии и гиперпатии, больше в дистальных отделах конечностей. Болевой синдром в области конечностей и позвоночника беспокоил 4,3% больных (n = 4). Нарушения функции тазовых органов были отмечены в 49,5% наблюдений (n = 46). Рецидивирующие воспалительные поражения мочеполовой системы (15,0%), пролежни (3,2%) и контрактуры суставов конечностей (20,4%) расценивались как осложнения основного заболевания.
Поражение грудного отдела спинного мозга наблюдалось у 29,2% пациентов с ТБСМ (n = 62), из них у 93,5% (n = 58) имели место симметричные центральные парезы и параличи в нижних конечностях, причем в 62,9% случаев (n = 39) отмечалось преобладание полных плегий. У всех пациентов определялись проводниковые расстройства поверхностной и глубокой чувствительности начиная с уровня на 2 сегмента ниже поврежденного сегмента. Болевой синдром в области нижних конечностей и позвоночника беспокоил 11,3% больных (n = 7). Нарушения функции тазовых органов регистрировались в 46,8% наблюдений (n = 29). Определялись рецидивирующие воспалительные поражения мочеполовой системы (17,7%), пролежни (6,4%) и контрактуры суставов нижних конечностей (17,7%).
Поражение пояснично-крестцового отдела спинного мозга отмечалось у 26,9% пациентов с ТБСМ (n = 57). Для данного уровня поражения была характерна неравномерность двигательных нарушений с преимущественным поражением одной ноги (45,6% больных, n = 26) и существенным преобладанием патологических симптомов в дистальных отделах нижних конечностей. Отмечалось относительное уменьшение доли полных плегий по сравнению с другими уровнями поражения спинного мозга. Так, если при патологии на шейном уровне полные параличи наблюдались у 88,2% пациентов, то при грудном уровне повреждения их доля составила уже 62,9%, а при пояснично-крестцовом только 40,4%, причем различия между всеми уровнями повреждения были статистически значимыми (p < 0,001).
В 42,1% наблюдений (n = 24) у пациентов с поражением пояснично-крестцового отдела имелись атрофии мышц нижних конечностей, локализация которых определялась топикой поражения спинальных сегментов поясничного утолщения. Наряду с двигательными нарушениями диагностировались расстройства чувствительности — преимущественно сегментарные и часто асимметричного характера. Болевой синдром в области конечностей и позвоночника беспокоил 12,3% пациентов (n = 7). Нарушения функции тазовых органов регистрировались в 61,4% наблюдений (n = 35). Из осложнений наблюдались рецидивирующие воспалительные поражения мочеполовой системы (14,0%), пролежни (3,5%) и контрактуры суставов нижних конечностей (21,0%).
Таким образом, обследованный контингент больных характеризовался значительной тяжестью поражения. Наиболее тяжелыми были неврологические нарушения у пациентов с шейным и грудным уровнями поражения. Это подтверждается интегративной оценкой неврологического статуса пациентов на основе классификации Американской ассоциации спинальной травмы (American Spinal Cord Injury Association) (табл. 2). Так, тяжесть повреждения нервной системы у пациентов с шейным уровнем поражения (преобладает группа B, имеется группа А) статистически значимо выше, чем у пациентов с пояснично-крестцовым уровнем (преобладает группа C) (p < 0,05).
Таблица 2
Распределение больных с травматической болезнью спинного мозга по степени повреждения (классификация ASIA) в зависимости от уровня поражения
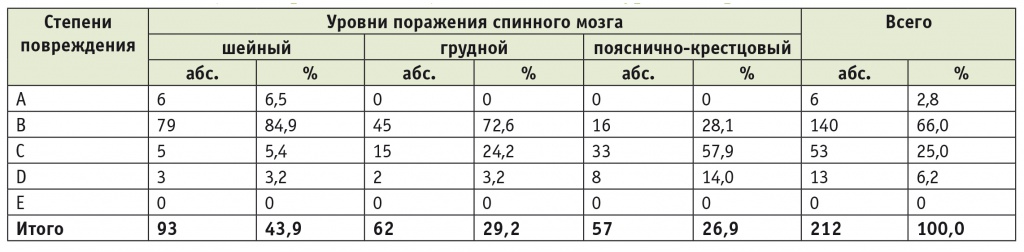
Примечание. ASIA (American Spinal Cord Injury Association) — Американская ассоциация спинальной травмы.
С целью количественного определения нарушений функций (двигательных и интеллектуальных), активности, участия пациентов в повседневной и социальной жизни использовали шкалу функциональной независимости (Functional Independence Measure — FIM) и функциональную оценочную шкалу (Valutazione Funzionale Mielolesi — VFM). Показатели активности в сфере самообслуживания и мобильности пациентов зависели от уровня поражения спинного мозга (табл. 3).
Таблица 3
Суммарные оценки нарушений функций, активности и участия по шкалам FIM и VFM у пациентов основной группы с травматической болезнью спинного мозга в зависимости от уровня поражения, баллы
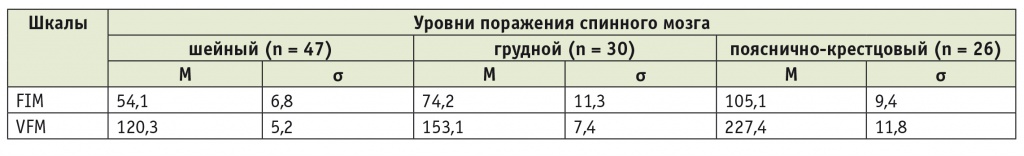
Примечание. FIM (Functional Independence Measure) — шкала функциональной независимости; VFM (Valutazione Funzionale Mielolesi) — функциональная оценочная шкала.
При исследовании с помощью шкал FIM и VFM бóльшие степени функциональной зависимости в повседневной жизни были выявлены при шейном уровне поражения спинного мозга, а меньшие — при пояснично-крестцовом уровне. Все различия в группах между всеми уровнями повреждения были статистически значимы (р < 0,001).
У всех пациентов с ТБСМ оценивали нарушения функционирования по МКФ. Для оценки нарушений активности и участия были отобраны наиболее характерные категории кодов, используемых при травме спинного мозга. Основные различия выявлены между пациентами с поражением шейного и пояснично-крестцового отделов позвоночника (р < 0,001). Пациенты с шейным уровнем поражения испытывали значительные ограничения при обучении и применении знаний в 65,6% случаев, а пациенты с повреждением пояснично-крестцового отдела — лишь в 22,8%. В домене «мобильность» тяжелые и абсолютные нарушения встречались у 54,8% больных с шейным уровнем поражения против 26,3% больных с пояснично-крестцовым уровнем. Ограничения при самообслуживании чаще возникали у пациентов с шейным уровнем поражения (71,0%) по сравнению с пациентами с травмой пояснично-крестцового отдела спинного мозга (26,3%). Серьезные проблемы выявлены при анализе домена «бытовая жизнь» у 82,8% пациентов с поражением шейного отдела, тогда как больные с повреждением пояснично-крестцового отдела испытывали тяжелые и абсолютные нарушения в данном домене лишь в 28,1% случаев (табл. 4).
Таблица 4
Частота встречаемости тяжелых и абсолютных нарушений активности и участия у пациентов с травматической болезнью спинного мозга
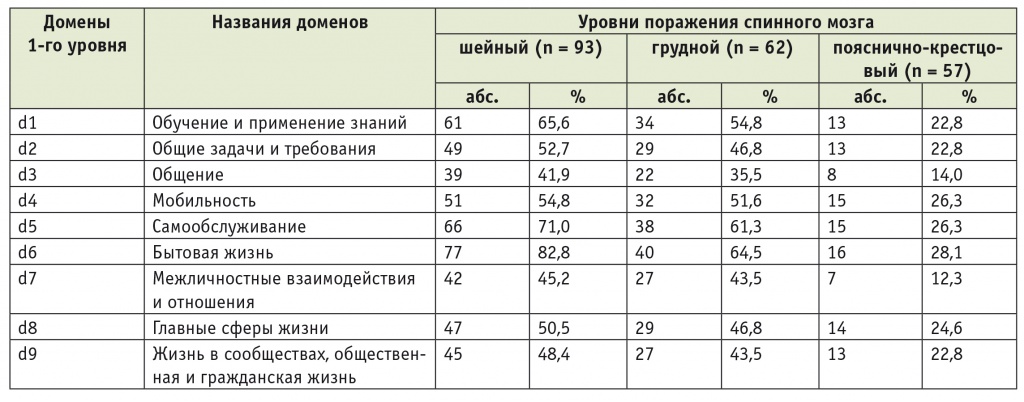
Примечания.
1. МКФ — Международная классификация функционирования, ограничений жизнедеятельности и здоровья.
2. Тяжелые и абсолютные нарушения — нарушения уровней 3 и 4. Активность и участие оценены по доменам первого уровня МКФ.
С целью оценки реабилитационного потенциала с позиции сохранности нервных центров и проводящих путей, резервов нейропластичности, процессов реиннервации у всех больных применяли электрофизиологическое исследование. Анализировали показатели амплитуды, частоты биоэлектрической активности в состоянии покоя и при максимальном произвольном сокращении, а также тип глобальной ЭМГ по Ю. С. Юсевич (1963). В мышцах в зоне центрального пареза в покое регистрировалась тоническая активность, обусловленная повышением тонуса мышц при спастическом параличе; при максимальном произвольном усилии ЭМГ-потенциалы характеризовались сниженной амплитудой или отсутствовали.
У пациентов с поражением спинного мозга на шейном и пояснично-крестцовом уровнях в зоне пареза наблюдались II и IV типы ЭМГ-активности, характеризовавшие последовательные степени двигательных нарушений. Из них II тип ЭМГ-активности прогностически благоприятен, так как он отражает сохранность большого количества мотонейронов, достаточного для реализации произвольного движения. Это особенно важно у больных с видимым отсутствием движений. А IV тип ЭМГ-активности характеризует тяжелое нарушение произвольных движений, при поражении сегментов спинного мозга он обычно регистрируется в атрофированных мышцах. Можно предположить, что данный тип активности объективно свидетельствует о неблагоприятном прогнозе восстановительных мероприятий ввиду исчерпания реабилитационного потенциала на соответствующем нейрометамерном уровне нервной системы.
У пациентов с шейным уровнем поражения асимметрия средней амплитуды ЭМГ в соответствующих мышцах рук с правой и левой стороны отмечалась в 100% наблюдений (n = 93), у больных с пояснично-крестцовым уровнем в соответствующих мышцах ног — в 96,8% наблюдений (n = 60), тогда как у больных с грудным уровнем поражения и центральным парезом в ногах асимметрия была выявлена только в 36,8% случаев (n = 21). Статистически значимые различия обнаружены между всеми уровнями повреждения (p < 0,001).
Проанализировано применение активной медицинской реабилитации (АМР) у больных основной группы в сравнении с группой контроля, в которой применялась стандартная медицинская реабилитация. У пациентов с ТБСМ с шейным уровнем поражения в основной группе было установлено увеличение показателей по шкале VFM на 6,5% (до реабилитации — 120,3 ± 5,2 балла, после — 128,1 ± 7,4 балла; p < 0,001) и по шкале FIM на 15,3% (до реабилитации — 54,1 ± 6,8 балла, после — 62,4 ± 7,7 балла; p < 0,001), тогда как в контрольной группе изменение данных показателей не имело статистической значимости — 3,0% по VFM (со 118,1 ± 5,7 до 121,6 ± 4,5 балла; p > 0,05) и 3,1% по FIM (с 54,6 ± 6,9 до 56,3 ± 7,1 балла; p > 0,05).
В основной группе было установлено увеличение показателей по шкале VFM на 15,3% (до реабилитации — 153,1 ± 7,4 балла, после — 176,5 ± 8,1 балла; p = 0,003) и шкале FIM на 17,1% (до реабилитации — 74,2 ± 11,3 балла, после — 86,9 ± 16,4 балла; p = 0,002), тогда как в контрольной группе изменение данных показателей не было статистически значимым — 2,4% и 2,6% соответственно (до курса — 156,3 ± 5,8 балла, после — 160,1 ± 6,3 балла (p = 0,24) и до курса — 73,8 ± 12,6 балла, после — 75,7 ± 13,9 балла (p = 0,21) соответственно).
В основной группе у пациентов с пояснично-крестцовым уровнем поражения после курса АМР отмечали увеличение показателей по шкале VFM на 13,7% (до курса — 227,4 ± 11,8 балла, после — 258,6 ± 12,1 балла; p < 0,001) и по шкале FIM на 11,6% (до курса — 105,1 ± 9,4 балла, после — 117,3 ± 8,9 балла; p < 0,001). В контрольной группе в процессе реабилитации значения этих показателей статистически значимо не изменились: по шкале VFM рост составил 3,7% (225,8 ± 10,3 и 234,2 ± 9,5 балла соответственно; p > 0,05) и по шкале FIM — 4,2% (104,2 ± 6,1 и 108,6 ± 7,2 балла соответственно; p > 0,05).
Динамика нарушений активности и участия по МКФ в основной группе у пациентов с шейным уровнем повреждения показала уменьшение тяжелых и абсолютных нарушений в доменах «общие задачи и требования» у 33,4%, «общение» у 45,0%, «самообслуживание» у 36,4%, «жизнь в сообществах, общественная и гражданская жизнь» на 30,5% (рис. А).
Рис. Динамика нарушений активности и участия тяжелой и абсолютной степени (уровней 3, 4) после активной медицинской реабилитации у больных основной группы с поражениями шейного (А), грудного (Б) и пояснично-крестцового (В) отделов спинного мозга (по доменам первого уровня Международной классификации функционирования, ограничений жизнедеятельности и здоровья), n
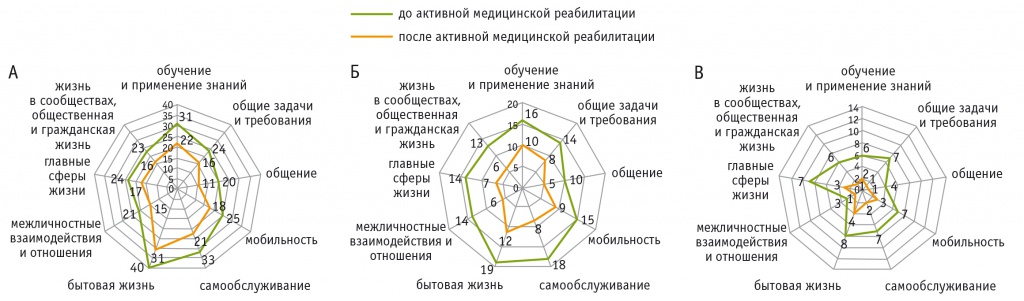
У пациентов с поражением грудного отдела после курса АМР количество тяжелых и абсолютных нарушений в домене «межличностные взаимодействия и отношения» уменьшилось на 57,2%, в доменах «мобильность» и «самообслуживание» — на 40,0% и 55,6% соответственно (рис. Б).
У пациентов с поражением пояснично-крестцового отдела отмечали статистически значимо бóльшие изменения во всех доменах, чем при других уровнях повреждения. После курсов АМР наибольшие изменения выявлены в доменах «общие задачи и требования» (у 85,7), «общение» (у 75,0%), «самообслуживание» (у 71,4%), «бытовая жизнь» (у 53,9%), «жизнь в сообществах, общественная и гражданская жизнь» (у 83,4%) (рис. В).
В контрольной группе после реабилитации значения рассмотренных показателей активности и участия по доменам первого уровня МКФ статистически значимых изменений не продемонстрировали (p > 0,05).
Программа исследования ЭМГ включала регистрацию мигательного полисинаптического рефлекса (МПР) у 212 больных ТБСМ. После проведенной реабилитации в основной группе по сравнению с контрольной отмечался статистически значимый положительный эффект по ведущим клинико-электрофизиологическим показателям. Из трех компонентов МПР наиболее значительными в аспекте данного исследования явились изменения показателей R2-компонента.
Полисинаптическая рефлекторная возбудимость (ПРВ) ствола головного мозга в основной группе у пациентов с шейным уровнем поражения после курса АМР достоверно уменьшилась (длительность R2-компонента МПР до АМР — 45,4 ± 1,7 мс, после — 40,7 ± 1,8 мс; p < 0,05), что отражало улучшение баланса возбуждения и торможения в ЦНС. В контрольной группе статистически значимых различий между ПРВ до и после реабилитации не установлено (45,9 ± 1,5 мс и 45,8 ± 1,6 мс соответственно; p > 0,05).
У пациентов с поражением грудного отдела ПРВ ствола головного мозга в основной группе после курса АМР достоверно уменьшилась (длительность R2-компонента МПР до АМР — 38,5 ± 1,7 мс, после — 35,5 ± 1,1 мс; p < 0,01). В контрольной группе статистически значимой динамики ПРВ в ходе реабилитации не выявлено (с 38,2 ± 1,5 мс до 37,7 ± 1,6 мс; p > 0,05).
При анализе ПРВ в основной группе у пациентов с пояснично-крестцовым поражением позвоночника после курса АМР обнаружено достоверное снижение длительности R2-компонента МПР (до курса АМР — 37,9 ± 1,3 мс, после — 35,2 ± 1,1 мс; p < 0,01). В контрольной группе показатели ПРВ до и после реабилитации статистически значимых различий не продемонстрировали (длительность R2-компонента составила 37,8 ± 1,6 мс и 36,9 ± 1,7 мс соответственно; p > 0,05).
Данные, полученные при тестировании на комплексе EN-TreeM до и после курса АМР, представлены в таблицах 5–7.
Таблица 5
Динамика показателей свободного движения до и после реабилитации у пациентов с шейным уровнем повреждения при травматической болезни спинного мозга
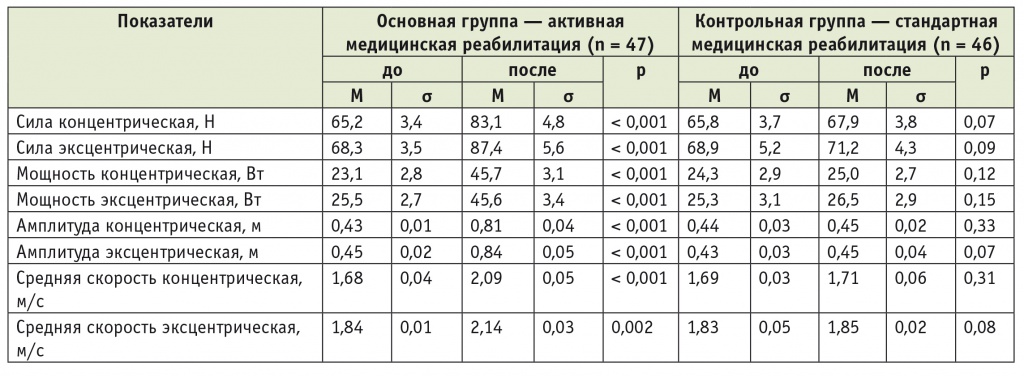
Таблица 6
Динамика показателей свободного движения до и после реабилитации у пациентов с грудным уровнем повреждения при травматической болезни спинного мозга
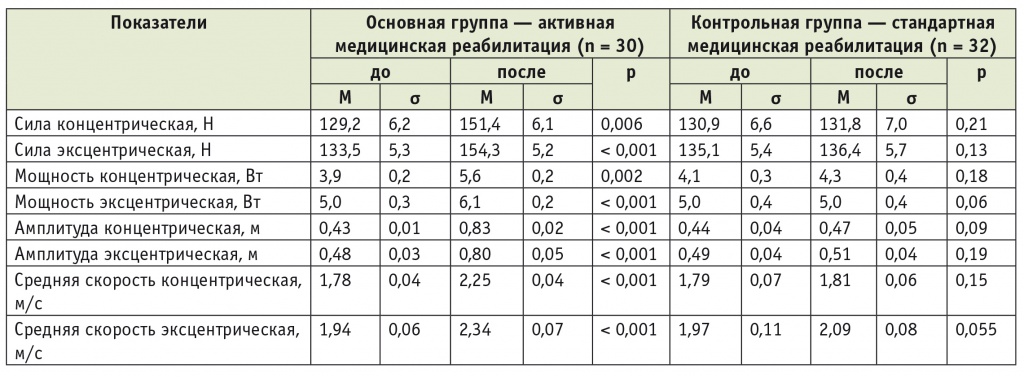
Таблица 7
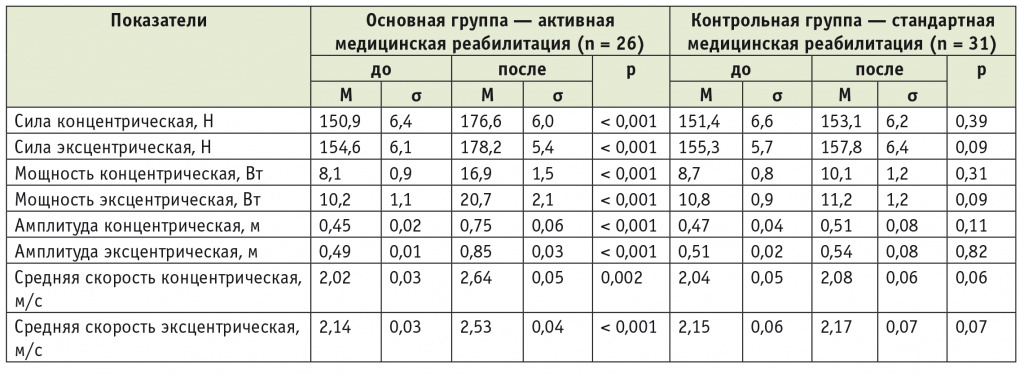
Динамика показателей свободного движения до и после реабилитации у пациентов с пояснично-крестцовым уровнем повреждения при травматической болезни спинного мозга
После проведенного курса АМР в основной группе у пациентов с поражением шейного отдела спинного мозга было отмечено увеличение концентрической силы на 27,5% и эксцентрической силы на 28,0% (в каждом случае p < 0,001), а в контрольной группе — увеличение концентрической силы на 3,2% и эксцентрической силы на 3,3% (по каждому показателю p > 0,05). Рост преимущественно эксцентрической силы у пациентов с травмой шейного отдела связан с целенаправленным укреплением разгибателей предплечья и предотвращением сгибательных контрактур обоих лучезапястных суставов и запястья (см. табл. 5).
При анализе динамики концентрических и эксцентрических амплитуд в основной группе больных с шейным уровнем поражения выявлено увеличение этих показателей в 1,9 и 1,9 раза, т. е. на 88,4% и 86,7%, соответственно (в обоих случаях p < 0,001), а в контрольной группе — только на 2,3% и 4,6% (по обоим показателям p > 0,05). Увеличение амплитуды при эксцентрических сокращениях лучезапястных суставов объективно демонстрирует уменьшение тонуса сгибателей и улучшение функции кисти (см. табл. 5).
В отношении показателей средних концентрических и эксцентрических скоростей в основной группе пациентов с шейным уровнем поражения выявлено повышение на 24,4% (p < 0,001) и 16,3% (p = 0,002) соответственно, тогда как в контрольной группе — только на 1,2% и 1,1% (для обоих показателей p > 0,05). Существенная положительная динамика показателей концентрических и эксцентрических скоростей у пациентов основной группы связана с ежедневными тренировками, в результате которых на фоне АМР повышаются эластичность и выносливость тренируемых мышц (см. табл. 5).
У больных ТБСМ с грудным уровнем поражения по сравнению с пациентами с травмами шейного отдела до лечения были выявлены более высокие показатели силы при концентрических и эксцентрических сокращениях: в основной группе разница составила 98,2% и 95,5% соответственно (см. табл. 6).
Увеличение силы и мощности при концентрических сокращениях связано с укреплением мышечного корсета, повышением выносливости мышц спины и нижних конечностей (табл. 6).
У пациентов с пояснично-крестцовым уровнем поражения спинного мозга выявлялись самые высокие показатели силы при концентрических и эксцентрических сокращениях нижних конечностей (см. табл. 7).
Увеличение мощности, средней скорости и амплитуды при концентрических сокращениях связано с повышением эластичности и выносливости мышц нижних конечностей, что обусловлено многократной ежедневной тренировкой мышц, участвующих в ходьбе. Это подтверждается исследованиями ряда авторов [5, 10].
Выводы
1. В результате АМР, проведенной у пациентов с ТБСМ при шейном уровне повреждения, достигнуто снижение длительности R2-компонента МПР по ЭМГ на 10,4%, что отражает улучшение баланса возбуждения и торможения в ЦНС, а по механограмме — увеличение показателей силы, преимущественно при эксцентрических сокращениях верхних конечностей (p < 0,001), и средней скорости концентрической (p < 0,001), что позволило повысить степень самообслуживания и независимости в повседневной жизни у 36,4% пациентов.
2. При грудном уровне повреждения у пациентов с ТБСМ выявлено снижение длительности R2-компонента МПР по ЭМГ на 7,8%, а по механограмме — увеличение силы и мощности, преимущественно при концентрических сокращениях мышц спины (p = 0,006 и p = 0,002 соответственно) и при эксцентрических сокращениях (р = 0,001); это позволило повысить степень самообслуживания и независимости в повседневной жизни у 58,9% пациентов, активности и участия — у 55,6%.
3. При пояснично-крестцовом уровне повреждения у пациентов с ТБСМ обнаружено снижение длительности R2-компонента МПР по ЭМГ на 7,1%, а по механограмме — увеличение мощности и амплитуды при концентрических сокращениях нижних конечностей (p < 0,001) и средней скорости (p = 0,002), что дало возможность улучшить мобильность и степень независимости в повседневной жизни у 71,4% пациентов.
ЗАКЛЮЧЕНИЕ
Таким образом, использование технологий активной медицинской реабилитации с биологической обратной связью под контролем электромиографии повышает активность и участие по Международной классификации функционирования, ограничений жизнедеятельности и здоровья, в частности степень самообслуживания и независимости в повседневной жизни, у пациентов с травматической болезнью спинного мозга при шейном, грудном и пояснично-крестцовом уровнях спинального поражения.








